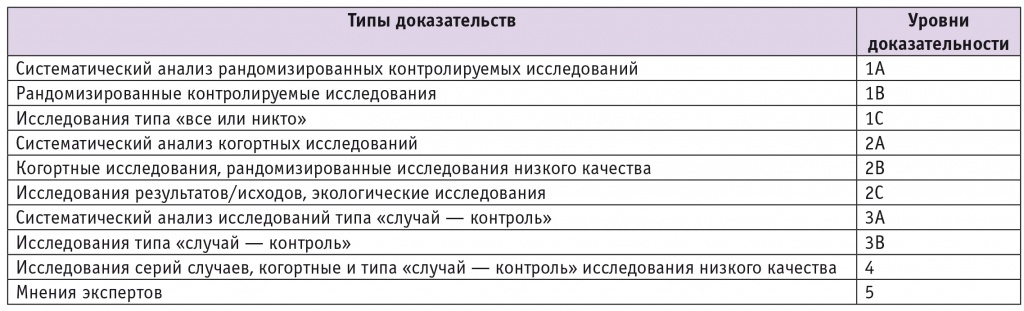
Накопленные в настоящее время данные о распространенности бактерий — возбудителей заболеваний человека и об их устойчивости к антибактериальным препаратам свидетельствуют о вступлении человечества в постантибиотическую эру [23], а также диктуют необходимость четкого регламентирования показаний к использованию антибиотиков, в том числе в акушерской практике, что и является целью данной статьи. Уровни доказательности приводимых рекомендаций определены в соответствии с классификацией Оксфордского центра доказательной медицины (Oxford Center for Evidence-Based Medicine) (табл. 1).
Таблица 1
Уровни доказательств для терапевтических исследований [10]
В основе рациональной антибактериальной терапии лежат три принципа:
принцип эмпирической терапии — использование антибактериальных препаратов до верификации возбудителя и определения чувствительности с учетом наиболее вероятных возбудителей данной инфекции;
принцип деэскалационной терапии — целенаправленная смена антибактериального препарата широкого спектра после уточнения возбудителя (а также тестирования на чувствительность к антибиотикам) на лекарственное средство с более узким спектром антибактериальной активности;
принцип ступенчатой терапии — смена способа введения препарата с парентерального (внутривенного, внутримышечного) на пероральный при наличии клинико-лабораторного эффекта от проводимой антибактериальной терапии (отсутствии лихорадки и других проявлений общеинтоксикационного синдрома, снижении числа лейкоцитов и уровня СРБ в крови и т. д.). Это не только имеет фармакоэкономический смысл (экономия затрат на терапию), но и повышает приверженность больных лечению.
Ограничительная стратегия в отношении применения антибиотиков у беременных. Соблюдение четких алгоритмов назначения антибактериальных препаратов беременным имеет значение не только для матери, но и для новорожденного. Согласно результатам когортных исследований, посвященных проблеме раннего неонатального сепсиса, антибиотикорезистентность микроорганизмов чаще наблюдается у новорожденных, чьи матери получали антибиотикотерапию при беременности. Риск резистентности возрастает при увеличении длительности и повторных курсах антибактериальной терапии, повторных госпитализациях матери во время беременности, недоношенности [39].
В соответствии с требованиями Территориального фонда обязательного медицинского страхования по оформлению медицинской документации, в истории родов необходимо обосновывать показания для антибиотикопрофилактики и антибиотикотерапии.
Надо подчеркнуть, что правильно и четко сформулированный диагноз сам по себе предотвращает неоправданное назначение антимикробных препаратов [37].
АНТИБИОТИКОПРОФИЛАКТИКА
Цели антибиотикопрофилактики:
сокращение частоты и уменьшение степени тяжести послеродовых инфекционных осложнений;
сведение к минимуму влияния антибактериальных препаратов на микробиом пациентки и другие защитные механизмы макроорганизма;
снижение частоты развития нежелательных лекарственных реакций [2].
Показания к антибиотикопрофилактике
кесарево сечение — плановое и неотложное (уровень 1A);
ручное обследование полости матки, в том числе с целью отделения плаценты (уровень 4);
наличие глубоких разрывов мягких тканей родового канала (уровень 5);
проведение трех и более влагалищных исследований в родах (уровень 5);
преждевременный разрыв плодного пузыря (ПРПП) при доношенной беременности — вводятся антибиотики по прошествии 12 часов безводного промежутка и повторные дозы до окончания родового акта (уровень 1A);
положительные результаты бактериологических исследований отделяемого полового тракта на Streptococcus agalactiae в III триместре (уровень 2A);
внутриматочные вмешательства в послеродовом периоде (в частности, аспирация содержимого полости матки при лохиометре) (уровень 5).
Возможно расширение показаний для антибиотикопрофилактики в случаях неблагоприятных социально-экономических условий жизни беременной, выраженной анемизации (хронической анемии тяжелой степени или острой постгеморрагической анемии), повышенной кровопотери и при других патологических состояниях, когда ожидаем протекторный эффект антибиотикопрофилактики [11].
При наличии показаний она может быть пролонгирована до курсовой антибиотикотерапии.
Периоперационная антибиотикопрофилактика
Снижение частоты послеродового эндометрита на две трети — три четверти, а также частоты раневых инфекций подтверждает необходимость проведения антибиотикопрофилактики у женщин, которым выполняется плановая или неотложная операция кесарева сечения [5, 12, 22–26, 31, 32, 34, 37, 38].
Профилактика заключается во внутривенном введении одной терапевтической дозы β-лактамного антибиотика за 30 минут до начала операции (уровень 1A). При необходимости (например, в случае проведения кесарева сечения после длительного безводного промежутка) антибиотикопрофилактику продлевают до полного курса антибиотикотерапии [4].
Предоперационное введение антибиотиков (за 30 минут до начала операции) имеет преимущество перед интраоперационным, так как ассоциировано со значительным снижением частоты эндометрита (на 41%); по частоте развития раневой инфекции и инфекционных заболеваний у матери и ребенка режимы введения не различаются [7–9, 13, 16, 19–21].
Антибиотикопрофилактика снижает риск послеоперационных и послеродовых инфекционных осложнений в среднем на 10–30%, однако она не заменяет строгого следования правилам асептики и антисептики, а также качественной хирургической техники [4].
Препараты выбора для антибиотикопрофилактики (определены на основании литературных данных [3, 4, 6] и ежегодного анализа бактериального пейзажа лечебно-профилактических учреждений):
амоксициллин/клавуланат 1,2 г внутривенно;
ампициллин/сульбактам[1] 1,5 г внутривенно;
цефуроксим[2] 0,75 г внутривенно.
В качестве альтернативного препарата при наличии аллергической реакции на β-лактамы может быть использован азитромицин в дозе 500 мг внутривенно однократно [3].
АНТИБИОТИКОТЕРАПИЯ
Показания к курсовой антибактериальной терапии:
лихорадка в родах и послеродовом периоде, а также другие признаки интраамниотического инфекционного процесса (например, гноевидные выделения);
соматическая патология с инфекционным компонентом в стадиях суб- и декомпенсации (хронический бронхит, инфекция мочевыделительной системы (МВС), например бактериурия, цистит, пиелонефрит, в соответствии с данными бактериологического исследования и т. д.);
ПРПП при недоношенной беременности — при выжидательной тактике проводится 7–10-дневный курс с последующим повторным бактериологическим исследованием отделяемого цервикального канала (уровень 3A);
доказанное присутствие облигатных патогенов (Neisseria gonorrhoeae, Trichomonas vaginalis, Listeria monocytogenes) в отделяемом полового тракта;
угрожающие преждевременные роды (в том числе в сочетании с длительно сохраняющимися кровянистыми выделениями), изменение количества околоплодных вод (многоводие или маловодие) при предполагаемом инфекционном компоненте или в случае сочетания с другими показаниями для антибактериальной терапии.
Выявление при бактериологическом исследовании отделяемого полового тракта незадолго до родоразрешения обильного роста Escherichia coli, Enterococcus faecalis, E. faecium, Staphylococcus aureus, Haemophilus influenzae при отсутствии клинической симптоматики не является поводом для назначения антибактериальной терапии, однако необходима настороженность в отношении развития инфекционных осложнений у новорожденного, оптимальным является дублирование результата исследования в карту развития новорожденного.
Для проведения курсовой антибактериальной терапии используют те же препараты, что и для антибиотикопрофилактики (см. выше). Режим введения — 2–4 раза в сутки, длительность курса определяется конкретной клинической ситуацией, но не должна быть менее 5–7 дней, коррекция схем терапии производится по результатам антибиотикограммы. При необходимости подбора антибактериальной терапии в отношении L. monocytogenes следует учитывать резистентность к цефалоспоринам. В отсутствие факторов, отягчающих течение возможного инфекционного процесса, может быть применен ампициллин 0,5 г 4 раза в сутки внутривенно. Специфическая терапия трихомониаза: метронидазол 500 мг внутрь 2 раза в сутки в течение 5 дней.
В случае выписки пациентки из стационара для завершения начатого курса (при наличии клинико-лабораторного эффекта от проводимой антибактериальной терапии) парентеральный путь введения может быть заменен на пероральный; данный подход должен быть применен и в послеродовом периоде.
Пероральные (таблетированные) формы, рекомендуемые для продолжения начатых курсов антибиотикотерапии:
амоксициллин/клавуланат 500 мг + 125 мг или 875 мг + 275 мг 2–3 раза в сутки;
сультамициллин[3] 375 мг 2 раза в сутки.
Антибактериальная терапия при интраамниотической инфекции
Интраамниотическая инфекция — тяжелое осложнение беременности, зачастую предшествующее послеродовому эндометриту или системной инфекции [6, 17, 28, 40]. Клинический и субклинический инфекционный интраамниотический процесс является причиной ряда случаев преждевременных родов (согласно данным исследований, у 10% пациенток, госпитализированных с диагнозом преждевременных родов, результат бактериологического исследования околоплодных вод, полученных при амниоцентезе, был положительным [33]).
Для хориоамнионита характерен восходящий путь инфицирования из нижних отделов полового тракта. Этот процесс в большинстве случаев полимикробный, возможные возбудители: E. coli, Streptococcus группы B (GBS), представители родов Klebsiella, Bacteroides, Clostridium, Peptostreptococcus; субклинический вариант может быть ассоциирован с Mycoplasma, Ureaplasma, Fusobacterium [17, 28].
Хориоамнионит — клинический диагноз, характеризующийся двумя или более из следующих признаков:
лихорадка у беременной: t > 38 °С;
тахикардия у плода > 160 уд./мин;
тахикардия у беременной > 100 уд./мин;
болезненность матки, обычно в области дна, между схватками [31].
Субъективные симптомы (озноб, недомогание), зловонные выделения, лейкоцитоз наблюдаются часто, но не являются необходимыми для верификации диагноза.
При выявлении хориоамнионита вне зависимости от срока гестации беременная должна быть родоразрешена, оптимально это сделать в ближайшие 8–12 часов. Хориоамнионит — показание для родоразрешения, но не для кесарева сечения, однако ввиду наличия при хориоамнионите признаков страдания плода пациенток чаще родоразрешают абдоминально.
Для подбора адекватной антибактериальной терапии необходимо бактериологическое исследование отделяемого полового тракта, околоплодных вод, отделяемого с материнской поверхности плаценты (после родоразрешения), в случае гибели плода требуется бактериологический посев с его заушной области; хранение забранного материала до доставки в лабораторию крайне нежелательно.
Стартовая антибиотикотерапия в случае хориоамнионита — препараты широкого спектра действия (уровень 2B):
амоксициллин/клавуланат 1,2 г 2–3 раза в сутки внутривенно
или
ампициллин/сульбактам[4] 1,5 г 2–4 раза в сутки внутривенно.
При наличии зловонных выделений (признак анаэробной микрофлоры) в схему терапии включают метронидазол 500 мг 3 раза в сутки внутривенно, который дополняет действие β-лактамов в отношении грамотрицательной анаэробной микрофлоры.
МИКРОБИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ ОТДЕЛЯЕМОГО ПОЛОВОГО ТРАКТА
Данные бактериологического исследования отделяемого цервикального канала или заднего свода влагалища, проведенного при беременности, трудны для интерпретации. Это исследование обязательно при обследовании пациентки согласно действующим рекомендациям (в том числе в соответствии с приказом Минздрава России от 01.11.2012 № 572н «Об утверждении Порядка оказания медицинской помощи по профилю "акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)"», а также для определения колонизации S. agalactiae (в 35–37 недель гестации, уровень 1A [27]).
При подозрении на имеющийся инфекционный фактор показаниями к бактериологическому исследованию отделяемого цервикального канала или заднего свода влагалища служат:
мало-, многоводие, другие нарушения содержания амниотической жидкости (О40–О41.9 по МКБ-10);
задержка роста плода (О36.5) и плацентарные нарушения (О43.8);
врожденные пороки развития плода (О35.0–О35.9);
иммунизация при беременности (О36.0–О36.1).
С точки зрения прогнозирования риска гнойно-септических заболеваний разумнее проведение бактериологического исследования в родах с забором материала из межворсинчатого пространства материнской поверхности плаценты, в том числе при абдоминальном родоразрешении (несмотря на невысокую чувствительность метода при данной локализации). Бактериологическое исследование с забором отделяемого указанной локализации в родах необходимо проводить при длительном безводном промежутке, в случае лихорадки у роженицы, а также при антенатальной гибели плода.
Тактика при выявлении Streptococcus аgalactiae в отделяемом полового тракта[5]
S. agalactiae (GBS) признан наиболее частой причиной тяжелой ранней (развивающейся в первые 7 дней жизни) инфекции у новорожденных [18]. Проведение антибиотикопрофилактики в родах эффективно снижает риск ранних инфекционных осложнений у новорожденного, но не влияет на частоту развития поздних инфекционных осложнений, развивающихся на 7-й день жизни и позже. Существуют косвенные свидетельства действия антибиотикопрофилактики в родах на неонатальную смертность: обзор смертности, связанной с неонатальным сепсисом, в США выявил ее снижение в первую неделю после рождения в случае проведения антибиотикопрофилактики в родах (при этом используют стандартные препараты для антибиотикопрофилактики, см. выше) [18].
Пренатальный скрининг на GBS и последующее лечение (при GBS-носительстве) могут приводить к негативным последствиям для матери и ребенка: развитию анафилаксии, повышению медикаментозной нагрузки в родах и неонатальном периоде, селекции резистентных микроорганизмов.
В случае обнаружения при беременности GBS-носительства пренатальное лечение (до начала родов) не рекомендуется: антенатальная профилактика не уменьшает вероятность GBS-колонизации новорожденного в момент родов.
Пациенткам с GBS-бактериурией, выявленной при данной беременности, необходимо предложить антибиотикопрофилактику в родах даже в случае отсутствия бактериурии на момент родов (уровень 2A).
При обнаружении GBS-носительства при данной беременности женщины должны получить антибиотикопрофилактику в родах и при кесаревом сечении (уровень 2B).
В случае ПРПП при доношенной беременности при GBS-носительстве показана антибиотикопрофилактика; с учетом риска инфицирования плода при нарастании безводного промежутка в зависимости от акушерской ситуации может быть предложена индукция родов (уровень 2B).
При подозрении на хориоамнионит пациентке с GBS-колонизацией назначают антибиотикотерапию по стандартной схеме (см. выше); при отсутствии родовой деятельности выполняют ее индукцию (уровень 2A).
Если GBS был обнаружен при предыдущей беременности, вероятность носительства при последующей беременности составляет около 38%, что должно послужить поводом для полноценного обследования пациентки.
Показания к проведению GBS-специфической антибиотикопрофилактики в родах:
инвазивная GBS-инфекция у ребенка от предыдущих родов;
GBS-бактериурия при данной беременности;
положительный результат бактериологического исследования отделяемого полового тракта на GBS при данной беременности;
лихорадка в родах (t > 38 °С), хориоамнионит (следует использовать антибактериальный препарат β-лактамного ряда).
ТАКТИКА ПРИ ИНФЕКЦИИ МОЧЕВЫДЕЛИТЕЛЬНОЙ СИСТЕМЫ
Инфекция МВС характеризуется наличием в моче микроорганизмов в титре 105 КОЕ/мл при бессимптомном течении, а при наличии клиники воспалительного процесса — в титре более 100 КОЕ/мл вкупе с пиурией (> 7 лейкоцитов/мл мочи). Диагноз инфекции МВС должен быть подтвержден положительной культурой уропатогена, особенно у пациенток со стертой симптоматикой [19, 30].
С одной стороны, инфекция МВС ассоциирована с рисками для плода и матери (пиелонефрит, преждевременные роды, рождение детей с низкой массой тела, повышение перинатальной смертности) [35]. Рекомендовано на ранних сроках гестации как минимум один раз выполнять скрининг беременных на бактериурию с помощью культурального исследования мочи[6] и при получении положительных результатов проводить лечение (уровень 1A) для снижения риска пиелонефрита, малого веса плода при рождении, развития преждевременных родов [29, 35]. С другой стороны, в недавнем исследовании показано, что отсутствие терапии при бессимптомной бактериурии не повышает риск преждевременных родов у женщин с неосложненной беременностью; кроме того, абсолютный риск пиелонефрита при отсутствии санации бессимптомной бактериурии описан как низкий [19].
Основные возбудители инфекции МВС представлены в таблице 2; источник распространения уропатогенов — фекальная микрофлора, колонизирующая область промежности.
Таблица 2
Основные уропатогены при инфекции мочевыделительной системы
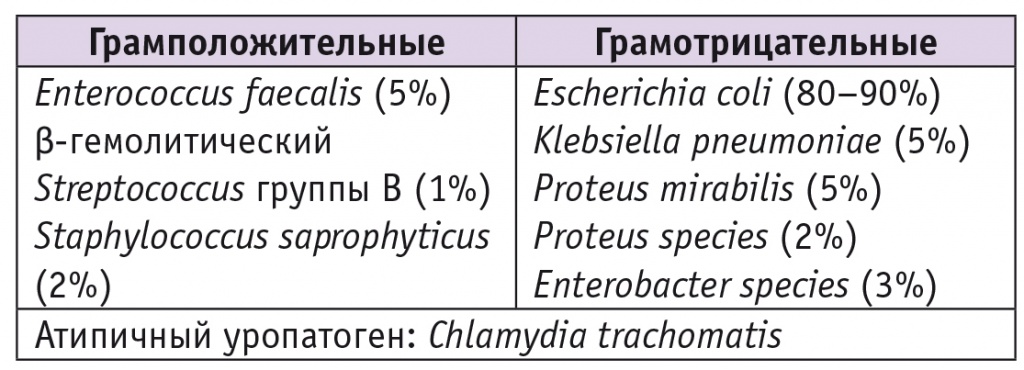
Грамположительные инфекты, в частности E. faecalis и GBS, клинически значимы. Агрессивный внебольничный уропатоген S. saprophyticus способен вызвать восходящую персистирующую и рецидивирующую инфекцию МВС. Уреазаположительные инфекты, в том числе Proteus, Klebsiella, Pseudomonas, могут защелачивать мочу, что ассоциировано с нефролитиазом. Хламидийная инфекция составляет порядка 30% атипически протекающих инфекций МВС, выявление Chlamydia trachomatis выполняется некультуральными методами, прежде всего ПЦР. Наличие GBS-колонизации может явиться причиной инфекционных осложнений у плода.
Важно соблюдать правила сбора и исследования мочи. Сбор проб мочи на исследование проводится до начала антибактериальной терапии; после гигиенических мероприятий выполняют забор средней порции утренней мочи. Катетеризация не должна рутинно использоваться из-за риска восходящей инфекции, но показана в случае невозможности гигиенических мероприятий, например ввиду выраженного ожирения. Маркировка проб мочи о способе забора (свободновыпущенная моча или полученная при катетеризации) обязательна.
Доставка материала в лабораторию должна производиться по возможности в течение часа после забора, поскольку длительное хранение проб при комнатной температуре может привести к ложным результатам.
Традиционно два положительных посева свободновыпущенной мочи, выявляющие идентичный инфект в количестве 105 КОЕ/мл и более, трактуются как положительный культуральный тест. При посеве мочи, полученной при катетеризации, однократное выявление одного инфекта в количестве 100 КОЕ/мл тоже расценивается как положительный диагностический тест. Содержание бактерий менее 105 КОЕ/мл, выявление двух и более микроорганизмов в большей степени свидетельствуют о контаминации.
Присутствие в моче микроорганизмов, которые не являются уропатогенами, в количестве более одного микроорганизма и в титре менее диагностического (< 105 КОЕ/мл), как правило, свидетельствует о контаминации пробы.
В связи с контаминацией частота ложноположительных результатов однократного посева средней порции мочи может достигать 40%.
Выявление в общем анализе мочи нитритов, эстеразы лейкоцитов, самих лейкоцитов, эритроцитов, белка, бактерий также может свидетельствовать в пользу наличия инфекции МВС.
Антибактериальная терапия при бессимптомной бактериурии и остром цистите
Препараты выбора при бессимптомной бактериурии и остром цистите — оральные антибактериальные средства [1, 19, 36]:
амоксициллин/клавуланат 625 мг 3 раза в сутки внутрь 7 суток;
фосфомицин 3,0 г внутрь однократно;
цефиксим 400 мг 1 раз в сутки внутрь 7 суток;
цефуроксим 250–500 мг 2 раза в сутки внутрь 7 суток[7].
Альтернативная терапия — нитрофурантоин[8] 100 мг 3 раза в сутки внутрь 7 суток (только во II триместре).
Фосфомицин эффективен в случае неосложненной инфекции МВС, вызванной чувствительными E. coli и E. faecalis. Как отмечено выше, он может назначаться в дозе 3,0 г per os однократно; при рецидивирующей инфекции возможен повторный прием 3,0 г фосфомицина через 24 часа.
Нитрофурантоин безопасен и эффективен при инфекции нижних отделов МВС, малая способность к тканевой пенетрации ограничивает его использование при пиелонефрите. Применение нитрофурантоина в конце III триместра ограничено из-за риска гемолитического эффекта у плода и новорожденного: действуя на ферменты незрелых эритроцитов, он способен вызывать их лизис.
Оптимальным является назначение антибактериальных препаратов в зависимости от данных антибиотикограмм.
С целью эрадикации уропатогена возможно проведение 10–14-дневных курсов антибиотикотерапии.
Повторные бактериологические исследования мочи должны быть выполнены спустя 1–2 недели после окончания терапии; отсутствие эрадикации уропатогена — показание для повторного 10- или 14-дневного курса лечения.
Антибактериальная терапия при остром пиелонефрите
При стабильном состоянии пациентки, неосложненном течении заболевания возможно пероральное лечение, в иных ситуациях показано внутривенное введение антибиотиков. Вследствие дегидратации из-за тошноты и рвоты при выраженной интоксикации существует вероятность развиразвития у пациентки респираторного дистресс-синдрома взрослых [19].
Возможна ступенчатая терапия: стартовое лечение парентеральным антибиотиком, а после стабилизации состояния — переход на пероральный прием того же антибиотика (или другого препарата из его группы с идентичным спектром действия) [19].
Схемы эмпирической терапии приведены ниже [1, 19]. Длительность антибактериального лечения определяется индивидуально, но должна составлять не менее 7 дней (при тяжелом течении заболевания — 14 дней и более).
Стартовая терапия:
амоксициллин/клавуланат 1,2 г 3 раза в сутки внутривенно или 625 мг 3 раза в сутки внутрь;
цефуроксим 750–1500 мг 3 раза в сутки внутривенно, внутримышечно или внутрь;
цефотаксим 1,0 г 3–4 раза в сутки внутривенно или внутримышечно;
цефтриаксон 1,0 г 1–2 раза в сутки внутривенно или внутримышечно;
цефтибутен 400 мг 1 раз в сутки внутрь;
цефиксим 400 мг 1 раз в сутки внутрь[9].
При тяжелом течении и угрозе развития уросепсиса предпочтительна терапия
- карбапенемами или следующими ингибиторозащищенными β-лактамами:
эртапенем 1,0 г 1 раз в сутки внутривенно 14 суток;
- имипенем/циластатин 500 мг 4 раза в сутки внутривенно 14 суток;
- меропенем 1,0 г 3 раза в сутки внутривенно 14 суток;
- цефоперазон/сульбактам 2–4 г 2 раза в сутки внутривенно 14 суток.
Если уропатоген известен (имеются результаты бактериологического исследования мочи), выбор антибактериального средства проводится после интерпретации антибиотикограммы. Возможные схемы терапии с учетом популяционных и локальных данных резистентности распространенных уропатогенов приведены в таблице 3.
Таблица 3
Выбор антибактериальной терапии в отношении распространенных уропатогенов [3]

При курации пациенток с рецидивирующим течением инфекции МВС, наличием инородных тел в МВС (микролитов, катетеров-стентов и др.), а также у женщин, перенесших хирургические вмешательства на органах МВС при беременности (в том числе наложение нефростомы), необходима настороженность в отношении таких возбудителей, как Pseudomonas aeruginosa, метициллин-устойчивый S. aureus. При их выявлении требуется коррекция антибактериальной терапии по результатам антибиотикограммы.
ЗАКЛЮЧЕНИЕ
Представленный обзор акушерских клинических рекомендаций в очередной раз показывает необходимость не только регламентированного назначения антибактериальных препаратов в условиях акушерского стационара, но и оптимизации рутинно применяемых схем лечения в соответствии с доказательными данными и клиническими рекомендациями последних лет. На основе изложенных рекомендаций авторами предложена программа контроля расходования антимикробных препаратов (Steward ship program), которая может быть разработана для каждого ЛПУ и является реализацией инициативы, предусматривающей только необходимое и оправданное использование антибактериальных препаратов у конкретного пациента [37]. Программа включает оптимизацию всех этапов терапии, в том числе выбор антибактериального препарата, пути введения, дозы, длительности лечения, применение принципов ступенчатой и деэскалационной терапии [14]; результаты интеграции программы в лечебный процесс — оптимизация расходования антибактериальных препаратов, стабилизация или снижение риска антибиотикорезистентности микроорганизмов, обеспечение безопасности пациента (унификация показаний к назначению антибактериальных препаратов минимизирует риск терапии без показаний), уменьшение затрат на лечение [15, 37, 41]. Внедрение программы [37] в работу Областного перинатального центра Свердловской областной детской клинической больницы № 1 (Екатеринбург) привело к сокращению расходования антимикробных препаратов в 2,5 раза в 2015 г. (6438 доз за первое полугодие) в сравнении с 2014 г. (19 141 доза за аналогичный период).







