ВВЕДЕНИЕ
В последние годы накоплено немало сведений о причинах неконтролируемого течения бронхиальной астмы (БА). Приоритетными направлениями в современной диагностике и терапии БА являются поиск и выделение биомаркеров аллергического воспаления и ремоделирования дыхательных путей[1, 2].
Репозиция внеклеточного матрикса дыхательных путей приводит к изменению архитектуры стенки бронхов и прогрессирующему снижению вентиляционной функции легких. Время развития ремоделирования (до, параллельно или после манифестации заболевания), его темпы, факторы, определяющие выраженность деструктуризации бронхиальной стенки, освещены во многих клинических исследованиях[3–5]. Установлено, что ремоделирование характеризуется сложными механизмами эпителиально-мезенхимального перехода, гиперплазии гладкомышечных элементов, развития новых сосудов.
Активация эндотелиальных клеток, включающихся в ангиогенез, контролируется факторами роста, в частности фактором роста эндотелия сосудов (vascular endothelial growth factor, VEGF-A). В результате действия проангиогенных факторов образуется новая капиллярная сеть, что приводит к усилению механизма обструкции за счет нарастания отека и гиперсекреции слизи в дыхательных путях[6–8].
Получены данные о взаимосвязи уровня VEGF-A с нарушением бронхиальной проходимости и степенью контроля над заболеванием. Однако на настоящий момент мало данных о статусе VEGF-A при контролируемом и неконтролируемом течении БА[5, 9].
Целью настоящего исследования явилось изучение концентрации VEGF-A при контролируемом (КБА) и неконтролируемом течении БА (НБА) у детей.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено обследование 71 ребенка с верифицированным диагнозом БА: 37 детей со среднетяжелым и 34 с тяжелым течением болезни.
Одномоментное исследование уровня VEGF-А проводилось с учетом наличия контроля заболевания в двух независимых выборках: I группа — 26 детей с КБА, II группа — 25 пациентов с НБА. Сравнивали больных КБА и НБА отдельно в группах среднетяжелого и тяжелого течения БА. Соотношение среднетяжелая/тяжелая БА в группе I составило 17/9, в группе II — 11/14 (р > 0,05). Соотношение мальчиков и девочек значимо не различалось, средний возраст пациентов — 9,0 ± 2,5 года. Диагноз БА установлен, согласно клиническим рекомендациям, отечественным согласительным документам[10].
Исследование проведено в 2014–2015 гг. Участников отбирали в отделении пульмонологии Краевой детской клинической больницы г. Читы (главный врач — Комаров В.В.) при поступлении на лечение по поводу обострения.
Критериями включения явились:
- возраст пациентов от 1 до 18 лет;
- наличие информированного добровольного согласия пациентов старше 15 лет, у детей до 15 лет — согласия родителей.
Критерии невключения:
- интеркуррентные воспалительные заболевания;
- хронические заболевания в стадии обострения;
- врожденные аномалии развития легких;
- тяжелые и декомпенсированные заболевания печени и почек, сердечно-сосудистой системы.
Критерий исключения: отказ родителей или пациентов от участия в исследовании.
Протокол исследования включал стандартное клинико-лабораторное обследование с оценкой основных вентиляционных параметров: объема форсированного выдоха за 1-ю секунду (ОФВ1), форсированной жизненной емкости легких (ФЖЕЛ), скоростных потоков на уровне крупных, средних и мелких бронхов (МОС25, МОС50 и МОС75). Лабораторно определена концентрация VEGF-A.
Этическая экспертиза: исследование организовано в соответствии с этическими принципами, предъявляемыми Хельсинкской декларацией Всемирной медицинской ассоциации (World Medical Association Declaration of Helsinki 1964 г. с поправками 2011 г.) и Правилами клинической практики в Российской Федерации, утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266 «Об утверждении Правил клинической практики в Российской Федерации». Протокол клинического исследования одобрен локальным этическим комитетом ФГБОУ ВО «Читинская государственная медицинская академия» Министерства здравоохранения Российской Федерации.
Статистическую обработку данных проводили с помощью стандартного пакета Statistica 6.0 (StatSoft Inc., США), Microsoft Office Excel с использованием методов непараметрического анализа. Для количественных данных определяли медиану, а также 25-й и 75-й процентили. Для всех видов анализа статистическую значимость различий констатировали при значениях p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Согласно современным данным, контроль астмы складывается из двух параметров: текущий клинический контроль симптомов и будущие риски неблагоприятного исхода заболевания[10, 11]. НБА диагностируют при недостаточном контроле симптомов заболевания и/или частых обострениях (≥ 2 раз в год), когда требуется прием оральных кортикостероидов, или при тяжелых обострениях (≥ 1 раз в год) и необходимости госпитализации[11].
В соответствии с современными рекомендациями, оценка степени контроля проводится за последние 4 недели; меньший срок (1–2 недели) не является достоверным, так как может включать в себя симптомы будущего обострения[11].
Краткая клинико-анамнестическая характеристика пациентов групп I и II представлена в таблице.
Таблица
Клиническая характеристика пациентов с контролируемым и неконтролируемым течением бронхиальной астмы (КБА и НБА)
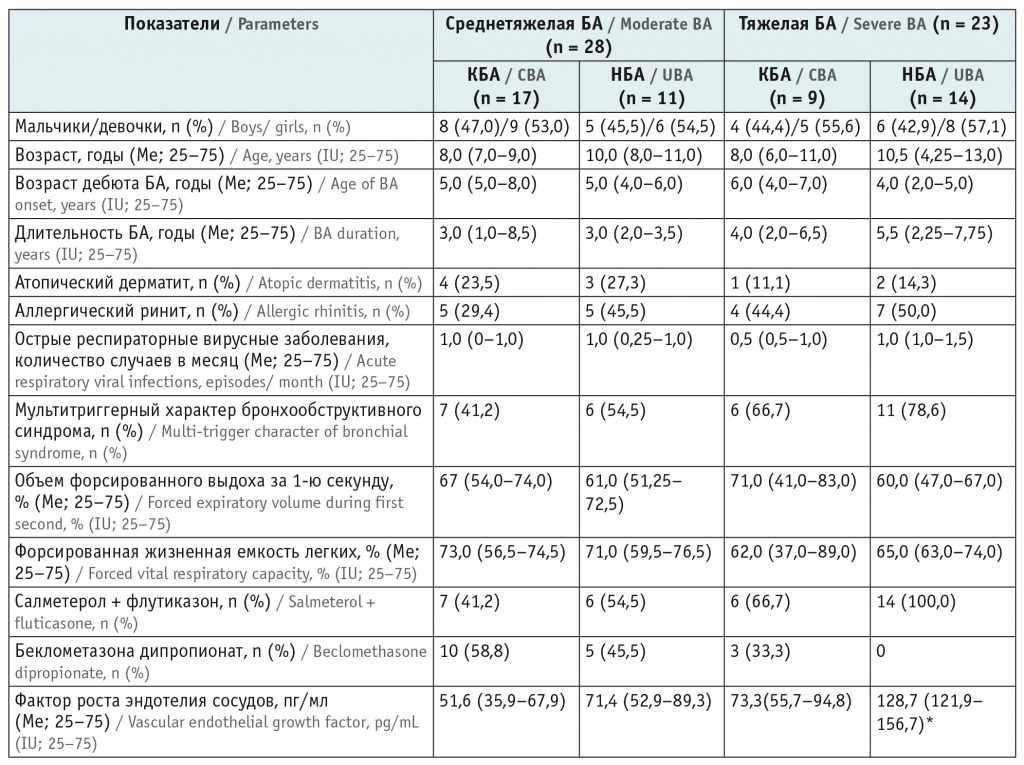
* Отличие от группы тяжелой контролируемой бронхиальной астмы по критерию Манна — Уитни статистически значимо (р < 0,05).
Следует отметить, что значимых различий по возрасту не было, хотя наметилась тенденция к отсутствию контроля среди детей среднего и старшего школьного возраста как при среднетяжелой, так и при тяжелой БА — 8 (72,7%) и 8 (57,1%) соответственно.
Длительность заболевания 5 лет и более превалировала у детей с неконтролируемой среднетяжелой и тяжелой астмой: 7 (28%) против 3 (11,5%) в группе КБА. Более ранняя манифестация тяжелой НБА у 8 (57,1%) больных сочеталась с длительностью заболевания более 5 лет. Целевые показатели хорошего контроля имели место у 21 (80%) пациента, наблюдаемого по поводу БА в течение 1–5 лет.
Значимость наследственного анамнеза подтверждается наличием атопических заболеваний у родственников при неудовлетворительном контроле среднетяжелой астмы у каждого пятого пациента. Отягощенная наследственность по обеим родственным линиям отмечалась у 7 (50%) детей с неудовлетворительным контролем тяжелой БА и лишь у 2 (22,2%) обследуемых с тяжелой КБА.
В раннем возрасте у детей с тяжелой НБА чаще наблюдалось wheezing («свистящее» дыхание) (1–2 раза в месяц), связанное или не связанное с ОРВИ: 6 (42,9%) случаев против 3 (33,3%) в группе тяжелой КБА (р > 0,05). Дневные и ночные симптомы заболевания провоцировались комплексом триггеров: более трети больных тяжелой НБА (78,6%) и 54,5% со среднетяжелой реагировали на физическую нагрузку, аллергены и респираторную вирусную инфекцию. В структуре аллергенов при потере контроля над заболеванием в основном встречалась поливалентная сенсибилизация (n = 7, 28%).
Содержание общего сывороточного IgЕ превышало референсные значения при тяжелой и среднетяжелой НБА: 215,5 МЕ/мл (95%-ный ДИ: 53,65–845,5 МЕ/мл) и 187,5 МЕ/мл (95%-ный ДИ: 92,4–360,5 МЕ/мл) соответственно. В группах КБА уровни IgЕ составили 105,5 МЕ/мл (95%-ный ДИ: 33,26–496,5 МЕ/мл) и 93,4 МЕ/мл (95%-ный ДИ: 32,3–462,9 МЕ/мл) соответственно.
В исследовании D. Lo и соавт. (2019) рекомендуется проводить КТ детям с длительным тяжелым течением БА в связи с вероятностью формирования структурных изменений в легких[12]. В нашем исследовании признаки гиперинфляции легочной ткани с неравномерностью вентиляции зарегистрированы только у 7 (28%) пациентов с неудовлетворительным контролем симптомов астмы, у остальных фиксировались признаки усиления легочного рисунка и гиперинфляции. Тяжелое течение БА сопровождалось признаками гиперинфляции при рентгенологическом обследовании у 8 (57,1%) детей с отсутствием контроля и только у 3 (33,3%) с хорошим контролем тяжелой астмы, неравномерность вентиляции описана у 5 (35,7%) из них.
Для оценки вентиляционных нарушений были выбраны показатели ОФВ1 и ФЖЕЛ. Известно, что снижение ФЖЕЛ может отражать наличие воздушных «ловушек», имеющих обратную корреляцию с остаточным объемом легких и демонстрирующих феномен гиперинфляции. Высокая степень периферического сопротивления может быть обусловлена выраженными изменениями дыхательных путей вследствие субэпителиального фиброза, отека и гиперплазии гладкомышечных элементов[13]. У детей с отсутствием контроля при среднетяжелой и тяжелой астме мы наблюдаем более низкие показатели ОФВ1, что подтверждает тяжесть течения заболевания и прогрессирующие изменения вентиляционной функции легких. Параметры ФЖЕЛ практически одинаковы вне зависимости от степени контроля (см. табл.).
Определение концентрации VEGF-A имеет существенное значение для пациентов с плохим контролем заболевания или его отсутствием. Заметим, что значимость данного показателя обусловлена формированием неокапиллярной сети в стенке бронха за счет гипоксии, особенно выраженной при тяжелом течении астмы.
При среднетяжелой БА концентрация VEGF-A выше в 1,4 раза у пациентов с неконтролируемым течением заболевания, чем у больных с хорошим контролем. Отмечено увеличение уровня VEGF-A в 1,8 раза (р < 0,05) при тяжелой НБА в сравнении с таковым при КБА, что предполагает инициацию его синтеза у детей с длительным хроническим воспалением дыхательных путей и, несомненно, демонстрирует его включение в процессы ремоделирования, наиболее выраженные при неконтролируемом варианте БА.
Анализ взаимоотношений уровня VEGF-А с показателями легочной вентиляции выявил значимую умеренной силы отрицательную связь с ОФВ1 (rs = –0,34) и ФЖЕЛ (rs = –0,51) при тяжелой НБА (р < 0,05), что подтверждается данными о тесной взаимосвязи гиперплазии гладкомышечных элементов с повышенной васкуляризацией[17].
Таким образом, мы установили, что концентрация VEGF-А выше у пациентов с отсутствием контроля заболевания, а это предполагает его вклад в процессы ремоделирования при БА[9]. Полученный вывод дополняется сведениями о взаимосвязи VEGF-А со снижением параметров легочной вентиляции при отсутствии целевого уровня контроля БА.
ЗАКЛЮЧЕНИЕ
Изучение уровня фактора ангиогенеза (VEGF-A) у детей при контролируемом и неконтролируемом течении бронхиальной астмы (БА) представляется нам очень важным. Неоваскуляризация усугубляет аномальную перестройку стенки бронха, а также увеличивает трансмиграцию клеток, участвующих в реализации аллергического воспаления в тканях, через эндотелий, создавая таким образом предпосылки для воспаления. В связи с этим с практической точки зрения VEGF-A можно рассматривать как потенциальную терапевтическую мишень при разработке антиангиогенных препаратов для контроля БА. Однако в исследовании присутствуют ограничения, в частности небольшие размеры выборки, что обусловливает необходимость продолжения изучения данного вопроса.
Поступила: 26.12.2019
Принята к публикации: 20.01.2020







