Не вызывает сомнений, что операции эндопротезирования суставов нижних конечностей, как и все прочие оперативные вмешательства, не имеющие «жизнеспасающего» характера, но направленные на повышение качества жизни, должны сопровождаться минимумом побочных эффектов или не иметь их совсем. В этой ситуации закономерно предъявляются повышенные требования к эффективности и безопасности их анестезиологического обеспечения. Парадоксально, но факт: единой точки зрения относительно оптимального метода анестезии и анальгезии в «большой» ортопедии до сих пор не сформировано. Более того, сложно назвать какоелибо хирургическое вмешательство помимо ТЭТС и ТЭКС, мнения об анестезиологическом обеспечении которого были бы настолько противоречивы, что доходили бы до взаимоисключающих. В данной обзорной работе мы рассмотрим различные точки зрения и попытаемся сделать определенные выводы в отношении оптимизации анестезиологического обеспечения ТЭКС и ТЭТС.
ЧТО ЕСТЬ В АРСЕНАЛЕ?
На сегодняшний день имеются четыре основных варианта анестезии и послеоперационной анальгезии при операциях указанного типа:
1) общая анестезия (ОА) с послеоперационным системным введением опиоидов (обычно в режиме анальгезии, контролируемой пациентом);
2) одновременная блокада бедренного и седалищного нервов (в сочетании с ОА или седацией), послеоперационное обезболивание достигается путем продленной блокады бедренного нерва (при ТЭКС);
3) спинальная анестезия (СА) с послеоперационной опиоидной анальгезией или (при ТЭКС) послеоперационной продленной блокадой бедренного нерва;
4) эпидуральная анестезия (ЭА), чаще комбинированная — спинальноэпидуральная анестезия (СЭА), с пролонгацией эпидуральной анальгезии на послеоперационный период.
Выбор определенного варианта анестезиологического обеспечения зависит от предпочтений той или иной клиники, а также имеет географические особенности. В частности, в большинстве стран Европы более популярны различные модификации регионарной анестезии. Возможно, это связано с тем, что еще в 1999 г. регионарная анестезия была представлена в качестве метода выбора в официальном документе Британской ассоциации ортопедов «Положительный опыт тотального эндопротезирования тазобедренных суставов» [5].
За океаном методом выбора изначально являлась ОА. Однако на протяжении последних 10–15 лет там произошла определенная эволюция взглядов, которую интересно проанализировать.
ЭВОЛЮЦИЯ ВЗГЛЯДОВ НА АНЕСТЕЗИОЛОГИЧЕСКОЕ ОБЕСПЕЧЕНИЕ «БОЛЬШИХ» ОРТОПЕДИЧЕСКИХ ОПЕРАЦИЙ В США
В 2013 г. группа американских коллег (среди которых были такие корифеи ортопедической анестезиологии, как S. Memtsoudis и N. Sharrock) в журнале Anesthesiology представила анализ анестезиологического обеспечения 382 236 пациентов приблизительно 400 американских клиник, перенесших операции первичного ТЭТС или ТЭКС в 2006–2010 гг. [6]. Нейроаксиальная анестезия (НА) была применена всего лишь у 10,5% пациентов (n = 40 036), НА в сочетании с ОА — еще у 12,9% (n = 49 396); основная часть пациентов (n = 292 804; 76,6%) была оперирована в условиях «чистой» ОА. В таблице 1 представлены некоторые данные этого исследования, свидетельствующие о влиянии метода анестезии на частоту серьезных осложнений периоперационного периода.
Таблица 1
Влияние метода анестезии на частоту серьезных осложнений периоперационного периода при тотальном эндопротезировании суставов нижних конечностей (2006–2010) [6]
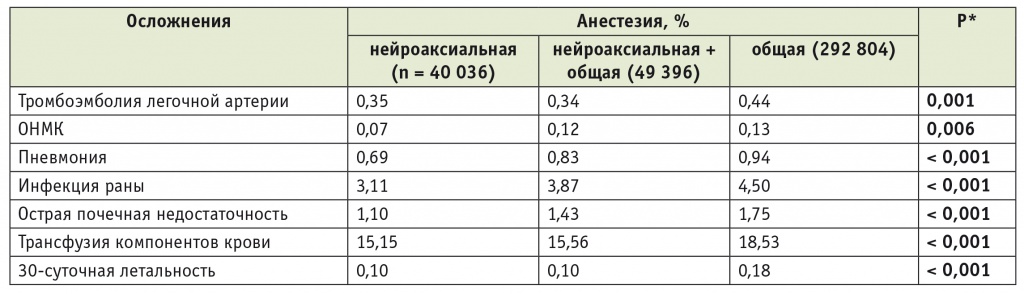
* Сравнение между нейроаксиальной и общей анестезией.
Примечание. ОНМК в таблицах 1–3 — острое нарушение мозгового кровообращения.
Как видно из представленной таблицы, 30суточная летальность среди пациентов, оперированных с применением НА, была почти в 2 раза ниже, чем в группе ОА, что обусловлено значительным снижением частоты жизнеугрожающих осложнений (ТЭЛА, ОНМК и т. д.). Авторы сделали осторожные выводы о том, что применение НА при первичном эндопротезировании суставов нижних конечностей сопряжено с лучшими результатами, чем использование ОА, но необходимы дальнейшие исследования.
Годом ранее практически та же группа авторов в журнале Regional Anesthesia and Pain Medicine опубликовала статью с оценками влияния метода анестезии (ОА или НА) на течение периоперационного периода у 15 687 пациентов, перенесших одномоментное двустороннее ТЭКС в период 2006–2010 гг. [7]. Основные результаты этой работы представлены в таблице 2.
Таблица 2
Влияние метода анестезии на частоту серьезных осложнений периоперационного периода при одномоментном двустороннем тотальном эндопротезировании коленных суставов (2006–2010) [7]
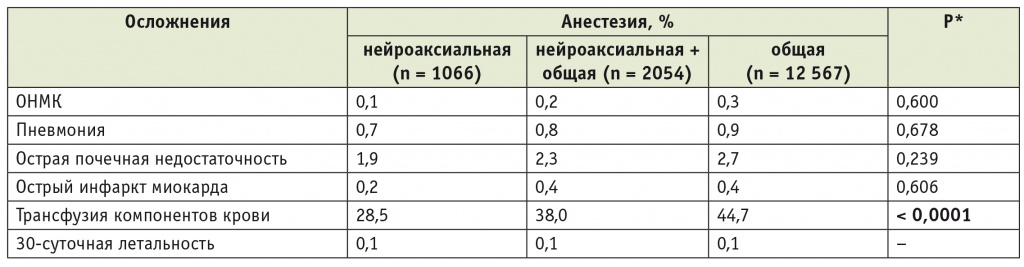
* Сравнение между нейроаксиальной и общей анестезией.
В данном исследовании частота применения НА также была невелика — 6,8%, в сочетании с ОА — еще 13,1%; «чистая» ОА использовалась в 80,1% случаев. Как видно
из таблицы, авторы не выявили влияния метода анестезии на летальность. Были отмечены тренд снижения частоты жизнеугрожающих осложнений при использовании НА (хотя различия и не достигали достоверной значимости), а также статистически значимое снижение потребности в гемотрансфузии на фоне НА. Тем не менее в заключении авторы указывают, что НА может быть использована как часть мультимодального подхода, направленного на снижение частоты осложнений после одномоментного двустороннего ТЭКС.
В ряде исследований, правда, уступавших вышеуказанным работам по количеству пациентов, продемонстрированы преимущества НА перед ОА в отношении снижения объема кровопотери и потребности в гемотрансфузии, уменьшения частоты тромбоэмболических осложнений, а также инфекции области хирургической раны [8–13].
В частности, в работе C. Chang и соавт. с участием 3081 пациента, перенесшего операции ТЭТС или ТЭКС, инфекция послеоперационной раны на протяжении 30 суток наблюдения была отмечена у 2,8% оперированных под ОА и у 1,2% оперированных в условиях НА [8].
В другом исследовании [14] проводился анализ послеоперационного периода у 16 555 пациентов, перенесших ТЭКС с применением ОА или НА. После ОА (9167 пациентов) частота пневмонии составила 0,45%, а после НА (7388 пациентов, оперированных под СА или ЭА) — 0,24%, т. е. на 47% меньше. В целом частота системной инфекции среди оперированных с применением ОА достигла 3,73%, а среди оперированных в условиях НА этот показатель был на 21% ниже — 2,95%.
В обзорной работе, посвященной госпитальным факторам риска инфекционных осложнений после ТЭТС, сделано заключение: в последние годы получен ряд доказательств, что регионарная анестезия, в сравнении с общей, снижает частоту системных и, вероятно, локальных инфекционных осложнений [15]. В качестве основных механизмов позитивного влияния авторы указали: 1) улучшение локальной тканевой перфузии, 2) стабилизацию иммунного статуса (снижение выраженности стрессответа, вызывающего иммуносупрессию) и 3) уменьшение потребности в гемотрансфузии (рассматриваемой как фактор иммуносупрессии).
Следует обратить внимание на то, что уменьшение потребности в гемотрансфузии на фоне НА уже в нескольких обзорных работах отмечено как значимый фактор снижения частоты осложнений послеоперационного периода [7, 13, 15]. Более того, анализируя современные подходы к анестезиологическому обеспечению операций эндопротезирования суставов нижних конечностей, G. Güler и соавт. в отдельные группы риска выделяют пациентов: 1) которым выполняется цементное эндопротезирование, 2) страдающих ХОБЛ, 3) оперированных в условиях ОА и 4) которым проводилась аллогенная гемотрансфузия [16].
Итак, к началу второго десятилетия XXI века в США была накоплена достаточно объемная информация, свидетельствовавшая о преимуществах регионарной анестезии перед ОА при обеспечении операций ТЭТС и ТЭКС. Каким же образом это повлияло на анестезиологическую тактику в американских клиниках?
Мультицентровое исследование, представленное в 2015 г., включило более 370 клиник США, в которых в период 2010–2012 гг. было выполнено 20 936 операций ТЭТС [17][1].
[1] Поскольку ранее упомянутое масштабное исследование S. Memtsoudis [6] тоже охватывало около 400 клиник, можно предположить, что данные и в том, и в другом случае были взяты из единого национального регистра. — Примеч. авторов.
В условиях ОА были оперированы 12 752 пациента (60,9%), у остальных 8184 пациентов (39,1%) применялась СА. Обращает на себя внимание тот факт, что по сравнению с предыдущим десятилетием процент НА увеличился более чем в 1,5 раза [6].
Важно отметить, что пациенты, оперированные под ОА, в целом были моложе (p < 0,001) и имели меньше сопутствующих заболеваний (по индексу коморбидности Чарлсона), тем не менее частота осложнений периоперационного периода у них была выше: 23,5% vs 19,6% у пациентов, оперированных с применением СА (табл. 3).
Таблица 3
Влияние метода анестезии на частоту серьезных осложнений периоперационного периода при операциях тотального эндопротезирования тазобедренных суставов (2010–2012) [17]
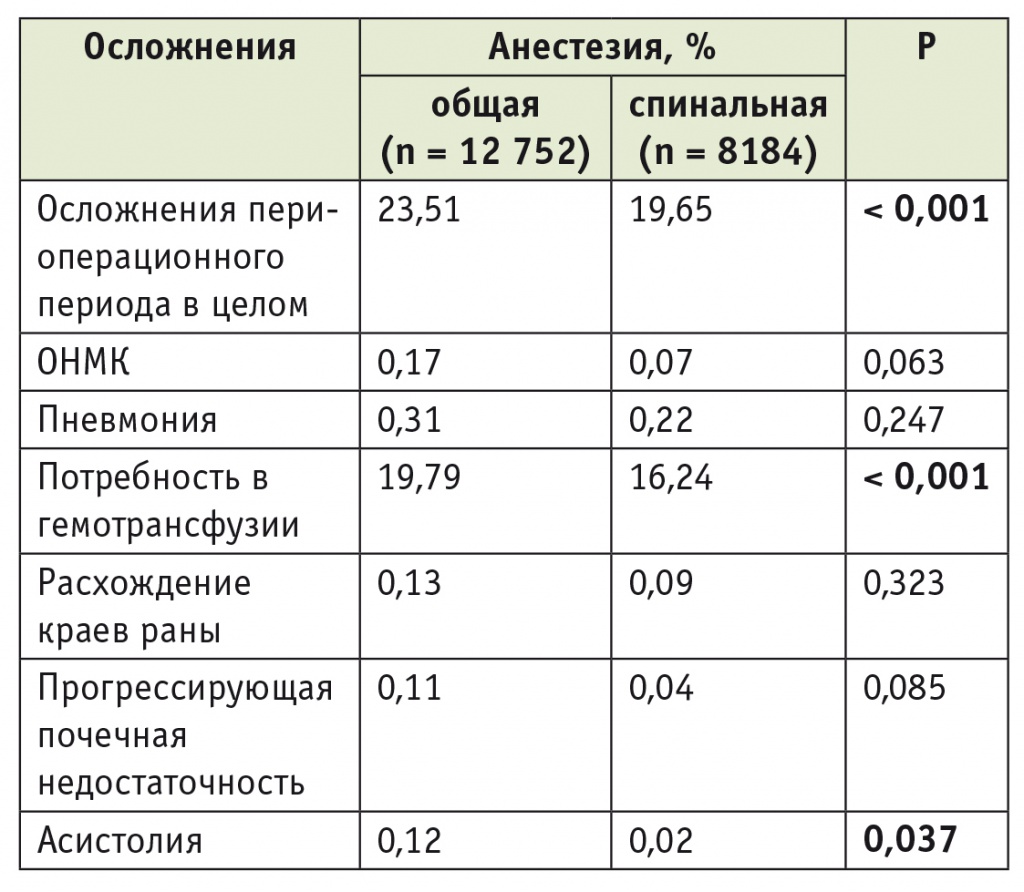
Среди оперированных под ОА были отмечены бóльшая частота ОНМК (0,17% vs 0,07%), пневмонии (0,31% vs 0,22%), прогрессирующей почечной недостаточности (0,11% vs 0,04%), более частое расхождение краев раны (0,13% vs 0,09%), бóльшая потребность в гемотрансфузии (19,8% vs 16,2%) и, наконец, более высокий риск периоперационной асистолии — 0,12% vs 0,02%.
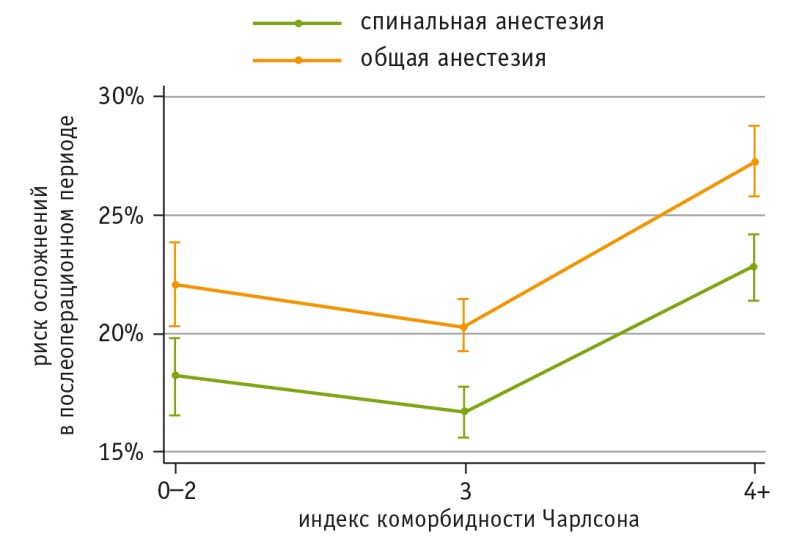
Вероятность любых осложнений послеоперационного периода среди пациентов с низким индексом коморбидности Чарлсона (0–2) была достоверно выше у оперированных под ОА (22,1%), чем под СА (18,2%). Аналогичное соотношение отмечено для пациентов с индексом Чарлсона, равным 3: 20,3% для ОА и 16,7% для СА. При индексе Чарлсона ≥ 4 риск осложнений оценивался в 27,3% для ОА и 22,8% для СА (рис.).
Рис. Прогнозирование вероятности осложнений в течение 30 суток после первичного тотального эндопротезирования тазобедренных суставов в зависимости от метода анестезии и индекса коморбидности Чарлсона [17]
Есть еще одно исследование, которое характеризует изменение подходов к обеспечению «больших» ортопедических операций в США. Его авторы, используя базу данных Института качества анестезии США (англ. Anesthesia Quality Institute), проанализировали информацию об анестезиологическом обеспечении 108 625 операций первичного ТЭКС, выполненных с 2010 по 2013 г. [18].
В условиях ОА были проведены 57,9% (n = 62 865) операций, еще 31,3% (n = 33 964) вмешательств выполнены с использованием НА, а оставшиеся 10,8% (n = 11 796) с использованием блокад периферических нервов (БПН). Таким образом, частота применения регионарной анестезии в целом уже превысила 40% [18].
Как и в цитированной выше работе B. Basques и соавт. [17], пациенты, которым проводилась ОА, были моложе (средний возраст — 66 лет), чем в группе НА (средний возраст — 67 лет). Среди оперированных с использованием БПН доля пациентов со статусом по классификации ASA ≥ III (44,9%) была больше, в сравнении с группами НА (37,7%) и ОА (37,5%) [18].
В данном исследовании учитывались категории лечебных учреждений, в которых выполнялись операции ТЭКС: университетская клиника, крупная муниципальная клиника с числом коек более 500, средняя муниципальная клиника (от 100 до 500 коек), мелкая муниципальная клиника (менее 100 коек). Большинство операций было выполнено в средних (62,8%) и крупных (18,4%) муниципальных клиниках. В средних клиниках чаще использовались ОА (62,6%) и НА (70%), чем БПН (43,4%). В крупных и мелких клиниках реже применялись ОА (15,6% и 4,3% соответственно) и НА (19,3% и 3,7% соответственно), чаще — БПН (31,3% и 13,2% соответственно) [18].
Предпочтения тому или иному методу анестезии во время ТЭКС зависели и от региона США. Так, на Юге преобладали ОА и БПН: 33,8% и 32,9% соответственно против 27,1% случаев НА. На Среднем Западе, напротив, была выше доля НА (45,6%), по сравнению с ОА (30,2%) и БПН (15,3%). На СевероВостоке превалировала доля БПН: 34,5% против 11,0% и 19,9% случаев НА и ОА соответственно. Запад характеризовался практически равными долями всех вариантов анестезии: БПН — 17,4%; НА — 16,3%; ОА — 16,0% [18].
В заключение авторы отметили, что частота использования ОА при ТЭКС неуклонно снижается начиная с 2010 г., тогда как доли НА и БПН растут. Эта тенденция связана с продолжающимися исследованиями влияния метода анестезии на результаты ТЭКС. В то время как отдельные специалисты утверждают, что исходы ТЭКС, выполненных под ОА, не отличаются от таковых при использовании регионарной анестезии [19], гораздо большее число исследований свидетельствует о преимуществах последней в отношении снижения частоты осложнений послеоперационного периода [6, 7, 11].
АНЕСТЕЗИЯ И СИНДРОМ ИМПЛАНТАЦИИ КОСТНОГО ЦЕМЕНТА
Сторонники использования ОА при эндопротезировании суставов нижних конечностей, отстаивая свою позицию, часто приводят аргумент о том, что на фоне ОА с ИВЛ проще справиться с синдромом имплантации костного цемента, если таковой возникает. В этой связи любопытной представляется публикация S. Memtsoudis и соавт., в которой оценивались изменения гемодинамики у 24 пациентов (в возрасте 40–87 лет), перенесших одномоментное двустороннее цементное ТЭТС [20], т. е., по сути, двойную «цементную нагрузку».
В условиях мониторинга гемодинамики (катетер СванГанца, инвазивный контроль АД) пациентам проводилась «гипотензивная» ЭА (уровень пункции — L1–2, 0,75%й раствор бупивакаина в дозе 15–25 мл). При этом достигался верхний уровень симпатического блока Т1–4 (который, как известно, на 3–4 сегмента выше аналогичного уровня сенсорного блока). Проводилась седация инфузией пропофола. Скорость внутривенной инфузии эфедрина (4–7 мкг/мин) регулировалась с целью поддержания сердечного выброса с АДсред 50 мм рт. ст. и ЧСС 55–80. Во время операции АДсред варьировало в пределах 45–55 мм рт. ст. [20].
Непосредственно во время установки эндопротезов авторы не отметили роста давления в легочной артерии, однако спустя 1 час и 24 часа после операции оно повышалось на 12% и 26% от исходного уровня соответственно. Легочное сосудистое сопротивление возрастало в ответ на установку второго эндопротеза. Спустя 1 час после операции оно оставалось повышенным на 22% относительно исходного уровня и на 33% в сравнении с началом операции [20].
Установлено, что применение контролируемой гипотензии с помощью «гипотензивной» ЭА сопровождается снижением давления в системе легочной артерии и легочного сосудистого сопротивления (без снижения сердечного выброса). При эмболии частичками цемента этот факт следует рассматривать как позитивный [20].
Ранее в эксперименте с моделированием легочной эмболии содержимым канала бедренной кости и продуктами полимеризации костного цемента было показано, что использование ЭА с симпатическим блоком, достигающим уровня верхних грудных сегментов, улучшает гемодинамические показатели за счет снижения среднего давления в бассейне легочной артерии и увеличения сердечного индекса [21]. Тот факт, что грудной (но не поясничный) уровень блока оказывал позитивное действие, подчеркивает роль симпатической блокады в этом процессе [22].
Таким образом, методика анестезии, использованная в исследовании S. Memtsoudis и соавт. [20], обеспечивала наилучший из возможных сценариев при эмболии интрамедуллярным содержимым во время ТЭТС.
БЕЗОПАСНОСТЬ АНЕСТЕЗИИ В «БОЛЬШОЙ» ОРТОПЕДИИ: НЕ ПОРА ЛИ ОТДАТЬ ПРЕДПОЧТЕНИЕ ПЕРИФЕРИЧЕСКИМ БЛОКАДАМ?
Наметившийся в последнее десятилетие тренд перехода от более инвазивных вариантов регионарной анестезии (СА и ЭА) к менее инвазивным (блокадам периферических нервов и сплетений, локальной инфильтрационной анальгезии) коснулся и «большой» ортопедии. Главным аргументом противников СА и (особенно) ЭА является опасение на счет такого грозного осложнения, как эпидуральная гематома. Фактором риска ее развития считают тромбопрофилактику, которая проводится 100% пациентов ортопедического профиля.
В конце XX — начале XXI века в специальной литературе можно было встретить утверждение о том, что назначение профилактических доз низкомолекулярных гепаринов увеличивает риск эпидуральной гематомы у пациентов, оперированных с использованием ЭА, до 1 : 3100. Так ли это? По данным трех современных масштабных исследований, частота эпидуральной гематомы после ТЭКС и ТЭТС, выполненных в условиях СА, составляет 1 : 775 000, в условиях ЭА — от 1 : 9000 до 1 : 26 000 анестезий [23–25].
M. Pumberger и соавт. проанализировали безопасность НА в ходе 100 027 операций ТЭТС и ТЭКС, выполненных в одной клинике в период 2000–2010 гг. [24]. Использовались два варианта НА: СА (n = 37 171) и комбинированная СЭА (n = 62 856). Признаки компрессии спинного мозга кровью или воздухом были выявлены в 8 случаях (подтверждены КТ или МРТ), т. е. с частотой 1 : 7857 анестезий, все случаи наблюдались при проведении СЭА.
Средний возраст этих 8 пациентов составлял 71,6 года, средний ИМТ — 29,1 кг/м2 (избыточный вес). Гематома была выявлена у пятерых, воздух в эпидуральном пространстве — у троих, т. е. истинная частота гематомы составила 1 : 12 571 анестезию. Воздух в эпидуральном пространстве является следствием применения отдельными анестезиологами порочной практики — использования в тесте потери сопротивления шприца с воздухом, а не наполненного физраствором. Все 5 пациентов с гематомой до операции принимали НПВС, один пациент — антитромбоцитарный препарат (клопидогрел), который был отменен за 4 суток до оперативного вмешательства (а надо за 6 суток), у одного больного имелась исходная тромбоцитопения (70 000), что является относительным противопоказанием для ЭА. После операции все 5 пациентов получали варфарин с целью тромбопрофилактики, в том числе один — варфарин + низкомолекулярный гепарин. Средний срок диагностики гематомы составлял 3,1 ± 1,5 суток после операции. Декомпрессионная ламинэктомия понадобилась двум пациентам (восстановление без неврологического дефицита) [24].
Какие выводы можно сделать на основании столь представительного и детального анализа безопасности? Вопервых, истинная частота серьезных осложнений НА низка, вовторых, практически все рассмотренные осложнения связаны не с порочностью самой методики, а с нарушением технологии ее выполнения, втретьих, адекватный мониторинг состояния пациентов и своевременно принятые меры позволяют избежать тяжелых последствий возникших осложнений.
Таким образом, опасности, декларируемые сторонниками отказа от нейроаксиальных блоков, преувеличены, даже «максимально инвазивная» СЭА сопровождается минимальным риском осложнений. Добавим, что еще в 2007 г. нами был разработан и внедрен в клиническую практику ГКБ № 67 г. Москвы протокол СЭА при операциях тотального эндопротезирования суставов нижних конечностей [26]. С тех пор с применением данной методики прооперировано около 3500 пациентов (2118 — только в 2012–2016 гг.), не отмечено ни одного случая эпидуральной гематомы или эпидурального абсцесса.
А что же периферические блокады? Проведено достаточное количество сравнительных исследований, в которых оценивались преимущества и недостатки периферических и центральных блокад при различных ортопедических вмешательствах [27–29]. Во всех случаях периферические блокады применялись в сочетании с ОА или для послеоперационного обезболивания пациентов, оперированных под СА. Продленная ЭА и продленные БПН обеспечивали равноценное качество послеоперационного обезболивания. Преимуществами БПН перед ЭА авторы считают отсутствие кожного зуда и послеоперационных нарушений мочеиспускания. Насколько эти преимущества значимы с клинической точки зрения, судить читателям. Кстати говоря, кожный зуд при ЭА возникает за счет эпидурального введения опиоидных анальгетиков, если их исключить, то нивелируется еще одно преимущество БПН.
Для успеха БПН, корректной периневральной установки катетеров для продленной анальгезии, как известно, необходимы: а) ультразвуковая локация этих структур, б) специальные наборы для продленных блокад, в) подготовленные специалисты. Далеко не все российские клиники имеют все вышеуказанное в своем арсенале.
Кроме того, в настоящее время нет ни одного исследования, свидетельствующего о позитивном влиянии БПН на течение послеоперационного периода в «большой» ортопедии.
И, наконец, несколько слов о перспективах применения локальной инфильтрационной анальгезии при эндопротезировании суставов нижних конечностей. В 2016 г. в журнале Current Opinion in Anesthesiology была опубликована обзорная работа Regional anesthesia in pain management [30]. В разделе «Альтернативы нейроаксиальной анальгезии» автор пишет: «В качестве альтернативы нейроаксиальной анальгезии и периферическим блокадам может рассматриваться инфильтрация операционной раны местными анестетиками, которая являлась объектом нескольких исследований последнего десятилетия. Недавно выполненный метаанализ выявил, что для обезболивания после тотального эндопротезирования коленного сустава длительная инфузия местных анестетиков в рану более эффективна, чем плацебо, но при ее применении возрастает частота инфекционных осложнений» [30].
Данная информация, на наш взгляд, должна полностью исключать возможность применения локальной инфильтрационной анальгезии в ортопедии.
ЗАКЛЮЧЕНИЕ
Анализ специальной литературы позволяет сделать вывод, что вопрос о выборе оптимальной анестезиологической тактики при операциях тотального эндопротезирования тазобедренного (ТЭТС) и коленного (ТЭКС) суставов остается дискутабельным. Наряду с обсужденными выше работами, где отмечается положительное влияние регионарной анестезии вообще и нейроаксиальной в частности на течение раннего послеоперационного периода, существуют и публикации, отрицающие это влияние [19, 31]. На наш взгляд, данные о позитивной роли спинальной и эпидуральной анестезии, полученные на огромном клиническом материале и приведшие к изменению анестезиологической тактики в клиниках США [6, 17, 18], выглядят более убедительными и должны приниматься во внимание при выборе метода анестезиологического обеспечения ТЭТС и ТЭКС в повседневной клинической практике.







