ВВЕДЕНИЕ
К началу ХХI века в Европе и США были сформулированы основные положения мультидисциплинарного метода ускоренного восстановления хирургических больных после плановых операций. В англоязычной литературе новая концепция обозначается двумя терминами: «быстрый путь в хирургии» (Fast-Track Surgery — FTS) и «ускоренное восстановление после хирургических операций» (Enhanced Recovery After Surgery — ERAS). В русскоязычной литературе устоявшегося термина для определения новой концепции нет. На наш взгляд, использование английских названий вносит путаницу и не совсем корректно, поэтому мы предлагаем обозначать новую концепцию как программу ускоренного выздоровления (ПУВ) пациентов. ПУВ предусматривает минимизацию стрессового воздействия хирургического лечения на организм больного на всех этапах периоперационного периода. Это реализуется за счет рациональной предоперационной подготовки, использования малоинвазивных и высокотехнологичных хирургических методов, анестетиков короткого действия и мультимодальной анальгезии, а также ранней реабилитации в послеоперационном периоде. В конечном счете улучшаются результаты хирургического лечения, уменьшаются количество осложнений и длительность госпитализации и, что немаловажно, повышаются «качество» пребывания больного в стационаре и его удовлетворенность от встречи с врачами. Все это было подтверждено в ходе обсервационных наблюдений в специализированных центрах [7], а также рандомизированных исследований [67, 79].
Внедрение ПУВ после хирургических вмешательств возможно лишь при тесном командном взаимодействии врачей хирургических специальностей, анестезиологов-реаниматологов, реабилитологов, клинических фармакологов, среднего медицинского персонала, специалистов диагностических служб и др. Кроме того, пришло время изменить сложившиеся оценочные представления о лечебном процессе у его непосредственных участников, в первую очередь у больных, считающих хирургическое лечение длительным, болезненным процессом, связанным со всяческими ограничениями и вынужденной неподвижностью [1–3].
Новая концепция была предложена врачом анестезиологом-реаниматологом, что лишний раз подчеркивает мультидисциплинарность подхода к ведению хирургических больных. В середине 90-х годов XX века датский анестезиолог-реаниматолог профессор Henrik Kehlet провел системный анализ патофизиологических механизмов возникновения осложнений после плановых хирургических вмешательств. В результате была выработана многокомпонентная система мер, направленных на снижение стрессовой реакции организма на хирургическую агрессию. Именно нивелирование последствий стресса явилось краеугольным камнем этой концепции [50]. Основной стартовой площадкой, на которой отрабатывались и внедрялись принципы ускоренного выздоровления, стала колоректальная хирургия. В пилотном исследовании (1997) H. Kehlet доказал, что комбинация оптимального обезболивания на основе перидуральной анестезии, ранней активизации больных и раннего энтерального питания уменьшает длительность восстановления и пребывания в стационаре после операций на ободочной кишке [49]. В дальнейшем концепция была доработана и всесторонне расширена на основе принципов доказательной медицины.
В РФ положения ПУВ успешно реализуются в ряде ведущих клиник. Однако внедрение основных принципов этой концепции сталкивается с рядом препятствий, в том числе с излишней осторожностью врачей и их нежеланием отходить от привычных стереотипов. Стоит упомянуть также недостаточную информированность пациентов о новых возможностях лечения. Эти проблемы в хирургии характерны не только для РФ, но в целом для всех стран.
Тщательный анализ применения ПУВ в мировом масштабе позволил сделать вывод о необходимости более интенсивного ознакомления клиницистов и пациентов с достижениями ПУВ, проведения обучающих семинаров, создания клинических рекомендаций с учетом особенностей национальных систем здравоохранения [78]. Ввиду важности проблемы представляется актуальной разработка национальных клинических рекомендаций по ПУВ. Первые клинические рекомендации по ускоренному восстановлению после хирургических вмешательств подготовлены для плановых операций на ободочной кишке. Это сделано с учетом наибольшего опыта работы в рамках стратегии ПУВ, имеющегося в РФ именно для данного контингента больных.
1. МЕТОДОЛОГИЯ
Мы надеемся, что находящийся перед вами документ послужит достижению практических целей. Нашей основной задачей является улучшение качества медицинской помощи хирургическим больным, и мы хотим достичь этого, дав возможность клиницистам лучше понять доказательную базу, определяющую текущую клиническую практику. Создание детальных, основанных на доказательствах рекомендаций позволяет также определить те области, в которых недостаточно имеющихся доказательств и требуются дальнейшие исследования.
Для разработки клинических рекомендаций была создана рабочая группа и избраны два сопредседателя.
За основу выбраны рекомендации Общества хирургии ускоренного выздоровления (англ. ERAS®Society), Европейской ассоциации клинического питания и метаболизма (англ. European Society for Clinical Nutrition and Metabolism — ESPEN) и Международной ассоциации клинического метаболизма и питания (англ. International Association for Surgical Metabolism and Nutrition — IASMEN) [36], а также публикации, вошедшие в Кохрановскую библиотеку, базы данных EMBASE и PubMed/MEDLINE. Глубина поиска составила 10 лет. Рекомендации являются результатом согласованного мнения экспертов, выработанного на основании анализа опубликованных исследований в этой области. Данные рекомендации не могут описать всего многообразия клинических ситуаций, возникающих в хирургии ободочной кишки, и призваны помочь врачу выбрать оптимальную стратегию и тактику периоперационного ведения конкретного пациента.
В тех случаях, когда настоящие рекомендации являются неприменимыми, врач может и должен обоснованно использовать альтернативный подход к лечению конкретного больного в соответствии с клинической ситуацией.
Оценка достоверности научных доказательств и убедительности рекомендацийпроизводилась на основании системы GRADE (англ. Grading of Recommendations Assessment, Development and Evaluation) [37, 38].
Методы, использованныедляоценкикачестваисилыдоказательств:
консенсус экспертов;
оценка значимости в соответствии с рейтинговой схемой.
Выделяли четыре уровня достоверности доказательств (англ. level of evidence) на основании качественных и количественных характеристик, а также согласованности доказательств. Для простоты исследования уровни достоверности доказательств обозначали латинскими буквами (табл. 1).
Таблица 1
Рейтинговая система оценки достоверности доказательств
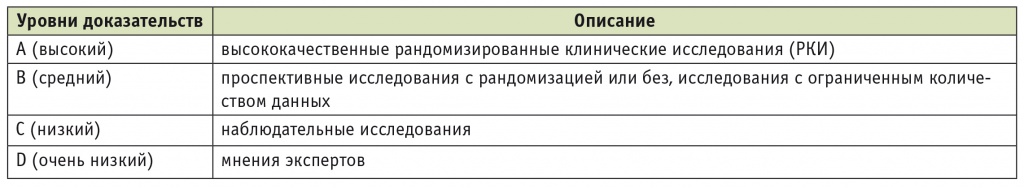
Шкала уровня убедительности рекомендаций (англ. grades of recommendations) включала две категории: сильная рекомендация (англ. strong recommendation) и рекомендация слабой силы/условная (англ. weak/conditional recommendation). Категории обозначали цифрами (табл. 2).
Таблица 2
Рейтинговая система оценки силы рекомендаций
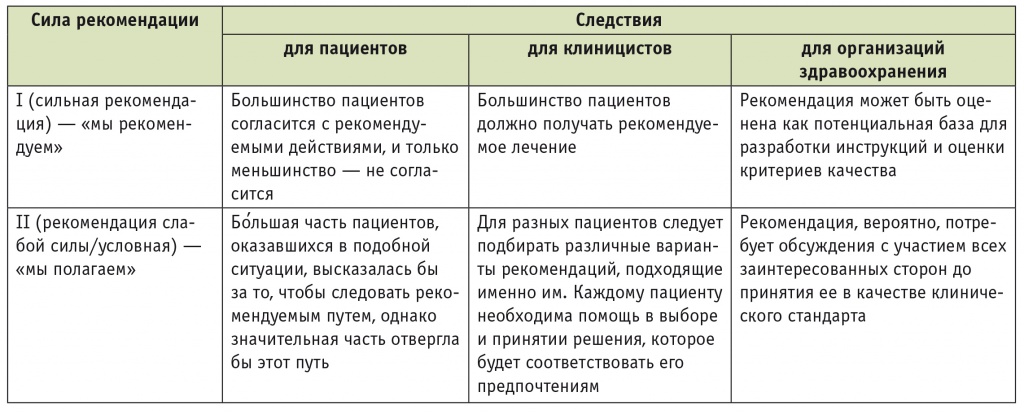
Категория сильной рекомендации присваивается в случае полной уверенности в том, что ожидаемая польза от применения вмешательства превосходит его нежелательные последствия. Категория условной рекомендации присваивается в случаях меньшей уверенности экспертной группы в благоприятном соотношении между ожидаемыми преимуществами и недостатками вмешательства.
В рекомендациях необходимо отличать силу рекомендаций от качества соответствующих доказательств. Данная система позволяет обосновать сильные рекомендации доказательствами низкого или, значительно реже, очень низкого качества, полученными в РКИ более низкого уровня или в обсервационных исследованиях. Одновременно слабые рекомендации могут основываться на высококачественных доказательствах. Первая ситуация складывается в редких случаях, когда силу рекомендаций определяют не доказательства из включенных исследований, а другие факторы, в то время как вторая ситуация отмечается чаще. Некоторые специалисты считают, что не должно быть рекомендаций без достаточной доказательной силы. Однако, поскольку клиницистам необходимо принимать решения в их текущей повседневной практике, они часто задают вопрос: «Что бы сделал эксперт в той или иной ситуации?» Мы предпочли сформулировать рекомендации, а не отвечать молчанием на подобные вопросы. Предлагаемые рекомендации часто оценены как имеющие низкую степень доказательности или малую рекомендательную силу. Очень важно, чтобы те, кто будет пользоваться ими, были об этом осведомлены. В любом случае эти рекомендации предназначены для того, чтобы быть для клиницистов отправной, а не конечной точкой изучения вопросов, относящихся к специфическому лечению пациентов в повседневной практике.
Индикаторы доброкачественной практики (англ. Good Practice Points — GPPs). Рекомендуемая доброкачественная практика базируется на клиническом опыте членов рабочей группы по разработке рекомендаций.
Экономический анализ. Анализ стоимости не проводился, публикации по фармакоэкономике не анализировались.
Методы валидизации рекомендаций:
внешняя экспертная оценка;
внутренняя экспертная оценка.
Описание методики валидизации рекомендаций. Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами. Комментарии, полученные от экспертов, систематизированы и обсуждены членами рабочей группы с внесением необходимых изменений.
Консультация и экспертная оценка. Предварительная версия была выставлена для обсуждения на сайтах www.fast-track.pro и www.общество-хирургов.рф для того, чтобы лица, не участвовавшие в разработке рекомендаций, имели возможность принять участие в обсуждении и совершенствовании рекомендаций.
Рабочая группа. Для окончательной редакции и контроля качества рекомендации повторно проанализированы членами рабочей группы.
Мы прилагали все усилия для того, чтобы избежать каких-либо действительных или кажущихся конфликтов интересов, которые могли бы возникнуть в результате внешних противоречий, персональных, профессиональных или деловых отношений членов рабочей группы.
2. ДООПЕРАЦИОННЫЙ ПЕРИОД
Информирование пациентов на дооперационном этапе. Пребывание в стационаре, а тем более хирургическое лечение, связано с высоким психологическим стрессом для пациентов. В их сознании преобладает доминанта неуверенности в дальнейшей жизни: работе и карьере, материальном благополучии, положении в семье, возможности активного отдыха. Подробная информация о хирургическом вмешательстве и анестезиологическом обеспечении, описание того, что с ними будет происходить в периоперационном периоде, способствуют уменьшению страха и тревоги, сокращению сроков пребывания в стационаре [14, 47]. Во время консультации хирурга и анестезиолога-реаниматолога (желательно до госпитализации) важно акцентировать внимание на роли самого пациента в процессах ускоренного восстановления после хирургического вмешательства. Для большей информативности необходимо использовать рекламные проспекты, буклеты, презентации и видеоматериалы. Адекватное разъяснение больному особенностей его поведения в периоперационном периоде способствует более раннему началу питания и активизации после операции, снижению потребности в обезболивающих препаратах, уменьшению числа осложнений [32].
Выводы: пациенты до операции в обязательном порядке должны быть информированы об особенностях течения периоперационного периода и возможностях ускоренного выздоровления (IC).
Оптимизация поведения пациентов на догоспитальном этапе. С учетом планировавшегося хирургического вмешательства предпринимались попытки изменить образ жизни пациента путем предоперационной физической адаптации. В основе гипотезы лежало положение об улучшении исходов операции после дополнительных стандартизированных физических нагрузок с целью воздействия на дыхательную и сердечно-сосудистую системы. Несмотря на улучшение ряда физиологических функций, не было установлено влияния дозированной физической нагрузки на исход хирургического лечения. Полученные результаты могли быть обусловлены большой долей пожилых пациентов в исследованиях [26].
Среди пациентов, злоупотребляющих алкоголем, отмечено повышение смертности после хирургических вмешательств вследствие возрастания числа кровотечений, случаев нагноения ран и в связи с большим количеством сердечно-легочных осложнений. Отказ от приема алкоголя за один месяц до оперативного вмешательства сопровождался снижением послеоперационной летальности за счет уменьшения дисфункции органов и систем [85]. У активных курильщиков после операции достоверно чаще развивались нагноения раны и легочные осложнения. Снижение числа послеоперационных осложнений достигалось отказом от курения за один месяц до поступления в стационар [61].
Выводы: за один месяц до операции пациентам необходимо отказаться от курения (IA) и приема алкоголя (IC).
Предоперационная подготовка кишечника. Долгое время незыблемым предоперационным стандартом был комплекс мероприятий по подготовке кишечника. Теоретическим обоснованием этого положения являлась гипотеза, что при механической очистке кишечника снижается его бактериальная обсемененность и, следовательно, уменьшается количество септических осложнений в послеоперационном периоде: несостоятельности швов кишечного анастомоза, перитонита, раневой инфекции. Пациенты негативно относятся к процедурам очистки кишечника перед операцией, что связано с неприятными ощущениями, возникновением тошноты, рвоты и вздутия живота, необходимостью голодать. Одновременно возможно развитие грубых водно-электролитных нарушений, дегидратации и нестабильности гемодинамики во время индукции в наркоз. Кроме того, в послеоперационном периоде увеличивается длительность пареза кишечника [46].
В исследованиях установлено: отказ от механической подготовки кишечника до операции на ободочной кишке не сопровождается возрастанием количества инфекционных осложнений независимо от способа доступа — открытого или лапароскопического [97]. Приводятся данные, что рутинная подготовка кишечника к операции связана с повреждением стенки кишки, развитием в ней воспалительных изменений и несостоятельности швов анастомоза [16]. Показано, что у пациентов, которым выполнялась механическая очистка кишечника, после операции чаще возникают интраабдоминальные абсцессы. Длительность госпитализации таких больных превышала сроки нахождения в стационаре группы сравнения [71].
Выводы: механическая подготовка кишечника не должна рутинно использоваться до хирургических вмешательств на ободочной кишке (IA).
Отказ от полного голодания перед операцией и применение специальных углеводных смесей. Голодание перед операцией начиная с полуночи прочно вошло в клиническую практику. Такой подход обосновывался риском задержки пищи и воды в желудке с последующим возникновением регургитации и аспирации во время вводного наркоза. Побочные эффекты такого ограничения очевидны: возможность развития гиповолемии, истощение запасов гликогена и гипогликемия, метаболический стресс. M. С. Brady и соавт. (2010) опубликовали метаанализ 22 рандомизированных исследований, посвященных предоперационному голоданию. Результаты позволили сделать вывод, что прекращение приема жидкостей, включая соки, воду, чай и кофе, за 2 часа до операции не увеличивает частоту аспирационных осложнений при плановых хирургических вмешательствах в сравнении с пациентами, голодавшими с полуночи до операции. Кроме того, не выявлено различий по количеству желудочного содержимого и его pH [10]. Эта точка зрения была подтверждена и в последующих публикациях [5]. Европейское общество анестезиологов рекомендует прием прозрачных жидкостей за 2 часа до вводного наркоза, а также 6-часовой отказ от приема твердой пищи [83]. Важно заметить, что у людей с избыточным весом скорость эвакуации пищи из желудка не отличается от таковой у худых [62]. У пациентов с диабетической нейропатией возможно замедление эвакуации из желудка твердой пищи, что потенциально может увеличить риск регургитации и аспирации [51]. Однако однозначных доказательств замедления опорожнения желудка нет. У больных сахарным диабетом (СД) 2 типа неосложненного течения зарегистрирована нормальная скорость эвакуации пищи [13]. Аналогичные данные получены у пациентов с СД, регулярно принимающих противодиабетические препараты [35].
Хирургическое вмешательство приводит к метаболическому ответу организма на травму. В раннем послеоперационном периоде преобладает катаболическая направленность, связанная с выбросом большого количества гормонов стресса (кортизол, глюкагон, катехоламины) и медиаторов воспаления (цитокины). Возникающая гипергликемия является ответом на формирование инсулиновой резистентности. Установлено, что прием за 2–3 часа до операции 400 мл углеводного напитка (мальтодекстрины) повышает комфортность пациента, устраняя жажду, голод и повышенную тревожность. Кроме того, углеводная терапия снижала потери азота в послеоперационном периоде и предотвращала развитие инсулинорезистентности. Назначение энергетического напитка приводило к более ранней активизации пациентов, препятствовало снижению мышечной массы и силы, сопровождалось уменьшением длительности пребывания пациентов в стационаре на один день [43, 68].
Выводы: пациентам следует разрешить прием жидкости не позднее чем за 2 часа и твердой пищи — за 6 часов до индукции в наркоз. У больных с нарушенной эвакуацией пищи из желудка и двенадцатиперстной кишки требуются особые меры предосторожности (IB). Пациентам перед плановыми операциями необходимо назначать напиток, содержащий углеводы (IC), у больных СД углеводный напиток сочетают с приемом противодиабетических препаратов (IID).
Премедикация. Традиционно на ночь пациентам назначали снотворное, а за 2 часа до операции — седативный препарат. В настоящий момент эта схема не считается оптимальной. Программы психологической подготовки больных перед операцией уменьшают уровень тревожности, что снижает потребность в транквилизаторах. Назначение седативной премедикации приводит к замедленной активизации, ухудшению психомоторных функций и задержке приема жидкости и еды в раннем послеоперационном периоде [55]. Седативные препараты короткого действия (мидазолам, пропофол) используют во время индукции и анестезии, а также при применении регионарной анестезии. Такой подход в сочетании с короткодействующими анестетиками и рокурония бромидом и в связке с сугаммадексом во время общей анестезии позволяет сократить время постнаркозной депрессии и выраженность когнитивных нарушений в послеоперационном периоде в связи с быстрым восстановлением нейромышечной проводимости.
Выводы: пациентам перед операцией не следует рутинно назначать седативные препараты, так как они замедляют восстановление в раннем послеоперационном периоде (IA).
Профилактика венозных тромбоэмболических осложнений (ВТЭО) в послеоперационном периоде. Профилактика ВТЭО, к которым относятся тромбоз глубоких вен (ТГВ), подкожный тромбофлебит и тромбоэмболия легочной артерии (ТЭЛА), включена в стандарты оказания помощи хирургическим больным. Установлено, что частота бессимптомного ТГВ после операций на ободочной кишке без тромбопрофилактики достигает 30%, при этом у 1% больных диагностирована ТЭЛА, приведшая к летальному исходу. Пациенты со злокачественными опухолями, выраженными сопутствующими заболеваниями, гиперкоагуляцией, а также принимающие кортикостероиды, входят в группу повышенного риска ВТЭО [31]. Все пациенты, оперированные на ободочной кишке, должны получать механическую тромбопрофилактику при помощи подобранных по размеру компрессионных чулок, так как они значительно снижают частоту возникновения ТГВ у больных, находящихся в стационаре. Эффективно также дополнительное применение прерывистой пневмокомпресcии, особенно у онкологических больных [44]. В многочисленных исследованиях доказана эффективность фармакологической профилактики ВТЭО с помощью низкомолекулярного (НМГ) и нефракционированного гепарина. В исследовании с участием 4195 пациентов, оперированных на ободочной и прямой кишке, продемонстрировано, что фармакологическая профилактика снижает частоту ВТЭО с 1,8% до 1,1%, а также общую смертность от колоректального рака [54]. Частота развития послеоперационного кровотечения, гепарининдуцированной тромбоцитопении и эпидуральной гематомы составляет (наилучший и наихудший сценарии соответственно): 1 из 54 000 и 1 из 24 000 случаев [22]. Рекомендуется не устанавливать и не извлекать эпидуральные катетеры в течение 12 часов после введения гепарина [12].
Выводы: всем пациентам следует носить подобранные по размеру компрессионные чулки и проводить перемежающуюся компрессию нижних конечностей, фармакологическая профилактика включает назначение НМГ (IA).
Антимикробная профилактика и обработка кожи. Использование антибактериальных препаратов с целью профилактики гнойных осложнений после плановых хирургических вмешательств на толстой кишке применяется повсеместно и сопровождается уменьшением числа осложнений. Выбор антибиотика зависит от типа хирургического вмешательства и резистентности микроорганизмов конкретного стационара. Целью назначения антибиотиков перед операцией является создание достаточной концентрации препаратов в крови и тканях. Согласно большинству рекомендаций, первая доза препарата назначается за 60 минут до кожного разреза. При использовании фторхинолонов введение начинают за 2 часа до начала операции. При наличии дополнительных факторов риска развития инфекции (большая длительность операции, массивная кровопотеря) проводится повторное введение антибиотиков. Спектр активности назначаемых антибиотиков должен включать аэробные и анаэробные бактерии [11]. В исследованиях по изучению эффективности различных типов обработки кожи общая частота развития инфекций послеоперационной раны в группе, в которой использовался концентрированный спиртовой раствор хлоргексидина, была на 40% ниже, чем в группе, где применялся повидон-йод [24]. Однако при использовании диатермии в присутствии спиртовых растворов для обработки кожи существует риск травм и термических ожогов [75]. Если перед операцией необходимо удалить волосы, стрижка волос приводит к инфекциям послеоперационной раны реже, чем бритье, тогда как время удаления волос не влияет на результат.
Выводы: стандартная антимикробная профилактика осуществляется путем внутривенного введения антибиотиков за 60 минут до начала хирургического вмешательства на ободочной кишке. При длительных операциях и массивной кровопотере необходимо введение дополнительных доз в зависимости от периода полувыведения используемого препарата (IA). Для обработки кожи целесообразно применять спиртовой раствор хлоргексидина (IA).
3. ОПЕРАЦИОННЫЙ ЭТАП
Стандартный протокол анестезии. В задачи анестезиолога-реаниматолога во время операционного вмешательства входят: минимизация хирургического стресса, анальгезия, обеспечение достаточного уровня седации и надежной миорелаксации [58]. Отдельного рассмотрения заслуживает поддержание водного и электролитного баланса с помощью инфузионной терапии.
У больных, оперируемых на толстой кишке, чаще всего используется сочетанная анестезия: общая анестезия анестетиками короткого действия — тотальная внутривенная анестезия (ТВА) или ингаляционная анестезия — и эпидуральная анестезия (ЭА). Для индукции в наркоз обычно применяются гипнотики короткого действия — пропофол или мидазолам — в комбинации с опиоидным анальгетиком фентанилом. Интубация трахеи проводится в условиях миорелаксации рокурония бромидом. Основная анестезия сочетается с ЭА ропивакаином. Поддержание основной анестезии осуществляется севофлураном/десфлураном в сочетании с фентанилом или препаратами ТВА (пропофол + фентанил). Введение рокурония бромида целесообразно проводить под контролем нейромышечного мониторинга. Глубокая нейромышечная блокада во время хирургического вмешательства улучшает обзор и условия оперирования, особенно при лапароскопическом доступе [21].
Большинство пациентов, оперируемых на ободочной кишке, — люди пожилого и старческого возраста. Имеются данные, что слишком глубокий уровень седации у таких пациентов повышает риск развития послеоперационного делирия и когнитивной дисфункции. Использование монитора биспектрального индекса позволяет избежать излишней седации [80]. Если для миорелаксации использовался рокурония бромид, по окончании анестезии для реверсии нейромышечной блокады может потребоваться введение сугаммадекса, что существенно сократит время восстановления TOF (англ. Train Of Four — мониторинг в режиме четырехразрядной стимуляции) — до 0,9.
Использование ЭА во время операции позволяет проводить эффективное обезболивание в послеоперационном периоде. Кроме того, уменьшение введения опиоидных анестетиков во время операции сопровождается более быстрым выходом из наркоза. При проведении сочетанной анестезии наблюдается минимальная выраженность хирургического стресса, что сопряжено с уменьшением резистентности к инсулину, послеоперационного болевого синдрома, частоты эпизодов послеоперационной тошноты и рвоты (ПОТР), числа осложнений [70, 87]. ЭА в качестве компонента сочетанной анестезии применяется как при лапаротомном, так и при лапароскопическом доступе. Однако во время лапароскопических операций при использовании положения Тренделенбурга проведение ЭА не всегда возможно из-за влияния на гемодинамику.
Выводы:при операциях на ободочной кишке необходимо использовать стандартизированный протокол сочетанной анестезии, предусматривающий минимизацию хирургического стресса, достаточный уровень анальгезии и седации, надежную миорелаксацию, а также быстрый вывод из наркоза, что достижимо при применении сугаммадекса (IC).
Периоперационная инфузионная терапия. До операции следует отказаться от механической подготовки кишечника и голодания. Для профилактики гиповолемии последний прием жидкости осуществляется за 2 часа до операции. Интраоперационная инфузионная терапия является неотъемлемым компонентом анестезиологического обеспечения хирургических вмешательств. Величина необходимой инфузии не может быть определена заранее как фиксированный объем растворов, она должна быть индивидуальной для каждого пациента [23]. Баланс жидкости во время оперативного вмешательства зависит от множества факторов, и это крайне затрудняет его адекватную оценку. Известно, что стрессовый ответ на хирургическое вмешательство способствует задержке жидкости. При больших абдоминальных операциях ситуацию осложняет целый ряд дополнительных факторов: особенности предоперационной подготовки желудочно-кишечного тракта (ЖКТ), патофизиология основного заболевания, а также множество интраоперационных составляющих, таких как кровопотеря, вазодилатация, вызванная сосудорасширяющими препаратами (в частности, местными анестетиками при ЭА), и перспирация [45].
Стенка ЖКТ очень плохо защищена от ишемического повреждения. Слизистая оболочка кишечника постоянно регенерирует, имеет высокую степень метаболической активности и, таким образом, является крайне уязвимой для ишемии. В послеоперационном периоде дисфункция ЖКТ может проявляться различными клиническими состояниями: от угнетения перистальтики до нарушений энтерального питания. Несостоятельность межкишечных анастомозов в абдоминальной хирургии достоверно коррелирует с недостаточной доставкой кислорода [53]. Повреждение стенки ЖКТ вследствие гипоперфузии и ишемии ведет к потере ее барьерной функции с транслокацией эндотоксинов и микроорганизмов в системный кровоток, а также к выделению большого количества медиаторов с развитием синдрома системной воспалительной реакции [65].
Гиперволемия, обусловленная недифференцированной волемической нагрузкой, способна приводить к отеку кишечника и увеличению объема интерстициальной жидкости в легких, что может способствовать возникновению осложнений. У пациентов с нормоволемией артериальное давление следует поддерживать при помощи вазопрессоров, чтобы избежать гиперволемии.
Известно, что при проведении больших оперативных вмешательств на органах брюшной полости потери жидкости затрагивают преимущественно внутрисосудистый сектор, это может приводить к гиповолемии [19]. Широко применяемая эмпирическая инфузионная терапия основывается на данных рутинного мониторинга — контроля артериального давления, частоты сердечных сокращений, центрального венозного давления, темпа диуреза. Названные параметры не являются надежными показателями в отношении оценки состояния волемического статуса, что затрудняет их использование для управления инфузионной терапией. При этом стратегия фиксированных объемов инфузионной терапии несет в себе риск либо перегрузки жидкостью, либо гиповолемии.
Дополнительные трудности при проведении инфузионной терапии возникают при лапароскопическом доступе, что связано с уменьшением сердечного выброса из-за положения Тренделенбурга и пневмоперитонеума. Глубокая миорелаксация позволяет поддерживать состоятельность пневмоперитонеума без увеличения давления инсуффляции СО2. Избежать последствий глубокого нейромышечного блока позволяет быстрая реверсия за счет сугаммадекса [21].
В настоящий момент доминирующей является концепция целенаправленной инфузионной терапии (ЦИТ), дающая возможность индивидуализировать назначение растворов и использование вазоактивных препаратов на основании данных гемодинамических переменных. Установлено, что ЦИТ позволяет оптимизировать состояние внутрисосудистого сектора, поддерживать на должном уровне тканевую перфузию и оксигенацию, способствуя улучшению исходов после больших хирургических вмешательств [73]. Особенно важно применение ЦИТ при лапароскопическом доступе [57].
Проведение ЦИТ требует использования минимального гемодинамического мониторинга: чреспищеводной допплерографии, определения вариабельности ударного объема (ВУО) левого желудочка и др. Исследования показали, что проведение ЦИТ с помощью минимально инвазивных методов гемодинамики сопровождается уменьшением длительности пареза ЖКТ, частоты ПОТР, количества осложнений и сроков госпитализации [34]. Установлено, что гемодинамические переменные, включая ВУО, измеренную на основании анализа формы пульсовой волны при катетеризации лучевой артерии у пациентов в условиях искусственной вентиляции легких, помогают прогнозировать ответ на инфузионную терапию [63]. Преимуществом мониторинга, основанного на анализе формы пульсовой волны, является возможность его использования в послеоперационном периоде для расчета ударного объема и сердечного выброса.
Мониторинг центрального венозного давления не всегда позволяет проводить ЦИТ, поэтому катетеризация центральных вен выполняется при необходимости обеспечения венозного доступа.
Объем инфузионной терапии в послеоперационном периоде должен быть минимально достаточным для поддержания нормоволемии. Следует отдать предпочтение энтеральному введению жидкостей и прекратить инфузионную терапию при первой же возможности (желательно не позднее чем утром после операции). Пациентам с гипотензией и нормоволемией, которым проводится ЭА, рекомендуется назначать вазопрессоры, а не избыточное введение растворов [45]. Сбалансированные кристаллоидные растворы эффективнее поддерживают водно-электролитный баланс, чем 0,9%-й раствор натрия хлорида [84].
Выводы: при проведении инфузионной терапии следует использовать сбалансированные электролитные растворы, а не физиологический раствор (IA). Во время операции назначение инфузионной терапии должно основываться на данных, полученных с помощью малоинвазивных методов контроля гемодинамики (IA). При развитии гипотонии, связанной с ЭА, в интра- и послеоперационном периодах при нормоволемии следует использовать вазопрессоры (IA). В послеоперационном периоде необходимо в минимально возможные сроки перейти на пероральное возмещение жидкости и прекратить инфузионную терапию (IA).
Хирургический доступ. Использование минимально инвазивных методик (эндовидеохирургические операции) уменьшает воспалительный компонент стрессового ответа, существенно снижая выраженность эндокринных реакций и катаболическую составляющую метаболизма [89]. Мини-инвазивная хирургия сопровождается уменьшением болевого синдрома, частоты развития осложнений и сроков госпитализации. Кроме того, важен психологический комфорт пациента, связанный с минимальными шрамами в месте введения троакаров и мини-лапаротомного доступа, в отличие от рубцов, остающихся при традиционных разрезах. В случае открытого оперативного вмешательства наблюдается тенденция к уменьшению повреждения органов и тканей благодаря использованию высокотехнологичной аппаратуры для разрезания тканей и обработки сосудов, а также применению специальных ранорасширителей для минимизации травмы передней брюшной стенки.
В многоцентровом исследовании сравнили результаты сегментарных колэктомий, проведенных открытым и лапароскопическим доступом. Установили, что продолжительность общей госпитализации при лапароскопическом оперативном вмешательстве короче на 2 дня. Регрессионный анализ показал, что лапароскопическая резекция является единственным прогностическим фактором, который позволяет сократить продолжительность госпитализации и частоту осложнений [90]. Считается, что лапароскопический тип вмешательства возможен у 90% пациентов, оперируемых по поводу рака ободочной кишки, а частота смены хирургической тактики во время операции не превышает 10% [15].
В настоящий момент продолжаются исследования по изучению эффективности роботизированной хирургии в сравнении с лапароскопическими операциями. К преимуществам роботизированной хирургии относят: объемный обзор, нивелирование тремора, масштабирование движений и улучшенную эргономику. Пока неясно, воплотятся ли эти преимущества в улучшение клинических исходов. В некоторых странах распространена методика лапароскопической хирургии с ручным ассистированием (англ. Hand-Assisted Laparoscopic Surgery — HALS) [4]. Однако нет надежных доказательств превосходства этой методики над обычной мультипортовой лапароскопией [20]. Существуют данные, демонстрирующие, что на результаты выздоровления влияет длина операционной раны, которая пропорциональна частоте возникновения послеоперационных грыж [56]. Ведутся также дискуссии относительно преимуществ поперечных разрезов перед продольными, но надежных рекомендаций пока не выработано [30]. Вместе с тем болевой синдром при продольных разрезах выражен меньше [60].
Выводы:для резекции ободочной кишки рекомендуется лапароскопический доступ при наличии подготовленного персонала (IA). При лапароскопическом доступе наблюдается уменьшение числа осложнений и длительности госпитализации (IB).
Назогастральная интубация. Назогастральная декомпрессия длительное время являлась неотъемлемым компонентом абдоминальной хирургии. Считалось, что назогастральная интубация способствует уменьшению числа случаев ПОТР, предотвращает расхождение швов анастомоза. В настоящее время это положение радикально пересмотрено: после операций на толстой кишке следует избегать стандартной назогастральной декомпрессии, так как ее применение ассоциировано с более частым повышением температуры тела в послеоперационном периоде и возникновением легочных осложнений. Подтверждено, что назогастральная интубация после операций на ободочной кишке сопровождается дискомфортом в области желудка, увеличением частоты раневой инфекции, несостоятельности швов анастомоза и легочных осложнений, а также сроков госпитализации [74]. Заведение назогастрального зонда во время плановой операции на ободочной кишке служит для декомпрессии воздуха, попавшего в желудок во время вентиляции легких на вводном наркозе. После окончания анестезии зонд должен быть удален.
Выводы: не следует в рутинном порядке использовать назогастральную интубацию у больных, оперируемых на ободочной кишке (IA). Назогастральный зонд удаляется после окончания общей анестезии (IA).
Профилактика интраоперационной гипотермии.Во время хирургического вмешательства у большинства пациентов температура снижается на 1–2 °С, что сопровождается периферической вазоконстрикцией и уменьшением доставки кислорода к тканям, нарушениями в системе гемостаза, увеличением объема кровопотери и длительности пробуждения [86]. Возникновение дрожи в послеоперационном периоде сопряжено с увеличением потребления тканями кислорода и риском развития ишемии миокарда [17]. Появление гипотермии связано с медикаментозной блокадой адаптивных механизмов терморегуляции, повышенной теплоотдачей через операционную рану, инфузией холодных растворов и низкой температурой в операционной [86].
Соблюдение режима нормотермии приводит к снижению числа осложнений со стороны сердечно-сосудистой системы, частоты раневой инфекции и потребности в гемотрансфузиях, а также к более быстрому восстановлению после общей анестезии [77]. Для предотвращения эпизодов переохлаждения в операционной необходимо осуществлять мониторинг температуры, использовать для переливания теплые растворы [17]. Методы активного согревания включают согревание тела пациента теплым воздухом и использование специальных матрасов с подогретой водой [33]. Активное согревание следует продолжать в послеоперационном периоде, пока температура тела пациента не достигнет 36 °C и выше [93].
Выводы: во время операции необходимо поддерживать режим нормотермии с помощью специальных систем обогрева и переливания теплых растворов (IA).
Дренирование операционной раны. Дренирование ран и полостей — наиболее устоявшаяся традиция в хирургии. Целью этой процедуры являются эвакуация раневого отделяемого, а также диагностика возникновения кровотечения и несостоятельности швов анастомоза. Пациенты крайне негативно относятся к дренажам, так как их нахождение в ране провоцирует боль и ограничивает подвижность.
В многоцентровых исследованиях доказано, что дренирование брюшной полости не влияет на частоту несостоятельности швов анастомоза, повторных операций, экстраабдоминальных осложнений и летальность. Вместе с тем возрастает длительность операции [72]. Эмпирические наблюдения показывают, что наличие дренажей уменьшает возможности ранней активизации пациентов.
Выводы:не рекомендуется рутинное использование дренажей, поскольку не доказана польза этого вмешательства и замедляется активизация пациентов (IA).
4. ПОСЛЕОПЕРАЦИОННОЕ ВЕДЕНИЕ БОЛЬНЫХ
Послеоперационное обезболивание. Общепризнанным является тот факт, что послеоперационный болевой синдром ухудшает результаты лечения. Однако до сих пор эта проблема не решена. Значительное количество хирургических больных не получает должного обезболивания, в том числе из-за отсутствия оптимальных схем анальгезии [25]. Анальгезия после обширных операций должна обеспечивать достаточный уровень обезболивания, способствовать ранней мобилизации, более активному восстановлению функции кишечника и питания, а также не вызывать осложнений [88]. В последнее время все чаще признается, что для определенных типов операций и разрезов подходят разные режимы анальгезии. Преобладающим остается использование компонентной (мультимодальной) анальгезии, сочетающей в себе регионарные методы анестезии, с отказом, по возможности, от опиоидов во избежание развития побочных эффектов. Применение наркотических анальгетиков сопровождается сонливостью и адинамичностью больных, парезом кишечника, эпизодами тошноты и рвоты.
При открытой срединной лапаротомии ЭА является оптимальным методом обезболивания в первые 72 часа после операции, способствуя более раннему восстановлению функции кишечника и уменьшению числа осложнений [9, 22]. Использование 0,2%-го раствора ропивакаина в сочетании с фентанилом обеспечивает оптимальное обезболивание и минимизацию риска моторного блока и гипотонии из-за симпатической блокады. В исследованиях доказано, что ЭА эффективнее анальгезии опиатами по следующим показателям: болевой синдром, предотвращение ПОТР, число осложнений, резистентность к инсулину [9, 70, 87]. Для устранения гипотензии, вызванной симпатической блокадой, при отсутствии гиповолемии следует назначать вазопрессоры. Желательно удалять эпидуральный катетер в течение 48–72 часов после операции, к моменту первой дефекации у пациента. Стоит, однако, заметить, что наличие эпидурального катетера и применение различных насосов ограничивают раннюю мобилизацию пациента [40].
Выраженность и продолжительность болевого синдрома после лапароскопических операций меньше, чем после открытых [59]. Однако при лапароскопических операциях с ручным ассистированием все же требуется разрез передней брюшной стенки. В настоящий момент альтернативой ЭА при этом типе операций является мультимодальное обезболивание на основе нестероидных противовоспалительных препаратов (НПВП), парацетамола и нефопама [28]. При необходимости в первые сутки назначают небольшие дозы опиоидных анальгетиков: трамадола или тримеперидина.
Проводятся исследования эффективности блокады поперечного пространства живота (БППЖ) в сочетании с парацетамолом или НПВП у больных после операций на ободочной кишке. БППЖ в сочетании с парацетамолом для обезболивания после лапароскопически-ассистированных операций позволила сократить использование опиоидов [94]. Однако рекомендации еще не выработаны.
Выводы: у больных с лапаротомным доступом для обезболивания целесообразно использовать ЭА на основе местных анестетиков и опиоидов (IA). При лапароскопических операциях альтернативой ЭА служит мультимодальная анальгезия (IB).
Периоперационная нутритивная поддержка. Большинство пациентов, которым планируется операция на ободочной кишке, могут не изменять свой пищевой рацион перед операцией. Однако, несмотря на референсные показатели индекса массы тела, у части пациентов имеются истощение и низкое потребление белка. Поэтому необходимо в процессе сбора анамнеза тщательно выяснять сведения о недавней потере веса и уменьшении количества потребляемой пищи.
Основу питания до и после операции у большинства пациентов, проходящих лечение в соответствии с концепцией ПУВ, составляет обычная еда. Но в контексте традиционного периоперационного ведения дополнительное пероральное питание, в том числе методом сиппинга (для удобства используются специальные смеси), может увеличить общее потребление пищи, что позволяет достичь целевых алиментарных показателей [82]. В рамках стратегии ПУВ пероральное дополнительное питание используется за день до операции и в течение как минимум первых четырех послеоперационных дней для достижения целевого энергообмена и потребления белка [29, 42].
У пациентов с истощением и снижением индекса массы тела назначение дополнительного перорального питания за 7–10 дней до операции сопровождается снижением частоты инфекционных осложнений и числа случаев несостоятельности швов анастомоза [91].
В послеоперационном периоде пациенты в соответствии с концепцией ПУВ могут пить жидкости сразу же после окончания постнаркозной депрессии, а затем есть обычную больничную пищу, спонтанно потребляя примерно 1200–1500 ккал/день [69]. Установлено, что раннее энтеральное питание ассоциировано со снижением числа инфекционных осложнений, продолжительности госпитализации и не влияет на частоту несостоятельности швов кишечного анастомоза [41].
Проводилось изучение эффективности энтерального иммунного питания, содержащего различные комбинации аргинина, глутамина, омега-3 жирных кислот и нуклеотидов. Высказывается точка зрения об эффективности такой нутритивной поддержки у истощенных пациентов [27, 64].
Выводы: до операции необходимо оценить алиментарный статус пациента и при наличии недостаточности питания назначить нутритивную поддержку в виде перорального дополнительного питания (IC). Голодание в периоперационном периоде должно быть сведено к минимуму. После операции и выхода из постнаркозной депрессии может быть возобновлен обычный прием пищи (IA). Назначение иммунного питания истощенным больным в периоперационном периоде может быть полезно (IIC).
Профилактика послеоперационной тошноты и рвоты. ПОТР встречается у 25–35% всех хирургических пациентов и является основной причиной неудовлетворенности пациентов лечением, кроме того, из-за этого осложнения нередко задерживается выписка из стационара. Этиология ПОТР включает прежде всего предрасполагающие факторы со стороны пациента, вид анестезии и саму операцию. Риск возникновения ПОТР выше у женщин, некурящих пациентов, больных с анамнезом «морской болезни». Чаще эпизоды ПОТР регистрируются после ингаляционной анестезии, в том числе при использовании закиси азота, и при назначении наркотических анальгетиков.
В настоящий момент разработаны шкалы, позволяющие выявить пациентов с повышенным риском возникновения ПОТР и назначить профилактические мероприятия [6]. Ряд клиницистов проводят профилактику ПОТР всем пациентам после обширных операций и в случае применения ингаляционных анестетиков и опиатов [52].
В последние годы для профилактики и лечения ПОТР используется мультимодальный подход. Он представляет собой сочетание нефармакологических и фармакологических противорвотных методик в дополнение к ПУВ [18]. К нефармакологическим методикам относятся исключение эметогенных стимулов (таких как ингаляционная анестезия) и более широкое использование пропофола для индукции и поддержания анестезии. Минимальный период голодания перед операцией в сочетании с углеводным напитком и достаточная гидратация пациентов также могут оказывать благоприятное действие.
Доказано, что ЭА и БППЖ снижают необходимость в послеоперационном применении опиатов, а это, в свою очередь, может повлиять на частоту ПОТР [92]. Широко практикуется использование НПВП как альтернатива анальгезии опиатами.
Противорвотные препараты можно разделить на четыре основные фармакологические группы в зависимости от системы рецепторов, на которую они воздействуют: холинергические, дофаминергические (D2), серотонинергические (5-гидрокситриптамина подтип 3 — 5-HT3) и гистаминергические (H1). Каждый из классов снижает риск ПОТР лучше, чем плацебо. Существует также большое количество данных в поддержку назначения дексаметазона, который предположительно действует через центральные и периферические механизмы [48]. Доказано, что дексаметазон способствует снижению частоты ПОТР, однако его иммуносупрессивное действие на результаты лечения онкологических заболеваний в долгосрочной перспективе неизвестно. Противорвотный эффект усиливается при назначении комбинации из двух или более противорвотных препаратов, например антагониста 5-HT3 — ондансетрона и блокатора дофаминовых рецепторов — дроперидола [39].
Если же, невзирая на профилактику, в послеоперационном периоде возникает ПОТР, можно назначать те препараты, которые не использовались для профилактики, чтобы добиться максимального эффекта мультимодального подхода.
Выводы:у больных, оперированных на ободочной кишке и имеющих два и более фактора риска возникновения ПОТР, необходимо использовать мультимодальный подход для профилактики и лечения этого осложнения (IC).
Раннее удаление мочевого катетера. Катетеризация мочевого пузыря используется для точного контроля диуреза, а также при задержке мочи и неспособности пациента контролировать тазовые функции. Длительное наличие мочевого катетера увеличивает риск развития мочевой инфекции, препятствует ранней мобилизации [95]. Если пациент способен контролировать тазовые функции, то удаление мочевого катетера возможно уже на 1‒2-е сутки после операции [96]. Более длительное нахождение мочевого катетера может потребоваться больным с ЭА. Однако в неконтролируемом исследовании не наблюдалось увеличения частоты задержки мочеиспускания при удалении мочевого катетера в первые сутки у больных с ЭА длительностью 48 часов [8].
Выводы: рекомендуется нахождение уретрального катетера в течение 1–2 дней (IC). Мочевой катетер может быть извлечен независимо от применения ЭА и ее продолжительности (IIC).
Ранняя мобилизация. Длительное нахождение в постели увеличивает частоту тромбоэмболических осложнений, дыхательных расстройств, снижает мышечную силу и увеличивает риск гемодинамических нарушений [66]. Активность пациента определяется как объективными, так и субъективными факторами. Важными являются адекватное обезболивание, своевременное удаление дренажей и катетеров. Кроме того, пациенту необходимо объяснить безопасность двигательной активности после операции, успокоить его относительно риска «расхождения швов» в раннем послеоперационном периоде. Подъем пациента с кровати с первых суток после операции и регулярная активность сопровождаются уменьшением количества послеоперационных осложнений и длительности пребывания в стационаре [55]. В рандомизированном исследовании LAFA показано, что мобилизация на 1–3-и сутки после операции в значительной степени обуславливает успех стратегии ПУВ. Вместе с тем неспособность к мобилизации в первый день после операции может быть связана с недостаточным обезболиванием, продолжением внутривенной инфузии, наличием мочевого катетера и низкой мотивацией пациента, а также сопутствующими заболеваниями [90]. Неспособность к мобилизации была одной из самых распространенных причин отказа от ПУВ [81].
Выводы: длительная иммобилизация повышает риск возникновения послеоперационных осложнений и развития мышечной слабости. В связи с этим пациентам необходима ранняя мобилизация в послеоперационном периоде (IC).
Основные положения ПУВ суммированы в таблице 3.
5. СУММАРНЫЕ РЕКОМЕНДАЦИИ
Таблица 3
Руководство по периоперационному ведению больных, оперированных на ободочной кишке, с позиций программы ускоренного выздоровления
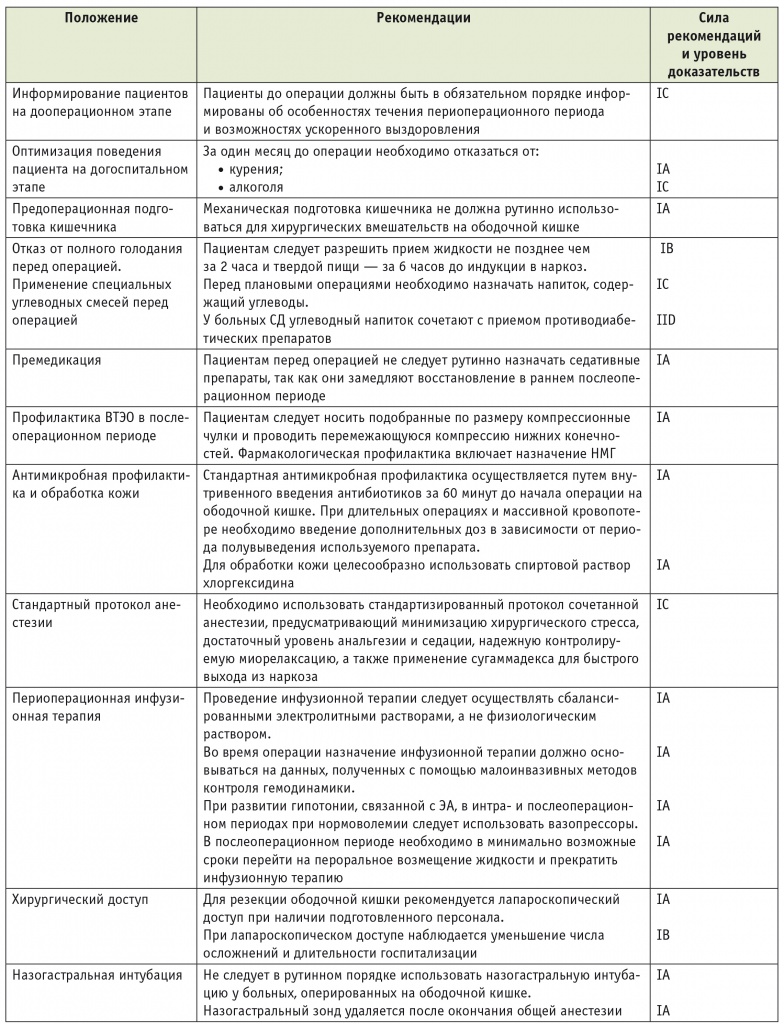
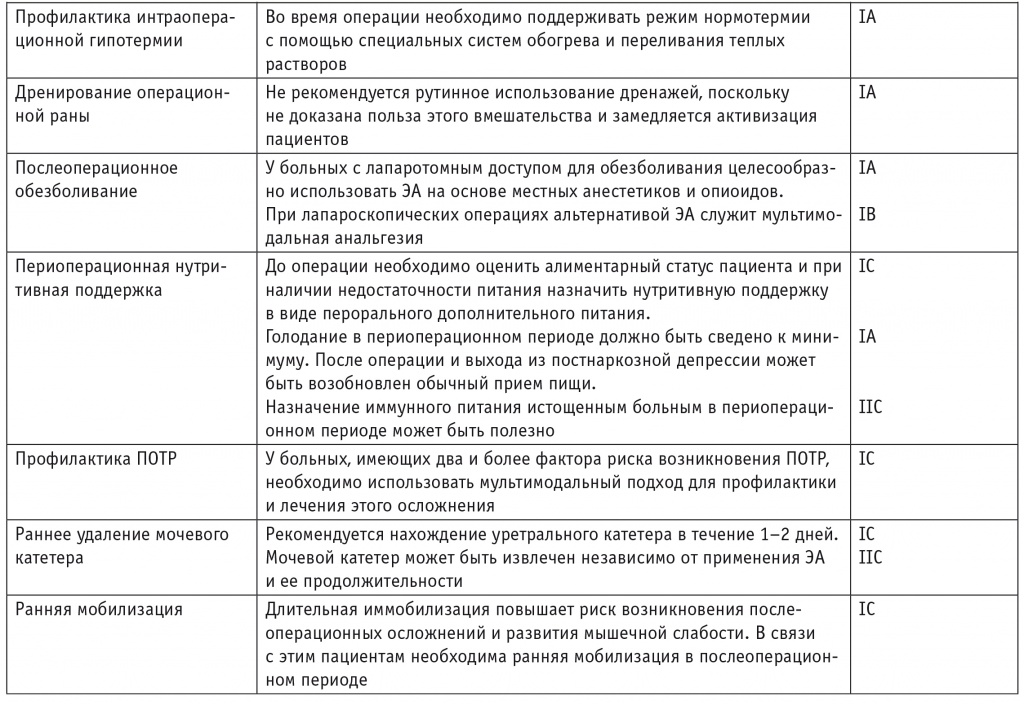
Примечание. ВТЭО — венозные тромбоэмболические осложнения; НМГ — низкомолекулярный гепарин; ПОТР — послеоперационная тошнота и рвота; СД — сахарный диабет; ЭА — эпидуральная анестезия.
6. ЗАКЛЮЧЕНИЕ
На начальном этапе обычно происходит внедрение отдельных компонентов ПУВ. К основным трудностям следует отнести прежде всего мультидисциплинарность программы. Реализация концепции возможна только при командной работе врачей различных специальностей: хирургов, анестезиологов-реаниматологов, нутрициологов, клинических фармакологов, — а также медицинских сестер. Определенным препятствием может быть менталитет пациентов. Техническая оснащенность операционных, возможности применения эндовидеохирургии тоже варьируют в масштабах страны.
В настоящий момент не вызывает сомнений востребованность ПУВ после хирургических вмешательств. Доказано, что ПУВ в сравнении с обычным ведением больных приводит к более ранней выписке пациентов из стационара, меньшему числу осложнений и не сопровождается увеличением числа случаев повторной госпитализации. Зарубежный опыт свидетельствует также об экономических преимуществах ПУВ [76].
ПУВ после операций на толстой кишке является динамически развивающейся концепцией. При получении новых доказательств эффективности тех или иных методик периоперационного ведения больных рекомендации будут усовершенствованы.
СОКРАЩЕНИЯ
БППЖ — блокада поперечного пространства живота
ВТЭО — венозные тромбоэмболические осложнения
ВУО — вариабельность ударного объема
ЖКТ — желудочно-кишечный тракт
НМГ — низкомолекулярный гепарин
НПВП — нестероидные противовоспалительные препараты
ПОТР — послеоперационная тошнота и рвота
ПУВ — программа ускоренного выздоровления
РКИ — рандомизированные клинические исследования
СД — сахарный диабет
ТВА — тотальная внутривенная анестезия
ТГВ — тромбоз глубоких вен
ТЭЛА — тромбоэмболия легочной артерии
ЦИТ — целенаправленная инфузионная терапия
ЭА — эпидуральная анестезия







