Последние два десятилетия за рубежом ознаменовались формированием и широким внедрением в клиническую практику новой концепции в хирургии — Fast Track, или Enhanced Recovery After Surgery (ускоренное восстановление после хирургических вмешательств, ERAS). Тщательный патофизиологический анализ осложнений после плановых хирургических вмешательств позволил обосновать комплекс мер, направленных на снижение стрессовых реакций организма больного на хирургическую агрессию. В нашей стране употребление англоязычных обозначений не приветствуется, наиболее корректным эквивалентом ERAS является название «Программа ускоренного выздоровления (ПУВ) после хирургических вмешательств». Встречается ошибочное мнение, что цель программы состоит в быстрой выписке пациентов из стационаров. Сокращение сроков пребывания на больничной койке и ранняя реабилитация — это результаты внедрения новых подходов к лечению, отражающие их эффективность. На начальных этапах использовались отдельные компоненты программы: обезболивание на основе эпидуральной анестезии, раннее энтеральное питание и ранняя активизация больных. В дальнейшем спектр технологий был расширен за счет включения компонентов, эффективность которых подтверждена в исследованиях, основанных на принципах доказательной медицины [29].
ПУВ является мультидисциплинарной, ее успешная реализация возможна только при командной работе медицинских специалистов различного профиля: хирургов, анестезиологов-реаниматологов, реабилитологов, клинических фармакологов и среднего медицинского персонала [1]. На догоспитальном этапе пациент консультируется как хирургом, так и анестезиологом-реаниматологом. Хирург устанавливает показания к операции, в задачи врача анестезиолога-реаниматолога входят выявление и коррекция сопутствующей патологии. Важный аспект ПУВ — разъяснение пациенту возможностей новой программы по ускоренной реабилитации, активное участие самого больного. И здесь остро встают вопросы нутритивного обеспечения периоперационного периода.
С одной стороны, врачи должны оценить нутритивный статус больного и, при необходимости, провести его коррекцию, а с другой — информировать о преимуществах ПУВ, в том числе объяснить, что перед хирургической операцией пациенту не придется голодать, а после ее окончания в кратчайшие сроки возможно энтеральное питание.
Основными задачами нутритивной поддержки у хирургических больных являются снижение катаболической реакции организма, восполнение энергетических затрат и обеспечение пластических потребностей организма. В зависимости от степени выраженности питательной недостаточности, тяжести метаболических нарушений и состояния ЖКТ нутритивная поддержка может быть реализована путем назначения энтерального питания либо, при невозможности его проведения или неэффективности, парентерального питания. В идеале нутритивная поддержка не должна «догонять уходящий поезд», что нередко происходит при ее назначении в условиях манифестированной нутритивной недостаточности. Компенсация нарушений метаболизма, развившихся в послеоперационном периоде, не всегда эффективна и более трудоемка, чем проведение коррекции субклинической нутритивной недостаточности в предоперационном периоде.
Одна из типичных догм, которую поддерживали и поддерживают анестезиологи-реаниматологии, опасаясь развития регургитации и аспирации на вводном наркозе, — необходимость голодания перед операцией. Голодание перед операцией негативно воспринимается больными, сопровождаясь жаждой, слабостью и неприятными эмоциональными переживаниями. Побочные эффекты такого ограничения очевидны: возможность развития гиповолемии, истощение запасов гликогена и гипогликемия, метаболический стресс. Необходимость голодания была опровергнута при исследовании скорости пассажа жидкой и твердой пищи из желудка в двенадцатиперстную кишку [20, 26]. Опубликованные в дальнейшем данные метаанализа 22 рандомизированных исследований, посвященных предоперационному голоданию [3], показали, что пероральный прием воды или прозрачных жидкостей (чай, сок без мякоти) за 2 часа до операции не увеличивает объем желудочного содержимого и его pH и не повышает частоту аспирационных осложнений в сравнении с этими показателями у пациентов, голодавших с полуночи до операции. Согласно рекомендациям Европейского общества анестезиологов, необходимо прекращать прием прозрачных жидкостей за 2 часа до индукции в наркоз, а твердой пищи — за 6 часов. Эти положения распространяются и на взрослых, и на детей [23]. Более длительные сроки отказа от пищи и воды требуются у пациентов с обструкцией верхних отделов ЖКТ.
Хирургическое вмешательство приводит к метаболическому ответу организма. В раннем послеоперационном периоде преобладает катаболическая направленность, связанная с выбросом большого количества гормонов стресса (кортизол, глюкагон, катехоламины) и медиаторов воспаления (цитокины). В ответ на формирование инсулинорезистентности возникает гипергликемия [2]. Доказана тесная взаимосвязь между выраженностью инсулинорезистентности и негативными исходами планового хирургического лечения. Снижение чувствительности к инсулину на 25% после кардиохирургических операций ассоциировано с увеличением частоты септических осложнений и повышением летальности [21].
Первоначально для предотвращения инсулинорезистентности использовали внутривенное введение глюкозы в дозе 5 мг/кг/мин ночью перед операцией [15]. Однако такая методика увеличивала водную нагрузку и была неудобна пациентам и персоналу. Позднее было предложено за 2 часа до операции давать больным углеводный напиток (раствор мальтодекстринов). После приема такого коктейля повышается комфорт пациентов (устраняются жажда и голод, появляется ощущение сытости) и происходит выброс инсулина в тех же количествах, что и после полноценного завтрака.
Влияние углеводного напитка на объем желудочного содержимого было изучено у 188 кардиохирургических больных (3–4-й классы по шкале ASA) [4]. Больным первой (основной) группы назначали углеводный напиток, второй — ароматизированную воду, больные третьей группы голодали с вечера накануне операции. Пациентам первой и второй групп разрешалось выпить 800 мл жидкости вечером и 400 мл за 2 часа до операции. Установлено, что различий между группами по объему желудочного содержимого перед началом анестезии не было. Кроме того, в основной группе потребовалась меньшая инотропная поддержка после завершения этапа искусственного кровообращения.
В другом рандомизированном плацебо-контролируемом исследовании с участием 252 пациентов, оперированных на органах ЖКТ, назначение углеводного напитка за 2 часа до начала наркоза сопровождалось уменьшением жажды, беспокойства, слабости и нарушений концентрации внимания после операции в сравнении с больными, получавшими плацебо [7].
В двух исследованиях, включавших 1537 и 1438 пациентов с оперативными вмешательствами на тазобедренных суставах, назначение углеводного напитка за 2 часа до начала наркоза приводило к снижению инсулинорезистентности на 1-е и 3-и сутки послеоперационного периода [24, 25]. У больных после плановых операций на толстой и прямой кишке также отмечено снижение инсулинорезистентности после приема углеводного напитка за 2 часа до операции. Одновременно пациенты реже испытывали чувство голода и жажды [28]. При операциях на толстом кишечнике включение углеводного напитка в предоперационную подготовку приводило к уменьшению длительности госпитализации [18]. Схожие результаты по сокращению сроков пребывания в стационаре получены при ретроспективном анализе трех проспективных рандомизированных исследований [14]. Согласно рекомендациям Европейского общества анестезиологов, назначение углеводного напитка за 2 часа до хирургического вмешательства улучшает самочувствие пациентов, снижает жажду и инсулинорезистентность в послеоперационном периоде [23].
В настоящее время за рубежом выпускается много официнальных препаратов на основе углеводных напитков с дополнительными ингредиентами. Вскоре и в РФ будет доступен аналогичный препарат — Провайд Экстра («Фрезениус Каби», Германия). Напиток выпускается с пятью различными вкусами во флаконах по 200 мл. В 100 мл раствора содержатся 33,5 г углеводов, 4 г белка, основные витамины и микроэлементы; энергетическая ценность составляет 150 ккал, осмолярность — около 700 мосмоль/л. Рекомендуемая доза — 400 мл накануне операции и 200 мл за 2 часа до начала анестезии.
Основу питания до операции у большинства пациентов, проходящих лечение в соответствии с концепцией ПУВ, составляет обычная еда. В задачи анестезиолога еще на догоспитальном этапе входят оценка и, при необходимости, коррекция нутритивной недостаточности. Это особенно актуально у больных, которым оперативное лечение проводится по поводу опухолей: несмотря на референсные показатели ИМТ, у таких пациентов нередко имеется истощение и низок уровень потребления белка. Необходимо провести скрининг нутритивной недостаточности, для которого разработаны надежные инструменты, включающие сбор анамнеза, определение антропометрических и лабораторных показателей. У больных хирургического и онкологического профилей применяются Nutritional Risk Screening 2002 (NRS 2002), Subjective Global Assessment и Nutritional Risk Index. Наиболее распространенным инструментом является скрининговый протокол NRS 2002, разработанный Европейской ассоциацией клинического питания и метаболизма для оценки наличия или риска развития нутритивной недостаточности у взрослых [11]. Согласно протоколу NRS 2002, при первичном осмотре пациента необходимо получить ответы на четыре вопроса:
1) ИМТ больного ниже 20,5?
2) отмечал ли пациент снижение массы тела за последние 3 месяца?
3) сократилось ли количество потребляемой пациентом пищи на протяжении последней недели?
4) имеется ли у пациента какое-либо тяжелое заболевание?
Наличие хотя бы одного положительного ответа является показанием для проведения окончательного скрининга (табл.).
Таблица
Скрининговый протокол оценки риска недостаточности питания Nutritional Risk Screening 2002 [11]
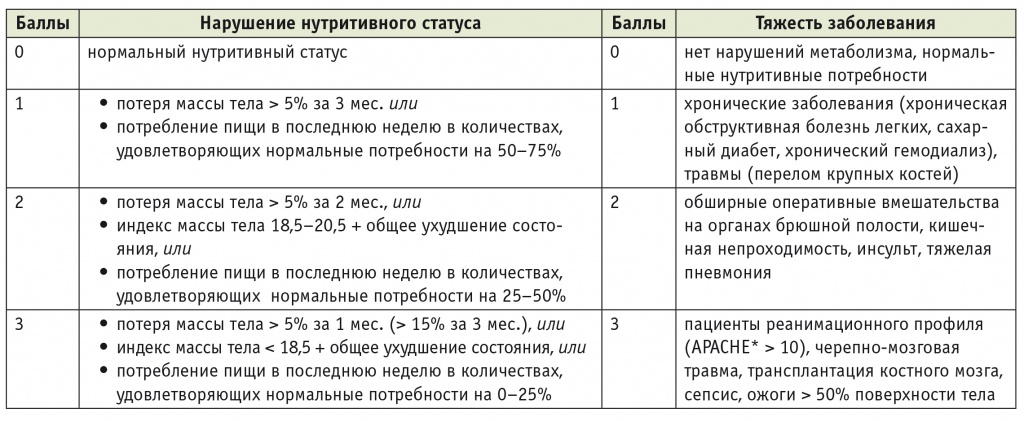
* APACHE — Acute Physiology and Chronic Health Evaluation (шкала оценки тяжести пациента).
Примечание. После скрининга баллы из левой и правой колонок суммируются, при возрасте 70 лет и старше добавляется 1 балл. При сумме ≥ 3 баллам требуется нутритивная поддержка.
Доказано, что при исходной недостаточности питания ухудшаются результаты хирургического лечения: возрастают количество осложнений, сроки госпитализации, летальность [31]. Коррекция недостаточности питания до операции позволяет оптимизировать течение послеоперационного периода. В контексте ПУВ у хирургических больных особое значение приобретает дополнительное пероральное питание, за счет которого можно увеличить общее потребление пищи и достичь целевых алиментарных показателей [22]. У пациентов с истощением и снижением ИМТ назначение дополнительного перорального питания за 7–10 дней до операции сопровождалось уменьшением частоты инфекционных осложнений и числа случаев несостоятельности швов анастомоза [27].
До операции дополнительное пероральное питание может быть реализовано с помощью сиппинга. Сиппинг — пероральный прием специальной смеси для энтерального питания маленькими глоткам (и, как правило, через трубочку). Он используется в ситуациях, когда обычный прием пищи, даже с высокой калорийностью, не обеспечивает возросших потребностей организма или при снижении аппетита. В таких случаях назначение жидких смесей с хорошими вкусовыми качествами способно скорректировать нутритивную недостаточность. Наряду с высокой калорийностью в небольшом объеме, смеси для сиппинга имеют и ряд других преимуществ. В частности, они сбалансированы по содержанию основных нутриентов, обогащены микроэлементами и витаминами, могут дополнительно содержать пищевые волокна и биоактивные компоненты. В качестве примера приведем Суппортан Напиток («Фрезениус Каби», Германия) — гиперкалорическую смесь, которая характеризуется высоким содержанием белка, омега-3 жирных кислот, антиоксидантов и пониженной долей углеводов. Препарат выпускается во флаконах по 200 мл. При проведении предоперационной подготовки (часто на догоспитальном этапе после выявления нутритивной недостаточности) к обычному рациону пациента добавляют две-три дозы напитка, что позволяет приблизить объемы поступающей энергии и пластических веществ к должным показателям. Таким образом, полноценно используется амбулаторный этап подготовки пациента к операции.
До недавнего времени питание пациентов после операции на ЖКТ подразумевало голодание до появления перистальтики кишечника. Такая тактика обосновывалась профилактикой несостоятельности швов анастомоза. Однако в экспериментальных и клинических работах доказано: раннее энтеральное введение питательных веществ способствует сохранению и восстановлению целостности слизистой оболочки кишечника, что имеет существенное значение для поддержания гомеостаза и укрепления иммунитета. Установлено, что усвоение питательных вещества в раннем послеоперационном периоде через ЖКТ сопровождается снижением уровня гиперметаболизма и улучшением азотистого баланса. При отсутствии энтерального поступления пищи не только происходят изменения в слизистой оболочке, но и развивается атрофия так называемой ассоциированной с кишечником лимфоидной ткани (gut-associated lymphoid tissue — GALT). К ней относятся пейеровы бляшки, мезентериальные лимфоузлы, лимфоциты эпителия и базальной мембраны. GALT принадлежит решающая роль в развитии транслокации бактерий из кишечника в системный кровоток. Кроме того, в ней происходит выработка лимфоцитов, продуцирующих IgA и отвечающих за иммунный статус всех слизистых организма [2].
Установлено, что раннее начало энтерального питания позволяет снизить частоту развития послеоперационных осложнений, длительность госпитализации, а также стоимость лечения по сравнению с таковыми при использовании методики полного парентерального питания или отсроченном начале нутритивной поддержки [6, 13].
Энтеральное питание может проводиться как per os, так и путем доставки питательных смесей в различные отделы ЖКТ с помощью зонда (зондовое питание).
Согласно ПУВ, в послеоперационном периоде пациенты могут начинать пить жидкости сразу после окончания постнаркозной депрессии, а затем есть обычную больничную пищу, спонтанно потребляя около 1200–1500 ккал/день, что способствует прекращению инфузионной терапии на 1–2-е сутки [19]. Назначение Суппортан Напитка позволяет избежать дефицита нутриентов и энергии. Подтверждение этого положения можно найти в работе C. Gillis и соавт., опубликованной в 2015 г. [5]. Авторы исследовали эффективность нутритивной поддержки ПУВ (ERAS) у больных после колоректальных операций. Согласно рекомендациям, в раннем послеоперационном периоде доставка энергии и белков не должна быть ниже 60% от нормальных показателей. Однако референсных значений удалось достичь только в отношении энергетической составляющей. Исследователи связывают полученные результаты с плохим аппетитом и изменениями настроения пациентов. Вместе с тем больным с исходными нарушениями питания в течение 30 дней после операции достоверно чаще требовалась повторная госпитализация. Этот пример лишний раз доказывает, что для устранения периоперативных нутритивных нарушений требуется назначение смесей с повышенным содержанием белка.
Ранний пероральный прием нутриентов с пищей и посредством сиппинга хорошо осуществим после хирургических операций вне ЖКТ или на его нижних отделах — ободочной и прямой кишке. После оперативных вмешательств на верхних отделах ЖКТ прием жидкости и пищи per os не всегда реализуем. Однако имеются работы, свидетельствующие о проведении перорального питания начиная со 2-х суток после операций на желудке. Так, в опубликованной в 2009 г. работе сообщается, что при питании per os со 2-х суток после гастрэктомии достоверно сокращались сроки пребывания пациентов в стационаре и повышалось качество их жизни [9]. В следующей публикации авторы подтвердили полученные результаты. Было показано, что у пациентов, прооперированных по поводу рака, питание per os, начатое со 2-х суток после гастрэктомии, ассоциировано с уменьшением длительности госпитализации, повышением качества жизни и меньшей частотой возникновения тошноты и рвоты в сравнении с теми, кто начал пероральный прием пищи с 4-х суток [8]. В многоцентровом рандомизированном контролируемом исследовании были получены схожие результаты. Раннее начало перорального питания после операций на верхних отделах ЖКТ не сопровождалось увеличением числа случаев несостоятельности швов анастомоза или повышением летальности. Однако при приеме пищи per os начиная с 1-х суток чаще регистрировали тошноту и рвоту [12]. В рекомендациях ERAS (2014) указывается, что после гастрэктомии прием жидкости и пищи возможен с 1-х суток послеоперационного периода. Если при пероральном приеме не удается доставить 60% энергии и белка, рекомендуется проведение индивидуальной нутритивной поддержки [17].
Надо признать, что на практике после операций на верхних отделах ЖКТ прием пищи через рот зачастую откладывается до контроля целостности анастомоза на 5-6-е сутки после операции. Это, по всей вероятности, связано с неуверенностью хирурга в результатах операции (к примеру, из-за технических проблем или большой кровопотери). Однако практика воздержания от перорального приема пищи до начала перистальтики и отхождения газов необоснованна.
Достаточно часто после хирургических вмешательств на верхних отделах ЖКТ питание осуществляется смесями, вводимыми через зонд, заведенный за анастомоз. Сообщается, что после панкреатодуоденальной резекции проведение энтерального питания возможно через еюностому, установленную в ходе операции [30].
Нутритивную поддержку хирургических больных необходимо рассматривать в контексте инфузионной терапии. Важным фактором, определяющим соотношение между приемом пищи через рот, зондовым питанием и внутривенным введением растворов, является баланс жидкости и электролитов [16]. Перегрузка жидкостью и натрием в периоперационном периоде ведет к образованию отека стенки анастомоза ЖКТ и замедляет восстановление перестальтики. H. Kehlet указывают на важную роль эпидуральной анальгезии в поддержании моторики ЖКТ, после обширных операций ее необходимо проводить не менее 2 дней [10]. Это позволяет ограничить системное использование опиатов для обезболивания и, тем самым, уменьшить их негативное влияние на моторику кишечника. Необходимо также избегать рутинной установки зондов в ЖКТ и удалять их как можно раньше. В большинстве случаев комплексное применение этих мер делает возможным прием пищи спустя несколько часов после хирургических вмешательств и позволяет пациентам возвратиться к обычному уровню потребления пищи через один-два дня после обширных операций на ЖКТ.
Необходимо помнить, что пациенты после выписки из стационара не всегда находятся под наблюдением врачей. Кроме того, у них часто имеются проблемы с аппетитом, депрессия, апатия, возможно ухудшение нутритивного статуса и отдаленных результатов хирургического лечения. Одним из решений этой проблемы является назначение препаратов для сиппинга, которые, имея небольшой объем и приятный вкус, могут компенсировать недостаток нутриентов, поступающих с обычной пищей.
Отдельной большой проблемой является нутритивный статус пациентов, получающих химиотерапию до/после обширных хирургических вмешательств. Исходные нарушения питания встречаются у 40–80% онкологических больных. Курсы химиотерапии зачастую приводят к прогрессированию нарушений питания, что связано с сопутствующими им тошнотой, рвотой и потерей аппетита. В послеоперационном периоде у этого контингента больных гораздо чаще приходится сталкиваться с нутритивной недостаточностью. Поэтому такие пациенты подлежат обязательному скринингу на предмет нарушения питания, интенсивной предоперационной подготовке и более длительной нутритивной поддержке в послеоперационном периоде. Преимущества имеют энтеральные способы доставки нутриентов (сиппинг, зондовое питание), а в случаях невозможности или неэффективности их применения назначают парентеральное питание.
ЗАКЛЮЧЕНИЕ
Нутритивную терапию важно рассматривать как компонент программы ускоренного восстановления (ПУВ), без которого эффективная реабилитация хирургических больных невозможна. Она не заменяет, а дополняет другие элементы программы. Нутритивная поддержка должна быть индивидуализирована в рамках ПУВ. До оперативного лечения необходимо проводить скрининг питательного статуса пациента, а при необходимости и его коррекцию. Перед операцией назначается углеводный напиток для профилактики инсулинорезистентности. В послеоперационном периоде следует перейти на раннее энтеральное питание, используя специализированные продукты.
Для успешной реализации нутритивной поддержки должно ограничиваться использование опиатов, провоцирующих тошноту и парез ЖКТ. При этом необходимо адекватное обезболивание, которое может быть достигнуто при мультимодальном подходе. Профилактика тошноты и рвоты достигается не только назначением антиэметических препаратов, но и исключением закиси азота из схем анестезии. Отказ от рутинной установки зондов способствует раннему питанию per os, а отказ от дренажей — профилактике возникновения пареза. Таким образом, реализация нутритивной поддержки — одного из важнейших компонентов ПУВ — возможна лишь при учете множества факторов и командной работе специалистов.







