Начало настоящего столетия отмечено широким распространением принципов хирургии, ориентированной на быструю активизацию и восстановление пациентов с ранним переводом из отделения интенсивной терапии. Указанная концепция получила название Fast-Track-хирургии. Целесообразность этих подходов подтверждена в различных областях хирургии, в том числе при вмешательствах на легких и сердце [7, 19]. В основе ранней активизации пациентов лежит концепция анестезии, ориентированной на быстрое пробуждение (Fast-Track-анестезии), подразумевающая рациональное использование современных внутривенных и ингаляционных анестетиков, применение миорелаксантов и наркотических анальгетиков с короткими периодами полувыведения, а также различных вариантов регионарной анестезии [8, 18].
Понятно, что в полной мере реализация принципов быстрой активизации и восстановления пациентов возможна при неосложненном течении послеоперационного периода. Почти при каждом четвертом вмешательстве на органах грудной полости возникают клинические ситуации, требующие продленного мониторного наблюдения и интенсивной терапии (в том числе кровотечения, повреждения ЦНС, почек, сердечная и, конечно, острая дыхательная недостаточность) [16]. Однако применение современных эффективных технологий интенсивной терапии позволяет кардинально снижать сроки лечения в ОРИТ даже при этих осложнениях, расширяя границы Fast-Track-хирургии.
Острую дыхательную недостаточность традиционно считают наиболее частым и значимым осложнением раннего послеоперационного периода вмешательств на органах грудной полости. После операций на легких и трахее тяжелые нарушения функции внешнего дыхания, требующие продленной респираторной терапии, возникают в 1–3% случаев [16]. Риск этого осложнения значительно возрастает после ранних реторакотомий, при которых послеоперационный период характеризуется тяжелым течением с летальностью, достигающей 35% [4, 13]. После операций на сердце острая дыхательная недостаточность развивается в 12–20% случаев [6], при этом ее наиболее тяжелая форма — острый респираторный дистресс-синдром (ОРДС) — возникает после 2,5–5% кардиохирургических вмешательств, а летальность при тяжелых формах ОРДС составляет 30–50% [14]. Наибольший риск развития послеоперационной дыхательной недостаточности (25–40%) и ОРДС (20–25%) отмечают при реконструктивных вмешательствах на нисходящем отделе грудной аорты [10].
Патогенетические механизмы развития острой дыхательной недостаточности при операциях на легких и грудной аорте во многом схожи. Значимую роль играют ишемия легких с последующим реперфузионным повреждением, их механическая травма и запускаемая при этих обширных операциях системная воспалительная реакция. Одним из ключевых последствий указанных механизмов становится повреждение системы легочного сурфактанта с неизбежным формированием зон микроателектазирования, увеличением шунтирования крови и развитием тяжелой гипоксемии, требующей респираторной поддержки с «агрессивными» параметрами. Важным следствием возникающего вторичного дефицита сурфактанта становится снижение местной резистентности к инфекции с повышением риска развития вентиляторассоциированных пневмоний (ВАП).
Указанные обстоятельства позволили нам предположить эффективность профилактического назначения препарата сурфактанта при вмешательствах на органах грудной полости с высоким риском развития острой дыхательной недостаточности. При этом мы рассчитывали на более быстрое и устойчивое восстановление показателей газообмена и биомеханики дыхания, снижение сроков проведения респираторной поддержки и риска развития ее осложнений, сокращение периода лечения в ОРИТ.
Целью выполненных авторами исследований была проверка указанной гипотезы при операциях с высоким риском развития дыхательной недостаточности — ранних реторакотомиях и реконструктивных вмешательствах на нисходящем отделе грудной аорты.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное контролируемое нерандомизированное исследование эффективности профилактического введения сурфактанта при ранних реторакотомиях вошли 47 пациентов (19 мужчин и 28 женщин, средний возраст — 54,7 ± 4,2 года), которые перенесли операции на органах грудной полости: расширенные пневмонэктомии (n = 33), субтотальные резекции пищевода с одномоментной пластикой широким желудочным стеблем (n = 9), расширенные лобэктомии и атипичные резекции долей легкого (n = 5). В раннем послеоперационном периоде у всех пациентов возникли показания для выполнения реторакотомий, что было связано с внутриплевральными кровотечениями (n = 35), а также с несостоятельностью анастомозов или культей бронхов (n = 12). После реторакотомий всем пациентам требовалась продленная респираторная поддержка, при проведении которой использовали стандартный протокол: дыхательный объем — 5–7 мл/кг; положительное давление в конце выдоха — 5 см вод. ст.; фракция кислорода во вдыхаемой смеси (FiO2), достаточная для поддержания насыщения гемоглобина артериальной крови кислородом (SaO2) выше 90%.
Больным основной группы (n = 37) во время реторакотомий и в раннем послеоперационном периоде выполнялось профилактическое и, при необходимости, лечебное введение препарата сурфактанта Сурфактант-БЛ (ООО «Биосурф», Россия); 10 пациентов контрольной группы этот препарат не получали. Группы не различались по возрасту, структуре перенесенных оперативных вмешательств, объему интраоперационной кровопотери.
Препарат сурфактанта вводили с помощью фибробронхоскопа болюсно в каждый долевой бронх в суммарной дозе 6 мг/кг на введение. Больным, перенесшим пневмонэктомии, препарат вводили в дозе 150 мг в единственное легкое. При необходимости повторное эндобронхиальное введение выполняли через 12 часов. Тактика респираторной поддержки и подходы к интенсивной терапии в исследуемых группах не различались.
С целью изучения эффективности профилактического применения препарата сурфактанта при операциях на нисходящем отделе грудной аорты было проведено проспективное контролируемое исследование, в которое включили 18 пациентов (4 женщины, 14 мужчин, медиана возраста — 54 (42; 63) года). Больным выполнялись реконструктивные операции по поводу расслоений аорты III типа по классификации DeBakey (n = 13), посттравматических ложных аневризм (n = 3) и торакоабдоминальных аневризм I типа по классификации E. Crawford (n = 2). В 8 случаях вмешательства проводились в экстренном порядке в связи с острым развитием расслоения грудной аорты (n = 5), нарушением перфузии спинного мозга и появлением параплегии (n = 1), развитием острой почечной недостаточности (n = 1), формированием ложной посттравматической аневризмы грудного отдела аорты (n = 1). Вмешательства выполняли под общей комбинированной анестезией (n = 7) или тотальной внутривенной анестезией (n = 11). Во всех случаях использовали эндобронхиальную интубацию двухпросветными левосторонними трубками; однолегочная вентиляция проводилась во время основного этапа операции. В конце операции, перед переводом пациента в ОРИТ, производили переинтубацию однопросветной эндотрахеальной трубкой. ИВЛ выполняли в режиме контроля по объему с дыхательным объемом 9 мл/кг, FiO2 поддерживали на уровне, достаточном для обеспечения SaO2 выше 95%. В 15 случаях основной этап операции проводили в условиях параллельного искусственного кровообращения. При трех операциях во время основного этапа дистальная перфузия осуществлялась путем наложения временного шунта.
Девяти пациентам основной группы после индукции анестезии, во время контрольной бронхоскопии, в левый главный бронх вводили Сурфактант-БЛ в дозе 3 мг/кг. Девять больных контрольной группы препарат сурфактанта не получали. В обеих группах строго придерживались стандартной анестезиологической тактики и подходов к послеоперационной интенсивной терапии. Группы не имели статистически значимых различий по основным исходным характеристикам.
Эффективность предложенного профилактического подхода оценивали на основе анализа динамики показателей газообмена и биомеханики дыхания, а также данных о клиническом течении раннего послеоперационного периода.
Статистический анализ проведен с помощью пакета Statistica 7.0 (StatSoft Inc., США). Для сравнения показателей двух независимых выборок при нормальном распределении применяли однофакторный дисперсионный анализ, в случаях распределения, отличного от нормального, — непараметрический критерий Манна — Уитни. Для сравнения качественных показателей использовали точный критерий Фишера. Критическим уровнем значимости считали р = 0,05. В выборках с нормальным распределением данные представляли в виде среднего арифметического и стандартного отклонения (М ± σ), в выборках с ненормальным распределением значения были представлены как медиана (25-й; 75-й процентили).
РЕЗУЛЬТАТЫ
Профилактическое применение препарата сурфактанта при ранних реторакотомиях после расширенных операций на органах грудной полости
Развитие осложнений, потребовавших выполнения повторных операций, сопровождалось выраженными нарушениями газообмена (табл. 1).
Таблица 1
Изменение показателей газообмена при ранних реторакотомиях после вмешательств на органах грудной полости в случаях профилактического применения препарата сурфактанта (основная группа, n = 37) и без его использования (контрольная группа, n = 10), М ± δ
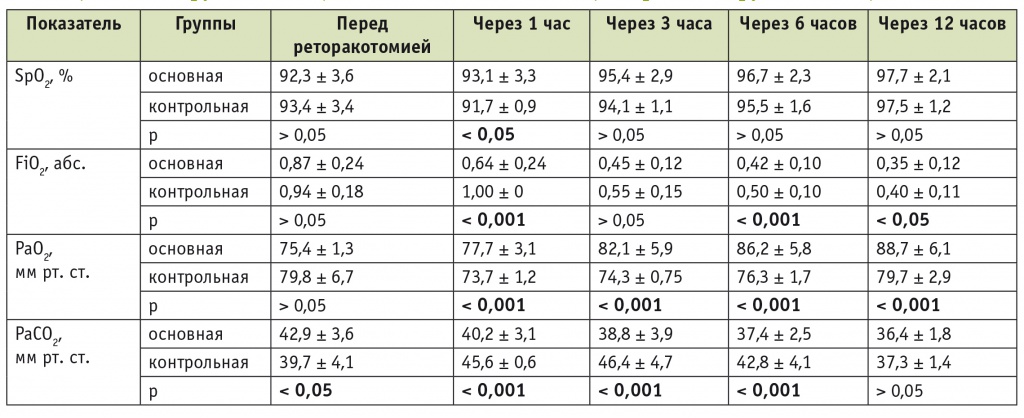
Примечание. В таблицах 1, 3: FiO2 — фракция кислорода во вдыхаемой смеси; PaCO2 — парциальное давление углекислого газа в атериальной крови; PaO2 — парциальное давление кислорода в артериальной крови; SpO2 — насыщение гемоглобина артериальной крови кислородом.
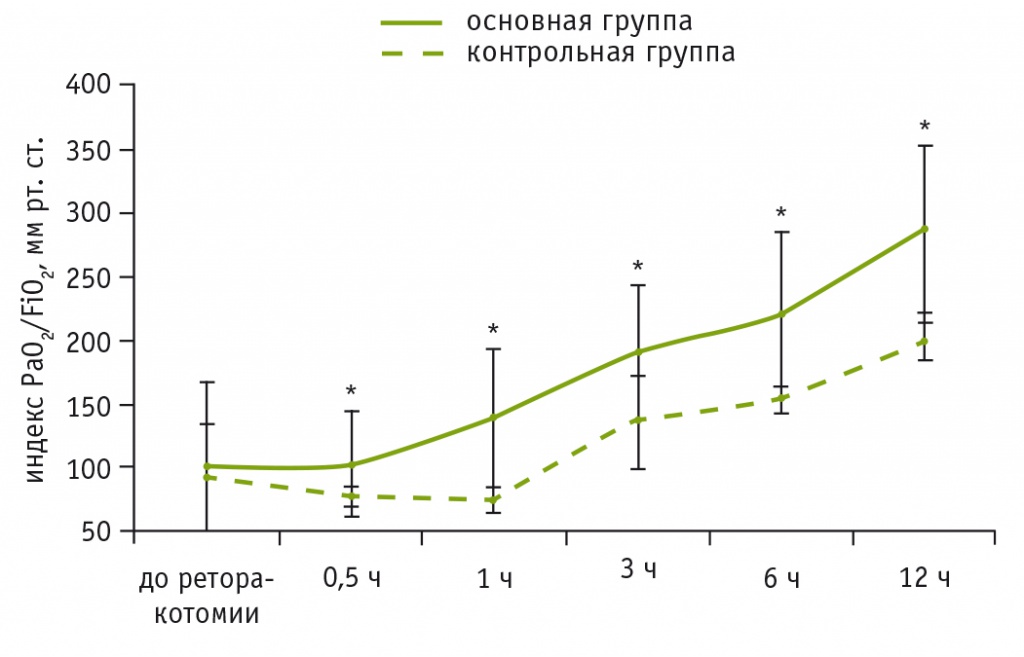
Как следует из данных, представленных в таблице 1, у пациентов контрольной группы тяжелая гипоксемия с необходимостью применения респираторной поддержки с FiO2, превышавшей 50%, сохранялась на протяжении шести послеоперационных часов. Профилактическое введение препарата сурфактанта приводило к более быстрому восстановлению показателей газообмена. Так, мы обнаружили достоверно более высокие значения парциального давления кислорода в артериальной крови (PaO2) у пациентов основной группы на протяжении первых 12 часов после реторакотомий. В этот же период у пациентов основной группы отмечали прогрессивное увеличение индекса PaO2/FiO2, причем во всех временны́х точках этот показатель превосходил таковой, зарегистрированный в контрольной группе (рис. 1). Более быстрое и устойчивое восстановление оксигенации позволило уже к 3-му часу после реоперации перевести пациентов основной группы на респираторную поддержку с FiO2 менее 50%.
Рис. 1. Изменение индекса PaO2/FiO2 в раннем послеоперационном периоде реторакотомий у пациентов основной и контрольной групп, мм рт. ст.
* P < 0,001
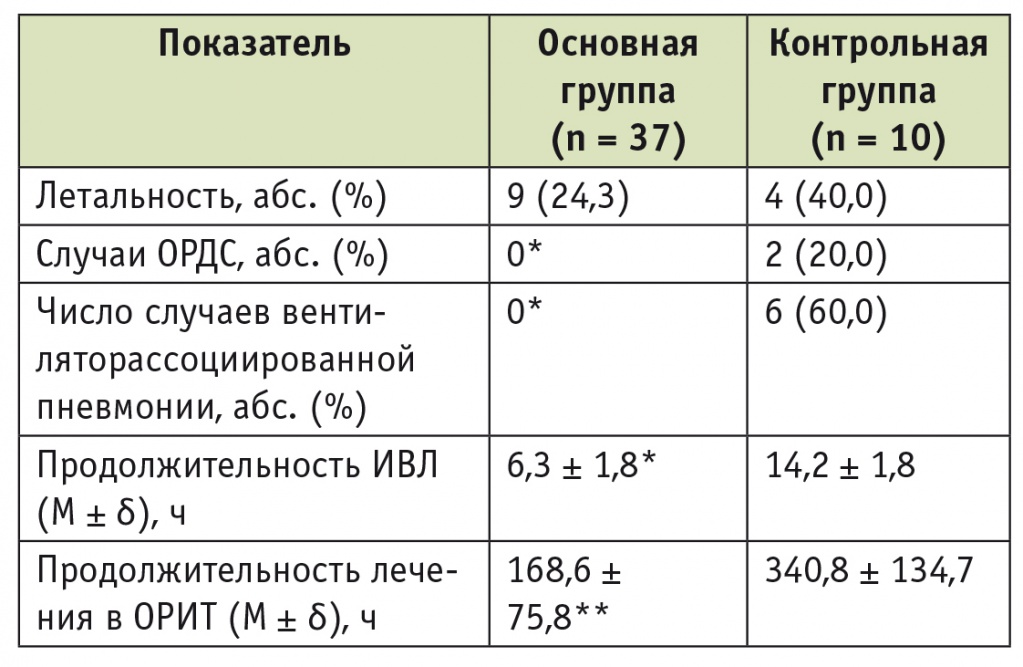
Клиническое течение послеоперационного периода реторакотомий в исследуемых группах различалось по ряду показателей (табл. 2). Так, при профилактическом использовании препарата сурфактанта продолжительность послеоперационной респираторной поддержки была достоверно ниже, чем в контрольной группе. Указанное различие можно связать с более быстрым и устойчивым восстановлением показателей газообмена.
Таблица 2
Показатели клинического течения послеоперационного периода ранних реторакотомий, выполненных после расширенных вмешательств на органах грудной полости
* P < 0,05.
** P < 0,01.
Примечание. В таблицах 2, 4: ИВЛ — искусственная вентиляция легких; ОРДС — острый респираторный дистресс-синдром; ОРИТ — отделение реанимации и интенсивной терапии.
Однако применение препарата сурфактанта имело не менее важные отдаленные последствия. Мы обнаружили достоверно меньшую частоту развития ОРДС при использовании препарата сурфактанта во время реторакотомий. Кроме того, применение этого профилактического метода предупредило развитие ВАП у пациентов основной группы, в то время как в контрольной группе частота ВАП достигла 60,0%. Вероятно, благодаря быстрой коррекции респираторных нарушений и предупреждению развития инфекционных осложнений продолжительность пребывания в ОРИТ у пациентов основной группы была в 2 раза меньше, чем у больных контрольной группы.
Профилактическое применение препарата сурфактанта при реконструктивных вмешательствах на нисходящем отделе грудной аорты
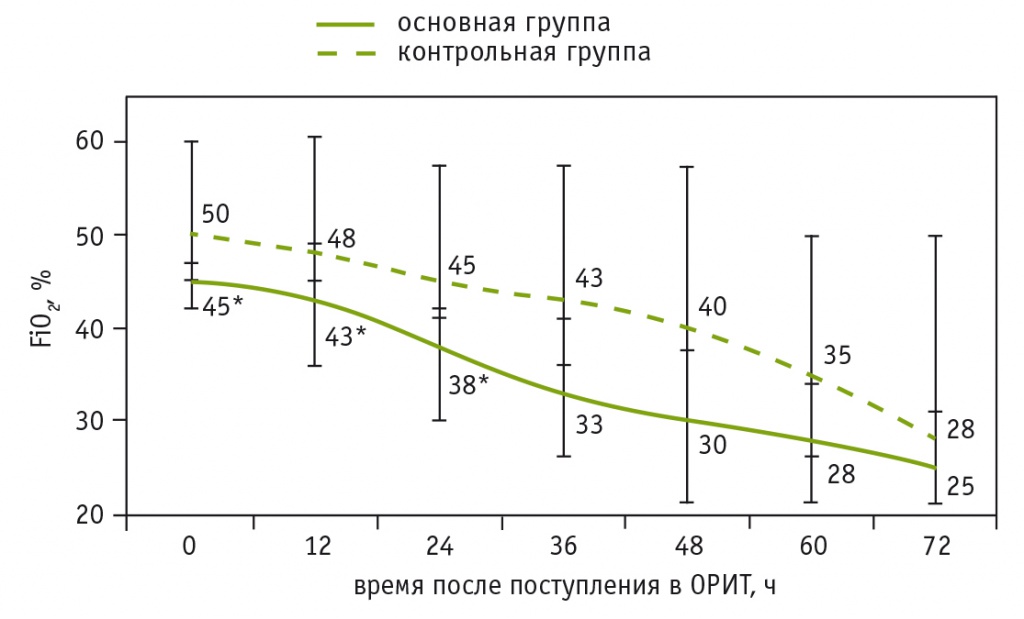
На фоне респираторной поддержки в раннем послеоперационном периоде не наблюдалось достоверных различий в значениях PaO2 и парциального давления углекислого газа в артериальной крови (PaCO2) у пациентов основной и контрольной групп (табл. 3). В то же время индекс PaO2/FiO2 был достоверно ниже у больных контрольной группы, что свидетельствовало о более выраженном интраоперационном поражении легких. У этих пациентов поддержание адекватной оксигенации требовало применения более высокой FiO2 (рис. 2).
Таблица 3
Изменения показателей газообмена в послеоперационном периоде вмешательств на нисходящем отделе грудной аорты в случаях применения сурфактанта (основная группа, n = 9) и без его использования (контрольная группа, n = 9)
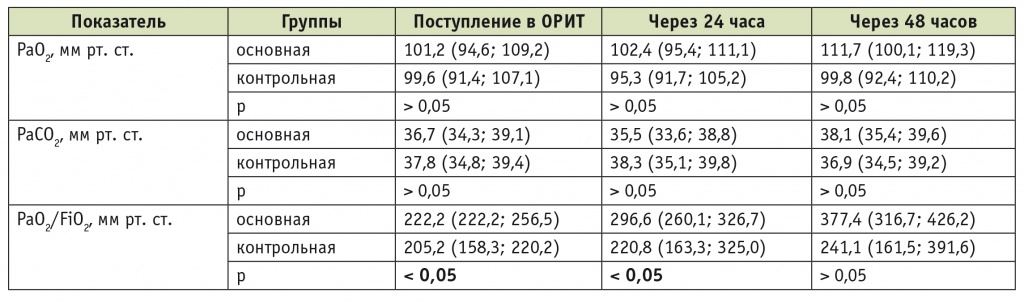
Примечание. Данные представлены как медиана (25-й; 75-й процентили).
Рис. 2. Изменение фракции кислорода во вдыхаемой смеси (FiO2) после вмешательств на нисходящем отделе грудной аорты, %.
* P < 0,05 при сравнении с контрольной группой.
Примечание. Указаны медианы значений
В основной группе не было отмечено случаев развития ОРДС. Только двум пациентам потребовалась продленная (более 24 часов) респираторная поддержка (52 и 74 часа), причинами которой могли быть синдром малого выброса и тяжелая эндогенная интоксикация, вызванная нарушениями артериального кровоснабжения почек и мезентериального бассейна. Обращало на себя внимание отсутствие случаев ВАП при профилактическом использовании препарата сурфактанта. В контрольной группе в первые сутки после операции были экстубированы только 4 пациента, 5 больных нуждались в продленной респираторной поддержке сроком от 49 до 336 часов, причем в трех случаях ее причиной был ОРДС. В контрольной группе отмечены 2 случая ВАП, оба пациента с этим осложнением скончались (табл. 4).
Таблица 4
Показатели клинического течения послеоперационного периода вмешательств на нисходящем отделе грудной аорты
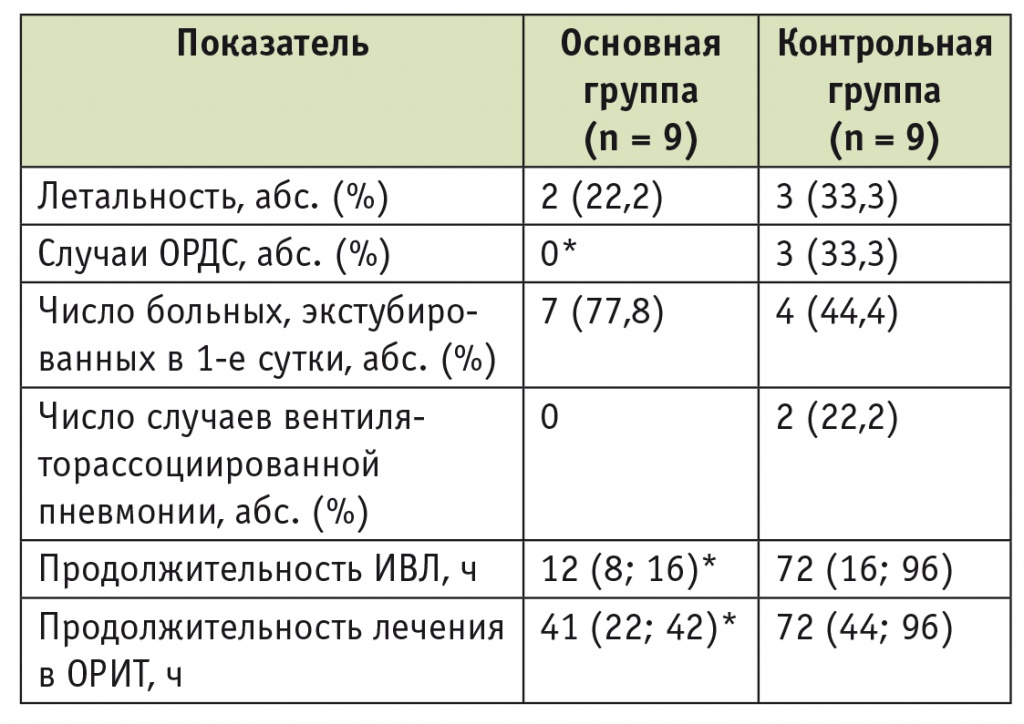
* P < 0,05.
Примечание. Данные по продолжительности ИВЛ и лечения в ОРИТ представлены как медиана (25-й; 75-й процентили).
Как следует из данных, представленных в таблице 4, превентивное введение препарата сурфактанта оказывало значимое влияние на течение послеоперационного периода реконструктивных вмешательств на нисходящем отделе грудной аорты. Менее выраженное интраоперационное повреждение легких позволяло достоверно сократить сроки перевода на самостоятельное дыхание и снизить риск прогрессирования поражения до степени ОРДС. Результатом снижения продолжительности респираторной поддержки и уменьшения доли пациентов с ОРДС и ВАП было достоверное сокращение сроков пребывания в ОРИТ.
ОБСУЖДЕНИЕ
Высказанное нами предположение о возможной эффективности профилактического применения препарата сурфактанта при вмешательствах с высоким риском развития послеоперационной дыхательной недостаточности получило подтверждение в исследованиях, выполненных в двух различных выборках — при ранних реторакотомиях после расширенных операций на органах грудной полости и при реконструктивных вмешательствах на нисходящем отделе грудной аорты. По-видимому, несмотря на несколько различающиеся патогенетические механизмы интраоперационного повреждения легких, вторичный дефицит сурфактанта, возникающий при этих вмешательствах, имеет важное значение как для развития ранних нарушений газообмена, так и в качестве фактора дальнейшего повреждения легких. Мы считаем, что в первую очередь по этим причинам в группах пациентов, превентивно получавших препарат сурфактанта, отмечено достоверное снижение продолжительности послеоперационной респираторной поддержки и частоты развития ОРДС.
Выполненные исследования обнаружили еще один важный компонент профилактического воздействия препарата сурфактанта, а именно его способность повышать резистентность легких к инфекции. Причем если в исследовании, проведенном при вмешательствах на аорте, снижение частоты развития ВАП имело характер тенденции (ни одного случая в группе профилактики и 22,2% в группе контроля), то при ранних реторакотомиях различие было статистически значимым (отсутствие пневмоний в группе профилактики и 60,0% в группе контроля; p < 0,05).
В современных литературных источниках указывается на риск развития ВАП от 29% до 70% в зависимости от причины и продолжительности респираторной поддержки с летальностью, достигающей 27–76% [9, 12]. В нашем исследовании у 22,2% пациентов, прооперированных на аорте, и у 60,0% больных, перенесших ранние реторакотомии, развилась ВАП, что соответствует указанным литературным данным. В то же время при профилактическом интраоперационном введении препарата сурфактанта не отмечено ни одного случая этого осложнения.
Основной причиной ВАП считают инвазию микрофлоры в нижние дыхательные пути и паренхиму легких, обусловленную интубацией трахеи и повреждением эпителия ротоглотки, транслокацией флоры из желудка и нарушениями мукоцилиарного клиренса. Сам по себе сурфактант может стимулировать фагоцитоз альвеолярных макрофагов, мукоцилиарный клиренс, а также агрегировать на своей поверхности вирусы и липополисахариды грамотрицательных бактерий [11, 15, 17]. Эти свойства, а также прямой антимикробный эффект ассоциированного с сурфактантом белка группы D трактуются в настоящее время как способность легочного сурфактанта обеспечивать врожденный и приобретенный локальный иммунитет. В проведенных нами исследованиях был использован природный препарат сурфактанта, максимально приближенный по своему составу к нативному легочному сурфактанту человека [5], что поддерживает предположение о повышении резистентности к инфекции. Именно для природного препарата сурфактанта показана способность снижать риск развития ВАП в случаях его назначения при ОРДС [2], острой дыхательной недостаточности у пациенток акушерско-гинекологического профиля [3] и при повреждениях легких после кардиохирургических вмешательств [1].
ЗАКЛЮЧЕНИЕ
В выполненных нами исследованиях получила подтверждение гипотеза об эффективности профилактического введения препарата сурфактанта при оперативных вмешательствах с высоким риском развития острой дыхательной недостаточности. Анализ результатов выявил три основных компонента профилактического воздействия: восстановление оксигенации, предупреждение дальнейшего усугубления интраоперационного повреждения легких и повышение резистентности к инфекции. Результатом превентивного применения природного препарата сурфактанта в конечном счете было снижение сроков проведения респираторной поддержки и пребывания пациентов в ОРИТ.
Нам представляется, что дальнейшее развитие предложенной методики позволит в полной мере реализовать принципы Fast-Track-анестезии и хирургии даже при вмешательствах на органах грудной полости с высоким риском развития острой дыхательной недостаточности.







