Эндометриоз мочевыделительной системы (ЭМС) встречается примерно у 1% женщин с эндометриозом, его частота среди пациенток с глубокими инфильтративными формами достигает 53%. В структуре заболеваемости ЭМС в 84% случаев поражается мочевой пузырь, реже (до 10%) — мочеточники, описаны единичные наблюдения эндометриоза почки и уретры [1, 2].
Злокачественная трансформация экстрагенитального эндометриоза является редким событием и на сегодняшний день до конца не изучена. С точки зрения онкогенеза только атипический эндометриоз (АЭ) рассматривается как морфологическая форма предрака, поэтому важно правильно диагностировать это заболевание с целью определения оптимальной тактики лечения.
Мы представляем клиническое наблюдение пациентки репродуктивного возраста с наружным генитальным эндометриозом и атипической формой эндометриоза мочевого пузыря (ЭМП).
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка Ш., 34 лет, поступила в отделение урологии 11.04.2017 г. c жалобами на боль в поясничной области справа, хроническую тазовую боль и циклическую дизурию.
Из акушерскогинекологического анамнеза известно, что менархе было в 11 лет, менструации по 5 дней, через 30–35 дней, сопровождающиеся дисменореей (интенсивность болей — 7–8 баллов по ВАШ). Беременность — одна, в 29 лет, закончившаяся срочными родами путем кесарева сечения в связи с первичной слабостью родовой деятельности. Лактация в течение 1 года. Прием КОК отрицает. Пациентка планирует беременность в будущем. Из сопутствующих гинекологических заболеваний выявлена лейомиома матки V типа (согласно классификации International Federation of Gynecology and Obstetrics 2011 г.). Наследственный онкологический анамнез не отягощен, у ближайших родственников встречались случаи эндометриоза.
При объективном осмотре определялся положительный симптом поколачивания по поясничной области справа. При гинекологическом исследовании матка увеличена до 5/6 недель, плотная, подвижная, безболезненная, область придатков без особенностей.
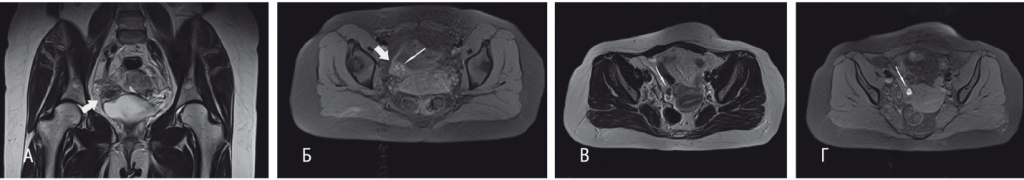
По данным МРТ органов малого таза, найдено новообразование размерами 29 × 43 × 29 мм, прилежавшее к предпузырному отделу правого мочеточника (рис. 1). Правый яичник содержал кистозное образование с геморрагическим содержимым диаметром до 25 мм.
Рис. 1. Магнитно-резонансная томограмма малого таза с контрастированием пациентки Ш. от 30.03.2017 г.(до хирургического вмешательства). А —Т2-взвешенное изображение (ВИ) в корональной проекции. Б — Т1-ВИ с жироподавлением в аксиальной проекции. На фрагментах А и Б локальное утолщение правой задне-латеральной стенке мочевого пузыря (толстая стрелка), которое гипоинтенсивно на Т2-ВИ, содержит гиперинтенсивные включения на Т1-ВИ с жироподавлением (тонкая стрелка) — типичные признаки для эндометриоидных гетеротопий. В — Т2-ВИ в аксиальной проекции. Г — Т1-ВИ с жироподавлением в аксиальной проекции. В проекции правого яичника между фолликулами определяется дополнительная кистозная структура (тонкая стрелка), которая гипоинтенсивна на Т2-ВИ, гиперинтенсивна на Т1-ВИ и признаки которой характерны для эндометриомы. Здесь и далее в статье фото авторов
При КТ почек отмечалось расширение всех групп чаш лоханки правой почки (до 100 × 76 × 92 мм), которое сдавливало нижнюю полую вену до 6 мм. Правый мочеточник расширен до 20 мм. Паренхима почки истончена, выделение контраста несимметричное. Чашечнолоханочная система левой почки не расширена.
На основании результатов обследований выставлен диагноз: новообразование мочевого пузыря, стриктура юкставезикального отдела правого мочеточника, уретерогидронефроз справа IV стадии.
Выполнено хирургическое вмешательство в плановом порядке: лапаротомия, резекция стенки мочевого пузыря с новообразованием, резекция нижней половины правого мочеточника, илеоуретеропластика справа, иссечение видимых эндометриоидных очагов мочевого пузыря и паравезикальной клетчатки.
Учитывая небольшие размеры эндометриомы правого яичника (25 мм), нереализованные репродуктивные планы, решено было воздержаться от овариоцистэктомии.
Послеоперационный период протекал без осложнений.
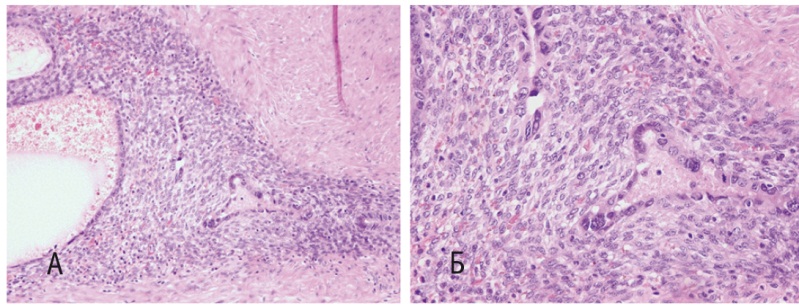
По данным гистологического исследования, в мышечной стенке мочевого пузыря имелись участки эндометриоидной стромы и эндометриоидных желез, часть из которых — с клеточной атипией, полиморфными ядрами (рис. 2). Правый мочеточник покрыт переходным эпителием с гипертрофией и очаговым фиброзом мышечного слоя.
Рис. 2. Микропрепарат атипического эндометриоза мочевого пузыря. А — окраска гематоксилином и эозином, 200-кратное увеличение; Б — окраска гематоксилином и эозином, 400-кратное увеличение
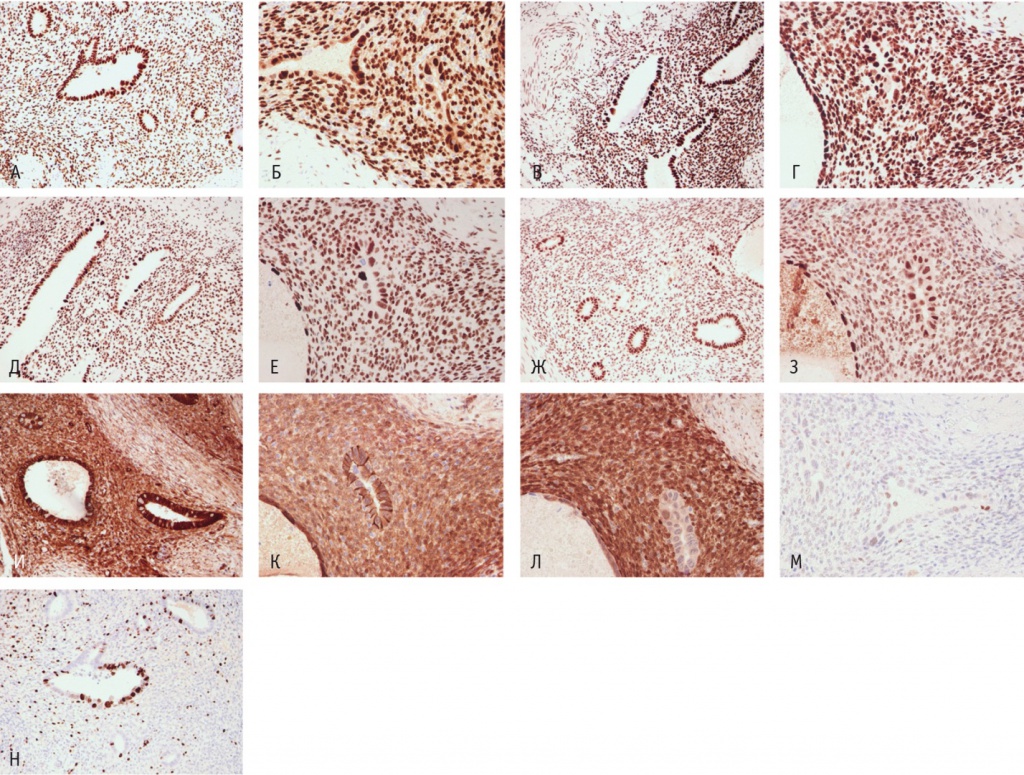
При проведении иммуногистохимического исследования наблюдалась позитивная реакция в эндометриоидных железах и в строме на эстрогеновые рецепторы в 95% клеток, на прогестероновые рецепторы — в 95% клеток, на BAF250a (ARID1a), MSH6, PMS2. В единичных крупных клетках — ядерная реакция βкатенина, негативная реакция на PTEN; слабое окрашивание стабилизированного дикого типа белка p53. Яркое окрашивание, характерное для мутантного типа, не выявлено; индекс Ki67 в крупных клетках — до 70% (рис. 3).
Рис. 3. Микропрепарат атипического эндометриоза мочевого пузыря, экспрессия: А — ER (эстрогеновых рецепторов), 200-кратное увеличение; Б — PR (прогестероновых рецепторов), 400-кратное увеличение; В — BAF250a (ARID1a), 200-кратное увеличение; Г — BAF250a (ARID1a), 400-кратное увеличение; Д — MSH6, 200-кратное увеличение; Е — MSH6, 400-кратное увеличение; Ж — PMS2, 200-кратное увеличение; З — PMS2, 400-кратное увеличение; И — β-катенина, 200-кратное увеличение; К — β-катенина, 400-кратное увеличение; Л — PTEN, 400-кратное увеличение; М — p53, 400-кратное увеличение; Н — Ki-67, 200-кратное увеличение.
Примечание. Белок p53 — транскрипционный фактор, регулирующий клеточный цикл, является продуктом гена-супрессора опухоли TP53. ARID1a (AT-rich interactive domain-containing protein 1a) — ген-супрессор опухолевого роста, который участвует в ремоделировании хроматина. BAF250a (Brahma-associated factor 250a) — белок, продукт гена ARID1a. CTNNB1 (Cadherin-associated protein beta 1) — ген-регулятор Wnt/β-катенинового внутриклеточного сигнального пути. β-катенин — белок, находящийся в комплексе с кадгеринами — молекулами клеточной адгезии, продукт гена CTNNB1. PTEN (Phosphatase and tensin homolog) — фосфатаза с двойной субстратной специфичностью, продукт гена PTEN, негативного регулятора PI3K/AKT/mTOR-сигнального пути. MSH6 (MutS homolog 6), PMS2 (Postmeiotic segregation increased 2) — белки, продукты соответствующих генов репарации неспаренных нуклеотидов (Mismatch repair)
Заключительный диагноз: Наружный генитальный эндометриоз IV степени. Атипический ЭМП. Стриктура юкставезикального отдела правого мочеточника. Уретерогидронефроз справа IV стадии. Эндометриоидная киста правого яичника. Интрамуральносубсерозная лейомиома матки.
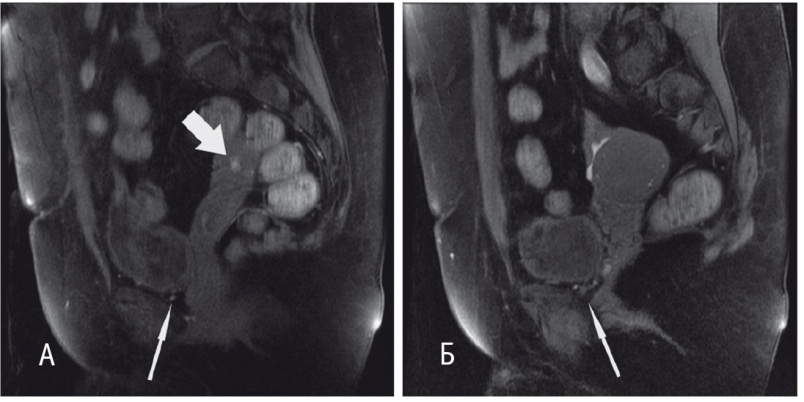
В качестве средства адъювантной терапии назначен диеногест в дозе 2 мг/сут. При контрольной МРТ органов малого таза через 6 месяцев отмечена положительная динамика в виде уменьшения размеров эндометриоидных изменений в стенке мочевого пузыря и в перивезикальной клетчатке, кистозного образования правого яичника с 25 мм до 8 мм (рис. 4, 5). В настоящее время на фоне применения диеногеста в течение 12 месяцев у пациентки отсутствуют жалобы и признаки рецидива заболевания.
Рис. 4. Магнитно-резонансная томограмма малого таза с контрастированием пациентки Ш. от 03.06.2017 г. (после хирургического лечения, до начала гормональной терапии). А — Т2-взвешенное изображение (ВИ) с жироподавлением в аксиальной проекции. Состояние после хирургического лечения: резекции стенки мочевого пузыря, резекции правого мочеточника, илеоуретеропластики. В области правой боковой стенки — участок деформации постоперационного характера (толстая стрелка). Б, В — Т1-ВИ с жироподавлением в сагиттальной проекции на разных уровнях. В проекции правого яичника — кистозное образование (толстая стрелка), содержимое которого гиперинтенсивно на Т1-ВИ за счет геморрагического содержимого, характерного для эндометридной кисты. Схожие по сигнальным характеристикам мелкие (до 4 мм) структуры, типичные для эндометриодных гетеротопий, определяются в области нижней стенки мочевого пузыря и в паравезикальной клетчатке (тонкая стрелка)
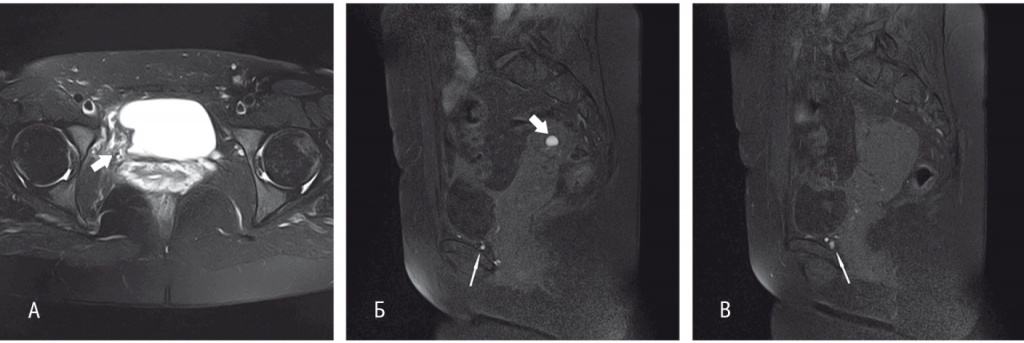
Рис. 5. Магнитно-резонансная томограмма малого таза с контрастированием пациентки Ш. от 22.11.2017 г. (после хирургического вмешательства и 6 месяцев приема диеногеста). А, Б — Т1-взвешенное изображение с жироподавлением в сагиттальной проекции на разных уровнях (на тех же уровнях, что и на рис. 4Б, В). Толстая стрелка — кистозное образование правого яичника; тонкие стрелки — эндометриоидные включения нижней стенки мочевого пузыря и перивезикальной клетчатки
ОБСУЖДЕНИЕ
ЭМП представляет собой гетеротопическое разрастание в пузырной стенке ткани, по морфологическим и функциональным свойствам подобной эндометрию. Изза топографоанатомических особенностей мочевой пузырь наиболее подвержен эндометриоидному поражению. Примерно у 85% больных ЭМП сочетается с другими проявлениями распространенного эндометриоза.
В настоящее время обсуждаются три патогенетических механизма эндометриоза, в частности ЭМП. Согласно имплантационной теории, причиной эндометриоза является диссеминация клеток эндометрия на брюшину и органы малого таза при ретроградной менструации или ятрогенное распространение имплантов во время хирургических вмешательств с повреждением эндометрия (абортов, диагностических выскабливаний, ручного обследования полости матки, кесарева сечения, гистерэктомии) [3].
Сторонники эмбриональной и метапластических теорий утверждают, что эндометриоидное поражение мочевого пузыря возникает при метаплазии Мюллеровых протоков и/или инвазии аденомиозных узлов в заднюю стенку мочевого пузыря, поскольку морфологическая структура этих очагов, представленных плотной соединительной тканью, состоящих из фиброзных и гладкомышечных клеток с участками эндометриальных желез и стромы, имеет большее сходство с аденомиозом, чем с эндометриозом брюшины. Однако существуют данные, противоречащие этим гипотезам: 1) гистологические материалы, подтверждающие наличие эмбриональных зачатков в области маточнопузырного пространства, никогда не были предоставлены; 2) доказано, что гладкомышечные клетки присутствуют во всех типах эндометриоидных гетеротопий [4]; 3) в большинстве опубликованных исследований не обнаружено сочетание узлового аденомиоза с ЭМП [5].
Клиническая картина ЭМП в значительной мере зависит от локализации, длительности течения и распространенности патологического процесса. Патогномичным симптомом ЭМП является циклическая дизурия. Поскольку случаи поражения эндометриоидными имплантами слизистой мочевого пузыря редки, гематурия при ЭМП нехарактерна [2].
Дифференциальную диагностику ЭМП необходимо проводить с доброкачественными новообразованиями мочевого пузыря, карциномой, интерстициальным циститом (синдромом болезненного мочевого пузыря) и хроническим уретральным синдромом [2].
Правильно выбранная методика УЗИ (комбинация трансвагинального и трансабдоминального исследований) имеет основополагающее значение для диагностики ЭМП, позволяя оценить локализацию и размер очага, расстояние между границами поражения и устьями мочеточника. При УЗИ мочевого пузыря на фоне анэхогенной мочи ЭМП визуализируется как выступающий в полость изо или гипоэхогенный дефект задней стенки с округлыми аваскулярными структурами и четкими контурами. Гетеротопии обычно имеют небольшой гиперэхогенный ободок из подслизистой и серозной оболочки мочевого пузыря [6].
МРТ — информативный метод диагностики ЭМП с чувствительностью до 77% и специфичностью до 98%. МРТвизуализация ЭМП обычно имеет гипоинтенсивный сигнал на Т2взвешенных изображениях, изоинтенсивный сигнал на Т1взвешенных изображениях и участки гиперинтенсивного сигнала на Т1 и Т2взвешенных изображениях [7].
Цистоскопия в клинической практике при ЭМП не является рутинным и информативным методом, поскольку эндометриодные импланты редко достигают слизистой оболочки мочевого пузыря. При поражении внутреннего слоя пузыря цистоскопию рекомендуется выполнять непосредственно перед или во время менструации, когда эндометриоидные гетеротопии несколько увеличены в размерах. Цистоскопия позволяет оценить расстояние между устьями мочеточников и границами эндометриоидных очагов для планирования объема хирургического вмешательства [8].
Прогестагены следует рассматривать как средства первой линии для терапии различных форм глубокого инфильтративного эндометриоза в связи с их эффективностью, безопасностью и хорошей переносимостью [9]. Диеногест относится к прогестагенам четвертого поколения, сочетая в себе свойства производных 19нортестостерона и прогестерона. Как производное 19нортестостерона он характеризуется высокой селективностью к прогестероновым рецепторам и, в отличие от других гестагенов, обладает специфическим антипролиферативным, антиангиогенным, проапоптическим и противовоспалительным эффектами, воздействуя на все звенья патогенеза эндометриоза. В литературе описано успешное лечение ЭМП диеногестом (2 мг/сут) до 16 месяцев. Отмечены быстрое купирование основного симптома — циклической дизурии, значительное уменьшение размеров очагов эндометриоза, нормализация уродинамических показателей, отсутствие рецидива в течение 1 года после прекращения приема диеногеста [10].
Учитывая хроническое течение эндометриоза, высокий риск рецидива после хирургического вмешательства, следует назначать адъювантное лечение на длительный срок, на фоне которого необходимо проводить мониторирование [11]. Ряд авторов также предполагают, что долговременная терапия диеногестом в дозе 2 мг может способствовать снижению риска малигнизации [12].
Хирургическое лечение ЭМП должно всегда выполняться после полного обследования, определения локализации очагов и их связи с мочеточниками. В настоящее время в литературе описаны несколько видов операций: открытая/лапароскопическая/роботассистированная резекция мочевого пузыря или ее комбинация с трансуретральной резекцией (ТУР). Поскольку при ТУР невозможны оценка глубины поражения стенки мочевого пузыря и тотальное иссечение узлов, отдельно данный метод не рекомендуется [13, 14].
Несмотря на более чем столетнюю историю изучения эндометриоза, многие аспекты, особенно касающиеся его малигнизации, остаются предметом исследований и дискуссий. Хотя эндометриоз считается доброкачественным заболеванием, по некоторым характеристикам он имеет такие черты злокачественности, как потеря контроля клеточной пролиферации, инфильтративный рост, локальное и отдаленное расположение очагов, характерное для процесса метастазирования [15].
Современные данные многочисленных морфологических и молекулярногенетических исследований формируют новое представление о злокачественной трансформации эндометриоза. В настоящее время наиболее изучена группа эндометриозассоциированных опухолей яичника. Выявленные мутации ARID1A, PIK3CA, PTEN, CTNNB1 как в эндометриомах, так и в эндометриоидных и светлоклеточных карциномах позволяют утверждать, что эндометриоз может быть предшественником этих форм злокачественных новообразований яичника.
На сегодняшний день в доступной литературе сообщалось только о 8 наблюдениях злокачественной трансформации ЭМП, возраст больных варьировал от 35 до 62 лет. По данным патоморфологического исследования, три опухоли были представлены эндометриоидными, четыре — светлоклеточными карциномами и одна — эндометриоидной стромальной саркомой [5].
С точки зрения онкогенеза только АЭ, выявляемый примерно у 8% больных эндометриозом, рассматривается как морфологическая форма предрака. АЭ не имеет специфических клинических проявлений и четких гистологических критериев, в связи с чем морфологическая верификация диагноза затруднительна. АЭ может характеризоваться клетками с крупным гиперхромным ядром или бледным ядром с выраженным плеоморфизмом, снижением соотношения цитоплазма/ядро и клеточной стратификацией [15].
Для дифференциации типичного эндометриоза и АЭ и определения потенциала его злокачественности нами предлагается оценка экспрессии иммуногистохимических маркеров BAF250a (ARID1a), βкатенина, PTEN, индекса Ki67, p53 в ткани опухоли, которые коррелируют с риском злокачественного перерождения эндометриоза.
ЗАКЛЮЧЕНИЕ
Представленный в статье клинический случай атипического эндометриоза мочевого пузыря (ЭМП), сложность его дифференциальной диагностики и гистологической верификации диктуют необходимость проведения иммуногистохимического исследования с оценкой экспрессии панели маркеров BAF250a (ARID1a), βкатенина, PTEN, индекса Ki67, p53, это позволит улучшить диагностический поиск. Важно правильно диагностировать атипический ЭМП, который рассматривается как морфологическая форма предрака, с целью определения оптимальной тактики лечения. Радикальное удаление эндометриоидных очагов в комбинации с длительной адъювантной терапией диеногестом является наиболее эффективным методом лечения.
Учитывая хроническое течение эндометриоза, высокий риск возникновения рецидива после хирургического вмешательства или отмены медикаментозной терапии, следует планировать лечение прогестагенами на продолжительный срок, поскольку данная группа препаратов отвечает критериям эффективности, долговременной безопасности и переносимости.







