Узловой зоб — распространенная эндокринная патология, включающая различные морфологические варианты узловых образований щитовидной железы (ЩЖ), определяемые пальпаторно и по данным ультразвуковой диагностики (УЗИ) ЩЖ на этапе первичной диагностики[1]. Возможности диагностического подхода узлового зоба весьма обширны.
Огромное значение на диагностическом этапе имеет физикальный осмотр пациента с пальпаторным исследованием ЩЖ, сбор анамнеза, а также оценка факторов риска развития злокачественного узлообразования. Наличие узловых образований фиксируется по результатам пальпации ЩЖ в 4–8% случаев в популяции[2, 3]. При этом пальпаторно узлы ЩЖ более 2 см выявляются в 77% случаев. Несмотря на относительно низкую чувствительность данного метода, пальпация является обязательным скрининговым методом диагностики узловых образований ЩЖ[1].
Повышенный интерес современного общества к заболеваниям ЩЖ, доступность диагностических методов и возможность проведения скринингов в области тиреоидологии привели к тому, что на сегодняшний день отмечается прирост заболеваемости раком ЩЖ (РЩЖ) более чем на 5% по данным Американского общества борьбы с раковыми заболеваниями1[4].
Среди всех установленных случаев узлового зоба примерно 5–10% приходится на долю злокачественных новообразований ЩЖ[3, 5, 6]. Большинство случаев злокачественных образований ЩЖ составляет высокодифференцированный РЩЖ. В структуре онкологической патологии РЩЖ имеет низкий уровень смертности, особенно при обнаружении на начальных стадиях. При этом смертность от РЩЖ в России по данным на 2017 г. составляет 0,38 случая на 100 тыс. человек[7]. При этом в ряде исследований отмечается увеличение частоты выявления опухолей ЩЖ крупных размеров, а также наличие регионарных и отдаленных метастазов на момент установления диагноза[8].
Цель статьи — оценка роли комплексного подхода в диагностике узловой патологии ЩЖ.
В качестве первоначального метода дообследования при наличии узлового образования ЩЖ по результатам скринингового пальпаторного исследования выступает УЗИ ЩЖ[1]. Данный метод является основным визуализирующим инструментально-диагностическим исследованием, который имеет ряд глобальных положительных преимуществ: доступность, бюджетность, высокая информативность, неивазивность, безопасность. УЗИ позволяет с высокой точностью определить локализацию, количество и размер узлов ЩЖ, а также составить характеристику узлов. Характерные ультразвуковые признаки, соответствующие злокачественности узла (гипоэхогенная солидная структура; неровный, нечеткий или полициклический контур; наличие микрокальцинатов; преобладание вертикального размера узла над горизонтальным («выше, чем шире»); отсутствие гипоэхогенного ободка по периферии (Halo); центральная гиперваскуляризация узла; увеличение и изменение эхоструктуры регионарных лимфатических узлов), позволили стратифицировать вероятность злокачественного потенциала узлов. С целью усовершенствования оказания медицинской помощи используется классификация TIRADS (Thyroid Image Reporting and Data System), отражающая долю злокачественности в процентах[3, 9].
Для дифференциальной диагностики доброкачественности и злокачественности узловых образований ЩЖ проводят соноэластографию сдвиговой волны. Данный метод ультразвуковой диагностики основан на оценке жесткости тканей: образования злокачественного потенциала визуализируются как ткани с более значимыми показателями упругости ткани, чем доброкачественные ткани. Эти возможности соноэластографии представляют собой большой диагностический интерес, однако точность данного метода остается дискутабельной[10–12].
Для оценки функциональной активности узловых образований используют метод радионуклидной диагностики (сцинтиграфию). В качестве радиофармпрепарата (РФП) принято использовать технеций-99m-пертехнетат (99mTc-пертехнетат), а также радиоактивные изотопы йода (123I, 131I). Радиоизотопы йода считаются «идеальным» РФП при проведении сцинтиграфии ЩЖ. Однако ввиду высокой стоимости и логистической сложности его использование в рутинной практике весьма ограничено[13].
При сцинтиграфическом исследовании с целью оценки функциональной активности узлов их подразделяют по степени накопления РФП на «холодные» и «горячие». Существует ряд исследований о том, что гиперфункционирующие «горячие» узлы на сцинтиграмме могут быть представлены злокачественными образованиями. По данным ряда метаанализов, частота встречаемости злокачественности в «горячих» узлах колеблется от 5 до 100% [14]. В качестве РФП в оценке злокачественности могут использоваться и другие вещества: 75Se-селенометионин, цитрат галлия-67, цезий-131, таллий-201, 99mTc-метоксиизобутил-изонитрилом[13]. Однако большинство из них показали низкую специфичность при радионуклидной дифференциальной диагностике узлов ЩЖ.
Кроме того, с целью дифференциальной диагностики образований паращитовидных желез (ПЩЖ) возможно проведение их сцинтиграфии[9].
Тонкоигольная аспирационная биопсия (ТАБ) признана «золотым стандартом» в дифференциальной диагностике узлов ЩЖ. Для интерпретации цитологического материала узлов ЩЖ используется классификация Bethesda Thyroid Classification (2009), с помощью которой можно оценить риск злокачественности образования. Данный метод позволяет с высокой точностью установить цитологическую принадлежность опухоли, однако некоторые вопросы в диагностике узлов при помощи ТАБ остаются открытыми[9].
По данным различных авторов, точность интерпретации результатов ТАБ колеблется в диапазоне 65–98%[3, 15]. Данные показатели связаны с возникновением ложноотрицательных и ложноположительных результатов пункционного исследования. Подобные результаты встречаются примерно в 16% и 12% случаев соответственно[3, 15, 16]. По данным научной зарубежной литературы, неопределенным результат ТАБ узлов ЩЖ получается в 10–30% случаев, что отражает необходимость совершенствования диагностических подходов в диагностике узловых образований ЩЖ.
Кроме того, одной из основных проблем в дооперационной диагностике узлов ЩЖ остаются фолликулярные и гюртклеточные опухоли. С учетом морфологического строения данных образований невозможно точно определить характер опухолей по результатам ТАБ[3]. С учетом ограниченных возможностей ТАБ в цитологической классификации Bethesda фолликулярные опухоли разделены непосредственно на две категории: атипия неопределённого значения (категория III) и фолликулярная неоплазия или подозрение на фолликулярную неоплазию (категория IV)[1].
Значительный прорыв в диагностике различных заболеваний занимает возможность выявления мутаций и генетических предрасположенностей к развитию конкретной патологии. Данный метод получил своё распространение и среди узловой патологии ЩЖ.
Медуллярный РЩЖ входит в структуру наследственного синдрома множественной эндокринной неоплазии IIА и IIБ типов, опосредованных мутацией гена RET на 10 хромосоме. Выделяют также изолированную семейную форму медуллярного РЩЖ[9, 17].
Наличие мутации генов возможно при узловой патологии ЩЖ не только злокачественного, но и доброкачественного потенциала действия. При доброкачественных функционально автономных узлах ЩЖ, характеризующихся их гиперфункцией, характерно наличие мутации онкогена GSP, кодирующего альфа-субъединицу G-белка или гена, кодирующего рецепторы тиреотропного гормона[17].
Молекулярно-генетический анализ позволяет решить вопрос дифференциальной диагностики фолликулярных опухолей. Так, при доброкачественных фолликулярных аденомах часто выявляют активирующие мутации онкогена RAS или потерю функции PTEN. По данным ряда исследований, наличие маркеров — галектина-3, НВМЕ-1 и цитокератина-19 — при изучении их иммуноэкспрессии соответствовало злокачественному фолликулярному образованию ЩЖ[18, 19].
Наличие мутации V600E гена BRAF является диагностическим критерием РЩЖ. По данным Д.Ю. Семенова и соавт., данная мутация устанавливалась в 79% случаев в группе пациентов с подтвержденным цитологическим диагнозом папиллярного рака, при этом у пациентов с дооперационным цитологическим диагнозом коллоидного зоба данной мутации не было выявлено[20]. В группе пациентов с окончательным диагнозом фолликулярной аденомы (n = 16) мутантный тип гена не обнаружен, однако из 2 пациентов с диагнозом фолликулярного рака мутация обнаружена у 1 пациента.
Наличие мРНК гена убиквитина в пункционном материале, выявленное методом полимеразной цепной реакции (ПЦР) в режиме реального времени, в ряде случаев может быть маркером высокодифференцированного РЩЖ со специфичностью и чувствительностью 68,6 и 68,4% соответственно[21].
Безусловно, молекулярно-генетические методы исследования представляют огромные перспективы в диагностике узловых образований ЩЖ. Однако до сих пор сохраняются сложности для внедрения данных методов в рутинную практику ввиду их высокой стоимости и сложности проведения.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка С., 51 год. Из анамнеза известно, что в 1995 г. впервые было выявлено узловое образование ЩЖ загрудинной локализации. 18.10.1996 г. в Тюменской областной больнице выполнена гемитиреоидэктомия справа. По результатам гистологического исследования: микрофолликулярный коллоидный зоб (Bethesda II). В послеоперационном периоде заместительную гормональную терапию препаратами левотироксина натрия не получала. До 2019 г. у эндокринолога пациентка регулярно не наблюдалась. В 2019 г. обратилась за медицинской помощью в связи с появлением ощущения дискомфорта в области передней поверхности шеи. Учитывая анамнез и вышеуказанные жалобы, пациентке в частной клинике г. Новый Уренгой было проведено УЗИ ЩЖ, по результатам которого отмечалось увеличение размеров узловых образований обеих долей в сравнении с данными в динамике. По результатам данных УЗИ была проведена ТАБ наибольших узлов, цитологическое описание соответствовало картине коллоидного зоба (Bethesda II). Пациентка продолжила динамическое плановое наблюдение.
В 2021 г. при плановом дообследовании по данным УЗИ ЩЖ отмечалось: положение железы частично загрудинное, что затрудняет визуализацию заднего контура. Форма ее асимметричная, контуры неровные, по боковому и задненижнему контуру нечеткие. Капсула не прерывается, не утолщена, дифференцируется четко по переднему контуру. Эхогенность ткани железы не изменена, структура диффузно неоднородная за счет гипоэхогенных мелкоочаговых изменений. Размеры ЩЖ увеличены. Общий объем ЩЖ составил 90,0 см3. Правая доля: размер 99 × 30 × 37 мм; объем доли 52 см3. Левая доля: размер 80 × 29 × 34 мм; объем доли 38 см3. Перешеек: длина 10 мм. Отмечалось наличие объемных образований обеих долей щитовидной железы. В правой доле в верхнем полюсе овальное однородное изоэхогенное узловое образование размером 13 × 11 × 11 мм с четкими ровными контурами, тонким гипоэхогенным ободком, по переднему краю дугообразный кальцинат, васкуляризация не прослеживается. Рядом изоэхогенное, несколько неоднородное за счет гипоэхогенных участков узловое образование размером 25 × 20 × 22 мм с ровными четкими контурами, скудной перинодулярной васкуляризацией. В левой доле на границе с перешейком в нижней трети изоэхогенное неоднородное образование размером 28 × 34 × 20 мм с четкими ровными контурами, некрупными очагами кистозной дегенерации и скудным смешанным кровотоком. Чуть выше — изоэхогенный однородный узел размером 26 × 26 × 16 мм с подобными характеристиками. Узловые образования в перешейке не определяются. При цветовом доплеровском картировании васкуляризация не изменена. Регионарные единичные шейные лимфоузлы справа размерами до 16 × 5 мм, слева до 21 × 7 мм с сохранной структурой. Визуализация ПЩЖ затруднена.
Заключение: диффузный узловой зоб. EU-TIRARDS 3. Невыраженные реактивные изменения единичных шейных лимфатических узлов.
Пациентке была проведена ТАБ наибольших узлов обеих долей: справа — неинформативно, слева — коллоидный узел (Bethesda II). В последующем пациентка была консультирована врачом-эндокринологом в г. Тюмень, рекомендовано оперативное лечение.
В апреле 2022 г. пациентка обратилась в Клинику имени профессора Ю.Н. Касаткина ФГБОУ ДПО РМАНПО для дообследования и определения дальнейшей тактики лечения.
При осмотре ЩЖ: на передней поверхности шеи отмечается послеоперационный атрофический рубец. При пальпации ЩЖ расположена типично, увеличена за счет возрастания размеров обеих долей, безболезненна, плотной консистенции, подвижна при глотании, не спаяна с окружающими тканями, пальпируются множественные узлы обеих долей. Регионарные лимфатические узлы при пальпации не увеличены.
Сопутствующие заболевания: гипертоническая болезнь I стадии, артериальная гипертензия 1 степени, риск сердечно-сосудистых осложнений 3, постоянно принимает гипотензивную терапию. Дислипидемия. Ожирение 1 степени (ИМТ 32 кг/м2). Рефлюкс-эзофагит. Хронический гастрит, вне стадии обострения.
Аллергологический анамнез: отрицает.
Наследственность: саркома лимфатических узлов у отца.
УЗИ ЩЖ: положение железы типичное, форма ее относительно симметрична, размеры увеличены: правая доля размером 25 × 33 × 64 мм, объем 28 см3; левая доля размером 32 × 27 × 62 мм, объем 29 см3, перешеек 14 мм. Контуры ЩЖ ровные, нижние полюсы долей прослеживаются, капсула не изменена. Эхогенность железы снижена. Эхоструктура долей и перешейка неоднородная. В левой части перешейка овальной формы — изоэхогенное образование размером 26 × 22 мм с четкими ровными контурами, периферическим гипоэхогенным ободком, диффузно-неоднородной внутренней эхоструктурой. В правой доле — гипоэхогенный узел округлой формы диаметром 14 мм, кальцинат в капсуле, дающий четкую акустическую тень, изоэхогенный узел диаметром 25 мм, мелкие анэхогенные внутренние включения, гипоэхогенный ободок. В левой доле аналогичной эхоструктуры образования размерами 25 и 20 мм, гипоэхогенное образование с кальцинатом по капсуле размером 16 мм. Без регистрации пери- и интранодулярных сосудистых эхосигналов. Региональные лимфатические узлы не визуализируются.
Заключение: УЗ-признаки диффузно-узловых изменений ЩЖ. EU-TIRARDS 3.
Компьютерная томография органов мягких тканей шеи: мягкие ткани шеи не деформированы, шейные позвонки не изменены. Мышцы дна полости рта симметричны, нормально развиты. Подчелюстная железа и видимые отделы околоушных слюнных желез не изменены. Стенки глотки и гортани не утолщены, полость не деформирована. Мышечные структуры шеи нормально развиты. Визуализируются увеличенные лимфатические узлы: средней яремной группы справа — до 10 × 12 мм, слева — до 6 × 9 мм, нижние яремные справа — до 8 × 12 мм, слева — до 10 × 15 мм. Отмечается увеличение правой доли, перешейка ЩЖ с распространением в верхнее средостение общим размером до 54 × 48 × 64 мм с включением образований с кольцевидным обызвествлением размерами до 11 × 13 мм. Отмечается неоднородное склеротическое уплотнение правых отделов тел C7, Th1 позвонков до 6 × 11 мм.
Заключение: КТ-картина образований правой доли, перешейка ЩЖ. Шейная лимфаденопатия. Изменения тел позвонков, вероятно, дегенеративного характера.
Пациентке был проведен полный комплекс предоперационного дообследования, в том числе лабораторного. В ходе дообследования по данным показателей лабораторной диагностики обращало на себя внимание повышение уровня паратиреоидного гормона, а также показателей общего и ионизированного кальция (табл. 1).
Таблица 1. Показатели лабораторного дообследования фосфорно-кальциевого обмена на дооперационном этапе
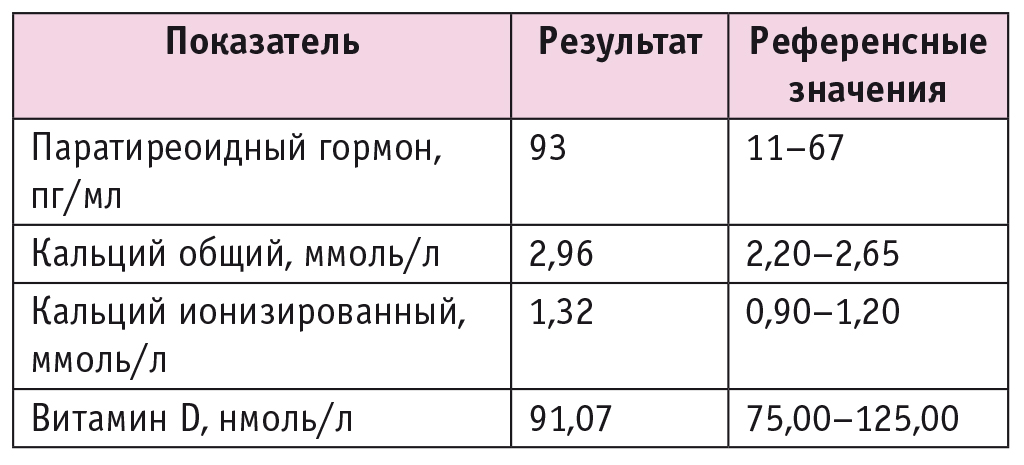
В связи с полученными лабораторными результатами фосфорно-кальциевого обмена, которые соответствовали показателям первичного гиперпаратиреоза, было проведено дообследование с целью топической диагностики первичного очага.
Сцинтиграфическое одноизотопное двуфазное исследование ЩЖ, ПЩЖ + однофотонная эмиссионная компьютерная томография (ОФЭКТ) проведены с использованием РФП 99mТс-технетрила. Введенная активность составила 550 МБк, лучевая нагрузка — 4,9 мЗв. Аллергических реакций не отмечено.
Через 20 и 120 мин после внутривенного введения РФП проведено статическое исследование ПЩЖ, а также ОФЭКТ области шеи и органов грудной клетки после второй фазы исследования.
На сцинтиграммах определяются очаги физиологической фиксации РФП (подчелюстные, околоушные слюнные железы, сердце) обычной интенсивности. Получено изображение ЩЖ: положение типичное, форма долей асимметрична, размеры увеличены, контуры неровные, интенсивность накопления РФП достаточная, визуализируется участок накопления радиотехнеция округлой формы, достаточной интенсивности в проекции верхнего средостения справа от срединной линии, без четкой сцинтиграфической границы с контуром нижнего полюса правой доли ЩЖ и перешейка, сцинтиграфические размеры до 56 мм, распределение РФП диффузно-неравномерное (рис. 1).
Рис. 1. Сцинтиграфическое исследование ЩЖ, ПЩЖ + ОФЭКТ пациентки С. Иллюстрации авторов.
Примечание: A — сцинтиграмма ранней фазы (через 20 мин после введения РФП); B — сцинтиграмма отсроченной фазы (через 120 мин после введения РФП); C — ОФЭКТ-изображение, аксиальный срез; D — ОФЭКТ-изображение, фронтальный срез; E — ОФЭКТ-изображение, сагиттальный срез (красными стрелками указана загрудинная локализация ткани ЩЖ)
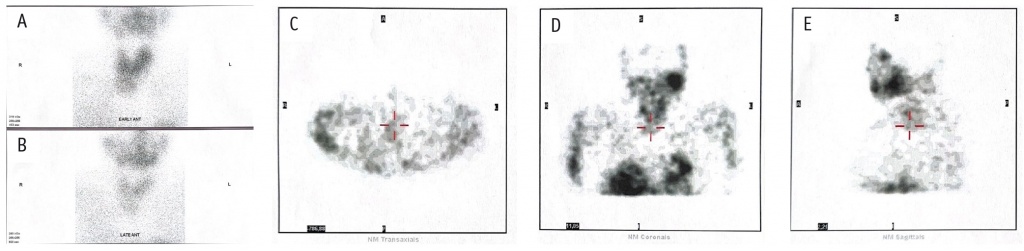
Во второй фазе исследования, а также при проведении ОФЭКТ с последующей 3D-реконструкцией накопления РФП в проекции типичного и атипичного расположения ПЩЖ не выявлено.
Заключение: сцинтиграфических признаков аденомы ПЩЖ не выявлено. Сцинтиграфические признаки гиперплазии ЩЖ, загрудинный рост.
С учетом жалоб пациентки, данных анамнеза и результатов дообследования пациентке было проведено оперативное вмешательство в объеме тиреоидэктомии. Интраоперационно слева у нижнего полюса левой доли определялось объемное образование ПЩЖ диаметром около 0,8 см, произведено его удаление.
Плановое гистологическое исследование: в обеих долях и перешейке — морфологическая картина многоузлового макро- и микрофолликулярного коллоидного зоба с фиброзированием, крупными кальцинатами, кистозными изменениями, также на всем протяжении ЩЖ определяются признаки хронического лимфоматозного тиреоидита с формированием лимфоидных фолликулов и гюртклеточной реакцией. В прилежащей к ткани ЩЖ клетчатке — 3 лимфатических узла с реактивными изменениями. В левой доле также определяется мелкое инкапсулированное образование трабекулярного вида, представленное фолликулярными клетками полигональной формы, с ядрами папиллярного типа, отмечается выраженный фиброз стромы и признаки интра- и межтрабекулярно расположенного гиалинового материала. Достоверных признаков капсулярной и сосудистой инвазии не обнаружено. Морфологическая картина крайне подозрительна по наличию гиалинизирующей трабекулярной опухоли, в ПЩЖ — аденома. Для достоверного определения характера данного образования препараты направлены в ФГБУ «НМИЦ эндокринологии» Минздрава России.
Произведен пересмотр готовых блоков и стекол. Результаты соответствовали папиллярной микрокарциноме ЩЖ на фоне многоузлового макро- и микрофолликулярного зоба и хронического лимфоцитарного тиреоидита. Образование ПЩЖ соответствовало аденоме.
Дополнительно на послеоперационном этапе проведен генетический анализ онкогенов в тканях с помощью метода ПЦР в реальном времени. Биологическим материалом для экстракции геномной ДНК служило 10 мг нативной ткани из образования ЩЖ. Оценивали носительство мутаций в «горячих точках» экзона 15 гена человека BRAF и экзонов 2, 3, 4 генов человека NRAS и KRAS. Результаты данного исследования не выявили наличия мутаций в вышеуказанных точках.
С учетом наличия высокодифференцированного РЩЖ по данным гистологического заключения послеоперационного материала пациентке была назначена терапия левотироксином натрия в дозе 150 мкг утром натощак и в дальнейшем рекомендовано проведение системной радионуклидной терапии 131I.
Учитывая удаление аденомы ПЩЖ, была произведена контрольная оценка функции ПЩЖ в послеоперационном периоде (табл. 2). Данных за нарушение функциональной активности ПЩЖ не получено.
Таблица 2. Показатели лабораторного дообследования фосфорно-кальциевого обмена в послеоперационном периоде
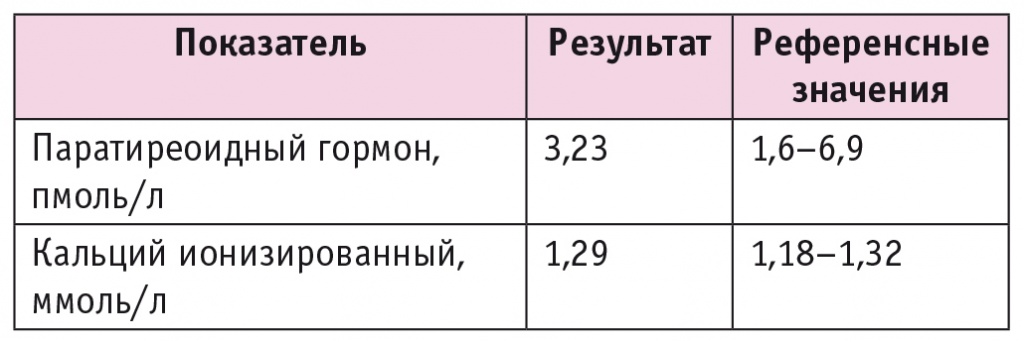
В дальнейшем пациентка продолжила наблюдение у эндокринолога по месту жительства.
ЗАКЛЮЧЕНИЕ
Несмотря на наличие стандартного перечня диагностических исследований, таких как УЗИ ЩЖ, ТАБ, нерешенные вопросы и ошибки в диагностике узловых образований ЩЖ сохраняются.
Основываясь на данном клиническом примере, хотелось бы подчеркнуть, что диагностическая тактика в области узловых образований ЩЖ требует комплексного персонализированного подхода с привлечением мультидисциплинарной команды профессионалов и использование различных методов диагностики в качестве дополнительных методов исследования, в том числе молекулярно-генетических. Только так возможно повысить точность диагностики на дооперационном этапе в сфере узловых образований ЩЖ и избежать ложных диагностических результатов.
Поступила: 31.05.2023
Принята к публикации: 08.08.2023
________
1 SEER Cancer Statistics Review, 1975–2013. URL: https://seer.cancer.gov/csr/1975_2015/







