С целью пренатального выявления ВПР и хромосомных аномалий (ХА) в настоящее время в мире в клиническую практику внедрен скрининг в I триместре беременности по выявлению аномалий кариотипа у плода, основанный на комбинированной оценке возраста матери, ультразвуковых маркеров ХА (например, толщины воротникового пространства), — ЧСС плода и биохимического компонента — концентраций РАРР-А и свободной β-субъединицы ХГЧ в сыворотке крови матери. По данным литературы, эффективность данного скрининга составляет 85–95% при доле ложноположительных результатов 5% [5, 18].
За последние 10 лет возможности ультразвуковой пренатальной диагностики в I триместре значительно расширились за счет использования дополнительных ультразвуковых маркеров ХА, таких как носовая кость, пульсационный индекс в венозном протоке и кровоток через трикуспидальный клапан в правых отделах сердца плода [7]. Включение этих параметров в алгоритм оценки индивидуального риска возникновения ХА позволяет значительно увеличить частоту обнаружения, с которой работает скрининговая программа (до 93–96%), а также снизить долю ложноположительных результатов до 2,5% [18]. Достичь таких показателей можно только при строгом соблюдении методологических подходов, касающихся ультразвукового компонента скрининга, что требует соответствующей квалификации врачей ультразвуковой пренатальной диагностики, а также внедрения программ внешнего аудита качества и результатов работы специалистов. По результатам скрининга оценивают индивидуальный риск, и пациентки, попавшие в группу высокого риска, направляются на медико-генетическое консультирование для решения вопроса о проведении инвазивных диагностических процедур с целью выявления аномалий кариотипа плода [4, 9].
В 2010 г. в трех первых регионах Российской Федерации (Московской, Ростовской и Томской областях) стал возможен запуск национального проекта «Пренатальная (дородовая) диагностика нарушений развития ребенка». На данный момент в большинстве регионов страны уже проведена огромная работа по подготовке штата врачей-экспертов ультразвуковой диагностики, сертифицированных для участия в скрининге в I триместре беременности и ежегодно проходящих независимый внешний контроль профессионализма и качества работы [2, 3].
Диагностика ХА плода проводится при помощи таких инвазивных процедур, как аспирация ворсин хориона, амниоцентез, плацентоцентез и кордоцентез, с последующим использованием молекулярно-генетических и цитогенетических методов исследования полученного биоматериала. Однако применение аспирации ворсин хориона или диагностического амниоцентеза, получивших наибольшее распространение в последнее время, связано с инструментальным внедрением в полость матки, которое сопровождается риском прерывания беременности от 0,5% до 1,0% [21]. Это может стать одной из причин отказа от процедуры и привести к снижению эффективности программы по выявлению ХА. Более того, факторы, которые обуславливают высокий риск развития ХА, например возраст матери, толщина воротникового пространства более 95-го процентиля, снижение концентрации РАРР-А в сыворотке крови, также увеличивают число осложнений беременности, что значительно повышает риски гибели плода и прерывания беременности, неверно ассоциируемые с инвазивным вмешательством [10].
Необходимо также отметить, что оцениваемые биохимические маркеры ХА у плода (PAPP-A и β-ХГЧ) являются косвенными и их концентрации в сыворотке крови беременной женщины зависят от многих факторов. Это приводит к получению достаточно высокого процента ложноположительных результатов в ходе проведения стандартного комбинированного скрининга в I триместре беременности [6].
Ставшее возможным около 20 лет назад определение свободной ДНК плода в плазме крови беременной ознаменовало начало новой эры эффективных методов определения генетических дефектов плода ― эры неинвазивного пренатального теста (НИПТ). Анализ литературы свидетельствует о полной тождественности мнений по вопросу целесообразности внедрения НИПТ в клиническую практику, поскольку данный метод позволяет оптимизировать любые виды скрининга ХА у плода, существующие на сегодняшний день в мире [11, 12, 15, 17, 19]. Применение НИПТ в структуре программ пренатальной диагностики ХА дает возможность повысить частоту обнаружения анеуплоидий (до 99% при трисомии 21), значительно снизить процент ложноположительных результатов (до 0,08% для синдрома Дауна), минимизировать число инвазивных диагностических вмешательств, а следовательно, и количество связанных с ними прерываний беременности. НИПТ в целом увеличивает эффективность проводимого скрининга ХА у плода и в конечном счете повышает долю обследованных женщин и частоту выявления плодов с аномалиями кариотипа [13, 14]. Однако экономическая составляющая использования НИПТ в структуре пренатального выявления аномалий кариотипа у плода на уровне гипотетических моделей альтернативных стратегий скрининга практически не изучена.
Цель настоящего исследования: оценка целесообразности внедрения НИПТ в существующий алгоритм скрининга беременных женщин на наличие ХА у плода на примере Томской области.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на базе Института стволовых клеток человека (г. Москва) при содействии Агентства стратегических инициатив РФ в 2015–2016 гг.
В рамках данного исследования была оценена возможность внедрения НИПТ в алгоритм пренатального скрининга в условиях системы здравоохранения Российской Федерации. Сравниваемыми альтернативами явились существующая модель скрининга, когда при помощи УЗИ и биохимического анализа крови формируется группа высокого риска ХА плода, а затем ХА выявляются путем инвазивной пренатальной диагностики (ИПД), и два гипотетических алгоритма пренатальной диагностики, при которых группы высокого риска ХА также создаются по результатам УЗИ и биохимического анализа крови, но последующее подтверждение ХА осуществляется с помощью НИПТ или комбинации НИПТ и ИПД.
На первом этапе исследования была оценена эффективность выявления ХА у плода методами инвазивной диагностики в структуре существующей модели скрининга с учетом реальной клинической практики на территории Томской области.
На основании представленных данных оценили число женщин группы высокого риска возникновения ХА плода, не прошедших инвазивную диагностику, и число детей с аномалиями кариотипа, родившихся в данной группе пациенток. При этом учитывали, что при направлении врачом-генетиком беременных на диагностическую процедуру доли плодов с ХА у пациенток, согласившихся и не согласившихся на инвазивное вмешательство, были одинаковы.
На основании рекомендаций по проведению пренатального скрининга было разработано «древо решений» при диагностике ХА в I триместре беременности (рис. 1).
Рис. 1. «Древо решений» при диагностике хромосомных аномалий плода.
Примечание. Здесь и на рисунках далее: ИПД ― инвазивная пренатальная диагностика, УЗИ ― ультразвуковое исследование, ХА ― хромосомная аномалия
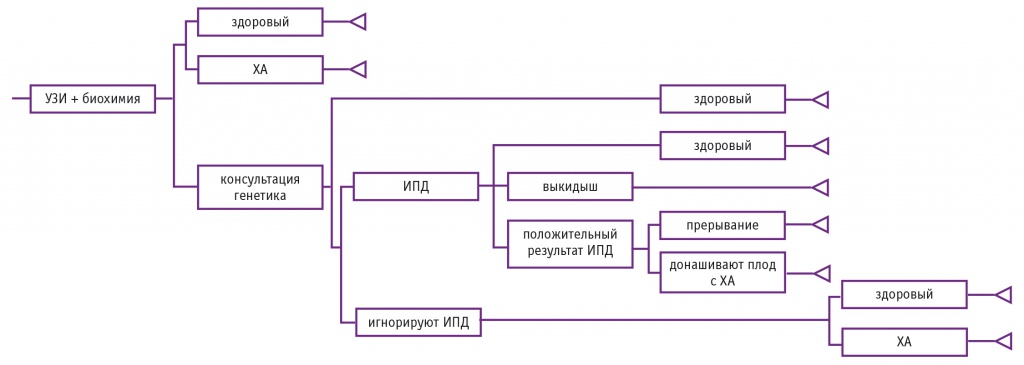
Так, согласно рекомендациям по пренатальной диагностике в I триместре беременности, женщины посещают акушера-гинеколога, который направляет их на скрининг, включающий комбинированную оценку ультразвуковых и биохимических маркеров ХА плода. Далее, после оценки индивидуального риска, выделяют группу беременных высокого риска. Их направляют на консультацию к врачу-генетику для определения оптимальной тактики ведения беременности и, при необходимости, для прохождения повторного УЗИ экспертного уровня, а по его результатам формируется группа пациенток, которым рекомендована инвазивная диагностическая процедура для подтверждения аномалий кариотипа плода. Однако в реальной клинической практике встречаются женщины, которые отказываются от дополнительного обследования либо не имеют доступа к инвазивным диагностическим процедурам (в том числе из-за необходимости обращаться к специалистам в другом регионе Российской Федерации). Данная группа также была учтена при построении «древа решений».
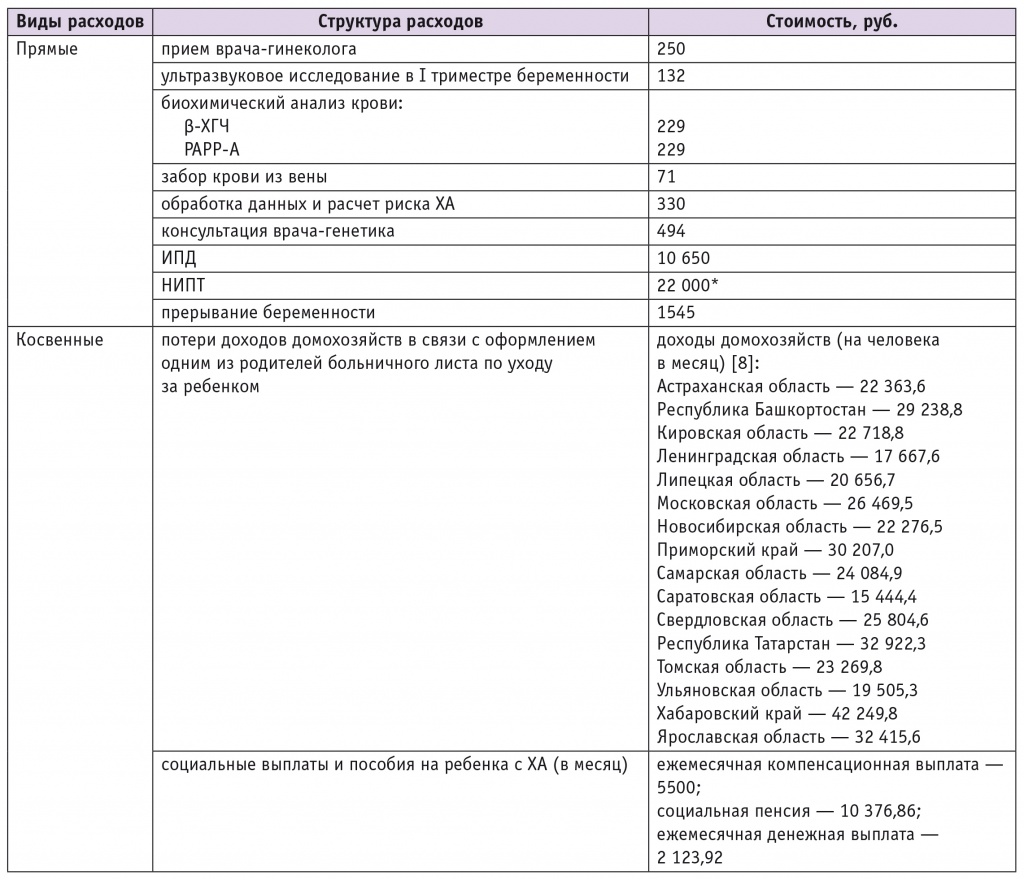
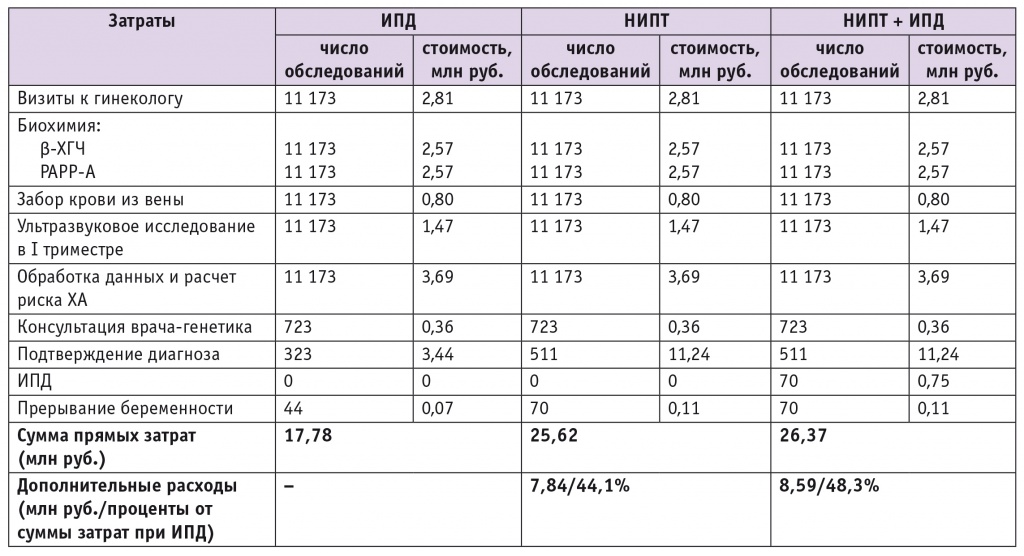
С учетом разработанного «древа» были оценены число женщин, проходящих каждый из этапов пренатального скрининга и диагностики, и суммарные расходы региональных систем здравоохранения на выявление аномалий кариотипа. Стоимость диагностических процедур, консультаций специалистов определяли согласно тарифам системы ОМС на 2014 г., представленным в таблице 1.
Таблица 1
Прямые и косвенные издержки на диагностику хромосомных аномалий плода согласно тарифам системы обязательного медицинского страхования (2014)
Помимо прямых медицинских расходов на диагностику ХА, консультации специалистов и прерывание беременности, оценивали косвенные медицинские расходы, связанные с рождением ребенка с ХА. К ним были отнесены расходы на социальные выплаты (согласно Указу Президента РФ от 26.02.2013 № 175 «О ежемесячных выплатах лицам, осуществляющим уход за детьми-инвалидами и инвалидами с детства I группы», Федеральному закону от 15.12.2001 № 166-ФЗ «О государственном пенсионном обеспечении в Российской Федерации» и Федеральному закону от 24.11.1995 № 181-ФЗ «О социальной защите инвалидов в Российской Федерации»), потери доходов домохозяйств, вызванные тем, что один из родителей вынужден взять больничный лист по уходу за ребенком, а также издержки на консультации специалистов по реабилитации и адаптации детей с синдромом Дауна.
Потеря доходов домохозяйства определялась как разница между средним ежемесячным заработком члена семьи в 4-м квартале 2014 г. и объемом социальных выплат. При анализе потерь доходов семьи учитывали и оплачиваемый отпуск по уходу за ребенком длительностью 1,5 года. Издержки на реабилитацию и адаптацию детей с синдромом Дауна определяли согласно годовому отчету фонда «Даунсайд Ап» (Downside Up), оказывающего консультативную и реабилитационную помощь семьям с такими детьми. Так, в 2014 г. фонд оказал помощь 4409 семьям, при этом суммарные расходы фонда на консультации специалистов, специализированные обучающие программы, обучение и адаптацию детей достигли 43,71 млн руб., или 9914 руб. на одного ребенка. Издержки на лечение возможных ВПР и осложнений, сопутствующих синдрому Дауна, в рамках данного исследования не учитывали.
Результаты исследования представлены в виде суммы прямых и непрямых расходов для каждой из сравниваемых альтернатив скрининга и диагностики для подтверждения диагноза ХА у плода. При этом горизонт исследования составил 10 лет, а коэффициент дисконтирования, согласно рекомендациям ВОЗ для Российской Федерации, — 3,5% в год.
При проведении исследования делали также анализ эффективности затрат, позволяющий определить схему диагностики с минимальными издержками системы здравоохранения на выявление одного случая ХА. При этом рассчитывали коэффициент эффективности затрат, представляющий собой отношение суммарных издержек на постановку диагноза к числу выявленных аномалий кариотипа:
СЕR = (DC + IC)/Ef,
где СЕR — соотношение «затраты/эффективность» (выявляет затраты, необходимые на единицу эффективности — на один выявленный случай ХА);
DC— прямые затраты (прямые медицинские и немедицинские затраты на диагностику ХА);
IC— непрямые затраты;
Ef— эффективность диагностики (число выявленных ХА).
Этот анализ позволяет оценить, насколько затраты на то или иное вмешательство соответствуют его эффективности, а также выбрать наиболее предпочтительную альтернативу, при которой соотношение «затраты/эффективность» (CER) будет минимальным, а значит, потребуется минимум средств для выявления одного случая ХА.
Приращение эффективности затрат представляет собой отношение разницы между издержками двух альтернативных вариантов скрининга к разнице в их эффективности:
ICER = (Costх – Costу)/(Еfх – Еfу),
где ICER — показатель приращения эффективности затрат (инкрементальный, или маржинальный, показатель соотношения затрат и эффективности, который фактически демонстрирует, каких дополнительных вложений требует достижение одной дополнительной единицы эффективности при использовании более действенной технологии);
Costх и Costу — затраты при использовании двух альтернативных методик;
Еfх и Уfу — эффективность диагностики при использовании двух альтернативных методик.
Наилучшей с позиции экономического анализа будет альтернатива, имеющая наименьшие коэффициенты «затраты/эффективность» и «приращение затрат».
РЕЗУЛЬТАТЫ
В рамках представленного анализа алгоритмов пренатальной диагностики ХА на основании данных реальной клинической практики в Томской области была оценена экономическая целесообразность внедрения НИПТ в структуру скрининговой программы по выявлению беременных группы высокого риска возникновения ХА плода. Альтернативной стратегией стала текущая клиническая практика. В первом случае вместо ИПД пациенткам предлагали пройти только НИПТ, во втором — комбинацию ИПД и НИПТ, когда все пациентки группы высокого риска по рекомендации врача-генетика проходят неинвазивный тест и только при его положительном результате направляются на кариотипирование плода.
Результаты оценки эффективности выявления ХА представлены на рисунках 2–4.
Рис. 2. Результаты пренатальной диагностики в Томской области (2014)
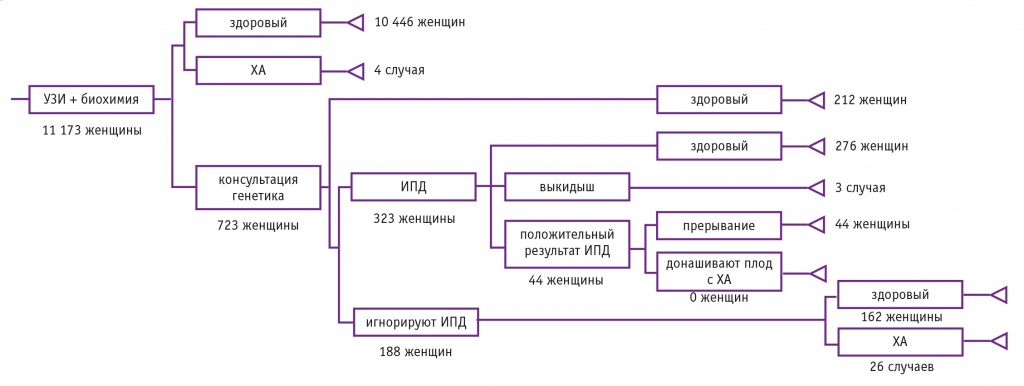
Рис. 3. Результаты пренатальной диагностики в Томской области с использованием неинвазивного пренатального теста.
Примечание. Здесь и на рисунке 4: НИПТ ― неинвазивный пренатальный тест
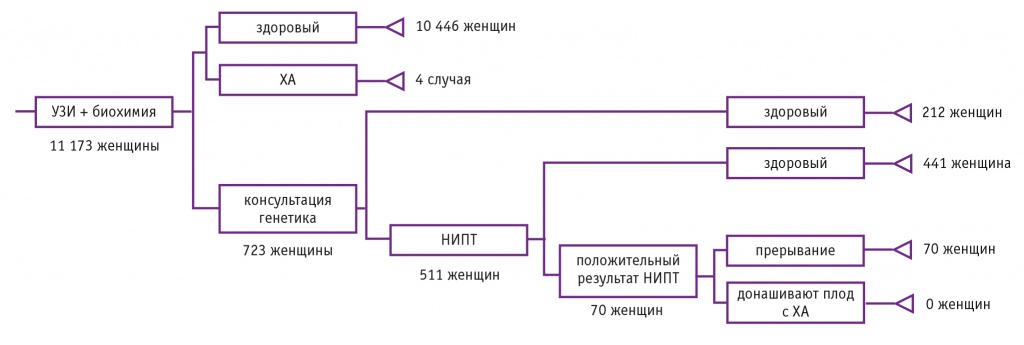
Рис. 4. Результаты пренатальной диагностики в Томской области с использованием комбинации неинвазивного пренатального теста и инвазивной пренатальной диагностики
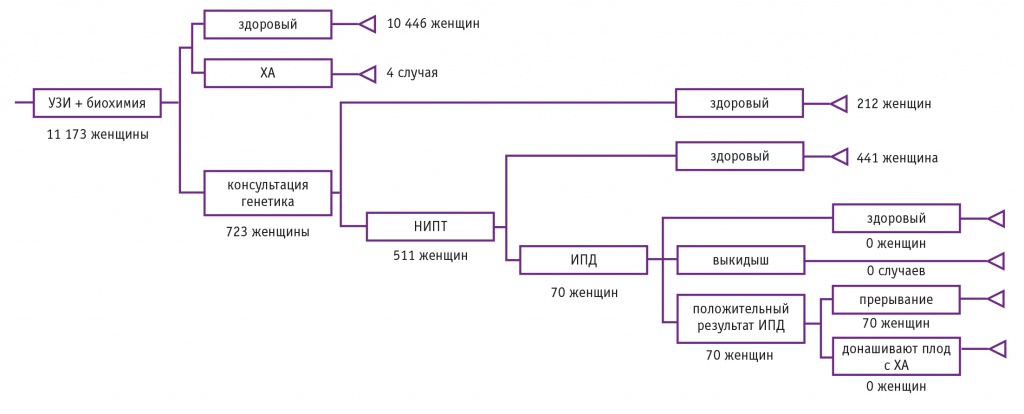
Как видно из рисунка 2, в 2014 г. пренатальный скрининг в I триместре беременности в Томской области прошли 11 173 женщины из 11 226 зарегистрированных, в результате него была сформирована группа высокого риска возникновения ХА из 723 беременных. В ходе консультации врача-генетика 511 женщинам из этой группы рекомендовали пройти инвазивную диагностику с целью верификации анеуплоидий. При обследовании 323 женщин были выявлены 44 ХА (эти беременности были прерваны), а у 188 отказавшихся от процедуры родились 26 детей с аномалиями кариотипа. В то же время у 10 450 беременных, не вошедших в группу высокого риска, также родились 4 ребенка с ХА (в целом в 2014 г. в Томской области появились на свет 30 детей с анеуплоидиями, 26 из них — у пациенток, отказавшихся от ИПД). Таким образом, среди женщин, прошедших комбинированный скрининг в I триместре беременности, были выявлены 44 (59,46%) ХА из 74. Доля ХА у женщин, не вошедших в группу высокого риска, — 5,40%; 35,14% ХА не были обнаружены по причине отказа пациенток от инвазивной диагностики. Общая доля ХА среди беременных женщин в Томской области в 2014 г. — 0,66%.
Необходимо отметить, что 53 беременные, зарегистрированные в 2014 г., не прошли пренатальную диагностику. Поскольку доля ХА в обследуемой популяции женщин составила 0,66%, вероятность рождения ребенка с анеуплоидиями в этой группе была очень низка.
С учетом представленных выше данных об эффективности выявления ХА в Томской области была смоделирована ситуация, когда вместо инвазивной диагностики применяли бы НИПТ. При этом делали предположение, что благодаря отсутствию риска прерывания беременности после выполнения НИПТ все пациентки из группы высокого риска по рекомендации врача-генетика пройдут данную процедуру. Так как чувствительность НИПТ составляет более 99%, то он даст возможность выявить все эпизоды ХА в группе пациенток с высоким индивидуальным риском (см. рис. 3).
Как видно из данных, представленных на рисунке 3, применение НИПТ может позволить выявить 70 (94,59%) эпизодов ХА из 74 в группе пациенток, прошедших пренатальный скрининг. В данном сценарии отсутствует риск прерывания беременности, составляющий при ИПД 0,5–1,0%.
На следующем этапе исследования была смоделирована ситуация, когда применялась комбинация НИПТ и инвазивной пренатальной диагностики ХА плода: все женщины из группы высокого риска возникновения анеуплоидий по рекомендации врача-генетика проходили бы НИПТ, а при его положительном результате — инвазивное вмешательство для определения кариотипа плода (см. рис. 4).
Согласно полученным данным, в случае применения комбинации НИПТ и ИПД также будут выявлены 70 (94,59%) эпизодов ХА из 74 в группе пациенток, прошедших пренатальный скрининг.
Далее были оценены прямые медицинские расходы, связанные с диагностикой ХА плода, консультациями специалистов и прерыванием беременности в случае выявления ХА. Стоимость диагностических процедур, консультаций специалистов и прерывания беременности была оценена согласно тарифам системы ОМС на 2014 г. (см. табл. 1).
Результаты анализа прямых затрат представлены в таблице 2. Текущие расходы на диагностику ХА плода в Томской области составили 17,78 млн руб., при этом 323 пациентки прошли инвазивную диагностику. Смоделированное применение только неинвазивного теста связано с дополнительными расходами системы здравоохранения, достигающими 7,84 млн руб. в год (44,1%). Данный факт объясняется как более высокой стоимостью процедуры НИПТ, так и бóльшим числом обследованных и, следовательно, бóльшим количеством прерванных беременностей при обнаружении ХА. Наиболее дорогостоящей из сравниваемых альтернатив была схема диагностики с применением и НИПТ, и инвазивного вмешательства. Ее реализация потребует дополнительно 8,59 млн руб. в год (48,3%), это связано с тем, что, помимо 511 НИПТ, схемой предусмотрено проведение 70 инвазивных процедур.
Таблица 2
Прямые затраты на диагностику хромосомных аномалий в Томской области
С учетом полученных данных об эффективности и стоимости диагностики ХА в Томской области были рассчитаны коэффициент эффективности затрат (СЕR) и инкрементальный коэффициент эффективности затрат (ICER) (табл. 3).
Таблица 3
Результаты анализа эффективности затрат на выявление хромосомных аномалий в Томской области

Стоимость выявления одного случая ХА в Томской области (CER) при верификации диагноза с применением инвазивной процедуры составила 404 091 руб. На фоне применения НИПТ, а также комбинации последнего с ИПД издержки системы здравоохранения на выявление одной ХА составили 366 000 руб. и 376 714 руб. соответственно. Таким образом, наиболее экономичной из сравниваемых альтернатив стала диагностика с использованием только НИПТ, данная технология позволит в наибольшей степени минимизировать бюджет, необходимый на выявление одного случая анеуплоидии. Стоимость выявления одной дополнительной ХА (CER) при смоделированном применении НИПТ составила 301 538 руб. в случае его изолированного использования и 330 385 руб. при комбинации неинвазивной процедуры и последующей инвазивной верификации.
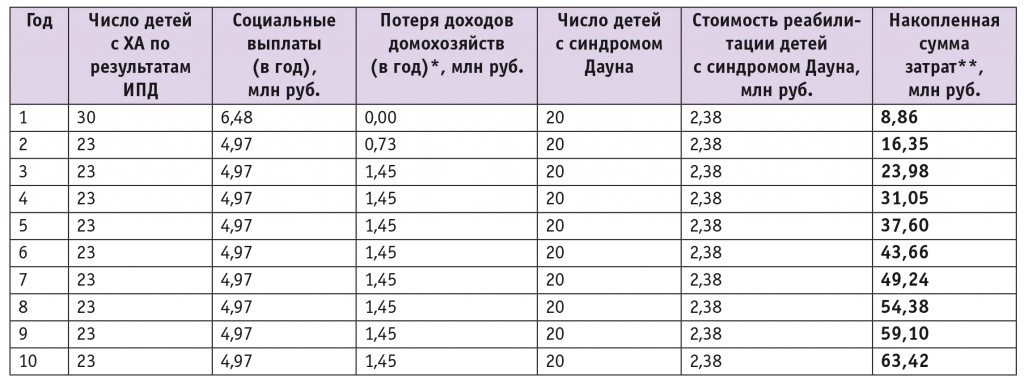
На следующем этапе исследования оценивались косвенные издержки, связанные с рождением детей с аномальным кариотипом. Результаты расчета косвенных затрат представлены в таблице 4.
Таблица 4
Результаты анализа косвенных затрат при применении инвазивной пренатальной диагностики
* С учетом 1,5-летнего декретного отпуска.
** С учетом коэффициента дисконтирования 3,5% в год.
В ходе анализа косвенных затрат учитывали, что в Томской области было 30 невыявленных пренатально новорожденных с ХА: у четверых детей матери не входили в группу высокого риска по результатам комбинированного ультразвукового и биохимического скрининга; 26 случаев ХА не были обнаружены в результате отказа беременных от проведения инвазивной диагностики. Далее определяли выживаемость детей с аномалиями кариотипа в течение 10-летнего горизонта исследования, при этом учитывали, что дети, больные синдромами Эдвардса и Патау, гибнут в первый год жизни. Согласно статистическим данным, в 2014 г. в Томской области родились 20 детей с трисомией 21 (синдром Дауна); 6 ― с трисомией 18 (синдром Эдвардса); 1 ― с трисомией 13 (синдром Патау); 2 ― с синдромом Шерешевского ― Тёрнера; 1 ― с синдромом Клайнфельтера.
При расчете косвенных затрат, связанных с социальными издержками, принимали во внимание, что в соответствии с Указом Президента РФ от 26.02.2013 № 175 с 1 января 2013 г. неработающему трудоспособному лицу, осуществляющему уход за ребенком-инвалидом в возрасте до 18 лет, полагается ежемесячная компенсационная выплата. Размер компенсации для родителя (усыновителя) составляет 5500 руб. В территориальном органе Пенсионного фонда также оформляются социальная пенсия и ежемесячная денежная выплата на ребенка. Их получателем является один из родителей. Так, согласно ст. 11, 18 Федерального закона от 15.12.2001 № 166-ФЗ, социальная пенсия при уходе за ребенком-инвалидом I группы в 2015 г. составила 10 377 руб. в месяц, а размер ежемесячной выплаты в 2015 г., согласно ст. 28.1 Закона от 24.11.1995 № 181-ФЗ, был равен 2123,92 руб. Таким образом, суммарный объем социальных выплат достиг 18 000,92 руб. в месяц, или 216 011,04 руб. в год.
При анализе косвенных затрат на потери доходов домохозяйств, связанные с рождением ребенка с ХА, учитывалось, что один из родителей прекращает трудовую деятельность из-за необходимости ухода за ребенком. Средний доход в Томской области в 4-м квартале составил 23 269,8 руб. в месяц, в пересчете на год — 279 238 руб.; 216 011 руб. из них будут компенсированы за счет социальных выплат. Таким образом, потери доходов домохозяйств в Томской области составят 63 229 руб. на одного ребенка с ХА в год. Учитывали также, что мать в течение 1,5 года находится в оплачиваемом декретном отпуске по уходу за ребенком.
В итоге косвенные издержки в случае применения существующего вида скрининга и рождения 30 детей с ХА в течение 10 лет достигли 63,42 млн руб. с учетом коэффициента дисконтирования 3,5% в год.
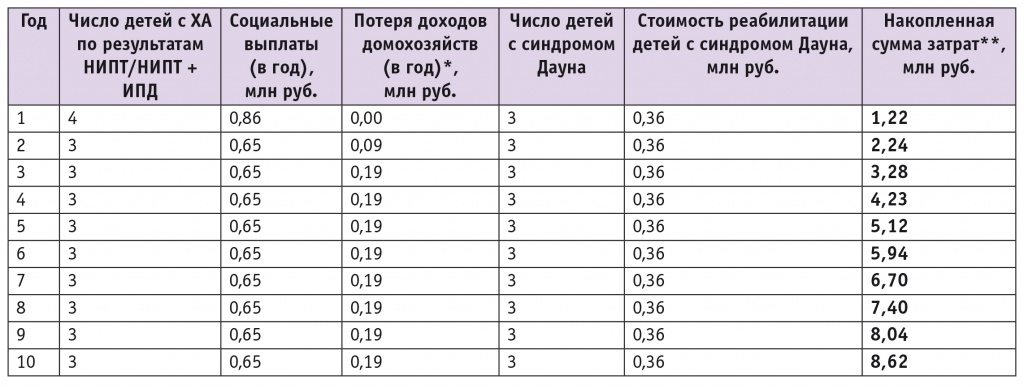
Аналогичным образом были рассчитаны косвенные издержки, связанные с рождением 4 детей с ХА при применении НИПТ и комбинации последнего с инвазивной диагностикой, при этом учитывали, что число детей с синдромом Дауна сократится пропорционально доле дополнительно выявленных ХА. Результаты представлены в таблице 5.
Таблица 5
Результаты анализа косвенных затрат при применении неинвазивного пренатального теста (НИПТ) и комбинации НИПТ с инвазивной пренатальной диагностикой
* С учетом 1,5-летнего декретного отпуска.
** С учетом коэффициента дисконтирования 3,5% в год.
В результате анализа косвенных расходов альтернативных сценариев, включающих диагностику с применением неинвазивной методики, суммарные косвенные издержки составили 8,62 млн руб. в течение 10 лет, что на 54,80 млн руб. меньше, чем в случае применения существующего комбинированного метода скрининга в I триместре беременности с последующим подтверждением результатов инвазивной диагностикой.
На основании полученных данных о прямых и косвенных затратах были рассчитаны суммарные издержки регионального бюджета на диагностику анеуплоидий, прерывание беременности, социальные выплаты и реабилитацию детей с аномалиями кариотипа в течение 10 лет при существующей схеме пренатальной диагностики, а также гипотетических альтернативных сценариях скрининга (табл. 6).
Таблица 6
Результаты анализа прямых и косвенных затрат в Томской области (млн руб.)
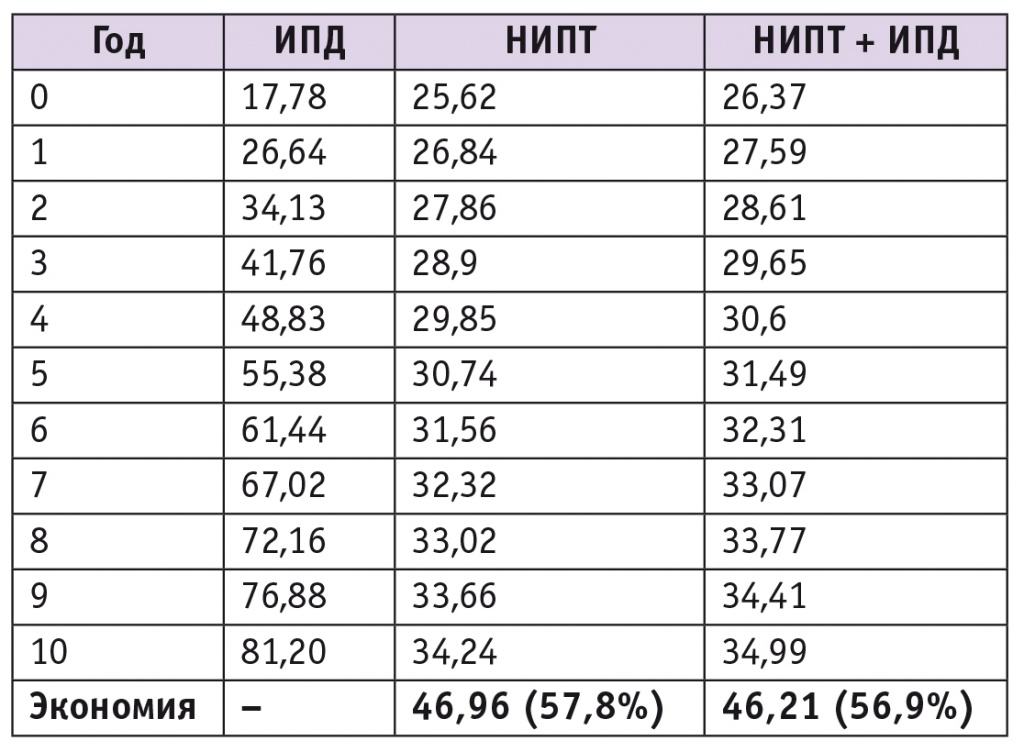
За счет сокращения косвенных расходов при выявлении дополнительных эпизодов ХА анализируемые схемы диагностики, включающие НИПТ, позволяют уменьшить суммарные расходы регионального бюджета Томской области, причем экономия достигает 46,21–46,96 млн руб. в течение 10 лет.
ЗАКЛЮЧЕНИЕ
В результате данного исследования, проведенного на территории Томской области, при смоделированном внедрении неинвазивного пренатального теста (НИПТ) в структуру пренатального скрининга беременных высокого риска возникновения хромосомной аномалии (ХА) у плода в I триместре установлено, что за счет гипотетического значительного числа снижения ложноположительных результатов, минимизации количества инвазивных вмешательств возможно выявить дополнительно до 35% аномалий кариотипа плода. В то же время увеличение и расширение объема и числа обследований за счет НИПТ может привести к росту прямых расходов системы здравоохранения (до 48,3% от таковых, необходимых при традиционном алгоритме пренатального скрининга).
В результате проведенного анализа эффективности затрат для каждого из трех сравниваемых сценариев диагностики ХА была оценена стоимость выявления одного случая ХА. Установлено, что внедрение НИПТ в схему пренатального скрининга позволяет не только повысить частоту выявления ХА, но и минимизировать бюджет системы здравоохранения, расходуемый на выявление одного случая ХА, на 6,7–9,4%. Данный факт говорит об экономическом преимуществе схемы диагностики, включающей НИПТ, которая помогает повысить эффективность расходования бюджетных средств.
За счет повышения эффективности пренатальной диагностики достигается экономия косвенных затрат, связанных с социальными выплатами, пособиями по временной нетрудоспособности родителей, ухаживающих за ребенком-инвалидом, и издержками на реабилитацию, обучение и адаптацию детей с аномалиями кариотипа. Так, в 10-летнем горизонте исследования экономия суммарных затрат региона может достигать 46,21 млн руб. при использовании алгоритма пренатального скрининга, предполагающего внедрение в группе пациенток высокого риска возникновения ХА у плода НИПТ с последующей верификацией его положительных результатов инвазивной диагностикой.
Таким образом, в сравнении с текущей клинической практикой применение комбинации НИПТ и инвазивных диагностических процедур является предпочтительной альтернативой, так как позволяет не только повысить эффективность выявления ХА, но и избежать необоснованных прерываний беременности в результате уменьшения числа инвазивных вмешательств, а в долгосрочной перспективе — достичь экономии регионального бюджета.







