ВВЕДЕНИЕ
Эпидемия сахарного диабета (СД) и его осложнений представляет собой серьезную угрозу для здоровья людей во всем мире. По данным Федерального регистра сахарного диабета, общая численность пациентов, состоявших на диспансерном учете с СД в Российской Федерации, на 01.01.2023 г. составила 4 962 762 человека[1]. По данным Международной федерации диабета, в 2021 г. СД во всем мире выявлен у 537 млн человек, при этом число пациентов быстро растет с тревожными тенденциями увеличения частоты заболеваемости среди детей и молодых людей в возрасте до 40 лет[2].
Важно подчеркнуть, что распространенность ожирения и избыточной массы тела среди больных СД чрезвычайно высока и, по данным некоторых авторов, достигает 90% заболевших[3]. Более того, в исследованиях установлено, что избыточная масса тела и ожирение во многом предопределяют развитие СД, что связано с патологическими изменениями структуры и функции жировой ткани[4].
Одним из современных перспективных направлений лечения СД является применение ингибиторов натрий-глюкозного ко-транспортера 2 типа (иНГКТ-2), лекарственные препараты этой группы (в частности, канаглифлозин, дапаглифлозин, эмпаглифлозин) обеспечивают снижение уровня глюкозы в крови, повышение качества жизни и улучшение прогноза за счет множества плейотропных эффектов[5, 6].
Очень важно отметить клиническую эффективность применения иНГКТ-2 у пациентов (особенно пожилого и старческого возрастов) с наличием коморбидности, в этом случае оптимальное решение проблемы — назначение препаратов, способных предотвращать прогрессирование и уменьшать выраженность клинических проявлений болезни, влияющих на продолжительность и качество жизни. Так, лечение пациентов с СД препаратами группы иНГКТ-2 обеспечивает выраженный терапевтический эффект при наличии у больных явлений хронической сердечной и/или почечной недостаточности[7, 8].
При анализе литературных источников найдены лишь одиночные исследования метаболических нарушений у пациентов с СД при лечении иНГКТ-2, при этом отсутствует комплексный подход к оценке клинической эффективности применения иНГКТ-2 с позиции взаимосвязи показателей углеводного и жирового обмена, антропометрических параметров, а также уровней адипокинов лептина (Л) и адипонектина (АДН) как параметров метаболического здоровья.
Цель исследования: комплексная (клиническая, лабораторная, инструментальная) оценка эффективности коррекции метаболических нарушений у пациентов с СД 2 типа (СД2) с помощью иНГКТ-2.
МАТЕРИАЛЫ И МЕТОДЫ
Под наблюдением находились 130 пациентов (70 мужчин, 60 женщин) в возрасте 40–70 лет (средний возраст — 56,3 ± 2,1 года). Критерии включения в исследование: верифицированный диагноз СД2 в течение не менее 5 лет, проведение регулярной терапии метформином (2000 мг в сутки), нецелевые показатели гликемического контроля (уровень гликированного гемоглобина (НbА1с) в диапазоне от 6,5 до 9,8%, в среднем — 8,9 ± 0,8%), наличие ожирения по абдоминальному типу (окружность талии/окружность бедер > 1), индекс массы тела (ИМТ) > 30 кг/м2. До включения в исследование все пациенты подписали информированное согласие на участие. Далее они были разделены на равнозначные по возрасту, полу, ИМТ, уровням Л и высокомолекулярного АДН в крови группы:
-
основная группа — 68 пациентов, которым к базовой терапии метформином 2000 мг в сутки добавлен иНГКТ-2 канаглифлозин 300 мг в сутки;
-
контрольная группа — 62 пациента, которые продолжали получать только базовую терапию метформином 2000 мг в сутки.
Помимо медикаментозного лечения, с пациентами регулярно проводились занятия по правилам питания при СД2, выдавались письменные рекомендации по коррекции рациона.
Исследование осуществлялось с 2017 г. по 2020 г. в ГБУЗ «Городская клиническая больница им. С.П. Боткина Департамента здравоохранения г. Москвы», которая является клинической базой кафедры эндокринологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России (заведующий кафедрой — д. м. н., профессор А.С. Аметов). Протокол исследования одобрен экспертной комиссией терапевтического факультета ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации по вопросам медицинской этики (протокол № 4 от 13.04.2017).
Клиническое обследование включало в себя сбор анамнеза, осмотр, измерение артериального давления, частоты сердечных сокращении, массы тела, роста, ИМТ, окружности талии.
Лабораторная диагностика основывалась на оценке следующих биохимических показателей: уровней НbА1с, гликемии натощак (ГН), постпрандиальной гликемии (ППГ) (на анализаторе DS5 VARIANT II TURBO, Bio-Rad Laboratories, США), холестерина, липопротеинов высокой и низкой плотности, триглицеридов (на аппарате ADVIA 2400, США) c использованием оригинальных коммерческих наборов производства Siemens Healthcare Diagnostics Inc. (США); АДН (иммуноферментным методом на анализаторе Adiponectin ELISA, Mediagnost, Германия); Л с использованием наборов DRG для иммуноферментного анализа Multiskan Labsystems, Финляндия.
Композиционный состав тела с оценкой количества висцерального жира определяли инструментальными методами — с помощью биоимпедансного анализатора (на аппарате InBody 720, Biospace, Южная Корея) и магнитно-резонансной томографии (МРТ) на уровне L4. Комплексное обследование по перечисленным методикам выполнялось до и через 6 месяцев после лечения.
Статистическая обработка результатов исследования проводилась в программе Statistica 8.0 (StatSoft Inc., США). Нормальное распределение подтверждали при помощи критерия Колмогорова — Смирнова. Рассчитывали среднее значение показателей и его ошибку (М ± m). Для оценки значимости различий использовали параметрический критерий — двусторонний критерий Стьюдента. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05 или 0,01.
РЕЗУЛЬТАТЫ
Динамика базовых показателей углеводного обмена у пациентов представлена на рисунках 1 и 2.
Рис. 1. Динамика уровней гликемии натощак и постпрандиальной гликемии у обследованных пациентов, р < 0,01 в обоих случаях
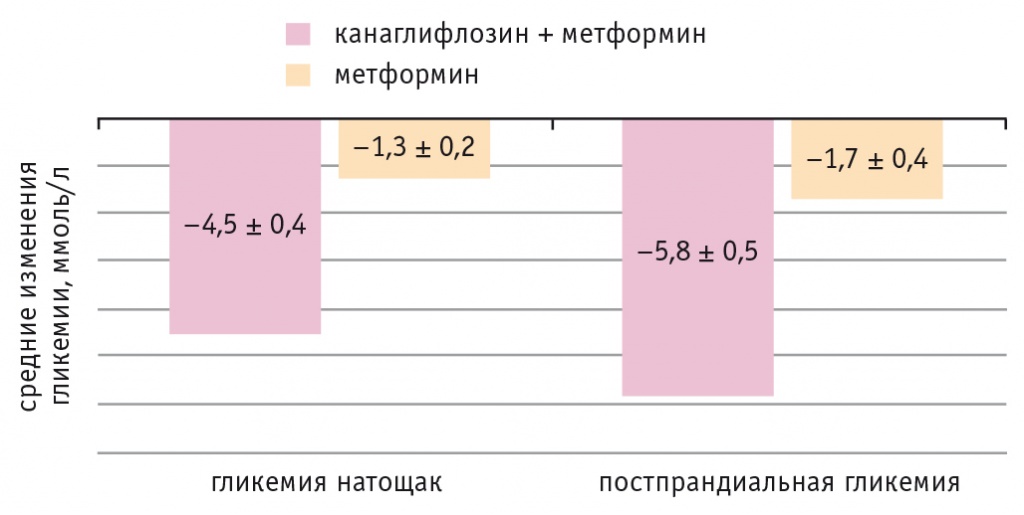
Рис. 2. Динамика уровня гликированного гемоглобина (HbA1c) у обследованных пациентов, р < 0,01 в обоих случаях

Представленные результаты свидетельствуют о более выраженных, статистически значимых (p < 0,01) различиях в снижении после лечения базовых показателей углеводного обмена в основной группе, чем в контрольной.
Сравнение липидного профиля не выявило статистически значимых различий по показателям холестерина, липопротеинов высокой, низкой плотности и триглицеридов между группами.
В реальной клинической практике для оценки жирового обмена широко используются стандартные антропометрические показатели. Однако они не позволяют достоверно определить количество висцерального жира, который имеет ключевое значение в развитии метаболических нарушений. Точная визуализация жировой ткани с измерением количества подкожного и висцерального жира дает возможность прогнозировать и оценить риск развития метаболических осложнений.
Висцеральное ожирение ассоциируется со всеми компонентами метаболического синдрома, а также является патогенетической основой хронического вялотекущего воспаления, которое, в свою очередь, прочно связано с риском появления сердечно-сосудистых заболеваний[9]. В связи с этим актуальной становится комплексная оценка жировой ткани с обязательным исследованием площади висцерального жира (ПВЖ).
Динамика клинических и инструментальных показателей жировой ткани у пациентов обеих групп представлена на рисунках 3 (А, В, С) и 4.
Рис. 3. Динамика антропометрических показателей у обследованных пациентов (р < 0,01 во всех случаях): А — индекса массы тела; В — массы тела; С — окружности талии
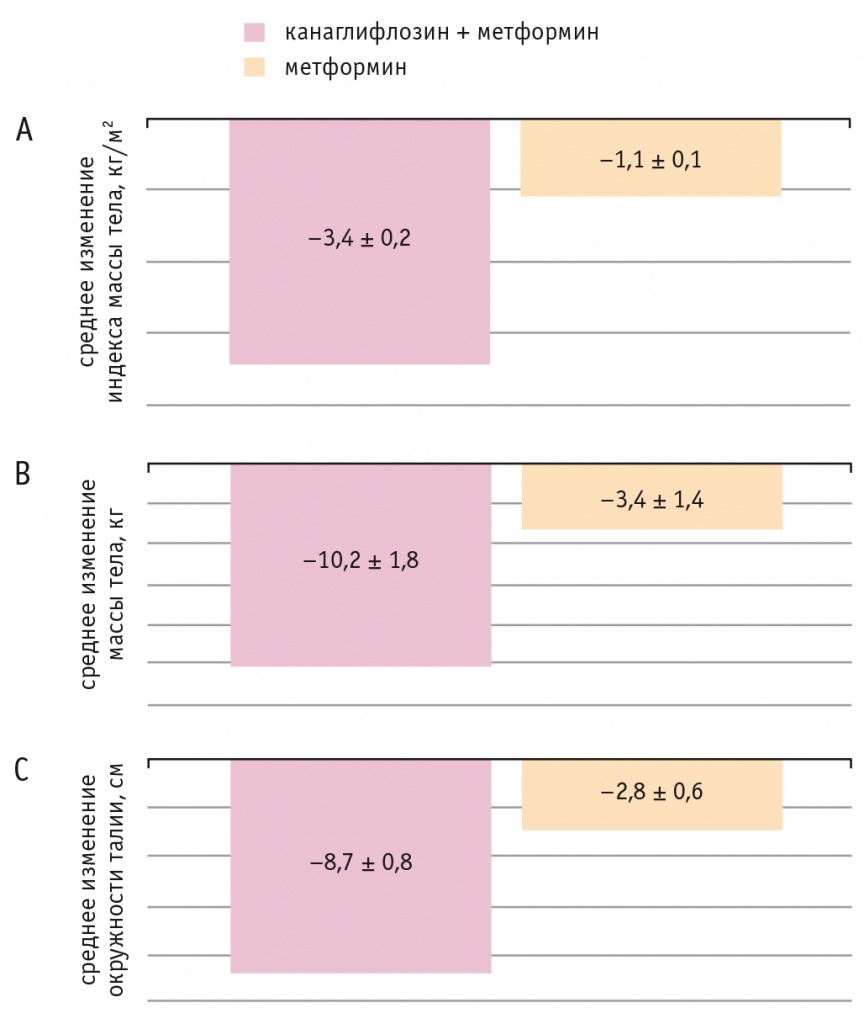
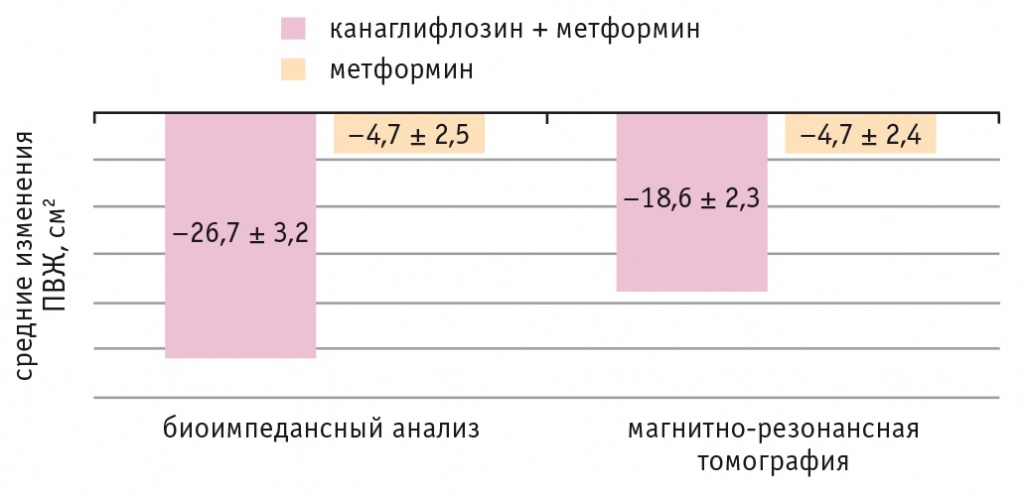
Рис. 4. Динамика площади висцерального жира (ПВЖ) у обследованных пациентов, р < 0,01 в обоих случаях
Через 6 мес терапии в обеих группах наблюдалось значимое снижение всех антропометрических показателей. Однако более выраженная динамика отмечалась в основной группе.
С помощью МРТ и биоимпедансного исследования области висцерального жира зафиксировано позитивное перераспределение жира за счет уменьшения ПВЖ, более сильные изменения были в основной группе.
Известно, что висцеральная жировая ткань является не только местом хранения и накопления энергии, но и представляет собой сложный гормонально активный орган, который синтезирует гормоноподобные вещества — адипокины. Важнейший адипокин — высокомолекулярный АДН. В многочисленных исследованиях продемонстрировано антиатерогенное и глюкозостабилизирующее действие АДН. Так, подавляя глюконеогенез в печени, он снижает эндогенную выработку глюкозы печенью и активирует окисление жирных кислот. Помимо этого, АДН улучшает чувствительность периферических тканей к инсулину, тем самым влияя на основные патогенетические звенья СД2, в то время как гипоадипонектинемия становится независимым фактором риска развития СД2[10–12].
Не менее важным с практической точки зрения адипокином является Л, который служит ключевым регулятором пищевого поведения. При наличии висцерального ожирения возникает компенсаторное снижение чувствительности гипоталамуса к центральному действию Л, что приводит к гиперлептинемии, лептинорезистентности и, как следствие, к развитию СД2[13].
Динамика уровней АДН и Л у пациентов представлена на рисунках 5 и 6.
Рис. 5. Динамика уровня адипонектина у обследованных пациентов, р < 0,01 в обоих случаях
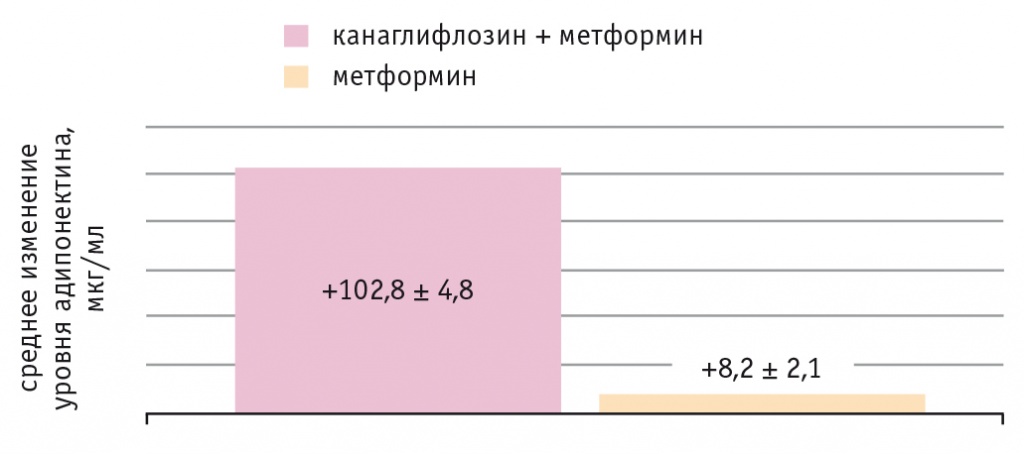
Рис. 6. Динамика уровня лептина у обследованных пациентов, р < 0,01 в обоих случаях
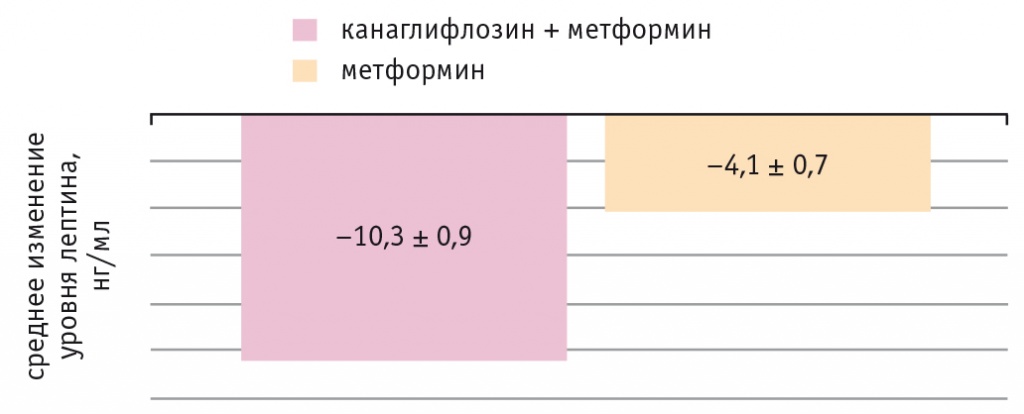
На фоне комбинированной терапии в основной группе более выраженно понизился уровень Л и увеличилось содержание АДН, чем в контрольной, хотя в обеих группах динамика была статистически значимой (р < 0,01 во всех случаях).
ОБСУЖДЕНИЕ
При обсуждении представленных результатов следует выделить три, по нашему мнению, принципиальных положения. Первое связано с выявленной высокой клинической эффективностью коррекции углеводного обмена препаратом иНГКТ-2, что в целом согласуется с накопленным опытом практического применения данных лекарственных средств у пациентов с СД2[14–16]. Терапевтическая глюкозурия на фоне приема иНГКТ-2 является основой уменьшения содержания HbA1c. В ранее проведенных исследованиях продемонстрировано, что назначение препаратов группы иНГКТ-2 обеспечивает его снижение в среднем на 0,4–0,8%[17].
В нашей работе получено более выраженное уменьшение уровня HbA1c (на 2,7%), при этом важно отметить, что доля пациентов, достигших целевого значения HbA1c, составила 64,4% при добавлении к стандартной терапии (метформину 2000 мг в сутки) иНГКТ-2 (канаглифлозина 300 мг в сутки), вероятно, благодаря комплексному воздействию, которое, помимо лекарственной терапии, включало рекомендации по низкокалорийному питанию и активному мониторингу пищевых дневников пациентов обеих групп.
Второе положение связано с положительной динамикой клинических и инструментальных показателей ПВЖ. Следует подчеркнуть, что, согласно современным представлениям, жировая ткань считается одним из мощных регуляторов метаболического гомеостаза за счет выработки значительного количества гормонов. Функциональный плейотропизм жировой ткани зависит от способности синтезировать и высвобождать большое количество гормонов, цитокинов, белков внеклеточного матрикса, а также ростовых и вазоактивных факторов, которые влияют на различные физиологические и патофизиологические процессы.
Механизмы, лежащие в основе дисфункции жировой ткани при СД, включают гипертрофию и гиперплазию адипоцитов, выработку провоспалительных цитокинов, нарушение ремоделирования внеклеточного матрикса и фиброз вместе с измененной секрецией адипокинов[18]. В нашей работе наблюдалось выраженное снижение массы тела в группе канаглифлозина и метформина — на 10,2 кг за 6 мес наблюдения. Эти изменения значительно отличаются от результатов, полученных другими исследователями. Так, по данным метаанализа 55 рандомизированных контролируемых исследований, на фоне приема иНГКТ-2 выявлено уменьшение массы тела в среднем на 0,9–2,5 кг, в отличие от группы плацебо[19]. Вероятно, такая выраженная динамика связана с исходным наличием ожирения у пациентов основной группы, а также с синергичным влиянием иНГКТ-2 и изменения образа жизни на фоне гипокалорийного питания, контроля пищевых дневников и активного мониторинга пациентов.
Анализируя полученные результаты, мы задавались вопросом о причинах более существенного снижения уровня HbA1c и массы тела в нашем исследовании. Скорее всего, это связано с персонифицированным наблюдением за нашим больными и возможностью регулярно обсуждать с врачом вопросы по режиму питания. Наши данные свидетельствуют о дополнительных возможностях улучшения важнейших метаболических параметров при таком подходе.
C целью оценки динамики площади жировой ткани, наряду с традиционными антропометрическими измерениями, применялся объективный метод оценки — биоимпедансный анализ в сочетании с МРТ, что соответствует инновационным диагностическим тенденциям[20, 21]. Снижение массы тела происходило за счет уменьшения ПВЖ, что является актуальным ввиду представлений об ассоциации увеличения ПВЖ и риска сердечно-сосудистых заболеваний. Значимое снижение ПВЖ у участников основной группы (в среднем на 22,3% по сравнению с показателем контрольной группы) указывает на высокую клиническую эффективность иНГКТ-2.
Третье положение связано с понятием метаболического здоровья у пациентов с СД. Необходимо отметить, что жировая ткань синтезирует гормоноподобные вещества, ключевое из них — АДН, характеризующийся антиатерогенным, антидиабетическим и противовоспалительным эффектом. АДН также способствует улучшению чувствительности периферических тканей к инсулину, тем самым влияет на патогенетические звенья СД[22]. В связи с этим АДН может быть дополнительной терапевтической мишенью при СД. Противоположное АДН действие оказывает Л. Пациенты с висцеральным ожирением имеют высокий уровень Л и лептинорезистентность, которая прочно ассоциирована с инсулинорезистентностью и, как следствие, с нарушением метаболизма жира[23]. В нашем исследовании отмечены значимые повышение уровня высокомолекулярного АДН (на 102,8 мкг/мл) и снижение концентрации лептина (на 10,3 нг/мл). Подобные результаты получены и в аналогичных исследованиях.
Так, в 2019 г. в метаанализе 10 исследований, оценивающих влияние иНГКТ2 на уровни Л и АДН у пациентов с СД2, выявлено, что по сравнению с плацебо отмечалось более выраженное снижение концентрации Л у пациентов группы лечения (стандартизированная средняя разница составила –0,29, 95% доверительный интервал (ДИ): –0,56; –0,03) и повышение уровня АДН (стандартизированная средняя разница — 0,30, 95% ДИ: 0,22; 0,38). Авторы сделали вывод, что терапия иНГКТ2 сопровождалась благоприятными с точки зрения метаболического гомеостаза изменениями содержания АДН и Л[24].
В исследовании W.T. Garvey и соавт. сравнивалось воздействие канаглифлозина 300 мг и глимепирида на динамику уровней ряда адипокинов, включая АДН и Л. Показано, что к 52-й неделе терапии у пациентов группы канаглифлозина уровень Л уменьшился на 25%, а концентрация АДН выросла на 17% по сравнению с таковыми в группе глимепирида. Соотношение Л/АДН снизилось в группе канаглифлозина и повысилось в группе глимепирида[25].
Наши данные демонстрируют более значимую динамику уровней биомаркеров, что обусловлено в первую очередь значительно бо́льшим снижением массы тела (–10,2 кг в нашем исследовании по сравнению с –4,1 кг в исследовании W.T. Garvey и соавт.).
ЗАКЛЮЧЕНИЕ
Полученные в настоящей работе данные достаточно убедительно свидетельствуют о том, что комбинированная терапия метформином и иНГЛТ-2 способствует комплексной коррекции метаболических нарушений. Показано, что уменьшение депо висцерального жира сопровождается восстановлением адипокинового статуса и значимым улучшением показателей гликемического контроля.
Поступила: 28.05.2023
Принята к публикации: 23.06.2023







