Под сердечно-сосудистыми событиями (cardiovascular events) в настоящее время понимают любое коронарное или цереброваскулярное событие: инсульт, острую ишемию миокарда, венозные тромбоэмболические осложнения (ВТЭО) или острый тромбоз периферических артерий.
Сердечно-сосудистые заболевания являются основной причиной инвалидизации и смертности женщин в постменопаузе.
Меры первичной профилактики, эффективные у мужчин, а именно прием ацетилсалициловой кислоты и статинов, у женщин оказываются неэффективными и существенно не снижают риск развития ИБС и инфаркта миокарда [1].
Именно поэтому в случаях, когда у женщин после естественной или хирургической менопаузы возникает дефицит половых гормонов, приводящий к ослаблению функции эндотелия, становится актуальным восстановление их содержания посредством менопаузальной гормональной терапии (МГТ) [2–4].
В настоящее время многие гинекологи и их пациентки относятся к МГТ позитивно, хотя есть и скептики, утверждающие, что МГТ может приносить не только пользу, которую никто не опровергает, но и вред. В частности, это относится к сосудистым осложнениям, способным возникнуть на фоне приема гормональных препаратов. Некоторые считают, что защитные возможности МГТ в отношении атеросклероза выражены незначительно, особенно если МГТ назначается несвоевременно, более пожилым пациенткам (старше 60 лет), и возможные негативные моменты, в том числе венозные тромбозы, нивелируют пользу от этой терапии [5].
Другие убеждены, что хроническая венозная недостаточность (ХВН), в том числе варикозная болезнь, является противопоказанием для назначения МГТ, поскольку МГТ увеличивает риск венозных тромбозов и возможной тромбоэмболии легочных артерий [6–7].
В целом и те, и другие суждения можно считать справедливыми, хотя и отчасти, поскольку существует много дополнительных моментов, связанных и с прогрессированием атеросклероза, и с развитием венозных тромбоэмболических осложнений.
Рекомендации Международного общества по менопаузе (International Menopause Society, IMS) 2016 г. однозначно указывают на снижение риска сердечно-сосудистых заболеваний благодаря положительному влиянию МГТ на сосудистую функцию, уровни липидов и метаболизм глюкозы [1].
Эстрогены, благодаря биологическим механизмам регуляции активности эндотелиальных и гладкомышечных клеток кровеносных сосудов и миокарда, положительно влияют на функцию эндотелия, снижая уровни молекул адгезии как сосудистых, так и воспалительных клеток [1], что в целом тормозит развитие атеросклероза. Эстрогены могут оказывать благоприятное локальное и системное воздействие, обусловленное рецептор-опосредованными эффектами, путем взаимодействия с α- и β-эстрогеновыми рецепторами, обнаруженными в эндотелиальных, гладкомышечных клетках и кардиомиоцитах.
Основные положительные свойства эстрогенов связаны не только с прямым протективным действием на артериальную стенку, но и с тем, что они, как уже было сказано выше, восстанавливают NO-зависимую эндотелиальную функцию, увеличивают продукцию эндотелиальной NO-синтазы, уменьшают пролиферацию гладкомышечных клеток артерий и высвобождение клетками эндотелия эндотелина 1 — мощнейшего вазоконстриктора, ингибируют кальциевые каналы и стимулируют калий-зависимые каналы и др. [3].
Большинство проведенных исследований посвящены влиянию МГТ на развитие ИБС как наиболее значимого проявления атеросклероза.
Существуют четкие и надежные доказательства того, что терапия эстрогенами может оказывать кардиопротективное действие, если она начата в период, близкий ко времени наступления менопаузы. Исследования Women's Health Initiative (WHI) показали снижение частоты развития ИБС и риска инфаркта миокарда в группе женщин 50–59 лет, получавших эстрогены.
Рандомизированное контролируемое датское исследование, длившееся 10 лет, показало снижение смертности и количества случаев госпитализации по поводу инфаркта миокарда и сердечной недостаточности примерно на 50% при раннем начале МГТ [8].
Р. Tuomikoski и соавт. (2014) проанализировали данные финского национального регистра за 2002–2009 гг., в который вошли 91 130 женщин в постменопаузе[9]. Длительность МГТ составила от 1 года до 9 лет, женщины были разбиты на две группы — более молодого (до 60 лет) и более старшего (60 лет и старше) возраста, при этом длительность наблюдения — 378 602 пациенто-года. Доказано статистически значимое уменьшение смертности от инфаркта миокарда при назначении МГТ в более раннем возрасте — практически в 2 раза.
S.R. Salpeter и соавт. (2009) опубликовали данные метаанализа, в котором были суммированы результаты 23 рандомизированных клинических исследований. В них участвовали в общей сложности 39 049 женщин в постменопаузе [10], которых разделили на две группы. Первая группа — пациентки до 60 лет, у которых терапия была начата менее чем через 10 лет после наступления менопаузы. Вторая группа — женщины 60 лет и старше, которым лечение назначили позже чем через 10 лет после наступления менопаузы. Метаанализ этих исследований показал значимое снижение частоты инфаркта миокарда и сердечной смерти при назначении МГТ в более раннем возрасте. МГТ за счет эстрогенной составляющей позволяет после наступления менопаузы тормозить атерогенез и увеличить длительность и качество жизни женщины.
Но роль эстрогенов состоит не только в непосредственной защите артериальной стенки, но и в положительном влиянии на липидный обмен, нарушения которого — второй важный фактор риска развития атеросклероза [11].
Холестерин вместе с фосфолипидами является частью всех клеточных мембран. Принципиально выделяют два основных класса липопротеинов: ЛПНП (атерогенный) и ЛПВП (антиатерогенный). ЛПНП взаимодействуют с соответствующими рецепторами на поверхности клеток, проникают внутрь клетки, разрушаются, а холестерин идет на синтез мембран. При избыточном поступлении холестерина в клетки эндотелия и макрофаги, находящиеся под эндотелием, могут образовываться «пенистые» клетки и атеросклеротические бляшки, что приводит к прогрессированию атеросклероза. Однако 75% рецепторов к ЛПНП находится на поверхности самих гепатоцитов — они не только синтезируют эту атерогенную фракцию, но и элиминируют ее из крови. Эстрогены способны увеличивать количество рецепторов на поверхности гепатоцитов, тем самым снижая уровень ЛПНП в плазме крови и уменьшая риск развития атеросклероза.
Основная роль ЛПВП заключается в захвате холестерина на поверхности клеток, в том числе эндотелия, и транспортировке его в печень, где он идет на синтез желчных кислот [10, 11].
Принципиально важно не просто содержание холестерина, ЛПНП и ЛПВП в крови, а соотношение атерогенной и антиатерогенной фракций, которое рассчитывается в виде коэффициента (индекса) атерогенности (Ка):
Ка = (общий холестерин – ЛПВП)/ЛПВП.
В настоящее время борьба с нарушением липидного обмена обычно сводится к назначению препаратов, снижающих уровни ЛПНП. В первую очередь это статины, которые блокируют ключевой фермент биосинтеза холестерина в печени, что, помимо пользы, приносит и определенные осложнения, в частности снижаются и уровни ЛПВП. Возможностей же увеличить их, к сожалению, очень мало[12].
Одна из возможностей заключается в выборе препарата для проведения оптимальной МГТ, поскольку не только эстрогеновый компонент может положительно влиять на липидный спектр, но и гестагеновая составляющая. Так, D. Cieraad и соавт. (2006) в исследовании, в котором приняли участие 193 женщины, показали значимое повышение уровней ЛПВП при проведении МГТ препаратом, содержащим дидрогестерон[13]. Подобный эффект не был получен при применении каких-либо других гестагенов.
Еще необходимо учитывать, что с возрастом повышается инсулинорезистентность, а это ведет к развитию СД 2 типа, который, помимо того, что сам может привести к серьезным осложнениям (микро- и макроангиопатии, ретинопатии, полинейропатии, нефропатии), является важным фактором риска атеросклероза. Эстроген в составе МГТ оказывает благотворное влияние на метаболизм глюкозы и инсулина, снижает резистентность к инсулину [14–15]. Исследование WHI показало, что у получавших комбинированную МГТ женщин частота СД 2 типа снижается на 21%, а у получавших монотерапию эстрогенами — на 12%[1].
Следует, однако, сказать, что некоторые прогестагены, особенно андрогенные, например норгестрел или медроксипрогестерона ацетат, входящие в состав препарата МГТ, могут нивелировать положительные свойства эстрогена. Прогестагены с остаточными андрогенными эффектами противодействуют повышению уровня холестерина ЛПВП, могут способствовать формированию абдоминального типа ожирения и нарушать толерантность к глюкозе вплоть до развития инсулинорезистентности за счет уменьшения числа инсулиновых рецепторов в жировой и мышечной ткани и увеличения уровней свободных жирных кислот[16].
Согласно Российскому протоколу по менопаузальной терапии, следует отдавать предпочтение средствам МГТ с метаболически нейтральным гестагенным компонентом. В частности, среди гестагенов значительными преимуществами обладают неандрогенные прогестагены (например, дидрогестерон) [8].
Одним из осложнений МГТ принято считать развитие ВТЭО, хотя на самом деле их количество невелико, первичной причиной служит ХВН.
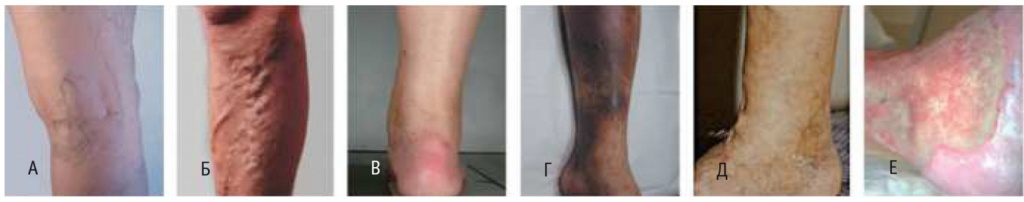
В настоящее время наиболее часто используется международная классификация ХВН CEAP (Сlinical — клиническая, Etiological — этиологическая, Anatomical — анатомическая и Pathophysiological —патофизиологическая). На практике, как правило, ограничиваются клиническим разделом этой классификации (рис.):
С0 — отсутствие симптомов болезни вен;
С1 — телеангиоэктазии и ретикулярные вены;
С2 — варикозно расширенные вены;
С3 — отек;
С4 — кожные изменения, обусловленные заболеванием вен (пигментация, венозная экзема, липодерматосклероз);
С5 — кожные изменения, указанные выше, и зажившая язва;
С6 — кожные изменения, указанные выше, и активная язва.
Рис. Виды хронической венозной недостаточности по СЕАР: А — телеангиоэктазии (С1); Б — варикозные вены (С2); В — отек (С3); Г — пигментация (С4); Д — зажившая венозная язва (С5); Е — открытая венозная язва (С6). Фото автора
Какие же виды и степени ХВН опасны при назначении МГТ, а какие нет?
В основе механизма тромбообразования в просвете сосудистого русла лежит так называемая триада Вирхова:
- повреждение сосудистой стенки;
- изменение характера тока крови;
- сдвиг гемостаза в сторону тромбообразования.
Повреждение сосудистой стенки, приводящее к турбулентному характеру кровотока, является основным фактором развития артериального тромбоза.
Еще один фактор формирования венозного тромбоза — замедление тока венозной крови, возникающее при гиподинамии, сердечной недостаточности, нарушении оттока от нижних конечностей, в том числе при ХВН.
Сдвиг состояния гемостаза в сторону тромбообразования, который может быть обусловлен сгущением крови на фоне приема диуретиков или обладающих диуретическим эффектом гестагенов (дроспиренон), также считается ведущим фактором развития венозного тромбоза.
Независимо от имеющихся факторов риска ВТЭО ХВН С0–С1 не представляет опасности в отношении венозных тромбозов и не является противопоказанием для назначения МГТ.
Решение о назначении МГТ желательно принимать при соблюдении определенных условий, снижающих риск развития венозного тромбоза [1, 8]. Одним из условий служит консультативное решение вопроса о необходимости исследования на гены тромбофилии, хирургического вмешательства или назначении ношения компрессионного трикотажа.
Очень важен состав препарата МГТ, т. е. входящие в него эстрогенный и гестагенный компоненты. Сами эстрогены могут увеличивать риск развития венозных тромбозов, особенно это касается этинилэстрадиола и конъюгированных эстрогенов. Аналоги натуральных эстрогенов, например, 17β-эстрадиол, наиболее предпочтительны в составе МГТ.
Следующий момент — тип гестагена, входящего в состав препарата МГТ. Поскольку задача гестагена в составе МГТ — только антипролиферативное действие на эндометрий в условиях эстрогеновой стимуляции, оптимально, если гестаген будет обладать высокоселективным действием и не будет влиять на другие виды рецепторов, кроме прогестероновых. Однако не все гестагены оказывают селективное влияние на рецепторы эндометрия, что может приводить и к нежелательным последствиям (табл.).
Таблица
Влияние прогестагенов на различные рецепторы
| Прогестагены | Прогестагенная активность | Эстрогенная активность | Андрогенная активность | Антиандрогенная активность | Глюкокортикоидная активность | Антиминералокортикоидная активность |
| Дидрогестерон | + | – | – | ± | – | ± |
| Дроспиренон | + | – | – | + | – | + |
| Прогестерон | + | – | – | ± | + | + |
| Медроксипрогестерона ацетат | + | – | ± | – | + | – |
| Норэтистерон | + | + | + | – | – | – |
Как видно из представленных данных [15] и было сказано выше, из наиболее часто применяемых прогестагенов предпочтителен дидрогестерон, поскольку он в отличие от дроспиренона и прогестерона имеет минимальную антимнералокортикоидную активность и не влияет на водно-электролитный обмен, не приводит к выведению жидкости из организма и не способствует сгущению крови (это однин из факторов риска развития венозного тромбоза).
В целом дидрогестерон оказывает селективное действие на прогестероновые рецепторы с очень высокой афинностью, что способствует профилактике гиперпластических процессов, не увеличивая риск венозных и артериальных тромбозов. С другой стороны, дроспиренон обладает и неселективным действием: в частности, кроме прогестероновых, он связывается с минералкортикоидными рецепторами и др., что увеличивает риск тромбозов [17]. Его можно считать одним из самых тромбогенных гестагенов в гормональной терапии не только за счет выведения жидкости из организма и сгущения крови, но и из-за его способности усиливать агрегацию тромбоцитов[17].
Факторами, влияющими на риск развития ВТЭО, также следует считать длительность проводимой МГТ и ее дозу. Как правило, наибольший риск ВТЭО существует в первый год терапии, в то время как в последующем он значительно снижается и шанс их возникновения становится минимальным [18]. Что касается дозы, то чем она меньше при гормонотерапии, тем меньше и риск ВТЭО. Абсолютными противопоказаниями к применению даже минимальных доз эстрогенов независимо от пути их введения служат только предшествующая идиопатическая или подтвержденная тромбоэмболия (тромбоз глубоких вен, тромбоэмболия легочных сосудов) или недавно перенесенная артериальная тромбоэмболия[19].
Кроме того, риск тромбозов во многом связан с гестагеном и тщательностью оценки рисков назначения препаратов с некоторыми из них. Например, риск венозных тромбозов при назначении дроспиренон-содержащих препаратов повышен в 5–15 раз в зависимости от контингента пациенток [20].
При использовании оптимальных комбинаций эстрогена и гестагена риск венозных тромбозов при своевременном начале терапии, возможно, не увеличивается. Так, в рандомизированном исследовании доказано, что пероральная и трансдермальная терапия эстрадиолом при сочетании с пероральным приемом дидрогестерона одинаково безопасна (не повышает вероятность возникновения венозных тромбозов). При этом только пероральная комбинация эстрадиола и дидрогестерона приводила к значимым улучшениям липидного спектра[21–22].
К тому же именно пероральная МГТ в отличие от трансдермальной предпочтительна с точки зрения улучшения гликемического профиля, что особенно важно для пациенток с СД 2 типа. Более того, согласно новым европейским рекомендациям 2018 года, своевременное начало МГТ может отложить развитие СД 2 типа, который также является существенным независимым фактором риска серьезных сердечно-сосудистых событий [23].
Таким образом, с точки зрения сердечно-сосудистых рисков при отсутствии противопоказаний к МГТ в целом (а они одинаковы для пероральной и трансдермальной МГТ) оптимальны именно пероральные комбинации.
Хотелось бы заключить обзор цитатой из рекомендаций IMS 2016 г. по здоровью женщин зрелого возраста и МГТ.
- «МГТ должна быть индивидуализирована и адаптирована в зависимости от симптомов и необходимости профилактики, а также персонального и семейного анамнеза.
- Преимущества и риски МГТ в значительной мере зависят от индивидуальных обстоятельств.
- Проведенные в течение последнего десятилетия исследования показали, что риски могут быть минимизированы, а преимущества — максимально увеличены путем выбора оптимального режима в оптимальный период.
- Безопасность МГТ зависит главным образом от возраста и времени, прошедшего после менопаузы» [1].
ЗАКЛЮЧЕНИЕ
Своевременное назначение менопаузальной гормональной терапии (МГТ) и соблюдение мер дополнительной профилактики венозных тромбозов, о которых говорилось выше, позволяют добиться максимального эффекта и свести к минимуму возможные осложнения. И, конечно, необходим правильный подход к выбору того или иного препарата МГТ. Риск венозных тромбозов при пероральной МГТ с дидрогестероном такой же низкий, как и при трансдермальной терапии. В то же время именно пероральные комбинации для МГТ с дидрогестероном предпочтительны с точки зрения комплексного снижения сердечно-сосудистых рисков, что продемонстрировано в рандомизированных исследованиях и метаанализах.







