ВВЕДЕНИЕ
Диффузный токсический зоб (ДТЗ) является аутоиммунным заболеванием, в основе которого лежит продукция аутоантител к рецепторам ТТГ, что приводит к хронической гиперсекреции тиреоидных гормонов[1, 2]. Раннее выявление группы риска рецидива ДТЗ крайне актуально, так как сохранение длительного тиреотоксикоза (ТТ) приводит к развитию тиреотоксической кардиомиопатии и формированию жизнеугрожающих нарушений ритма (фибрилляции предсердий), сердечной недостаточности, остеопорозу, что ухудшает прогноз трудоспособности и продолжительности жизни больных.
Основным методом лечения ДТЗ считается консервативная терапия с использованием тиреостатических препаратов в течение 12–18 месяцев[3–5]. Однако, по данным исследования[6], количество рецидивов ТТ после прекращения терапии составляет от 30% до 70%.
Кроме того, вероятность ремиссии остается низкой и после повторных курсов антитиреоидной терапии. Так, работа, проведенная в 1997 году, показала, что после первого курса лечения тиреостатиками 78% больных достигли ремиссии заболевания, после второго — 14%, после третьего — 5,5% и только 2,5% — после четвертого курса лечения[7]. Поэтому разработка и клиническая апробация методов ранней оценки вероятности ремиссии у больных ДТЗ — важная задача для оптимизации лечебной тактики.
В настоящее время надежных критериев ремиссии ДТЗ нет[8, 9]. В клинической практике ремиссией принято считать отсутствие рецидива ТТ на фоне применения антитиреоидной терапии, увеличения объема щитовидной железы (ЩЖ), прогрессии инфильтративной офтальмопатии, нарастания концентраций антител к рецептору ТТГ. Но даже при отсутствии этих критериев вероятность рецидива ДТЗ остается высокой[10, 11]. В настоящее время ведется поиск надежных предикторов ремиссии ДТЗ[12–16].
Показано, что отдельные критерии ремиссии ДТЗ ненадежны и только учет совокупности признаков ДТЗ позволит прогнозировать вероятность ремиссии заболевания[3]. Так, X.G. Vos и соавт. предложили шкалу оценки вероятности ремиссии ДТЗ GREAT, которая учитывала возраст пациента на момент дебюта заболевания, тяжесть гипертиреоза, сывороточные значения св. T4, уровни антител к рецептору ТТГ и объем ЩЖ. Клиническая апробация шкалы GREAT представлена в исследовании Swiss Group[12].
Вторая шкала разработана группой профессора E. Masiello. Она включает три компонента Мерзебургской триады — зоб, гипертиреоз и наличие инфильтративной офтальмопатии. В исследовании профессора E. Masiello на большой группе больных ДТЗ изучены чувствительность и специфичность модели CSS. Обнаружилось, что в период последующего наблюдения риск рецидива ТТ в группе больных с низкой его вероятностью был равен 36%, а если исходный риск рецидива ТТ был умеренным или высоким, в последующем он увеличивался до 50% и 59% соответственно[3].
В этом исследовании шкала GREAT показала подобные же результаты с несколько лучшим прогнозированием рецидива ТТ в группе больных с умеренным и тяжелым риском. Вероятность рецидива ТТ у пациентов умеренного риска была точно такой же (34%), как в наблюдательном исследовании профессора Т. Struja (Sweet Group), но значимо выше, чем в оригинальном исследовании профессора X.G. Vos (16%).
Таким образом, предложенные расчетные шкалы оценки вероятности ремиссии ДТЗ (GREAT и CSS), безусловно, являются полезными для использования в клинической практике и оптимизации лечебной тактики у пациентов с впервые выявленным ДТЗ. Однако обе шкалы несовершенны, и, вероятно, потребуются дополнительные критерии для более точного прогноза течения заболевания.
Цель исследования: разработать шкалу оценки вероятности ремиссии у больных ДТЗ для оптимизации лечебной тактики.
МАТЕРИАЛЫ И МЕТОДЫ
Нами обследованы 715 больных с ДТЗ, диагностированным в период с 1970 по 2014 г., среди них было 512 женщин и 203 мужчины. Исследование проводилось на базе Клиники факультетской терапии и Клинико-диагностического центра ФГБОУ ВО «ПСПбГМУ им. акад. И.П. Павлова». Критерии включения в исследование: подписанное информированное согласие на участие, возраст старше 18 лет на момент постановки диагноза. Критерии исключения: предшествующая беременность и/или прием амиодарона за предшествующий год, введение йодоконстрастных веществ за последние 3 месяца до исследования.
Исследование проводилось по двум направлениям: ретроспективный анализ и проспективное наблюдение.
Ретроспективный анализ включал 515 пациентов с ДТЗ (404 (78,5%) женщины и 111 (21,5%) мужчин), диагностированным за период с 1970 до 2010 г. Средний возраст больных составил 41,96 ± 0,60 года (41,15 ± 0,66 года у женщин, 45,25 ± 0,60 года у мужчин; р = 0,01). Все они получали терапию тиреостатиками на протяжении 12–18 месяцев. У всех больных исходно и в динамике консервативного лечения оценивали результаты УЗИ ЩЖ, гормонального обследования (содержание ТТГ, св. Т4, св. Т3), уровни антител к ТПО, ТГ, рецептору ТТГ. На момент дебюта заболевания учитывались также пол, возраст, факт табакокурения, характер сопутствующей терапии. После отмены лечения пациенты наблюдались каждые 6 месяцев в течение 5 лет. За это время полные данные исходно и в динамике получены у 334 пациентов с ДТЗ.
С целью разработки математической модели оценки вероятности ремиссии ДТЗ на фоне стандартной антитиреоидной терапии проведен пошаговый регрессионный анализ, на основании которого построена дискриминантная функция D, позволившая классифицировать больных на две группы. Группа 1 — значение D менее 3,26, группа 2 — значение D равно 3,26 и более.
В проспективное открытое нерандомизированное неконтролируемое исследование (рис. 1) включили 200 больных с впервые диагностированным ДТЗ (108 (54%) женщин и 92 (46%) мужчин) и в течение 4 лет за ними наблюдали. Их средний возраст на момент постановки диагноза составил 42,96 ± 0,60 года (44,17 ± 0,66 года у женщин, 46,25 ± 0,71 года у мужчин). Все пациенты получали стандартную тиреостатическую терапию в течение 12–18 месяцев. В последующем она была отменена в соответствии с существующими рекомендациями.
Рис. 1. Дизайн проспективного наблюдательного исследования больных диффузным токсическим зобом (ДТЗ)
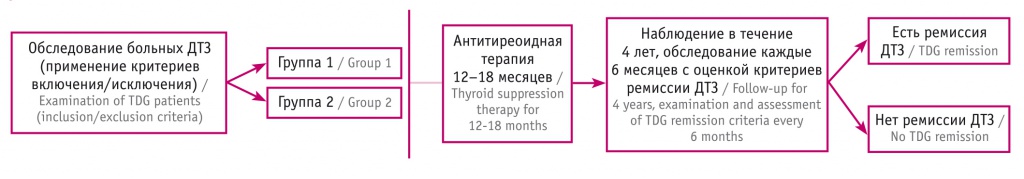
Согласно сформулированным прогностическим критериям, больные были разделены на две группы в зависимости от полученного значения D: группа 1 — значение D меньше 3,26 (риск рецидива ТТ низкий); группа 2 — значение D равно 3,26 и более (риск рецидива ТТ высокий).
Уровни ТТГ, св. Т4, св. Т3, содержание в сыворотке крови антител к рецептору ТТГ и к ТПО определялись методом ИФА. УЗИ ЩЖ производилось на аппарате SONOLINE G60 S (Siemens, Германия) датчиком 6,5–10 мГц. По данным УЗИ оценивался объем ЩЖ, который рассчитывался путем умножения длины, толщины, ширины каждой доли, результат умножался на коэффициент 0,479[17]. В норме объем ЩЖ у женщин — до 18 см3, у мужчин до — 25 см3. Учитывалось также наличие узлов ЩЖ.
Статистический анализ результатов исследования выполнен с помощью программы SPSS 16.0 (SPSS Inc., США). Количественные признаки представлены в виде среднего арифметического значения ± стандартное отклонение (при нормальном распределении значений признака). Межгрупповое сравнение значений количественных признаков проводилось с применением t-критерия Стьюдента и U-теста Манна — Уитни соответственно.
Частотные показатели в независимых выборках сравнивали с помощью критерия Пирсона χ2, а при числе наблюдений в одной из ячеек 4-польной таблицы < 5 — с помощью точного критерия Фишера. Статистически значимыми считали различия при p < 0,05.
С применением логистической модели рассчитывали вероятность ремиссии ДТЗ с учетом изучаемых параметров. Была построена дискриминантная функция D, которая позволила классифицировать больных.
РЕЗУЛЬТАТЫ
В ходе изучения анамнеза у 197 (38,3%) из 515 включенных в ретроспективное исследование больных ДТЗ выявлена наследственная предрасположенность к заболеваниям ЩЖ.
Все пациенты условно были разделены на две группы — с ремиссией заболевания (группа 1) и без нее (группа 2). У участников с неблагоприятным прогнозом ремиссии заболевания значимо чаще были указания на заболевания ЩЖ у ближайших родственников (р = 0,02). В этой группе также было значимо больше курящих пациентов (р = 001).
Уровни антител к рецептору ТТГ крови как исходно, так и через 18 месяцев терапии были значимо выше (р = 0,002) в группе 2 (11,97 ± 4,74 и 4,78 ± 1,44 ммЕ/л соответственно), чем в группе 1 (4,64 ± 2,12 мМЕ/л и 0,79 ± 0,328 мМЕ/л соответственно). Объем ЩЖ также значимо различался у пациентов с разными исходами консервативной терапии. У участников группы 1 объем ЩЖ исходно и через 18 месяцев лечения был существенно меньше (р < 0,001) такового у больных группы 2. Значимые различия выявлены и по уровням гормонов ЩЖ: в группе 2 исходный уровень св. Т3 и соотношение св. Т3/св. Т4 были выше, чем в группе 1 (в обоих случаях р < 0,0001).
С целью разработки математической модели прогнозирования вероятности ремиссии ДТЗ на фоне стандартной антитиреоидной терапии нами проведен регрессионный анализ. Для выявления переменных, максимально влияющих на результат лечения, и построения прогностической функции выполнялся пошаговый дискриминантный анализ. Использованы данные 334 пациентов с ДТЗ, у которых была полная информация по всем анализируемым показателям.
В результате выделены шесть значимых дискриминантных переменных, которые влияют на прогноз ремиссии ДТЗ. Переменные, расположенные в порядке значимости, приведены в таблице. Чем выше находится переменная в таблице, тем больше ее вклад в дискриминацию (разделение) пациентов по прогнозу вероятности ремиссии ДТЗ.
Таблица
Значимые переменные, влияющие на прогноз лечения больных диффузным токсическим зобом
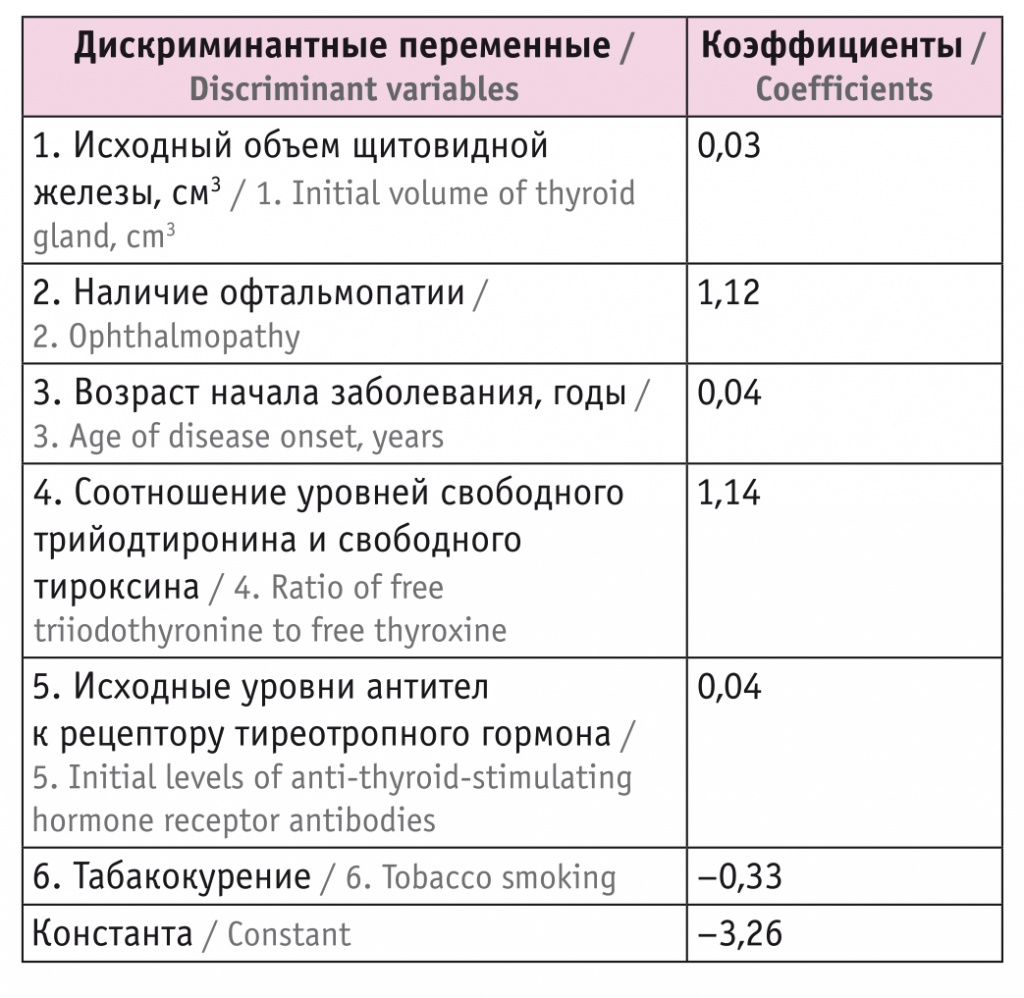
На основании отбора наиболее информативных признаков создано уравнение дискриминантной функции D:
D = 0,03 × исходный объем ЩЖ + 1,12 × офтальмопатию + 0,04 × возраст начала заболевания (годы) + 1,14 × соотношение св.Т3/св.Т4 + 0,04 × антитела к рецептору ТТГ (исходно) – 0,33 × курение,
где наличие офтальмопатии — 1, отсутствие — 0; наличие курения — 1, отсутствие — 0.
Для оценки вероятности ремиссии ДТЗ для каждого пациента вычисляется индивидуальное значение D. Если D < 3,26, то пациент будет иметь высокую вероятность ремиссии, если D ≥ 3,26, то вероятность ремиссии низка.
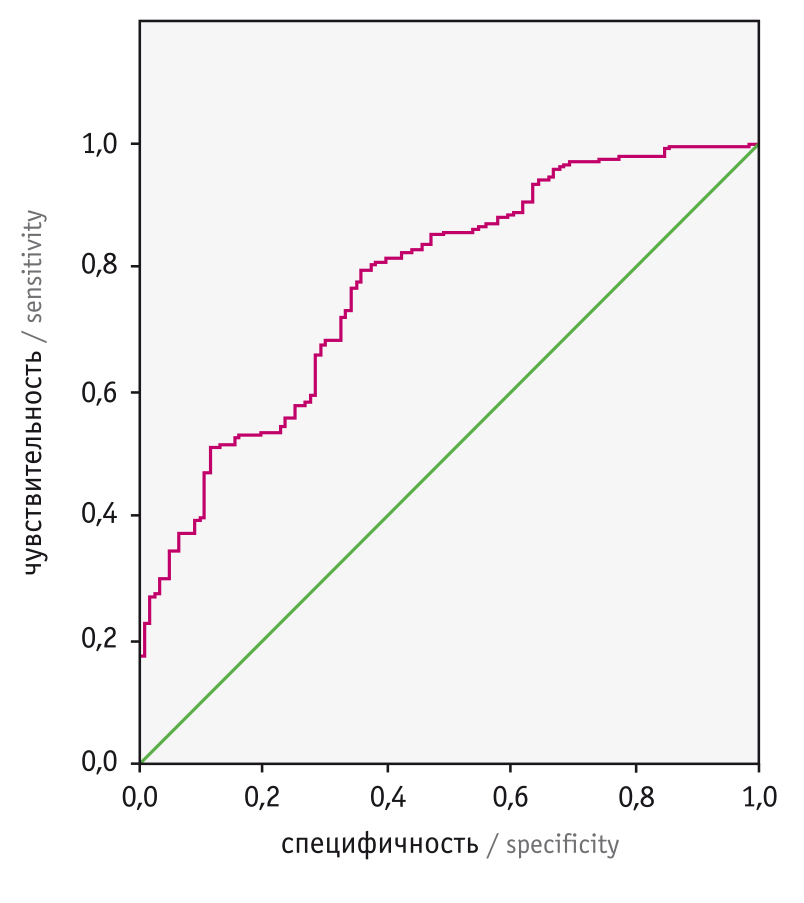
Для определения адекватности и возможности интерпретации взаимовлияния полученных показателей на оценку вероятности ремиссии нами проведен ROC-анализ. Площадь под кривой составила 0,776, что позволяет оценить качество модели как хорошее (рис. 2).
Рис. 2. ROC-кривая соотношения чувствительности/специфичности модели прогнозирования вероятности ремиссии у больных диффузным токсическим зобом
В ходе проспективного исследования 200 пациентов с впервые выявленным ДТЗ разделили на две группы в соответствии с вероятностью ремиссии: группа 1 — значение D менее 3,26 (n = 82, 41%); группа 2 — значение D равно 3,26 и более (n = 118, 59%). Все участники были сопоставимы по полу, возрасту, анамнезу табакокурения на момент постановки диагноза.
Первый анализ клинико-лабораторных данных проведен через 18 месяцев консервативной терапии, а далее — каждые 6 месяцев в течение 4 лет с оценкой вероятной ремиссии ДТЗ. Результаты представлены на рисунке 3.
Рис. 3. Оценка ремиссии диффузного токсического зоба с учетом D-критерия: группа 1 — D-критерий меньше 3,26, группа 2 — D-критерий равен 3,26 и более
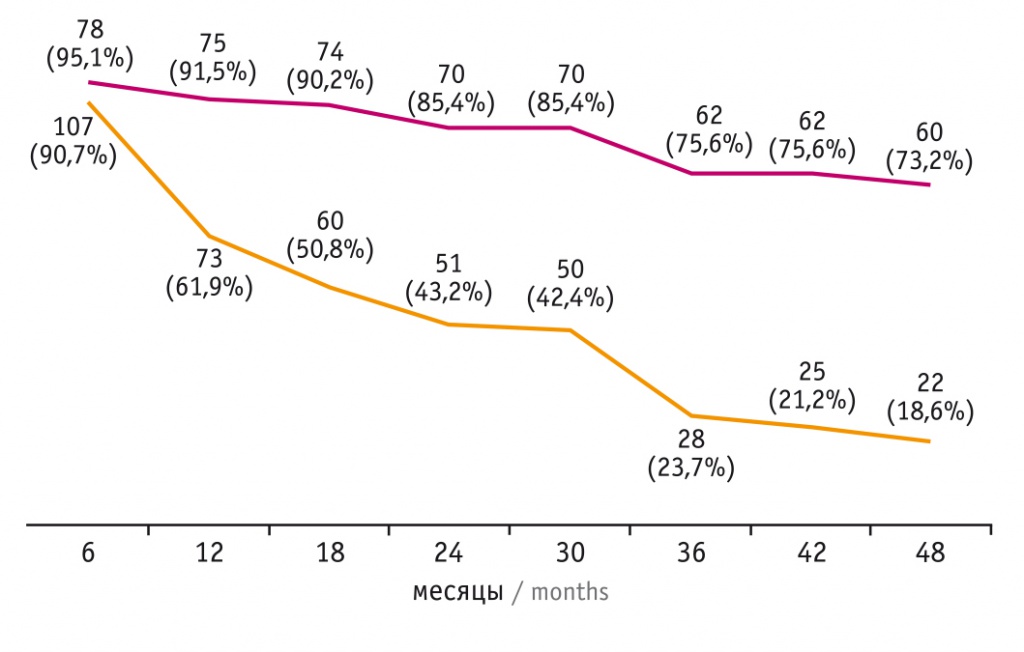
Как видно из представленных данных, в группе 1 число больных с ремиссией заболевания оставалось высоким и через 4 года (после отмены антитиреоидной терапии) составило 73,2%. В группе 2 количество участников с ремиссией ДТЗ значимо снижалось каждые полгода и через 4 года было равным 18,6% (р < 0,001).
Созданная расчетная модель оценки вероятности ремиссии ДТЗ обладает высокой чувствительностью (86%) и специфичностью (84%) и представляется важной для планирования лечебной тактики на момент постановки диагноза. Вероятно, пациентам с изначально неблагоприятным прогнозом целесообразно рекомендовать радикальные способы лечения (экстирпацию ЩЖ, радиойодтерапию) после устранения симптомов ТТ.
Пациентам с наиболее вероятной ремиссией заболевания рекомендовано наблюдение у эндокринолога на фоне проведения стандартной антитиреоидной терапии. Лечебная тактика в группе больных ДТЗ с рецидивом при изначально благоприятном прогнозе требует дальнейшего уточнения. Возможно, им требуется длительный прием тиреостатических препаратов в поддерживающих дозах.
ЗАКЛЮЧЕНИЕ
Разработанная шкала оценки вероятности ремиссии диффузного токсического зоба обладает высокой чувствительностью (86%) и специфичностью (84%) и позволяет прогнозировать течение заболевания в момент постановки диагноза и оптимизировать лечебную тактику.
Поступила: 21.01.2020
Принята к публикации: 19.02.2020







