В последние десятилетия отмечен неуклонный рост распространенности заболеваний щитовидной железы (ЩЖ), в том числе рака щитовидной железы (РЩЖ). Рост заболеваемости РЩЖ зарегистрирован не только среди взрослых, но и среди детей. В настоящее время выделяют несколько факторов, способствующих канцерогенезу:
-
неблагоприятная экологическая обстановка;
-
увеличение количества медицинских обследований с использованием ионизирующего излучения (КТ, рентгенография, сцинтиграфия);
-
распространение лучевых методов лечения;
-
значительное увеличение общего загрязнения окружающей среды токсичными веществами, имеющими канцерогенные свойства.
Кроме того, изменение образа жизни людей и эпидемия ожирения среди населения повышают риски развития всех видов онкологической патологии. Рост заболеваемости РЩЖ связан преимущественно с увеличением доли высокодифференцированного папиллярного РЩЖ, прогноз при котором традиционно считают наиболее благоприятным. Однако, несмотря на раннюю диагностику и совершенствование методов лечения, смертность при этом заболевании остается неизменной на протяжении многих десятилетий, в то время как при других формах рака (раке молочной железы, колоректальном раке) отмечена тенденция к снижению смертности.
Цель обзора: рассмотреть причины роста заболеваемости РЩЖ, оценить современные ультразвуковые и прогностические модели стратификации его риска.
Широкое распространение узловых образований среди населения земного шара, этнические и региональные особенности патологических изменений (йодный дефицит, радиационное загрязнение, пищевые привычки и т. д.) затрудняют дифференциальную диагностику доброкачественных и злокачественных форм заболевания. Несмотря на значительный прогресс методов визуализации узловых образований ЩЖ (УЗИ, соноэластографии, КТ и МРТ), сохраняются трудности в интерпретации результатов исследований и в принятии решений о тактике ведения пациентов. В настоящее время разработано множество документов, регламентирующих алгоритмы диагностики и лечения узловых образований, однако отсутствует единая стратегия ведения пациентов, особенно при подозрении на злокачественный процесс при отсутствии цитологической верификации РЩЖ [3]. Литературные данные указывают на гипердиагностику узловых образований ЩЖ и связанное с ней большое количество необоснованных хирургических вмешательств. Исследования последних лет направлены на создание прогностической модели, наиболее точно отражающей риск злокачественности у каждого пациента. Клинические и эхографические особенности злокачественных опухолей исследованы в различных популяциях, но из-за разницы в эпидемиологии, факторах риска и йодной обеспеченности эти модели следует определить для каждого отдельного региона.
РАСПРОСТРАНЕННОСТЬ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ
РЩЖ признан самым распространенным онкологическим заболеванием эндокринной системы и составляет приблизительно 1,0–1,5% всех вновь выявленных случаев рака. В течение последних трех десятилетий в мире отмечают неуклонный рост заболеваемости РЩЖ. По данным статистики, РЩЖ признан пятой по частоте формой рака у женщин [11]; доля РЩЖ в структуре заболеваемости злокачественными новообразованиями среди женского населения РФ в 2014 г. составила 2,8%. Показатели заболеваемости населения России злокачественными новообразованиями в 2004–2014 гг. выросли на 18,70%, среднегодовой темп роста составил 1,68%. Привлекает внимание значительный прирост частоты встречаемости РЩЖ среди мужского населения — 36,52%, в то время как среди женщин прирост составил 15,50%. Наибольший удельный вес РЩЖ приходится на возрастные группы 15–19 лет — 9,25%, 20–24 года — 9,48%, 25–29 лет — 9,25%, 30–34 года — 7,53% [2]. Рост заболеваемости связан с увеличением доли папиллярного РЩЖ, в то время как для других гистологических типов рака (медуллярного и анапластического) не выявлено каких-либо изменений. Подавляющее большинство обнаруженных новообразований представлено микрокарциномами размерами менее 2 см.
Несмотря на географические вариации распространенности РЩЖ, огромное влияние на этот показатель оказывает доступность диагностических ресурсов и в первую очередь УЗИ. Неуклонный рост заболеваемости РЩЖ обусловлен прежде всего ранним выявлением болезни: эпидемиологические данные свидетельствуют о смещении клинического спектра опухолей в сторону группы низкого клинического риска. Широкое применение УЗИ ЩЖ приводит к выявлению большого количества небольших узлов ЩЖ, не определяемых при клиническом обследовании. У большинства больных узловые образования обнаруживают случайно при выполнении диагностических процедур по поводу других заболеваний, например при цветном дуплексном сканировании брахиоцефальных сосудов [10]. Однако есть аргументы в пользу истинного увеличения заболеваемости. Если улучшение диагностики служит единственной причиной ее роста, то обнаружение малых опухолей на ранних стадиях должно сопровождаться прогрессирующим снижением выявляемости более крупных образований и поздних стадий онкологической патологии. Однако зафиксировано увеличение числа случаев РЩЖ на всех стадиях. Кроме того, выявляемость возросла преимущественно для папиллярного рака, в то время как улучшение диагностики должно было отразиться на всех гистологических типах. Наконец, при улучшении выявляемости следовало ожидать роста заболеваемости во всех возрастных и гендерных категориях. Тем не менее заболеваемость среди женщин увеличилась больше, чем среди мужчин (158% против 106% соответственно).
ФАКТОРЫ, СПОСОБСТВУЮЩИЕ РОСТУ ЗАБОЛЕВАЕМОСТИ РАКОМ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
Ионизирующее излучение — хорошо изученный фактор риска развития всех видов рака. ЩЖ более подвержена излучению в связи с поверхностным расположением и способностью накапливать йод. В течение последних 25 лет индивидуальная доза облучения в США удвоилась: с 3 мЗВ/год в 1980 г. до 6 мЗв/год в 2006 г. Эти изменения в основном связаны с проведением диагностических медицинских и стоматологических процедур [13]. КТ составляет всего 15% всех радиологических процедур в США, однако на ее долю приходится более 50% дозы облучения, поглощенной пациентом. Поскольку треть всех КТ выполняют в области головы/шеи, то ЩЖ подвергается серьезному воздействию радиации. Кроме того, использование йодсодержащих контрастных препаратов увеличивает влияние радиации из-за блокады фотонов йодом и увеличения энергии локального излучения.
Другим специфическим источником облучения ЩЖ служит I131, применяемый с диагностической и лечебной целью. Сканирование ЩЖ с I131, в 1973 г. достигавшее 13% всех обследований в радиологии, в настоящее время не превышает 1%, так как заменено сканированием с технецием (99mTc) — Технетрилом. Однако сегодня I131 чаще используют с терапевтической целью у пациентов с гипертиреозом. Кроме того, дополнительным источником облучения ЩЖ выступает лучевая терапия злокачественных новообразований головы и шеи. Так, в когорте детей, перенесших онкологическое заболевание, 7,5% всех вторичных злокачественных новообразований составляет РЩЖ. Таким образом, одной из вероятных причин роста заболеваемости РЩЖ служит увеличение воздействия радиации.
Другим независимым прогностическим фактором риска злокачественных новообразований у пациентов с узловым зобом может быть уровень тиреотропного гормона (ТТГ) [9]. ТТГ является фактором роста тиреоцитов, стимулируя пролиферацию клеток ЩЖ за счет цАМФ-опосредованных путей и способствуя их злокачественному перерождению. Дефицит йода приводит к компенсаторному повышению уровня ТТГ. Потребление йода при этом влияет на распределение гистологических типов РЩЖ, а не на общую заболеваемость. Недостаточное потребление йода приводит к преобладанию фолликулярных опухолей и уменьшению количества случаев папиллярного рака. При внедрении йодной профилактики в таких регионах средний уровень ТТГ уменьшается, а соотношение случаев папиллярного и фолликулярного раков увеличивается. Возможно, такой переход от фолликулярного к папиллярному гистологическому типу связан с частотой BRAF (V600E) мутации. BRAF-позитивный РЩЖ статистически значимо чаще встречается в регионах Китая с высоким потреблением йода, чем в контрольных регионах [5]. Роль уровня ТТГ в прогрессировании РЩЖ подтверждают снижение частоты рецидивов и повышение выживаемости больных РЩЖ, получающих супрессивную терапию левотироксином натрия. Уровень ТТГ положительно коррелирует со временем диагностики РЩЖ. И наоборот, риск развития РЩЖ ниже у пациентов с гипертиреозом на фоне функциональной автономии узловых образований. Аутоиммунный тиреоидит также может влиять на риск развития РЩЖ не только за счет манифестации гипотиреоза и повышения уровня ТТГ, но и вследствие гиперпродукции провоспалительных цитокинов и активации окислительного стресса.
Для некоторых злокачественных новообразований показана значительная корреляция риска с ожирением [4]. У пациентов, страдающих избыточной массой тела, вероятность развития РЩЖ также повышена. По литературным данным, инсулинорезистентность и гиперинсулинемия могут быть факторами риска развития РЩЖ. Инсулин регулирует экспрессию генов ЩЖ, стимулирует пролиферацию, дифференцировку и трансформацию тиреоцитов. Инсулинорезистентность отмечают у 50% пациентов с РЩЖ и только у 10% больных контрольной группы. Высокий ИМТ на момент установления диагноза ассоциирован с риском РЩЖ у женщин. Таким образом, пандемия ожирения, возможно, также способствует увеличению распространенности РЩЖ, но конкретные механизмы этого явления в настоящий момент неизвестны.
Несмотря на рост заболеваемости, смертность от РЩЖ остается стабильной и составляет около 0,5 случаев на 100 000 человек в год [11]. В отличие от других форм рака (в том числе рака молочной железы, толстой и прямой кишки, легких и предстательной железы), смертность от которых в последние два десятилетия уменьшается, коэффициент смертности от РЩЖ не только не уменьшается, но даже имеет тенденцию к увеличению. Имеющиеся данные указывают на значительное увеличение смертности от РЩЖ (в первую очередь, у мужчин): до +0,8% в год. Учитывая медленное прогрессирование РЩЖ, резкое увеличение заболеваемости может повлиять на смертность спустя много лет.
Повышение распространенности РЩЖ имеет как медицинское, так и социально-экономическое значение. Гипердиагностика с выявлением состояния, не влияющего на здоровье и выживаемость пациента, не только не приносит пользы, но и чревата возможными осложнениями (послеоперационным гипопаратиреозом, повреждением возвратного нерва). Кроме того, экономическая стоимость последствий гипердиагностики варьирует в широком диапазоне, в зависимости от обследований, сложности вмешательств и последующего наблюдения. Для уменьшения расходов выдвинуто множество предложений, например не пунктировать узлы менее 10 мм, наблюдать за микрокарциномами [1]. По данным исследований, затраты на лечение и последующее наблюдение можно снизить при опухолях с низкой степенью риска. Однако стратификация риска, основанная на клинических характеристиках, оставляет некоторую неопределенность не только по поводу рецидива заболевания, но и в отношении возможного метастазирования. В действительности экстракапсулярную инвазию, метастазировние в лимфатические узлы и экстратиреоидное распространение опухоли выявляют в 15–30% случаев микрокарцином. Отдаленные метастазы присутствуют в 1–3% случаев. Эти признаки взаимосвязаны и служат факторами риска рецидива и летального исхода РЖЩ. Следует также учесть, что подавляющие большинство пациентов с микрокарциномами (78%) при предложении наблюдения без хирургического вмешательства выбирают немедленное оперативное лечение.
Таким образом, для снижения количества ненужных вмешательств первоочередную роль играют понимание причин повышения заболеваемости РЩЖ и стратификация риска. Прогнозирование риска РЩЖ у больных с узловыми образованиями ЩЖ основано на клинических, биохимических и радиологических факторах. В настоящее время большинство исследований сосредоточено на изучении отдельных факторов риска, и лишь некоторые учитывают их сочетание. Надежная прогностическая модель, включающая комбинацию доступных клинических, лабораторных и радиологических признаков, должна быть достаточно чувствительной для применения на практике в процессе принятия врачом решения о дальнейшей тактике ведения пациента с узловым зобом.
ПРОГНОСТИЧЕСКИЕ МОДЕЛИ И СИСТЕМА TI-RADS
Стратификация риска — оценка риска развития заболевания у пациента, помогающая врачу принять решение и определяющая его рекомендации и дальнейшую тактику. Широкое применение УЗИ и его относительно низкая стоимость определили ключевую роль этого метода в диагностике РЩЖ. Основная цель УЗИ, наряду с установлением нозологического заключения (коллоидный узел, киста и т. д.) и детализацией характера изменений, состоит в определении стратегии ведения пациента, времени динамического наблюдения, решении вопроса о тонкоигольной аспирационной биопсии (ТАБ) узла и последующей терапии.
Используя принципы классификации ультразвуковых и рентгенологических изображений молочных желез Breast Imaging Reporting and Data System, разработанной Американской ассоциацией радиологов, Horvarth Е. и соавт. в 2009 г. создали систему интерпретации и протоколирования визуализации очаговой патологии щитовидной железы Thyroid Imaging Reporting and Data System (TI-RADS) [6]. Предпосылками ее создания стали быстрый рост заболеваемости; стремительное улучшение выявляемости очаговой патологии ЩЖ (совершенствование диагностических методик и технологий визуализации, большое количество ошибок на всех этапах диагностического поиска; субъективность критериев отбора пациентов для проведения ТАБ; отсутствие преемственности специалистов, неверная или неполная интерпретация данных УЗИ ЩЖ как непосредственно врачами-диагностами, так и эндокринологами и хирургами; отсутствие стандартного подхода. В 2011 г. J. Y. Kwak и соавт. модифицировали систему TI-RADS [7]. Система TI-RADS — классификация определенных признаков, выявляемых при УЗИ ЩЖ, по степени риска злокачественного образования, система интерпретации и протоколирования очаговой патологии ЩЖ для разработки тактики ведения пациента. Использование шкалы позволяет значительно улучшить интерпретацию выявляемой патологии ЩЖ и стандартизировать лечебно-диагностический алгоритм [15]. В настоящее время в России систему TI-RADS используют редко.
Анализ ультразвукового изображения ЩЖ по шкале TI-RADS предполагает выделение нескольких оценочных категорий [12] (табл.).
Таблица
Thyroid Imaging Reporting and Data System (TI-RADS): ультразвуковая классификация узлов щитовидной железы
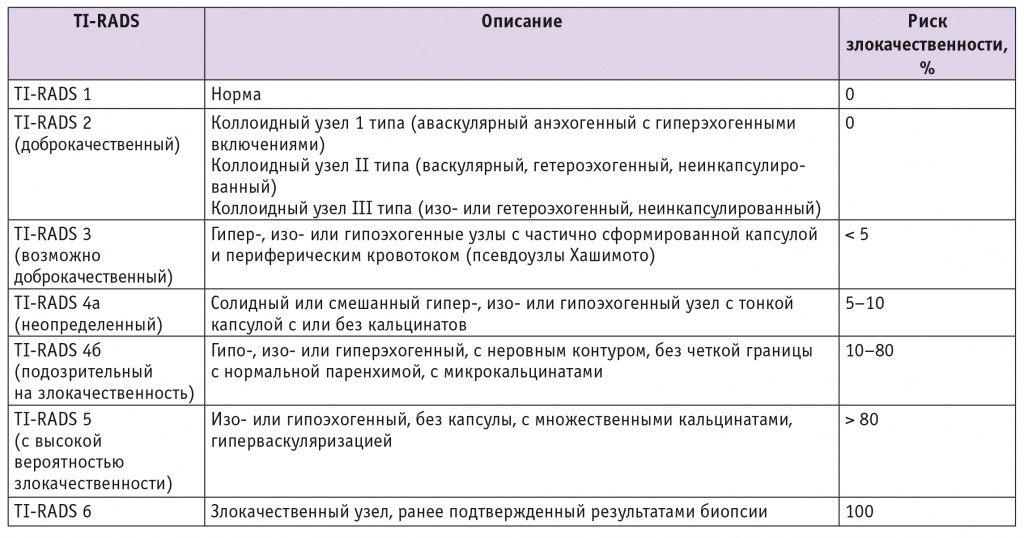
Категория 1 TI-RADS (нормальная щитовидная железа)
Различные варианты нормы ЩЖ по данным комплексной эхографии, исключающие злокачественность. Объем и структура ЩЖ соответствует возрасту, конституции и физиологическому состоянию пациента. Отсутствуют как прямые, так и косвенные признаки патологических процессов диффузного и очагового характера. Рекомендации: динамическое плановое обследование соответственно возрасту; биопсия не предусмотрена.
Категория 2 TI-RADS (доброкачественные образования)
Доброкачественные изменения ЩЖ:
-
простые кисты;
-
коллоидные узлы;
-
диффузная форма аутоиммунного тиреоидита (АИТ);
-
изолированные макрокальцинаты;
-
изоэхогенные узлы.
Состояния — стабильные изменения после перенесенных хирургических операций на ЩЖ. Рекомендации: контрольное обследование каждые 12 мес; биопсия не предусмотрена.
Категория 3 TI-RADS (вероятно доброкачественные образования)
Доброкачественные изменения ЩЖ с вероятностью рака не более 2–5%:
-
коллоидные узлы с минимальными признаками атипии;
-
диффузная форма АИТ с узлообразованием;
-
атипичные или сложные кисты, жидкостные образования с признаками воспаления.
Характеристики узла: овальная форма, четкие границы, изоэхогенная и гиперэхогенная структура. Рекомендации: наблюдение каждые 6–12 мес. По показаниям или по желанию пациента возможна прицельная ТАБ узла.
Категория часто является переходной, и если в результате динамического УЗИ возникает подозрение на злокачественные процесс, то случай переводят в категорию 4. Если при контрольном УЗИ отмечена положительная динамика или стабильная ультразвуковая картина, то случай переводят в категорию 2. Если по результатам двукратных ТАБ узел доброкачественный, то дальнейший ультразвуковой контроль онкологического риска не показан.
К сомнительным также относят узлы (очаговые изменения) ЩЖ, которые в короткие сроки (6–12 мес) значительно изменили:
-
размеры (при увеличении объема более чем на 30–50%);
-
ультразвуковые характеристики в серой шкале (кальцинаты, жидкостный компонент, деформация капсулы и т. д.);
-
характеристики кровотока в цветовом картировании (появление неоангиогенеза);
-
цветовой паттерн в режиме компрессионной эластографии;
-
показатели эластичности при эластографии более чем на 30–50% в сторону повышения.
Кроме того, эта категория включает узлы ЩЖ различной эхогенности, структуры и васкуляризации при сочетании (появлении) с патологически измененными лимфатическими узлами шеи (особенно яремными), не выявляемыми при эхографии ранее.
Категория 4 TI-RADS (подозрение на злокачественное образование)
Выявленные изменения указывают на риск РЩЖ, составляющий 5–80%. Выделяют низкую, среднюю (умеренную) и высокую степень вероятности рака. К этой группе относят образования с основными ультразвуковыми признаками злокачественности (1–4 признаками):
-
шириной, превышающей высоту;
-
нечеткими, неровными границами;
-
выраженной гипоэхогенностью;
-
микрокальцинатами;
-
высокой жесткостью при эластосонографии.
В эту группу включены:
-
коллоидные узлы с признаками злокачественности разной степени выраженности;
-
диффузная форма АИТ с узлообразованием;
-
атипичные или сложные кисты.
Рекомендации: ТАБ узлов под контролем УЗИ. При получении результатов цитологического исследования пунктатов, подтверждающих доброкачественный или вероятно доброкачественный характер образования, его относят к категории TI-RADS 2 или 3 соответственно, предполагая тщательный ультразвуковой мониторинг через 6 мес. При цитологическом подтверждении РЩЖ решают вопрос об оперативном лечении, при повторных УЗИ в предоперационном периоде образование переводят в категорию 6.
Категория 5 TI-RADS (образование с высокой вероятностью рака щитовидной железы)
К данной категории относят образования ЩЖ с высокой вероятностью злокачественности — более 80% (более 5 ультразвуковых признаков). Рекомендации: обязательна ТАБ под контролем УЗИ.
Категория 6 TI-RADS (цитологически подтвержденное злокачественное образование щитовидной железы)
В категорию 6 входит морфологически подтвержденный РЩЖ.
Основное преимущество системы TI-RADS перед ранее используемыми алгоритмами состоит в ее простой и удобной схеме, а также высокой чувствительности, доказанной крупномасштабными исследованиями. Применение шкалы обеспечивает преемственность оптимальных лечебно-диагностических мероприятий в случае динамического наблюдения пациентов у разных специалистов, в разных лечебных учреждениях. Кроме того, к несомненным достоинствам системы TI-RADS относится хорошая корреляция с принятой в 2010 г. международной цитологической классификацией патологии ЩЖ (The Bethesda System for Reporting Thyroid Cytopatology) [8]. Недостатком системы можно считать субъективность оценки, поскольку результаты УЗИ зависят от оператора. Кроме того, не исключены ложноположительные и ложноотрицательные результаты УЗИ [12]. По мнению разных исследователей, пристальное внимание необходимо уделить категориям TI-RADS 3 и 4а. Категория TI-RADS 3 является, по сути, переходной. При быстром росте узла или изменении кровотока врач должен принять решение о проведении ТАБ узла, который формально принадлежит к группе вероятно доброкачественных образований. Категория TI-RADS 4а включает около 27% всех узлов. Индивидуальный риск злокачественного новообразования низкий, в пределах 1–6%, однако эти узлы до сих пор составляют около 20% всех карцином, выявляемых при УЗИ. Это говорит о противоречии между низким индивидуальным и общим риском исследуемой популяции. Игнорирование таких узлов может привести к ошибочным диагнозам 20% карцином, что неприемлемо. В связи с этим будущие исследования необходимо сосредоточить на узлах категории 4а для определения дополнительных признаков, уточняющих риск злокачественных новообразований внутри категории.
J. Witczak и соавт. предложили прогностическую модель, основанную на использовании независимых предикторов злокачественности, включающих уровень ТТГ, возраст, пол пациента и ультразвуковые характеристики узлов ЩЖ (неровные границы, микрокальцинты, эхогенность) [14]. Каждому показателю присваивали балл: ТТГ > 2,5 мкМЕ/мл = 1 балл; возрастная группа < 30 лет и > 60 лет = 1 балл; нечеткие неровные границы = 2 балла; смешанная эхогенность = 1 балл; гипоэхогенность = 2 балла. Для узлов с суммой баллов более 4 определена высокая чувствительность (86,9%), а более 7 баллов — высокая специфичность (94,7%) в отношении риска злокачественности образований. По данным J. Witczak и соавт., из 70 пациентов с неопределенными результатами цитологического исследования в 40 (57%) случаях оценки не превышали 2 балла, и только 2 (5%) пациентам установлен окончательный диагноз РЩЖ, 21 (30%) пациенту с суммой баллов 1 в итоге поставлен диагноз доброкачественного образования. Таким образом, у пациентов с неопределенными результатами цитологического исследования отрицательная прогностическая ценность ≤ 2 баллов составила 95–100%.
Использование балльной системы «2–10» помогает стратифицировать риск злокачественных новообразований у больных с узловым зобом. Эта модель особенно удобна у пациентов с неопределенными результатами цитологического исследования или в условиях, где инвазивные методы менее предпочтительны, например у пожилых пациентов или беременных. В таком случае более высокие баллы будут диктовать необходимость более агрессивной тактики, в то время как для пациентов с низкой суммой баллов возможна выжидательно-наблюдательная тактика.
ЗАКЛЮЧЕНИЕ
Усилия специалистов, участвующих в ведении пациентов с заболеваниями щитовидной железы (ЩЖ), направлены на выявление причин роста заболеваемости раком, улучшение диагностических методик, позволяющих выявлять злокачественные образования на ранних стадиях, на создание систем стратификации риска с высокой чувствительностью и специфичностью, прогностической ценностью положительного и отрицательного результата. Использование классификации Thyroid Imaging Reporting and Data System или комплексной прогностической модели с оценкой биохимических, клинических и ультразвуковых факторов риска помогает улучшить выявляемость злокачественных новообразований, уменьшить количество необоснованных инвазивных диагностических процедур и оперативных вмешательств, снизить экономические затраты, обеспечить преемственность между врачами различных специальностей, стандартизировать подходы к тактике ведения пациентов с неопределенными результатами цитологического исследования.







