ВВЕДЕНИЕ
Болезнь Грейвса — органоспецифическое аутоиммунное заболевание, которое имеет мультифакториальную этиологию, включающую связь аллелей главного комплекса гистосовместимости II класса с нарушением толерантности к антигенам щитовидной железы, которая реализуется под воздействием определенных эпигенетических факторов в виде патологического иммунного ответа с развитием лимфатической инфильтрации тиреоидной паренхимы и продукции аутоантител к различным компонентам тиреоцитов[1]. Главную роль в инициации и развитии аутоиммунного процесса при болезни Грейвса играют специфические иммуноглобулины (Ig) класса G — антитела к рецептору тиреотропного гормона (рТТГ), которые секретируются аутореактивными B-лимфоцитами и могут длительное время циркулировать в периферической крови пациентов с болезнью Грейвса даже после хирургического и радионуклидного лечения[2, 3].
Традиционные методы лечения пациентов с болезнью Грейвса, в т. ч. антитиреоидные препараты, хирургическое вмешательство и радиоактивный йод (131I), практически не изменились за последние 70 лет[4]. Долго считалось, что хирургическое и радионуклидное лечение являются радикальными методами, так как устраняют главную интратиреоидную антигенную детерминанту заболевания — рТТГ — и вызывают стойкий гипотиреоз[5, 6].
Однако, по современным представлениям, гипотиреоз, развившийся после тиреоидэктомии или лечения 131I у пациентов с болезнью Грейвса, не только приводит к необходимости пожизненной заместительной терапии гормонами щитовидной железы, но и не восстанавливает нарушенную супрессорную функцию регуляторных Т-лимфоцитов (Treg), дефект которых лежит в основе иммунологической толерантности при гипертиреозе Грейвса[7].
В последнее время все больше исследователей уделяют внимание Treg, их супрессорной функции в отношении антиген-специфической активности хелперных Т-клеток (Th), а также поиску дефектных субпопуляций B-лимфоцитов после использования различных методов лечения заболевания[8, 9]. В то же время остаются неизученными состояние дефекта Treg и связанные с ним патологические субпопуляции B-клеток у пациентов с болезнью Грейвса после устранения органа-мишени и снижения антигенной нагрузки на иммунную систему больных.
Идентификация дефектных Treg и В-клеток в крови людей с болезнью Грейвса после тиреоидэктомии поможет создать специфический, целенаправленный подход, дающий новую возможность достижения иммунологической ремиссии заболевания[10].
Цель исследования — изучить уровни Treg и B-клеток в периферической крови у пациенток с болезнью Грейвса в динамике после тиреоидэктомии.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено одноцентровое наблюдательное проспективное когортное открытое контролируемое исследование с участием пациенток с лабораторно подтвержденной болезнью Грейвса. Исследование выполнено на клинических базах ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России — в эндокринологическом центре КГБУЗ «Краевая клиническая больница» (заведующий — д. м. н., профессор Догадин С.А.) и в лаборатории молекулярно-клеточной физиологии и патологии ФГБНУ «ФИЦ «Красноярский научный центр СО РАН» обособленное подразделение «НИИ медицинских проблем Севера» (заведующий — д. м. н., профессор Савченко А.А.).
В исследование включены 96 пациенток с болезнью Грейвса, средний возраст — 42,86 ± 10,81 года. Наблюдение за ними осуществлялось с 24 мая 2016 года по 25 марта 2021 года.
Критерии включения: женский пол, возраст от 18 до 65 лет, отсутствие отягощенного анамнеза по заболеваниям щитовидной железы у самих больных и у кровных родственников, отсутствие структурных изменений, по данным ультразвукового исследования (УЗИ) щитовидной железы.
Критерии исключения: узловой/многоузловой токсический зоб, беременность, лактация, эндокринная офтальмопатия, наличие инфекционных и аллергических заболеваний, новообразования, системные заболевания соединительной ткани, другие заболевания органов эндокринной системы, острые респираторные и вирусные инфекции, сердечная недостаточность, введение профилактических прививок в течение двух месяцев, предшествующих иммунологическому и гормональному анализу.
Контрольную группу составили 85 здоровых женщин аналогичного возраста без отягощенного анамнеза по заболеваниям щитовидной железы, а также по аутоиммунным заболеваниям у них самих и кровных родственников, без структурных изменений, по данным УЗИ щитовидной железы, на момент включения в исследование.
Верификация диагноза, консервативное лечение тиамазолом, отбор пациенток на оперативное лечение проводились, согласно национальным клиническим рекомендациям1. Все участницы наблюдались в исследовательском центре с момента дебюта заболевания и получали медикаментозное лечение тиамазолом по стандартной схеме с постепенным переходом на поддерживающую дозу тиреостатика.
Клинико-гормональное и иммунологическое обследование проводилось на фоне стойкого медикаментозного эутиреоза до операции, а также через 1, 3 и 6 месяцев после оперативного лечения.
УЗИ щитовидной железы делали при помощи аппарата Philips iU22 xMatrix (США) с линейным датчиком 7,5 МГц. Увеличенным считался объем щитовидной железы, превышающий 18 мл, рассчитанный по формуле J. Brunn (1981).
Оперативное лечение производилось на базе II хирургического отделения КГБУЗ «Краевая клиническая больница» (хирург — эндокринолог Маньковский В.А.), объем операции — эпифасциальная тиреоидэктомия. Сразу после операции всем пациенткам назначалась заместительная гормональная терапия левотироксином натрия.
Содержание тиреоидных гормонов определяли методом хемилюминесцентного иммуноанализа на автоматическом анализаторе Architect i1000sr (Abbott Diagnostics, США), референсные показатели: для ТТГ — 0,4–4,0 мЕд/л, свободного тироксина (свТ4) — 9,01–19,05 пмоль/л, свободного трийодтиронина (свТ3) — 2,14–6,42 пмоль/л. Уровень антител к рТТГ оценивался методом иммуноферментного анализа при помощи стандартного набора Medizym T.R.A. (Medipan Diagnostica, Германия), рекомендованная точка разделения — 1,5 мЕд/л, серая зона — 1–1,5 мЕд/л.
Treg и В-клетки в периферической крови исследовали методом проточной цитометрии с использованием прямой иммунофлуоресценции и моноклональных антител (Beckman Coulter, США), меченных FITC (fluorescein-isothiocyanate), PE или RD1 (phycoerythrin), ECD (phycoerythrin-TexasRed-X), PC5 (phycoerythrin-cyanin 5), PC7 (phycoerythrin-cyanin 7) и APC (allophycocyanin) в следующих панелях: CD45-FITC/CD127-PE/CD3-ECD/CD25-PC5/CD4-PC7/CD8-APC и CD5-FITC/CD19-ECD/CD45-PC5/CD27-PC7. Распределение антител по каналам флуоресценции проводили в соответствии с принципами формирования панелей для многоцветных цитофлуориметрических исследований[11].
Пробоподготовку осуществляли по стандартной методике[12]. Анализ окрашенных клеток делали на проточном цитофлуориметре Navios (Beckman Coulter, США) Красноярского регионального центра коллективного пользования ФИЦ КНЦ СО РАН. В каждой пробе анализировали не менее 50 000 лимфоцитов.
Статистический анализ производили в пакете прикладных программ Statistica 8.0 (StatSoftInc., 2007). Полученные данные описывали в виде медианы (Ме) и интерквартильного размаха (1-й и 3-й квартили, Q1–Q3), а также в виде средних арифметических значений и стандартных отклонений от среднего (М ± SD) в случае нормального распределения показателей.
Для определения характера распределения полученных данных использовали критерий Шапиро — Уилка. Достоверность различий между исследуемыми показателями оценивали по непараметрическому критерию Манна — Уитни (Mann — Whitney U-test). При сравнении двух связанных групп применяли критерий Вилкоксона (Wilcoxon matched pairs test). Для оценки значимости различий частот в зависимых группах использовался критерий χ2 МакНемара. Различия считали статистически значимыми при p < 0,05.
Все исследования выполнены с информированного согласия испытуемых и в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. Протокол исследования рассмотрен и одобрен локальными этическими комитетами ФГБОУ ВО «Красноярский государственный медицинский университет имени профессора В.Ф. Войно-Ясенецкого» Минздрава России (протокол № 72/2016 от 09.11.2016) и КГБУЗ «Краевая клиническая больница» (протокол № 124 от 07.04.2016).
РЕЗУЛЬТАТЫ
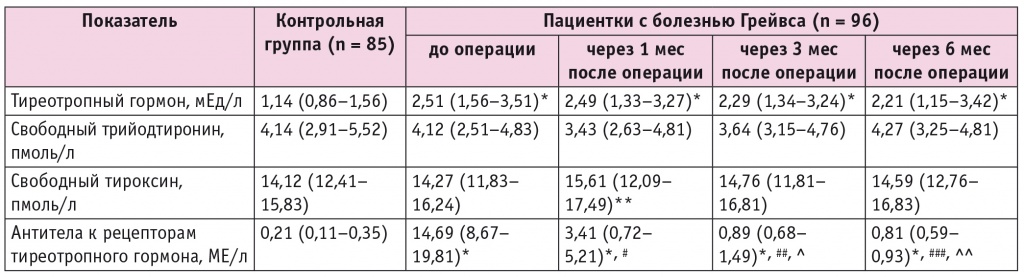
Медиана продолжительности приема тиамазола у обследуемых пациенток с болезнью Грейвса перед операцией составила 9 (7–11) месяцев. На момент оперативного лечения все они находились в состоянии медикаментозного эутиреоза, но при сохранении высокого титра антител к рТТГ (табл. 1).
Таблица 1
Клинико-гормональная характеристика пациенток с болезнью Грейвса в динамике после тиреоидэктомии, Ме (Q1–Q3)
Примечания.
1. Отличия от контрольной группы статистически значимы: (*) — р < 0,001; (**) — < 0,01.
2. Отличия от показателей до операции статистически значимы: (#) — p = 0,011; (##) — p = 0,013; (###) — p < 0,001.
3. Отличия от показателей через 1 мес после операции статистически значимы: (^) — р = 0,01; (^^) — р = 0,012.
Медиана титра антител к рТТГ на момент манифестации заболевания составляла 13,42 (10,42–18,27) МЕ/л и статистически значимо не отличалась от значения, установленного при обследовании пациенток в состоянии медикаментозного эутиреоза до оперативного лечения. При этом у женщин с болезнью Грейвса в динамике послеоперационного периода происходило последовательное статистически значимое снижение титра антител к рТТГ.
Следует отметить, что через 6 месяцев после операции содержание антител к рТТГ в крови у больных находилось в референсном диапазоне значений, но оставалось статистически значимо выше контрольных величин.
При изучении уровней Treg (CD3+CD4+CD127LowCD25High) и B-клеток (CD19+) в периферической крови у пациенток с болезнью Грейвса в динамике после тиреоидэктомии выявлены статистически значимые изменения в зависимости от сроков наблюдения в послеоперационном периоде (табл. 2).
Таблица 2
Содержание регуляторных Т-лимфоцитов и В-клеток в крови у пациенток с болезнью Грейвса в динамике после тиреоидэктомии, Ме (Q1–Q3)
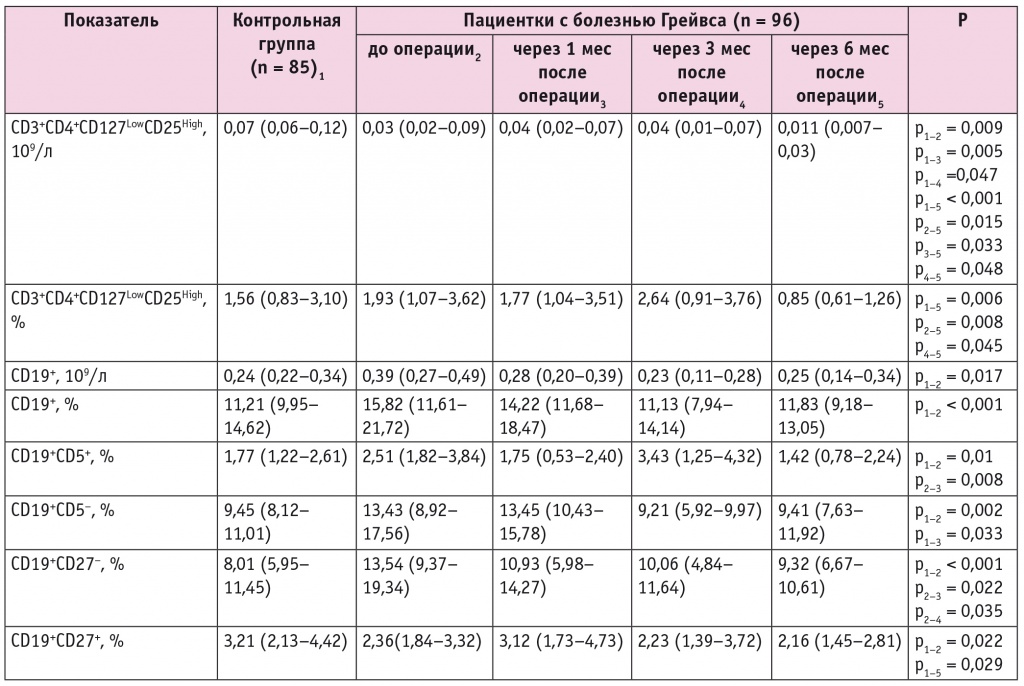
Так, если абсолютное количество Treg в крови у пациенток было ниже контрольных значений уже в дооперационном периоде и еще больше понизилось на 6-м месяце после тиреоидэктомии, то процентное содержание этих клеток стало меньше контрольных и исходных показателей только к концу периода наблюдения. Абсолютное и относительное количество CD19+-клеток в крови у пациенток с болезнью Грейвса до операции оказалось выше, чем в контрольной группе, но уже через 1–3 месяца снизилось до контрольного уровня и не изменялось до конца периода наблюдения.
В то же время процент CD19+CD5+- и CD19+CD5–-клеток у обследованных пациенток в дооперационном периоде был значительно выше, чем у женщин контрольной группы. Содержание CD19+CD5+-клеток уменьшилось уже через 1 месяц после тиреоидэктомии и сохранялось на уровне контрольных значений.
Процент CD19+CD5–-клеток через 1 месяц после операции существенно не изменился, но затем снизился до контрольных показателей. Доля CD19+CD27–-клеток у пациенток с болезнью Грейвса в дооперационном периоде была выше, чем у участниц контрольной группы, через 1 месяц после операции уменьшилась до контрольных значений и оставалась в данном диапазоне до конца наблюдения. В то же время содержание CD19+CD27+-клеток у больных до операции оказалось сниженным по сравнению со значениями контрольной группы, в период 1–3 месяцев после тиреоидэктомии соответствовало контрольным значениям, но на 6-м месяце после операции вновь понизилось.
ОБСУЖДЕНИЕ
К тиреоидным аутоантителам, имеющим решающее клиническое значение при болезни Грейвса, относятся антитела к рТТГ[13]. Несмотря на то что при оперативном лечении заболевания вместе с тиреоидной тканью удаляется и основная масса B-лимфоцитов, продуцирующих антитела к рТТГ, уровни последних могут оставаться повышенными в периферической крови достаточно долгое время после операции[14].
Исходно высокое содержание антител к рТТГ у пациенток с болезнью Грейвса свидетельствует о том, что ликвидация отрицательных влияний гипертиреоза на иммунную систему не обеспечивает восстановление системы иммунорегуляции. Кроме того, следует подчеркнуть, что выявленный повышенный титр общей фракции антител к рТТГ у пациенток с болезнью Грейвса через 6 месяцев после оперативного лечения может содержать иммуноглобулины, блокирующие стимулирующий эффект ТТГ, и тем самым принимать участие в развитии гипотиреоза[15].
Но в то же время некоторые авторы отмечают, что рецидив после субтотальной резекции щитовидной железы может быть связан с сохранением достаточного объема паренхимы, способной реагировать на стимулирующие антитела к рТТГ, и достаточного количества лимфоцитов, способных продолжать иммунную атаку[16]. Однако настоящее исследование демонстрирует, что даже после тиреоидэктомии и радикального устранения очага продукции специфичного антигена заболевания — рТТГ — сохраняется пониженный системный уровень Treg, который может определять их низкий потенциал в дальнейшей реализации супрессорной функции.
Интерес к Treg при болезни Грейвса как основной популяции клеток периферической крови, способной подавлять аутоиммунный процесс, не угасает уже многие годы[9, 17]. В частности, показано, что CD4+CD25+Foxp3+Treg являются иммуносупрессивной фракцией Th-клеток, которые снижают активность иммунной атаки к собственным антигенам при болезни Грейвса, секретируя такие иммуносупрессивные цитокины, как интерлейкин 10 и трансформирующий фактор роста β, ингибируя антиген-презентирующие клетки и супрессируя секрецию интерлейкина 2[18, 19].
Нормальное абсолютное и относительное количество Treg у пациенток с болезнью Грейвса до и в течение трехмесячного периода наблюдения после операции, вероятно, отражает долгосрочное иммуномодулирующее влияние консервативной терапии тиамазолом и ликвидацию отрицательного действия гипертиреоза на дефект Treg.
Полученные нами результаты демонстрируют, что у женщин с болезнью Грейвса уже в дооперационном периоде было снижено абсолютное количество Treg, тогда как процентное содержание клеток в этот период примерно соответствовало контрольным значениям. Можно предположить, что подобное соотношение абсолютного и относительного количества Treg характеризует повышенный уровень миграции Т-клеток при сохранении их субпопуляционного состава. При этом через 6 месяцев после тиреоидэктомии на фоне еще более выраженного понижения абсолютного количества Treg выявлялось снижение процента этих клеток. Необходимо отметить, что уменьшение содержания Treg в крови пациенток с болезнью Грейвса в этот период обследования совпадает с минимальной концентрацией аутоантител к рТТГ.
Более ранние исследования показали, что при болезни Грейвса дефект Treg проявляется не только в снижении числа этих клеток в периферической крови, но и в нарушении их функции, о чем свидетельствуют высокие уровни общей популяции Th-клеток (CD3+CD4+) и активированных Th-клеток (CD3+CD4+CD25+) у пациентов с болезнью Грейвса с длительностью медикаментозного эутиреоза более 12 месяцев[20]. Тем не менее в настоящем исследовании установлено снижение активности аутоиммунного процесса у пациенток с болезнью Грейвса при пониженном уровне Treg в крови, что, по-видимому, связано с реализацией супрессорной функции данной фракции Т-клеток после их миграции из периферического кровотока.
Известно, что В-лимфоциты играют основную роль в реализации аутоиммунных процессов в иммунопатогенезе болезни Грейвса[1, 2, 21]. У пациенток с болезнью Грейвса до операции абсолютное и относительное количество В-клеток в крови было выше, чем у женщин контрольной группы.
Данное повышение определяется за счет высоких уровней двух основных субпопуляций: В1- (CD19+CD5+) и В2-клеток (CD19+CD5–). В то же время при исследовании содержания наивных В-клеток (CD19+CD27–) и В-лимфоцитов памяти (CD19+CD27+) обнаружено, что высокий уровень общих В-лимфоцитов в дооперационном периоде у пациенток с болезнью Грейвса определялся за счет наивных В-клеток, тогда как количество В-лимфоцитов памяти было сниженным.
Уже через 1 месяц после операции (и до конца периода наблюдения) содержание общих В-лимфоцитов у обследованных больных соответствовало контрольным значениям, но при отсутствии полной нормализации субпопуляционного состава В-клеток. Так, повышение доли В2-лимфоцитов у больных сохранялось и через 1 месяц после тиреоидэктомии и только затем снизилось до контрольных значений.
В то же время процент В1-клеток у пациенток с болезнью Грейвса нормализовался уже через 1 месяц после операции и сохранялся на контрольном уровне до конца периода наблюдения. Содержание наивных В-лимфоцитов восстанавливалось на 1-м месяце наблюдения и оставалось в диапазоне контрольных значений через 6 месяцев после операции. Однако относительное количество В-клеток памяти в крови пациенток с болезнью Грейвса через 1 и 3 месяца после операции соответствовало контрольным значениям, тогда как на 6-м месяце после тиреоидэктомии вновь оказалось пониженным, как в дооперационном периоде.
Необходимо отметить, что при ряде иммунопатологических состояний именно с В1-клетками связывают инициацию и поддержание аутоиммунных процессов[22, 23]. Однако при болезни Грейвса в качестве тиреоид-стимулирующих аутоантител выступают IgG, которые синтезируются плазматическими клетками, дифференцируемыми из В2-лимфоцитов[3, 24]. В связи с этим сохранение повышенного уровня В2-клеток через 1 месяц после операции характеризует сохранность иммунных механизмов, поддерживающих активность аутоиммунного процесса. Через 3 месяца после операции количество В2-клеток нормализовалось.
Однако через 6 месяцев после тиреоидэктомии у пациенток на фоне нормализации уровней В1- и В2-клеток выявлялось снижение количества В-клеток памяти, что может быть связано как с долгосрочной активацией их миграционной способности, так и с развитием иммуносупрессивного состояния вследствие ингибирования аутоиммунного процесса.
ЗАКЛЮЧЕНИЕ
После тиреоидэктомии, в послеоперационном периоде, у пациенток с болезнью Грейвса на фоне снижения концентрации аутоантител к рТТГ в крови сохранялось низкое абсолютное и относительное количество Treg. Более того, через 6 месяцев после тиреоидэктомии содержание Treg в крови у обследованных уменьшилось по сравнению с исходным (до операции) уровнем.
Повышенное до операции количество большинства субпопуляций В-лимфоцитов у пациенток с болезнью Грейвса восстановилось уже через 3 месяца после тиреоидэктомии. Однако исходно пониженное содержание В-клеток памяти наблюдалось и через 6 месяцев после операции. В целом можно заключить, что активность аутоиммунного процесса при болезни Грейвса после тиреоидэктомии уменьшается, но при сохранении у больных в течение длительного времени (не менее 6 месяцев) регуляторных механизмов иммуносупрессивного состояния с повышением миграционной активности клеток иммунной системы.
Поступила: 07.11.2022
Принята к публикации: 03.02.2023
________
1 Клинические рекомендации по диагностике и лечению тиреотоксикоза с диффузным зобом (болезнь Грейвса), узловым/многоузловым зобом. Российская ассоциация эндокринологов; 2021. URL: https://rae-org.ru/system/files/documents/pdf/kr_versiya_3.0_fin_otredaktirovan_16.05.2021g.pdf (дата обращения — 15.04.2023).







