ВВЕДЕНИЕ
Сахарный диабет (СД) и преждевременная смертность пациентов, страдающих им, являются одними из основных проблем системы здравоохранения. По данным International Diabetes Federation, 537 млн человек, то есть каждый десятый представитель взрослого населения, страдают диабетом, преимущественно 2 типа (СД2). Несмотря на наличие множества антидиабетических лекарственных средств, которые обеспечивают стойкий контроль углеводного обмена, только в 2021 году в результате осложнений СД умерли 6,7 млн человек1. В связи с тем, что около 85% людей, страдающих СД2, имеют избыточную массу тела и нарушение жирового обмена[1], в последнее время наряду с нейтрализацией глюкозотоксичности в лечении СД все больше внимания стали уделять контролю липотоксичности.
Ингибиторы натрий-глюкозного котранспортера 2 типа (иНГЛТ-2) — единственный класс антидиабетических препаратов с доказанной эффективностью в снижении общей смертности пациентов до 32%, по результатам долгосрочного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования EMPA-REG OUTCOME 2015 года[2]. Кроме этого, при использовании иНГЛТ-2 впервые продемонстрировано снижение частоты основных сердечно-сосудистых событий MACE на 11%, частоты госпитализаций по поводу хронической сердечной недостаточности на 31%, а также частоты неблагоприятных ренальных исходов, включая диализ[3–6].
По результатам мультинационального проспективного рандомизированного двойного слепого плацебо-контролируемого исследования DECLARE-TIMI 58, у 17 160 пациентов с СД2 и установленными сердечно-сосудистыми осложнениями или множественными факторами риска их развития прием дапаглифлозина способствовал уменьшению частоты комбинированной конечной точки по общей смертности и госпитализации по поводу хронической сердечной недостаточности на 17%[7].
Однако известно, что иНГЛТ-2 имеют умеренную эффективность в отношении компенсации непосредственно углеводного обмена, они снижают уровень гликированного гемоглобина (HbA1c) в среднем на 0,5–0,8%[8]. При относительно невыраженном гликемическом эффекте иНГЛТ2 оказывают влияние на жировой обмен, что может играть важную роль в уменьшении смертности пациентов[9, 10].
Цель исследования: оценка эффективности дапаглифлозина в коррекции нарушений углеводного обмена и метаболизма жира при СД2.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена на клинической базе Российской медицинской академии непрерывного профессионального образования (в отделении эндокринологии Центральной городской клинической больницы гражданской авиации (ЦКБ ГА), г. Москва) и отдела лабораторной диагностики Научного центра неврологии, г. Москва. Исследование продолжалось с сентября 2019 г. по апрель 2023 г.
В исследование вошли 60 пациентов (24 мужчины, 36 женщин) в возрасте от 39 до 77 лет (средний возраст — 40,2 ± 8,3 года) с подтвержденным диагнозом СД2 в сочетании с ожирением (средний индекс массы тела (ИМТ) — 31,1 ± 1,3 кг/м2), госпитализированных в отделение эндокринологии ЦКБ ГА.
Как видно из данных таблицы 1, группа характеризовалась декомпенсацией углеводного обмена, дислипидемией и нарушением жирового обмена, в частности следует обратить внимание на показатель адипонектина, находящийся ближе к нижней границе нормы (у здоровых людей рекомендуемый диапазон — 5–37 мкг/мл), который является главным маркером метаболического здоровья.
Таблица 1
Клиническая характеристика пациентов
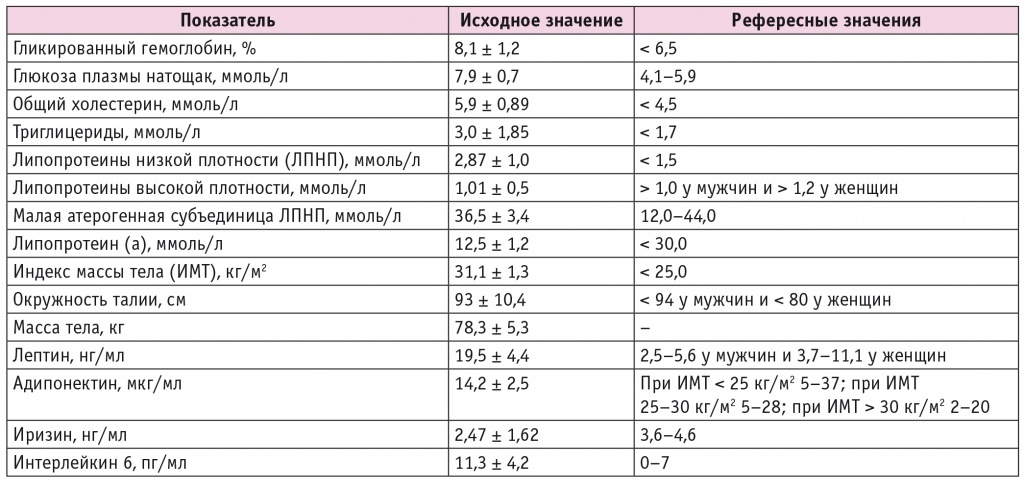
К терапии метформином больным добавили дапаглифлозин в дозе 10 мг, также пациенты обучались принципам рационального питания («Тарелка здорового питания» Гарвардской школы общественного здравоохранения[11]) в школе диабета. В течение последующих 6 месяцев наряду с параметрами углеводного обмена (глюкозы плазмы натощак, HbA1c) оценивалось состояние жирового обмена: проводились антропометрия (окружность талии, масса тела, ИМТ), биоимпедансное сканирование состава тела, а также исследование уровней адипокинов (адипонектина, лептина, иризина, интерлейкина (ИЛ) 6) и липидограммы (содержания общего холестерина, липопротеинов низкой плотности (ЛПНП), липопротеинов высокой плотности (ЛПВП), липопротеина (а), малой атерогенной субъединицы ЛПНП (sЛПНП), триглицеридов) в динамике: исходно (до добавления к терапии дапаглифлозина) и через 3 и 6 месяцев после инициации лечения этим препаратом.
Критерии включения в исследование: СД2, ожирение или избыточная масса тела (ИМТ выше 27 кг/м2), возраст старше 18 лет, отсутствие в анамнезе приема препаратов ряда иНГЛТ-2.
Критерии исключения: СД 1 типа, гестационный диабет, хроническая болезнь почек (ХБП) 4–5 ст. (скорость клубочковой фильтрации < 30 мл/мин/1,73 м2 по формуле CKD-EPI), тяжелый кетоацидоз, диабетическая кома или прекома, выраженное нарушение функции печени (повышение активности печеночных трансаминаз (аланинаминотрансферазы и/или аспартатаминотрансферазы) более 2,5 раз выше нормы) на фоне терапии, печеночная недостаточность.
Все пациенты подписали информированное согласие на участие. Проведение исследования одобрено локальным этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации (протокол от 26.11.2019 г.).
Статистическая обработка данных осуществлялась с помощью системы статистического анализа Statistica v.10. Для оценки динамики использовался критерий Вилкоксона. Различия считались статистически значимыми при р < 0,005.
РЕЗУЛЬТАТЫ
Углеводный обмен
После добавления к терапии дапаглифлозина отмечено уменьшение уровня HbA1c через 3 и 6 месяцев. Через 3 месяца показатель HbA1c снизился на 0,4% и в среднем по группе составил 7,7 ± 0,8%, а через 6 месяцев — на 0,6% от исходного, до 7,5 ± 0,7% (p = 0,08 и p = 0,093 соответственно).
Концентрация глюкозы плазмы натощак через 3 месяца понизилась до 7,3 ± 1,2 ммоль/л, через 6 месяцев — до 7,1 ± 0,7 ммоль/л. Уменьшение показателя за 6 месяцев терапии было статистически значимым и в среднем составило 0,8 ммоль/л (p < 0,05).
Жировой обмен
Как видно из данных таблицы 2, добавление к терапии дапаглифлозина привело к снижению массы тела до 76,5 ± 2,6 и 75,0 ± 2,3 кг через 3 и 6 месяцев соответственно, т. е. в среднем на 1,8 и 3,3 кг (p = 0,05 и p < 0,05 соответственно). Статистически значимая динамика ИМТ отсутствовала (p > 0,05), окружность талии пациентов уменьшилась в среднем на 4,5 см за 6 месяцев (p = 0,022).
Таблица 2
Сравнение показателей антропометрии и состава тела до и после назначения дапаглифлозина
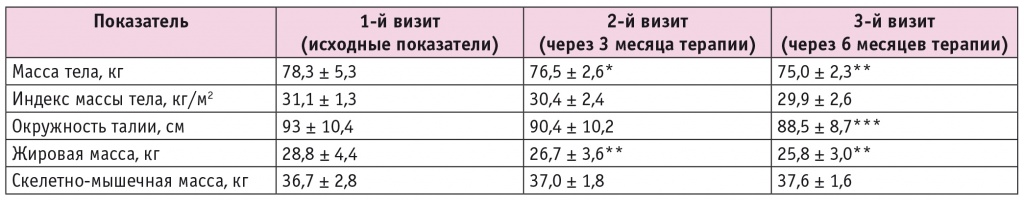
Примечание. Отличия от исходных показателей статистически значимы: (*) — р = 0,05; (**) — р < 0,05; (***) — р = 0,022.
По данным биоимпедансного сканирования состава тела, наблюдалось статистически значимое уменьшение жировой массы, в среднем через 3 и 6 месяцев — на 2,1 и 3 кг (p < 0,05 в обоих случаях). По результатам сканирования композитного состава тела также обнаружено увеличение скелетно-мышечной массы на 0,3 и 0,9 кг соответственно (p = 0,06).
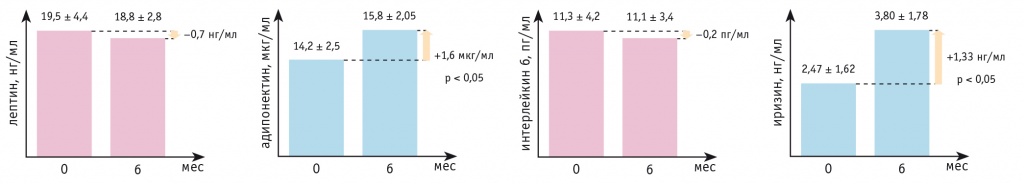
После изучения динамики стандартных показателей жирового обмена были исследованы показатели метаболизма жира. Стоит отметить, что зафиксировано статистически значимое увеличение уровней адипонектина и иризина — в среднем на 1,6 мкг/мл и 1,33 нг/мл (p < 0,05 для обоих показателей), что соответствовало положительной динамике данных антропометрии и биоимпедансного сканирования состава тела.
Снижение уровня лептина через 6 месяцев после инициации терапии дапаглифлозином составило 0,7 нг/мл (p = 0,073). Концентрация ИЛ-6 также уменьшилась статистически незначимо (p > 0,05) (рис. 1).
Рис. 1. Динамика уровней адипокинов за 6 месяцев
Липидограмма
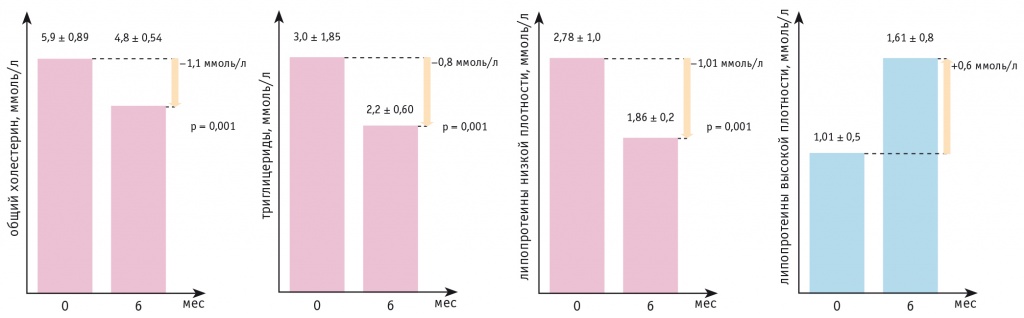
На фоне приема дапаглифлозина наблюдалась положительная динамика показателей липидного обмена (рис. 2). Так, отмечено статистически значимое снижение уровня триглицеридов — в среднем на 0,8 ммоль/л (p = 0,001), показатель через 6 месяцев наблюдения — 2,2 ± 0,6 ммоль/л. Уменьшение содержания общего холестерина и ЛПНП через 6 месяцев также было статистически значимым и составило 1,1 и 1,01 ммоль/л соответственно (p = 0,001 для обоих показателей). Статистически значимая динамика уровней ЛПВП, липопротеина (а), sЛПНП отсутствовала.
Рис. 2. Динамика показателей липидограммы через 6 месяцев
Таким образом, добавление к метформину дапаглифлозина способствовало нормализации параметров углеводного обмена, положительной динамике антропометрических показателей (снижению массы тела, ИМТ, окружности талии) и параметров биоимпедансного сканирования состава тела в сочетании с положительной динамикой уровней маркеров состояния жирового обмена, в особенности адипонектина. Для более наглядной иллюстрации вышеописанных результатов приведем клинический случай.
Клинический случай
История болезни № 2567. Пациентка Ц., 66 лет. Диагноз: СД2, целевой уровень HbA1c < 7,5%. Диабетическая нефропатия, ХБП С3а. Гипертоническая болезнь 2 ст., риск 4. Экзогенно-конституциональное ожирение 2 ст. Стаж диабета ~ 5 лет. Получаемая терапия: метформин 2000 мг/сут вечером.
Впервые диагноз СД2 у больной установлен в 2016 г. Была инициирована терапия метформином в дозе 2000 мг/сут. Пациентка следовала принципам рационального питания, физическая активность — низкая. При ухудшении самочувствия (появились жалобы на жажду и сухость во рту) ее госпитализировали в эндокринологический стационар, где при обследовании выявлен уровень HbA1c 8,4%. К текущей терапии добавлили дапаглифлозин в дозе 10 мг/сут.
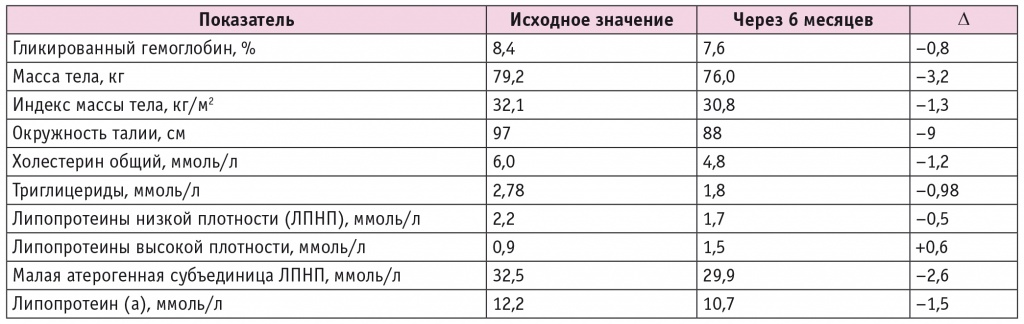
В результате за 6 месяцев на фоне данного лечения показатель HbA1c снизился до 7,6%. Отмечена выраженная положительная динамика параметров липидограммы: уровень общего холестерина снизился с 6,0 до 4,8 ммоль/л, триглицеридов — с 2,78 до 1,8 ммоль/л, ЛПНП — с 2,2 до 1,7 ммоль/л, концентрация ЛПВП выросла с 0,9 до 1,5 ммоль/л (табл. 3).
Таблица 3
Динамика показателей углеводного и липидного обмена и антропометрии у пациентки Ц.
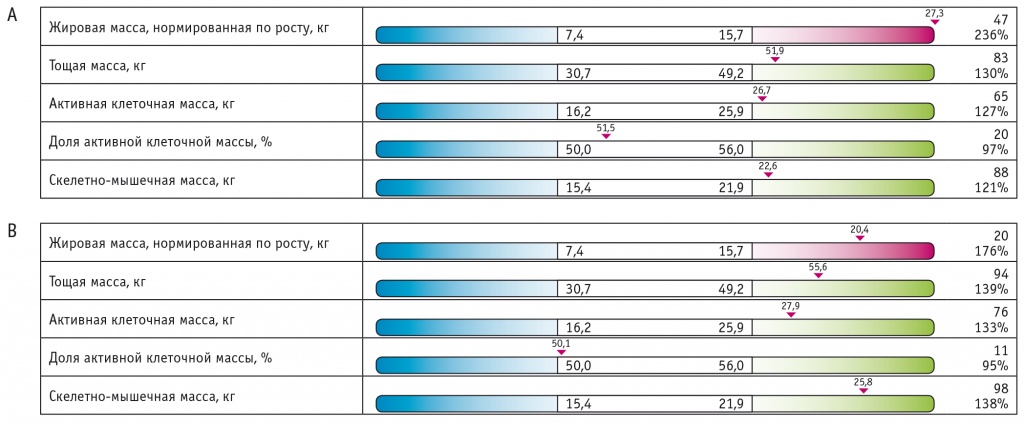
Наблюдалась и положительная динамика показателей жирового обмена: масса тела пациентки уменьшилась на 3,2 кг, повторное исследование состава тела четко продемонстрировало перераспределение жировой ткани: жировая масса снизилась на 6,9 кг, а костно-мышечная увеличилась на 3,2 кг (рис. 3).
Рис. 3. Результаты биоимпедансного сканирования состава тела пациентки Ц. в динамике за 6 месяцев.
Примечание. А — исходные показатели; В — через 6 месяцев после инициации терапии дапаглифлозином
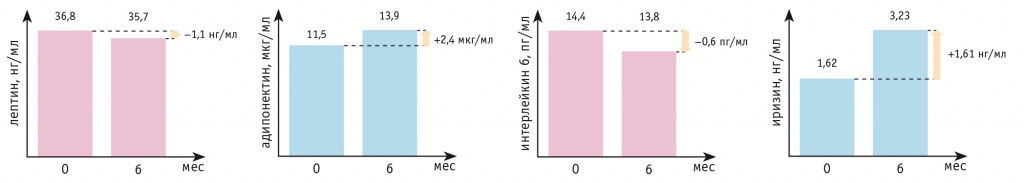
С полученными данными коррелировали результаты исследования адипокинов в плазме крови: уровень лептина снизился на 1,1 нг/мл, ИЛ-6 — на 0,6 пг/мл, а уровни адипонектина и иризина увеличились на 2,4 мкг/мл и 1,6 нг/мл соответственно (рис. 4).
Рис. 4. Динамика уровней адипокинов за 6 месяцев у пациентки Ц.
ОБСУЖДЕНИЕ
Наше исследование показало, что инициация терапии дапаглифлозином у пациентов с СД2, которые ранее получали метформин, ассоциировалась не только с компенсацией углеводного обмена, но также с вероятностью достижения клинически значимого снижения массы и нормализацией показателей метаболизма жира. Эти результаты можно учитывать при выборе препарата для интенсификации терапии СД.
Известно, что в среднем на фоне лечения иНГЛТ-2 уровень HbA1c снижается на 0,5–0,9%[12]. Результаты нашего исследования выявили уменьшение концентрации HbA1c на 0,6%, что коррелирует с имеющимися данными.
Ожирение — независимый предиктор риска гипертонии и дислипидемии, а также сердечно-сосудистых событий, которые являются основными причинами смерти пациентов с СД2. Снижение массы тела считается ключевым фактором в лечении диабета, поскольку оно также потенциально способствует уменьшению уровня гликемии, поэтому актуальны препараты, которые не просто улучшают гликемический контроль, но и снижают массу тела и жировую массу.
Многие исследования демонстрируют доказанную эффективность иНГЛТ-2 в отношении этих показателей[13–16]. В частности, при 24-недельном наблюдении больных с избыточной массой и СД добавление к терапии дапаглифлозина привело к уменьшению массы тела, а также жировой массы, по данным биоимпедансного сканирования состава тела, и к увеличению уровня адипонектина, что ассоциировалось со снижением систолического и диастолического артериального давления[17].
В другом исследовании лечение дапаглифлозином сопровождалось не только уменьшением массы тела, но и статистически незначимым (p = 0,052) понижением концентрации иризина[18]. В противовес приведенным результатам в нашем исследовании отмечено увеличение уровня этого миокина. Роль иризина в патогенезе СД и сердечно-сосудистых заболеваний все еще остается недостаточно исследованной и требует дальнейшего изучения.
Нормализация жирового обмена может повлиять на другие сопутствующие СД2 состояния, такие как дислипидемия и гипертония, и способствовать сокращению полипрагмазии[19]. К тому же не стоит забывать о том, что прием многих антидиабетических препаратов (инсулина, препаратов сульфонилмочевины) сопровождается нежелательными явлениями в виде увеличения массы тела или отсутствием какого-либо влияния на массу (ингибиторы дипептидилпептидазы 4). Дапаглифлозин, по данным метаанализа 15 исследований, обеспечивает лучший контроль уровней глюкозы плазмы натощак и HbA1c, массы тела по сравнению с плацебо, в комбинации с ингибиторами дипептидилпептидазы 4, препаратами сульфонилмочевины, а также другими классами сахароснижающих препаратов[20].
Не менее важным является уменьшение массы тела у пациентов с СД2 за счет снижения жировой массы, без потери костно-мышечной массы, что особенно актуально для больных пожилого возраста, подверженных развитию саркопении. В нашем исследовании биоимпедансное сканирование состава тела выявило уменьшение жировой массы и увеличение костно-мышечной массы у участников.
Авторы нескольких работ продемонстрировали, что потеря массы тела в результате лечения иНГЛТ-2 достигается именно за счет уменьшения жировой массы. Так, исследование при участии 50 пациентов с СД2 и средним ИМТ 27 кг/м2 показало снижение массы тела и жировой массы, по данным компьютерной томографии, а также уменьшение степени эктопии жира при сохранении массы скелетной мускулатуры[21].
В одном из исследований обнаружено, что потеря массы, вызванная добавлением к терапии дапаглифлозина, у пациентов с СД2 в первую очередь является результатом снижения жировой, а не тощей массы[17]. Кроме этого, иНГЛТ-2 уменьшают степень периферической инсулинорезистентности, в том числе улучшают чувствительность мышечной ткани к инсулину[22], стимулируют липолиз в жировой ткани[23], что также способствует снижению жировой массы и положительно влияет на мотивацию пациентов к продолжению терапии.
ЗАКЛЮЧЕНИЕ
В ответ на назначение дапаглифлозина у пациентов наблюдалось умеренное уменьшение уровней HbA1c и глюкозы плазмы натощак, однако обращала на себя внимание динамика показателей метаболизма жира. Особый интерес представляет адипонектин, который, по данным литературы[24, 25], является наиболее достоверным показателем метаболического здоровья. Выявлено статистически значимое увеличение его уровня в плазме крови на фоне терапии дапаглифлозином. Эти результаты коррелируют с данными биоимпедансного сканирования состава тела — уменьшением жировой массы и увеличением скелетно-мышечной массы.
Определенный интерес представляет также иризин — миокин, регулирующий процесс перехода белой жировой ткани в бурую. Нами отмечено статистически значимое повышение его уровня в крови пациентов.
Вместе эти данные подразумевают возможный процесс перераспределения и ремоделирования жировой ткани и переход из метаболически нездорового в метаболически здоровое ожирение.
Полученные одновременно параметры липидограммы также свидетельствуют о возможности применения иНГЛТ-2 с целью предупреждения развития атеросклеротических изменений сосудов и сердечно-сосудистых осложнений. Таким образом, коррекция дисфункции жировой ткани в качестве фокуса лечения может обеспечить не только контроль СД2, но и снижение кардиометаболических рисков у таких пациентов. Все еще требуется дальнейшее изучение данного вопроса. В настоящее время эта работа продолжается.
Поступила: 15.05.2023
Принята к публикации: 13.06.2023
________
1 IDF Diabetes Atlas, 10th ed. Brussels, Belgium: International Diabetes Federation; 2021; World Health Organization Diabetes Fact Sheets, 2022.







