Снижение функциональной активности щитовидной железы, так называемый субклинический гипотиреоз (СГ), часто выявляется, особенно у пациентов старших возрастных групп[1]. Диагноз гипотиреоза устанавливается при стойком повышении уровня ТТГ, оно должно быть подтверждено дважды с интервалом в 2–3 месяца.
Известно, что у 40% больных старшей возрастной группы возможна спонтанная нормализация содержания ТТГ при повторном измерении[2]. Это связано с физиологическими особенностями секреции ТТГ. Известно, что пик его секреции приходится на ночные и утренние часы, после полудня концентрация ТТГ может несколько снижаться[3, 4]. Супрессия ТТГ в гипофизе осуществляется с помощью свободного трийодтиронина (Т3 св.), который образуется путем периферической конверсии из свободного тироксина (Т4 св.). Периферическая конверсия Т4 в Т3 в гипофизе осуществляется дейодиназой 2-го типа[5].
Как правило, причиной гипотиреоза в йодобеспеченной популяции является исход аутоиммунного тиреоидита (АИТ)[6]. Известно, что активность дейодиназы 2-го типа в определенной степени может подавляться у пациентов с тяжелыми соматическими заболеваниями, в острых ситуациях, в условиях ацидоза, снижения скорости клубочковой фильтрации, при приеме ряда лекарственных препаратов (глюкокортикостероидов, амиодарона, рентгеноконтрастных веществ)[1];. Поэтому у пожилых коморбидных пациентов некоторое повышение уровня ТТГ не всегда является исходом АИТ. Формирование стойкого гипотиреоза, как правило, ассоциировано с высокими значениями антитиреоидных антител (АТ) и более высокими значениями ТТГ[7].
Клиническая значимость СГ до сих пор оспаривается. Известно, что СГ становится фактором сердечно-сосудистого риска. Снижение функциональной активности щитовидной железы связано с инсулинорезистентностью, гипергомоцистеинемией, дислипидемией. Однако нет убедительных данных об эффективности заместительной терапии СГ препаратами тироксина в крупных исследованиях по изучению сердечно-сосудистых исходов у пациентов с СГ[8]. В литературе имеются данные о том, что сердечно-сосудистые исходы ассоциированы с уровнем ТТГ более 7 мМЕ/л, и лечение СГ препаратами левотироксина
эффективно и целесообразно в группе больных с сердечно-сосудистыми заболеваниями.
В соответствии с существующими рекомендациями, вопрос о тактике лечения СГ у пожилых коморбидных пациентов решается индивидуально [9]. Вероятно, группы больных с СГ неоднородны, и представляется актуальной стратификация пациентов с СГ для оптимизации последующей лечебной тактики.
Изучение содержания АТ к тиреоидной пероксидазе (ТПО) у больных СГ очень важно, так как повышение концентрации АТ к ТПО является надежным предиктором стойкого гипотиреоза. Известно, что АТ к ТПО фиксируют комплемент и опосредуют реакции антителозависимой клеточной цитотоксичности[10]. АТ к ТПО не выявляются у здоровых людей, распознают один и тот же иммунодоминантный регион на молекуле ТПО.
В крупных эпидемиологических исследованиях показано, что АТ к ТПО ассоциированы с женским полом, старшим возрастом и повышением уровня ТТГ. АТ к тиреоглобулину (ТГ) сейчас не используются для диагностики АИТ. В настоящее время хорошо изучена эпитопная специфичность АТ к ТГ. Известно, что ТГ презентирует около 40 антигенных детерминант[11]. Часть АТ к ТГ формируются в онтогенезе, выявляются в норме и поддерживают иммунологическую толерантность. Поэтому определение концентрации АТ к ТГ не всегда отражает иммунопатологический процесс и менее эффективно для диагностики АИТ.
Таким образом, представляется важным изучение АТ к ТПО у пациентов с СГ различного пола и возраста, оно позволит выделить группу больных, у которых гипотиреоз не является стойким, не ассоциирован с сердечно-сосудистыми рисками и, вероятно, не требует активного лечения.
Цель исследования: определить концентрацию АТ к ТПО у больных СГ различного пола и возраста.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось в 2017 году. В него включены 7466 пациентов различных клинических подразделений Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова. Исследование было одобрено этическим комитетом ПСПбГМУ. Все больные подписали информированное согласие на процедуры обследования в клиниках ПСПбГМУ.
У всех пациентов проводили скрининговое определение уровня ТТГ. При повышении его ≥ 4,0 мМЕ/л измеряли концентрацию Т4 св. СГ считали уровень ТТГ от 4,0 до 10,0 мМЕ/л при нормальном содержании Т4 св.
Сведения о возрасте и гендерной принадлежности участников получали из базы данных клинических подразделений ПСПбГМУ (медицинская информационная система qMS от СП.АРМ).
Уровень ТТГ определяли методом ИФА реагентами 3-го поколения с использованием анализатора Beckman Coulter (США). При измерении с помощью данной методики ложно завышенные концентрации ТТГ (макро-ТТГ) автоматически не учитывались.
Уровень ТТГ менее 0,4 мМЕ/л считался низким (группа 0). За нормальный уровень ТТГ принимались значения от 0,4 до 2,4 мМЕ/л (группа 1). Концентрация ТТГ от 2,5 до 3,9 мМЕ/л включительно соответствовала пограничному значению (группа 2), от 4,0 до 10,0 мМЕ/л — СГ при нормальном содержании св. Т4 (группа 3). Концентрацию ТТГ более 10,0 мМЕ/л считали манифестным гипотиреозом при условии снижения уровня Т4 св. (группа 4).
Уровень Т4 св. измеряли с помощью Access Immunoassay Systems (США). Референсный интервал для Т4 св. — 7,8–14,3 пмоль/л. Содержание АТ к ТПО определялось при помощи Orgentec Anti-TPO ELISA (Германия) методом ИФА (референсный диапазон — 0–75 МЕ/мл).
В соответствии с классификацией ВОЗ, использовали градацию больных по возрасту[12]: группа 0 — юный возраст (18–24 года); группа 1 — молодой возраст (25–44 года); группа 2 — средний возраст (45–59 лет); группа 3 — пожилой возраст (60–74 года); группа 4 — старческий возраст (75–89 лет) и группа 5 — долгожители (90 лет и старше).
Для статистической обработки данных использовали программный пакет SAS Enterprise Guide 6.1 (США). Несмотря на большой объем выборки, исследуемые параметры имели ненормальное распределение (негауссовское) в соответствии с критериями Колмогорова — Смирнова, поэтому применялись непараметрические критерии Манна — Уитни в случае двух переменных и критерии Краскелла — Уоллеса в случае трех и более группирующих. Различия считали статистически значимыми при р < 0,05.
Категориальные данные были описаны с помощью частот и процентов. Для анализа использовались таблицы сопряженности и методы χ2 или чувствительный критерий Фишера в случае малого числа наблюдений.
РЕЗУЛЬТАТЫ
Среди обследованных был 2231 (29,88%) мужчина и 5235 (70,12%) женщин. Возраст их составлял от 18 до 99 лет, в среднем — 55,09 ± 17,14 года. Средний возраст мужчин — 55,22 ± 16,41 года, женщин — 55,04 ± 17,45 года. Группы мужчин и женщин были сопоставимы по возрасту, какие-либо значимые различия не выявлены (р = 0,67).
Уровень ТТГ был от 0,00 до 100,00 мМЕ/л и в среднем составил 2,62 мМЕ/л, медиана — 1,73 (1,11–2,71) мМЕ/л. В общей группе больных 2,5 и 97,5 процентили составили 0,10 и 8,88 мМЕ/л соответственно. У мужчин медиана ТТГ — 1,56 (0,97–2,31) мМЕ/л, у женщин — 1,82 (1,17–2,90) мМЕ/л. У женщин концентрация ТТГ была значимо выше, чем у мужчин (р < 0,0001).
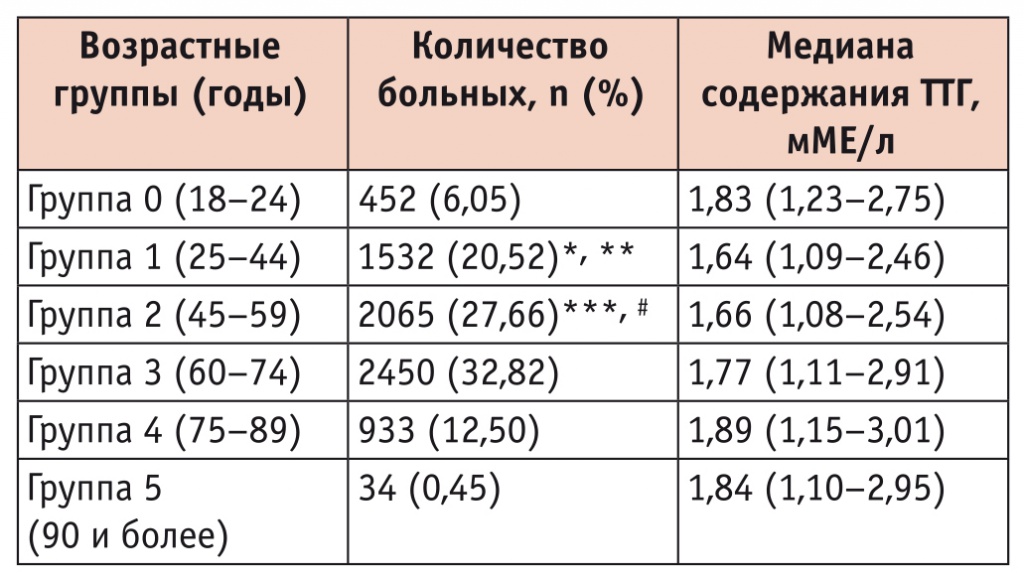
В таблице 1 представлены медианы содержания ТТГ в различных возрастных группах.
Таблица 1
Медиана содержания тиреотропного гормона (ТТГ) у больных различных возрастных групп
Примечания:
1) отличия от группы 3 статистически значимы: (*) — р = 0,006; (***) — р = 0,003;
2) отличия от группы 4 статистически значимы: (**) — р = 0,0003; (#) — р = 0,0002.
При сравнении уровней ТТГ в различных возрастных группах были выявлены значимые различия: между группой 1 и группами 3 и 4 (р = 0,006 и р = 0,0003 соответственно), между группой 2 и группами 3 и 4 (р = 0,003 и р = 0,0002 соответственно). Таким образом, у пациентов старших возрастных групп медиана уровня ТТГ была значимо выше, чем у лиц молодого и среднего возраста.
При анализе всего массива данных найдена слабая положительная корреляционная связь между уровнем ТТГ и возрастом (r = 0,05, p < 0,0001). При делении выборки по возрастным группам слабая корреляция обнаружена только в возрастной группе 2 (45–59 лет): r =
0,04, p = 0,04.
Проанализирована также зависимость между возрастом больных и уровнем ТТГ в группах мужчин и женщин. У мужчин группы 0 концентрации ТТГ значимо отличались от таковых у мужчин групп 2 и 3: 2,01 (1,21–2,74) мМЕ/л против 1,44 (0,91–2,15) и 1,45(0,94–2,23) мМЕ/л соответственно, в обоих случаях р < 0,0001. Кроме того, у мужчин группы 4 уровень ТТГ значимо отличался от показателей у мужчин групп 2 и 3: 1,75 (1,11–2,96) мМЕ/л против 1,44 (0,91–2,15) и 1,45 (0,94–2,23) мМЕ/л соответственно, в обоих случаях р = 0,002.
Существенные различия в содержании ТТГ выявлены между женщинами группы 1 и групп 3 и 4: 1,65 (1,11–2,51 мМЕ/л против 1,95 (1,22–3,23) (р < 0,0001) и 1,94 (1,17–3,07) (р = 0,001) соответственно; а также между участницами групп 2 и 3 (1,80 (1,17–2,73) мМЕ/л), р = 0,0005). Таким образом, у пациентов старших возрастных групп повышение концентрации ТТГ наблюдали несколько чаще.
При анализе уровней ТТГ в возрастных группах в зависимости от пола найдены значимые различия между мужчинами и женщинами в группах 2 (45–59 лет) и 3 (60–74 года). В обоих случаях уровни ТТГ были значимо выше у женщин, чем у мужчин (р < 0,0001).
В дальнейшем все пациенты были сгруппированы в зависимости от уровня ТТГ в соответствии с существующими рекомендациями (как указано ранее) (табл. 2).
Таблица 2
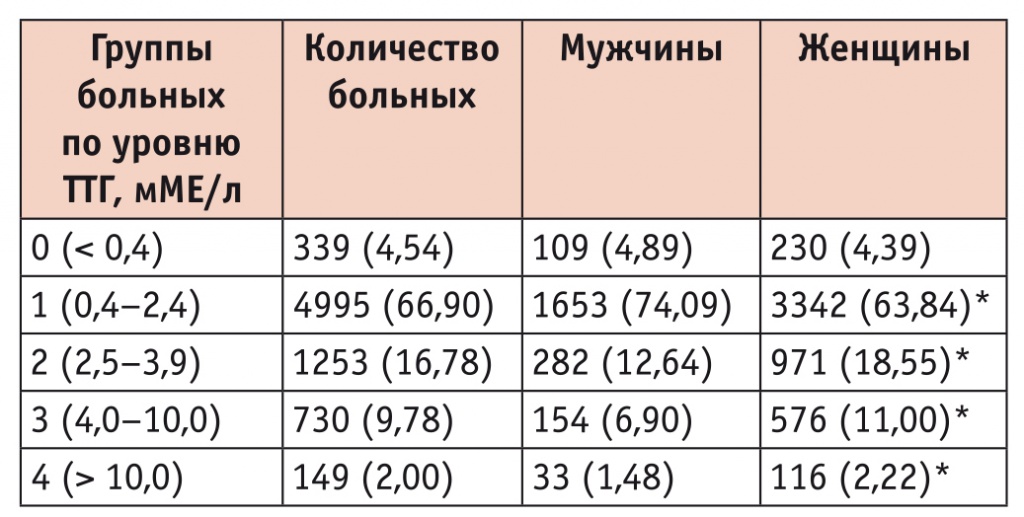
Распределение обследованных больных в зависимости от уровня тиреотропного гормона (ТТГ) гипофиза, n (%)
* Р < 0,05.
Как видно из представленных данных, нормальная концентрация ТТГ (0,4–2,4 мМЕ/л) значимо чаще встречалась у мужчин, чем у женщин. Высоконормальное содержание ТТГ, субклинический и манифестный гипотиреоз значимо чаще выявляли у женщин (р < 0,05).
Представлялось актуальным изучить распределение уровней ТТГ в группе больных СГ. Их общее число — 730. Как указывалось ранее, по литературным данным, у большинства пациентов с СГ уровень ТТГ — от 4,0 до 7,0 мМЕ/л[13]. Более того, по результатам проспективных наблюдений, рост уровня ТТГ более 7,0 мМЕ/л имеет клиническую значимость и ассоциирован с неблагоприятными сердечно-сосудистыми исходами[14]. Поэтому среди больных с СГ была выделена группа пациентов с содержанием ТТГ от 4,0 до 6,9 мМЕ/л. Такие показатели зафиксированы у 578 (79,18%) больных.
Согласно литературным данным, основная причина возникновения гипотиреоза, как субклинического, так и манифестного, в йодобеспеченной популяции — исход АИТ. Главный маркер его — АТ к ТПО[6]. Известно, что АТ к ТПО обладают цитолитической активностью и являются предиктором формирования стойкого гипотиреоза.
АТ к ТПО определяли у 304 пациентов с СГ различного пола и возраста: у 146 таких больных они выявлялись, у 158 не выявлялись. Клинико-лабораторные показатели больных СГ в зависимости от наличия/отсутствия антитиреоидных АТ представлены в таблице 3.
Таблица 3
Клинико-лабораторные показатели больных субклиническим гипотиреозом в зависимости от наличия/отсутствия антитиреоидных антител (АТ к ТПО)
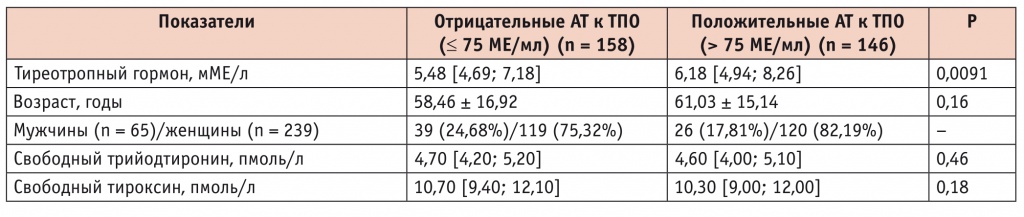
Результаты корреляционного анализа показали, что повышение АТ к ТПО ассоциировано с более высокими уровнями ТТГ (r = 0,117, p = 0,043). Таким образом, АТ к ТПО отражают формирование иммунологических нарушений в ткани щитовидной железы и являются надежным предиктором стойкого гипотиреоза.
Представлялось важным проанализировать содержание АТ к ТПО у пациентов с СГ с различной степенью повышения уровня ТТГ. Поэтому их распределили на группы с умеренным (4,0–6,9 мМЕ/л) и диагностически значимым (≥ 7,0 мМЕ/л) увеличением этого показателя. Данные представлены в таблице 4.
Таблица 4
Содержание антитиреоидных антител (АТ к ТПО) у больных субклиническим гипотиреозом с различными уровнями тиреотропного гормона (ТТГ), n (%)

Как видно из таблицы 4, в группе больных СГ без АТ к ТПО в 73,42% случаев наблюдалось умеренное повышение уровня ТТГ (4,0–6,9 мМЕ/л). В группе пациентов с СГ с диагностически значимым повышением АТ к ТПО различные диапазоны значений ТТГ выявлялись с одинаковой вероятностью.
ЗАКЛЮЧЕНИЕ
В работе представлены результаты обследования большой когорты больных многопрофильного стационара Северо-Западного региона. Субклинический гипотиреоз выявлен у 9,78% обратившихся за помощью. Повышение уровня ТТГ ассоциировалось с женским полом и старшим возрастом. Вероятно, умеренное повышение концентрации ТТГ (4–6,9 мМЕ/л) в большинстве случаев не связано с аутоиммунными заболеваниями щитовидной железы. У пожилых больных некоторое увеличение уровня ТТГ возможно вследствие ряда других причин (легкого ацидоза, снижения скорости клубочковой фильтрации, активности дейодиназы 2-го типа, влияния лекарственных препаратов). По литературным данным, примерно в 40% случаев умеренное повышение уровня ТТГ обратимо, и при следующем измерении он, как правило, снижается до нормальных значений[2].
Таким образом, стойкий гипотиреоз у больных, обратившихся за помощью, вероятно, характеризуется более высокими показателями ТТГ (более 7 мМЕ/л) и наличием антитиреоидных антител. Умеренное повышение уровня ТТГ (4,0–6,9 мМЕ/л), особенно у пожилых больных, скорее всего, не является клинически значимым, не отражает иммунопатологический процесс в щитовидной железе и не требует заместительной терапии тиреоидными гормонами.







