Следует отметить, что, несмотря на успехи в изучении патогенетических механизмов АИГ, позволившие определить ключевые инструменты его успешной терапии, остаются нерешенными важнейшие диагностические задачи. Требует ответа ряд теоретических и методологических вопросов, например: имеет ли АИГ пусковые механизмы или развивается спонтанно? могут ли триггерные антигены быть обнаружены и валидированы? возможно ли прогнозировать и уменьшать риск развития АИГ? В клинической практике возникают такие трудные ситуации, как лечение продвинутых форм цирроза печени в исходе АИГ, развитие тяжелого или фульминантного АИГ с печеночной недостаточностью, АИГ на фоне беременности с высокой биохимической активностью и ведение групп пациентов с неудачей стандартного лечения (при этом следует различать недостаточный ответ на терапию, наличие толерантности или нежелательных побочных эффектов), контроль и мониторинг риска прогрессирования заболевания.
Термин АИГ в его нынешнем значении был введен I. R. Mackay и его коллегами в 1965 г., когда была признана концепция аутоиммунитета [11].
В настоящее время АИГ трактуется как хроническое воспалительное заболевание печени с характерной портальной и перипортальной инфильтрацией иммунными клетками, с гипергаммаглобулинемией и наличием типичных аутоантител (ауто-АТ), указывающих на продолжающуюся аутоиммунную реакцию против печеночных аутоантигенов, которое без лечения приводит к необратимому повреждению гепатоцитов и в конечном счете — к тяжелой печеночной недостаточности, а при лечении преимущественно отвечает на иммуносупрессивную терапию.
Имеются исследования, посвященные эпидемиологии АИГ. Однако в большинстве таких работ четкие критерии для диагностики заболевания не были применены. Данные по заболеваемости во всем мире приблизительно сопоставимы и варьируют в пределах от 0,8 до 3 на 100 000 населения с преобладанием в некоторых регионах в пределах от 11 до 24 на 100 000 [3, 15]. От 11% до 20% всех случаев хронических заболеваний печени в западных странах приходятся на АИГ [9].
По данным научно-исследовательского отдела гепатологии Московского клинического научно-практического центра Департамента здравоохранения г. Москвы (МКНЦ ДЗМ), в период 2015-2016 гг. частота аутоиммунных заболеваний в структуре хронических заболеваний печени составила 16,7%, частота АИГ в структуре аутоиммунных заболеваний — 21,5% (рис. 1, 2).
Рис. 1. Структура хронических заболеваний печени по данным МКНЦ ДЗМ за 2015-2016 гг. (n = 2939).
Примечание. АБП — алкогольная болезнь печени; АИГ — аутоиммунный гепатит; ЛИГ — лекарственно-индуцированный гепатит; НАЖБП — неалкогольная жировая болезнь печени; ПБЦ — первичный билиарный цирроз; ПСХ — первичный склерозирующий холангит; ХЗП — хронические заболевания печени; HBV, HCV, HDV — вирусы гепатита B, C, D
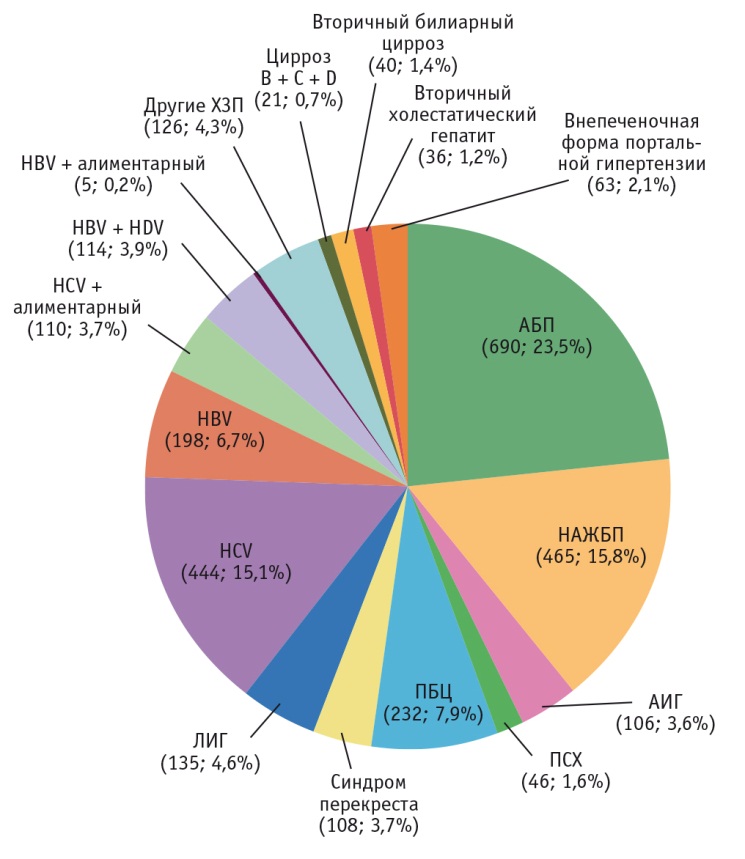
Рис. 2. Структура аутоиммунных заболеваний печени по данным МКНЦ ДЗМ за 2015-2016 гг. (n = 492).
Примечание. АИГ — аутоиммунный гепатит; ПБЦ — первичный билиарный цирроз; ПСХ — первичный склерозирующий холангит
ДИАГНОСТИКА АУТОИММУННОГО ГЕПАТИТА
Диагноз АИГ основывается на комплексной оценке клинических признаков и симптомов, лабораторных изменений (биохимических и иммунологических), морфологической картины, а также на исключении других форм хронических гепатитов (вирусных, лекарственно-индуцированных, метаболических и др.). АИГ характеризуется широтой клинических проявлений: от бессимптомного течения на момент постановки диагноза (случайно выявленные повышенные уровни трансаминаз, жалобы на усталость при активном опросе) до продвинутого цирроза и других форм печеночной недостаточности (табл. 1) [7, 12].
Таблица 1
Характеристика аутоиммунного гепатита (АИГ) [7]

У значительной части взрослых больных АИГ имеются одновременно несколько аутоиммунных заболеваний, которые могут рассматриваться как внепеченочные проявления и либо предшествуют появлению признаков поражения печени (что является частой причиной поздней диагностики АИГ), либо развиваются впоследствии, в последнем случае их симптомы накладываются на клиническую картину АИГ. Это укрепляет иммунологическую этиологию заболевания. Генетическая предрасположенность к АИГ тесно связана с HLA-DR3- и DR4-аллелями. Клиническая картина АИГ наиболее часто сопровождается такими ассоциированными заболеваниями, как тиреоидит (10-23%), сахарный диабет 1 типа (7-9%), неспецифический язвенный колит (2-8%), ревматоидный артрит (2-5%), целиакия (1-2%), системная красная волчанка (1-2%) [14].
В лабораторных показателях крови для АИГ характерны наличие цитолитического синдрома за счет повышения показателей аланин- и аспартатаминотрансферазы (АЛТ и АСТ), увеличение в 1,5-2 раза и более содержания гамма-глобулинов и/или IgG, присутствие антител (АТ). Однако не все эти лабораторные данные должны обнаруживаться у каждого конкретного пациента. Повышение уровня IgG — частая находка при АИГ, но нормальные его значения могут встречаться у 30% больных [1].
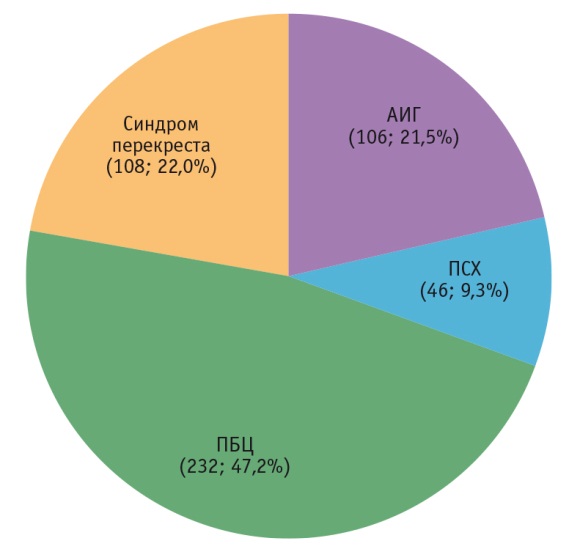
«Визитной карточкой» АИГ, позволяющей своевременно установить диагноз заболевания, является обнаружение собственных АТ — ауто-АТ — циркулирующих белков, не обладающих ни органной, ни видовой специфичностью. Их наличие остается признаком заболевания при отсутствии доказанной вирусной, метаболической, генетической, токсической этиологии хронического гепатита. В настоящее время определены различные типы АТ и антигены-мишени (табл. 2) [14]. Исследователи рассматривают эти маркеры в аспекте их значения для дифференциальной диагностики и изучения патогенеза АИГ. Заболевание подразделяется на два основных типа: АИГ-1 и АИГ-2, — однако определяют также АИГ 3-го типа и недифференцированный тип.
Таблица 2
Типы аутоантител и антигены-мишени при аутоиммунном гепатите [14]
* Встречаются не только при аутоиммунном гепатите.
Примечание. АИГ — аутоиммунный гепатит; АТ — антитела; РНК — рибонуклеиновая кислота; УДФГТ — уридиндифосфат-глюкуронозилтрансфераза.
Морфологические признаки. Согласно мнению известных морфологов, имеются три варианта гистологической картины при АИГ: типичная гистология; гистология, соответствующая АИГ; атипичная гистология [2, 5].
Типичной гистологией считаются пограничный (interface) гепатит, лимфоплазмоцитарная инфильтрация портальных трактов с распространением воспаления в дольки, эмпериполез, а также формирование розеткоподобных структур [4]. При этом для типичной гистологической картины должны присутствовать все признаки. Гистология, не противоречащая (или соответствующая) АИГ, подразумевает лимфоидную инфильтрацию портальных трактов без перечисленных выше типичных признаков. Гистологию называют атипичной не в случае отсутствия полного соответствия, а при наличии картины, характерной для другого заболевания печени, например для стеатогепатита [10].
Следует помнить, что гистологические признаки АИГ являются типичными, но не специфичными, они имеют невысокую специфичность (81%), низкие показатели чувствительности (40%) и прогностической ценности (68%) [6, 9]. Вопрос о необходимости проведения биопсии печени и морфологического исследования для диагностики АИГ в настоящее время решен однозначно. Согласно рекомендациям Американской ассоциации по изучению заболеваний печени (англ. American Association for the Study of Liver Diseases, 2010), Британского гастроэнтерологического научного общества (англ. British Society of Gastroenterology, 2011) и Европейской ассоциации по заболеваниям печени (англ. European Association for the Study of the Liver, EASL, 2015), биопсия печени является необходимым условием установления диагноза АИГ, рекомендуется всем пациентам с подозрением на АИГ и, в случае отсутствия противопоказаний, должна быть выполнена до начала лечения [7, 8, 12]. При тяжелой коагулопатии (например, при остром/молниеносном начале заболевания) можно использовать доступ через яремную вену. Безопасность биопсии под визуальным контролем в ходе мини-лапароскопии доказана даже у больных с выраженной коагулопатией. Помимо диагностики морфологическое исследование необходимо для выбора тактики лечения.
Однако потенциальные ограничения и осложнения биопсии печени обусловили активный интерес клиницистов к неинвазивным методам диагностики, примером чего является оценка фиброза с помощью транзиентной фиброэластометрии печени (ФЭ) и фибротестов. Согласно Практическим рекомендациям EASL (2015), ФЭ может считаться стандартом неинвазивного теста для измерения эластичности печени (уровень и сила рекомендации — A1), имеет высокую достоверность при вирусных гепатитах (A1), чуть менее достоверна при других хронических заболеваниях печени (A1), обладает бо’льшей эффективностью для обнаружения цирроза печени, чем стадий фиброза (A1). Алгоритм сочетания ФЭ и серологических биомаркеров представляется наиболее привлекательным и достоверным (A2). Однако в настоящее время нет достаточной доказательной базы и невозможно дать рекомендации по применению неинвазивных тестов у пациентов с АИГ (A1) [6, 7].
Рекомендации и их доказательные базы прошли проверку в соответствии с Системой оценки, развития и анализа рекомендаций (англ. Grade of Recommendation, Assessment, Development and Evaluation, GRADE). В системе GRADE определяются уровни и сила рекомендаций. Сила рекомендаций (1 — сильные, 2 — слабые) отражает качество доказательности и определяется уровнем (A — высокий, B — средний, C — низкий) и степенью доказательности: I — рандомизированные контролируемые исследования; II-1 — контролируемые исследования без рандомизации; II-2 — когортные аналитические исследования или исследования типа «случай-контроль»; II-3 — множественные наблюдения, существенные неконтролируемые эксперименты; III — мнение признанных авторитетов, описательная эпидемиология [6, 7].
Диагностические критерии. В 1993 г. Международная группа по изучению аутоиммунного гепатита (англ. International AutoImmune Hepatitis Group, IAIHG) предложила диагностические критерии заболевания, которые были пересмотрены и дополнены в 1999 г. Поскольку критерии были сложны и предназначались в большей степени для научных целей, IAIHG в 2008 г. разработала упрощенную систему подсчета баллов, которая стала более практичным инструментом в ежедневной клинической практике. Согласно упрощенным критериям, при диагностике учитываются морфологические признаки АИГ, титры АТ, уровни гамма-глобулинов/IgG, отсутствие вирусного гепатита (табл. 3) [4, 9].
Таблица 3
Упрощенные диагностические критерии Международной группы по изучению аутоиммунного гепатита (IAIHG) [7]
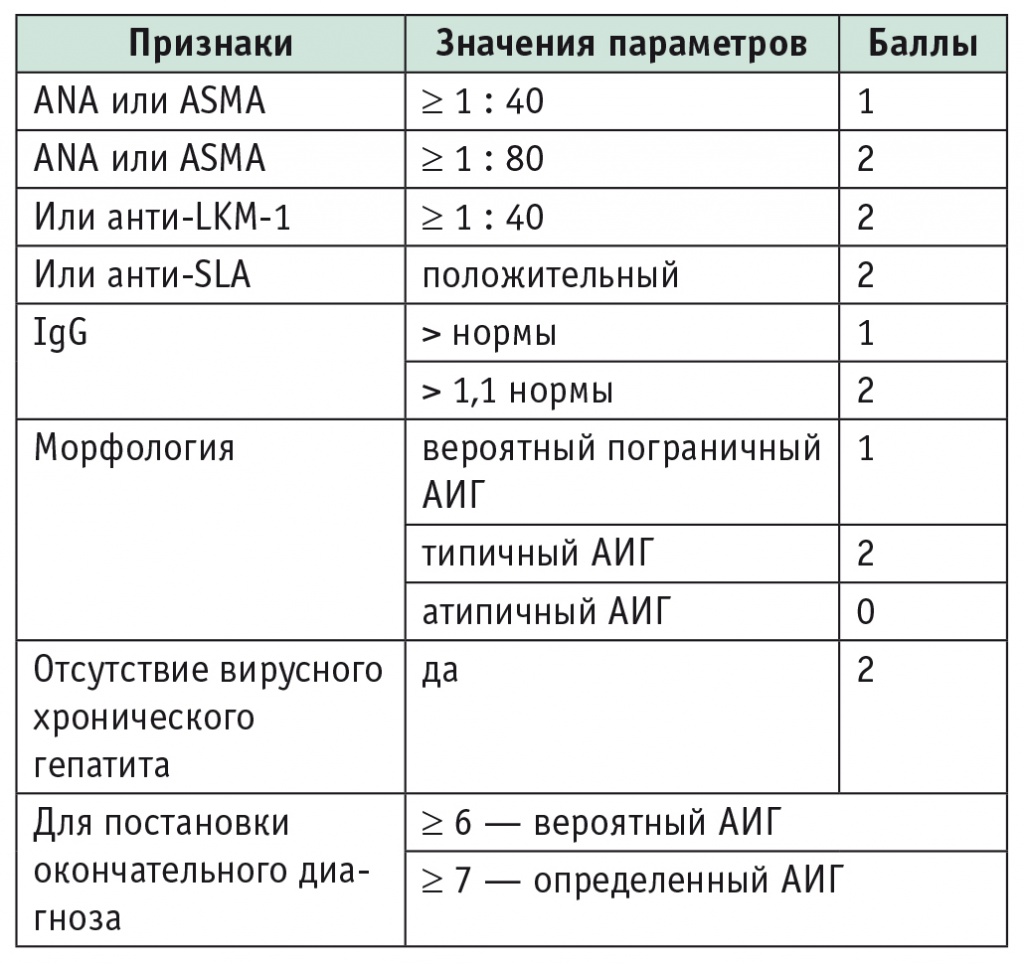
Примечание. АИГ — аутоиммунный гепатит; ANA — антинуклеарные антитела; АSMA — антитела к гладкой мускулатуре; анти-LKM-1 — антитела к микросомам печени и почек 1-го типа; анти-SLA — антитела к растворимому антигену печени.
ЛЕЧЕНИЕ АУТОИММУННОГО ГЕПАТИТА
АИГ — первое заболевание печени, при котором глюкокортикостероидные препараты (ГКС) получили доказательство своей эффективности в рандомизированных клинических исследованиях и стали «визитной карточкой» терапии. У лечения АИГ есть две основные цели: индукция ремиссии и ее поддержание.
Кому и когда надо начинать иммуносупрессивную терапию? Все пациенты с активным АИГ должны получать лечение (степень доказательности — I). Дозы лекарственных средств следует подбирать в зависимости от активности заболевания (III). Лечение иногда не требуется лишь пациентам со спонтанной ремиссией, которых следует активно наблюдать и обследовать каждые 3-6 месяцев (III) [7]. В таблице 4 указаны абсолютные и относительные показания к назначению иммуносупрессивной терапии [12].
Таблица 4
Показания для лечения аутоиммунного гепатита [12]
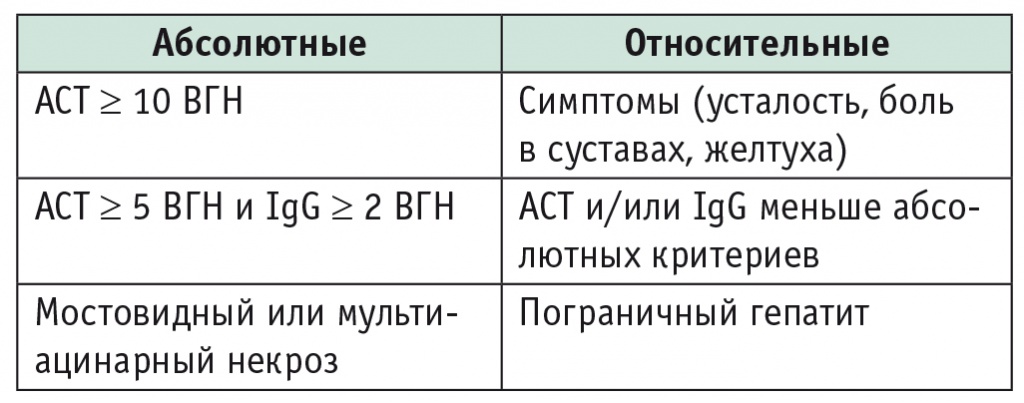
Примечание. АСТ — аспартатаминотрансфераза; ВГН — верхняя граница нормы.
Существующая стандартная терапия первой линии включает преднизолон с последующим присоединением азатиоприна (степень доказательности — I). Начальная доза преднизолона должна составлять 0,5-1 мг/кг/сут. Более высокие его дозы быстрее индуцируют ремиссию, однако имеют более выраженные нежелательные явления стероидной терапии (II-2). Оптимальное время присоединения азатиоприна — через 2 недели после начала применения преднизолона при уровне билирубина не выше 100 мкмоль/л. Начальная доза должна составлять 50 мг/сут при последующем ее увеличении в зависимости от токсичности и ответа на терапию до поддерживающей дозы 1-2 мг/кг (II-2). Лечение АИГ зависит от ответа. Схемы терапии должны быть индивидуализированы (III). Лечение следует продолжать как минимум 3 года или не менее 24 месяцев после полной нормализации уровней трансаминаз и IgG (II-2). Оценка индекса гистологической активности перед отменой терапии обязательна. Пациенты нуждаются в динамическом наблюдении во время лечения для оценки нежелательных явлений и после его отмены для контроля риска рецидива [7].
Результаты стандартной терапии первой линии в целом вполне удовлетворительны: лечение приводит к трехлетней ремиссии у 65-87% пациентов. Поддерживающая терапия низкими дозами преднизолона (< 10 мг/сут) в комплексе с азатиоприном или монотерапия азатиоприном в более высокой дозе (2 мг/кг/сут) более эффективны, чем монотерапия преднизолоном в дозе 10-15 мг/сут. Возможные осложнения длительной терапии системными ГКС: «стероидный» сахарный диабет; присоединение инфекционных заболеваний, в том числе активация дремлющих инфекционных очагов (туберкулез!); развитие или обострение остеопороза; обострение язвенной болезни; ухудшение течения гипертонической болезни; развитие острого психоза; кушингоидный синдром; псевдомиастенический синдром. Перечисленные заболевания или состояния могут быть у больного, которому кортикостероидная терапия лишь предстоит. В этих случаях ГКС противопоказаны [4, 11].
Включение в схему индукции АИГ топического стероида будесонида (9 мг/сут) в сочетании с азатиоприном позволяет снижать частоту развития побочных эффектов системных ГКС. Эта схема — альтернатива для пациентов с наибольшим риском стероидных нежелательных эффектов, однако неприменима при циррозе печени и внепеченочных проявлениях. При приеме будесонида для поддержания ремиссии у пациентов, первоначально получавших преднизолон, стероидные побочные эффекты снизились с 44,8% до 26,4% [12, 13].
Около 5-10% больных не переносят стандартную терапию первой линии или имеют противопоказания к ней, и около 5-10% демонстрируют недостаточный или неудовлетворительный ответ [4]. Если результаты лечения первой линии неудовлетворительны, необходимо рассмотреть альтернативные схемы второй и третьей линий с применением таких препаратов, как микофенолата мофетил и ингибиторы кальциневрина (циклоспорин, такролимус). Основное преимущество этих средств — мощное и быстрое иммуносупрессивное действие, но они обладают собственными побочными эффектами, в числе которых гипертензия, нарушение функции почек, сахарный диабет, гиперлипидемия и неврологические нарушения, долгосрочное повышение риска развития злокачественных опухолей.
Трансплантация печени является эффективным спасительным лечением даже у пожилых людей, но АИГ может развиваться у всех больных с дисфункцией трансплантата после пересадки печени.
Далее представлено клиническое наблюдение, которое при ретроспективном анализе раскрывает целый ряд тактических ошибок в лечении пациентки.
Клиническое наблюдение
Пациентка Г., 1958 года рождения, поступила в отделение хронических заболеваний печени МКНЦ ДЗМ с жалобами на снижение аппетита, увеличение живота в объеме, отеки нижних конечностей, слабость.
Из анамнеза известно, что больная до последнего времени считала себя здоровой, активно работала. При изучении амбулаторной карты выяснено, что 10 лет назад при однократном исследовании в анализе крови отмечалось повышение уровней АЛТ и АСТ до 3-4 норм. Врачом поликлиники было высказано предположение о наличии неалкогольного стеатогепатита, однако повторные анализы не были назначены, ни врач поликлиники, ни пациентка не придали этому факту особого значения. В дальнейшем около 7 лет к врачам не обращалась, алкоголь не употребляла, вела активный образ жизни.
Три года назад почувствовала слабость, общее недомогание, в биохимическом анализе крови выявлялись признаки резко выраженного цитолитического синдрома (АЛТ/АСТ — 2500/3600 Ед/л). Была госпитализирована в терапевтический стационар ГКБ для дообследования и лечения. Маркеры вирусных гепатитов не были обнаружены, выявлены антинуклеарные ауто-АТ (3,5 Ед/мл). Диагностирован АИГ-1, и начата монотерапия преднизолоном в дозе 60 мг/сут. При динамическом контроле через 10 дней от начала лечения показатели трансаминаз снизились (АЛТ/АСТ — 450/360 Ед/л). Больная была выписана с рекомендацией постепенно снижать дозу преднизолона и продолжать динамическое наблюдение. Однако пациентка после достижения биохимической ремиссии (нормализации уровней АЛТ и АСТ) отказалась от дальнейшего приема преднизолона, ввиду того что отметила увеличение веса, появление волос на лице и выпадение волос на голове.
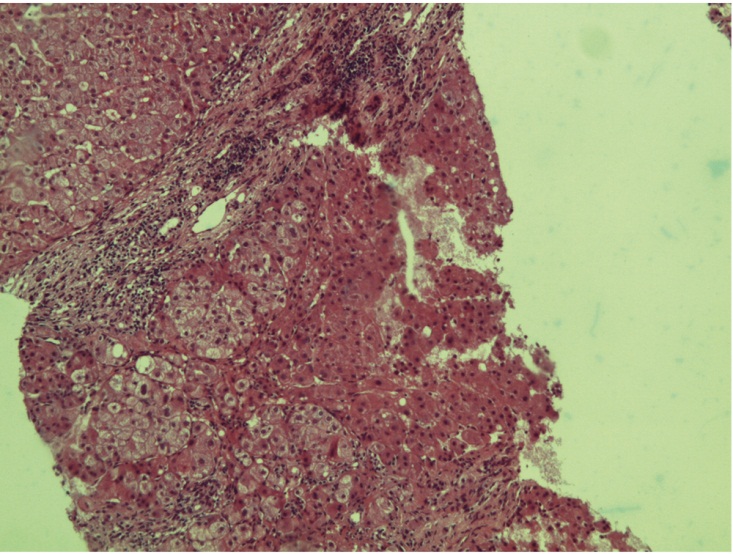
Через год пациентка вновь обратилась к врачу поликлиники в связи с повышением уровня АЛТ до 2,5 нормы. Была госпитализирована в стационар по месту жительства, где ей провели биопсию печени и диагностировали активный цирроз печени: шкала Metavir — A2F4 (рис. 3). Признаков портальной гипертензии и гепатодепрессии не выявлено.
Рис. 3. Гистологическая картина печени у пациентки Г. Окраска по методу Ван Гизона, ув. × 200. Фото Д. Л. Ротина.
Сформированные ложные дольки, разделенные септами разной толщины, с густыми лимфоплазмоцитарными инфильтратами и васкуляризацией (шунты — истинный цирроз). A2F4 по шкале Metavir
Назначено лечение будесонидом в дозе 9 мг/сут под динамическим наблюдением гастроэнтеролога по месту жительства. Через 6 месяцев в связи с ухудшением состояния в виде резкого нарастания общей слабости, увеличения живота в объеме врачом поликлиники был отменен будесонид и вновь назначен преднизолон в дозе 40 мг/сут, однако спустя неделю состояние пациентки резко ухудшилось, появились признаки энцефалопатии. Была госпитализирована в отделение хронических заболеваний печени МКНЦ ДЗМ (ЦНИИГ).
При поступлении состояние средней тяжести. Температура тела — 38,5 °С. Нормостенического телосложения. Повышенного питания: ИМТ — 28 кг/м2. Кожные покровы бледные, сухие. В легких дыхание везикулярное, ЧДД — 20/мин. Тоны сердца приглушены, ритмичны, ЧСС — 90/мин. АД — 100/70 мм рт. ст. Язык обложен белым налетом. Живот при пальпации болезненен в эпигастральной области и правом подреберье, увеличен в объеме за счет асцита средних размеров. Печень +2,0 см ниже края реберной дуги. Селезенка не пальпируется. Симптом поколачивания отрицателен с обеих сторон. Отеки стоп, пастозность голеней. На вопросы отвечает замедленно, внимание снижено, забывчива, в собственной личности и пространстве ориентирована. Тест связи чисел — 63 секунды, что соответствует печеночной энцефалопатии 1-2-й степени.
В клиническом анализе крови отмечен лейкоцитоз до 12,7 тыс/мкл, палочкоядерные — 10%.
В биохимическом анализе крови: признаки умеренно выраженного цитолитического синдрома (АЛТ/АСТ — 200/310 Ед/л), минимальный синдром холестаза (общий билирубин — 38 мкмоль/л, прямой — 7 мкмоль/л, гамма-глутамилтранспептидаза (ГГТП) — 170 Ед/л, ЩФ — 280 Ед/л), креатинин — 98 мкмоль/л, синдром гепатодепрессии (альбумин — 21,6 г/л, протромбин — 25%), гипергаммаглобулинемия (60%), IgG — 19,9 г/л (16,2 верхней границы нормы). Ауто-АТ (антинуклеарные АТ, АТ к гладкой мускулатуре, АТ к микросомам печени и почек 1-го типа, антимитохондриальные АТ субтипа М2) не выявлены.
При исследовании асцитической жидкости выявлен выраженный цитоз — 20 000 клеток/мкл, — представленный на 95% нейтрофильными лейкоцитами и на 5% лимфоцитами.
Таким образом, у пациентки имели место проявления системной воспалительной реакции (лихорадка, лейкоцитоз в крови), признаки печеночной энцефалопатии, нараставшая печеночная недостаточность и гепатодепрессия; данные исследования асцитической жидкости позволили диагностировать спонтанный бактериальный перитонит.
Клинический диагноз. Цирроз печени в исходе аутоиммунного гепатита, класс С по Чайлду — Пью (14 баллов), оценка по шкале MELD (англ. Model for End-stage Liver Disease) — 15 баллов. Портальная гипертензия. Отечно-асцитический синдром. Асцит 2-й степени. Спонтанный бактериальный перитонит. Печеночная энцефалопатия, 2-я стадия.
Проводилась антибактериальная терапия спонтанного бактериального перитонита — асцита: антибиотики цефалоспоринового ряда III поколения, фторхинолоны, альбумин, диуретическая терапия, L-орнитин-L-аспартат. Преднизолон был отменен при поступлении.
На фоне лечения отмечались снижение показателей цитолитического синдрома (АЛТ/АСТ — 84,6/36,8 Ед/л), холестатического синдрома (билирубин — 31,3 мкмоль/л, ГГТП — 71,4 Ед/л, ЩФ — 122,4 Ед/л), уменьшение синдрома гепатодепрессии (альбумин — 30 г/л, протромбин — 39%). В клиническом анализе крови нормализовался уровень лейкоцитов. Асцит 1-й степени. В асцитической жидкости: цитоз — 100 клеток/мкл, представленный на 25% нейтрофилами.
Была проведена консультация в отделе трансплантологии Научно-исследовательского института скорой помощи им. Н. В. Склифосовского Департамента здравоохранения г. Москвы, больную включили в ближайший лист ожидания трансплантации печени. Выписана с рекомендацией трансплантации печени.
Обсуждение клинического случая. В тактике терапии АИГ был допущен ряд ошибок, каждая из которых могла привести к фатальному исходу заболевания, и все эти ошибки можно было предотвратить. При первом обращении пациентки к врачу и выявлении повышенных уровней аминотрасфераз был выставлен диагноз неалкогольного стеатогепатита, хотя, как известно, это заболевание диагностируется методом исключения. Обязательное в таких случаях исследование ауто-АТ, характерных для АИГ, не было назначено. В результате в течение 7 лет пациентка динамически не наблюдалась и совсем не получала лечения.
Прекращение терапии ГКС после достижения биохимической ремиссии из-за отказа пациентки, вызванного плохой переносимостью преднизолона, при ретроспективном рассмотрении вызывает серьезные возражения. На этом этапе следовало обсуждать вопрос о назначении топических кортикостероидов, в частности будесонида. Отсутствие патогенетической терапии привело к прогрессированию заболевания и формированию цирроза печени. В то же время запоздалым и необоснованным оказалось назначение будесонида на этапе сформировавшегося цирроза печени. И непростительно ошибочным было назначение преднизолона на стадии декомпенсации цирроза, вызвавшее тяжелое инфекционное осложнение в виде спонтанного бактериального перитонита; развитие системной воспалительной реакции уменьшило шансы на успех в случае трансплантации печени.
Резюме. При лечении АИГ определяющее значение имеет не только поиск эффективных препаратов, но и правильное применение их на практике. Схемы лечения, не включающие кортикостероиды, особенно важны, потому что причиной плохих отдаленных результатов может быть низкая приверженность лечению ГКС: молодые пациенты, женщины нередко отказываются от преднизолона из-за увеличения массы тела и нежелательных косметических эффектов. Решение проблемы отчасти видится в структурировании терапии; использование схем с минимальным включением ГКС может принести большую пользу в отдельных группах пациентов. Задачи врача при лечении больных АИГ: контроль и предотвращение нежелательных побочных явлений, при необходимости — их коррекция; раннее выявление проблемных больных (с непереносимостью терапии, с плохим ответом на нее); обеспечение долгосрочного поддерживающего лечения.
Приведенное ретроспективное клиническое наблюдение позволяет привлечь внимание врачей общей практики к такой сложной проблеме, как АИГ. Оно демонстрирует необходимость тщательного и всестороннего обследования пациента с первыми проявлениями заболевания печени, грамотного и своевременного применения системных и топических кортикостероидных препаратов.
ЗАКЛЮЧЕНИЕ
Аутоиммунный гепатит (АИГ) — хроническое заболевание печени, прогрессирующее без адекватной терапии. Для достижения успеха необходимо максимально раннее начало лечения на доцирротической стадии. У больных с циррозом печени (ЦП) в исходе АИГ терапия требует особой осторожности в связи с трудностью оценки ее эффективности (поскольку при ЦП не всегда имеет место гипергаммаглобулинемия, часто отмечается весьма умеренное повышение уровней аланин- и аспартатаминотрансферазы) и риском развития осложнений и нежелательных явлений. Рекомендуется тщательное наблюдение за пациентом на всех этапах лечения с учетом высокого риска инфекционных осложнений, при отсутствии эффекта показана трансплантация печени.







