Адекватная коррекция метаболических расстройств и быстрое восполнение дефицита белков, жиров и углеводов у тяжелобольных являются одним из основных звеньев комплексной терапии[3, 7, 9]. Искусственное питание — обязательный и необходимый компонент лечения у онкологических больных с заболеваниями верхнего отдела ЖКТ, которым по тем или иным причинам противопоказано выполнение радикальных операций[11, 14].
В настоящее время преимущества энтерального питания в комплексном лечении онкологический больных и пациентов с нарушенной функцией глотания (после перенесенного острого нарушения мозгового кровообращения, при боковом амиотрофическом склерозе) неоспоримы. Современные технологии парентерального питания позволяют обеспечить больного всеми необходимыми нутриентами, но следует помнить, что его длительное применение не является физиологически обоснованным для организма и может сопровождаться рядом специфических осложнений[11, 16]. При невозможности естественного приема пищи энтеральное питание пациенту можно проводить через интестинальные зонды, гастро- или еюностому. Для кратковременного энтерального питания (послеоперационный период) обычно используют различные модели интестинальных зондов, которые заводят в ЖКТ во время операции или эндоскопическим путем[4]. Длительное энтеральное питание с помощью данного метода невозможно из-за угрозы образования пролежней от зонда, что ограничивает срок его нахождения в просвете ЖКТ. Обычно при неврологических нарушениях, сопровождающихся угнетением сознания, снижением или полным отсутствием глотательного рефлекса, при тяжелой сочетанной травме и т. д. требуется проведение длительной (более 4 недель) нутритивной поддержки[3, 6, 12]. Именно в таких случаях целесообразно применять гастро- или еюностомию.
В хирургической практике существует много методик лапаротомного наложения гастростомы, однако подавляющее большинство из них не удовлетворяют современным требованиям и сопровождаются большим количеством осложнений — от 6 до 50%[5, 8, 19]. Наиболее частые из них: подтекание желудочного содержимого в свободную брюшную полость, выпадение гастростомической трубки, ее миграция, нагноение послеоперационной раны, мацерация кожных покровов вокруг выведенной гастростомы и т. д.
В настоящее время благодаря внедрению в практику современных минимально инвазивных технологий методикой выбора для проведения длительного искусственного питания является чрескожная эндоскопическая гастростомия (ЧЭГ), которая представляет собой минимально инвазивный способ установки гастростомической трубки путем пункции брюшной и передней стенок желудка под эндоскопическим контролем[1, 2, 13]. Впервые ЧЭГ была произведена в 1979 г. у 4,5-месячного ребенка эндоскопистом J. Ponsky и детским хирургом M. Gauderer (США, г. Кливленд). Методика была представлена на ежегодном собрании Американской детской хирургической ассоциации (APSA) во Флориде в 1980 г. как альтернатива традиционной гастростомии и получила название pull-through (метод установки гастростомы через рот)[15, 18]. Ее основными преимуществами являются минимальная травматичность, быстрота установки, возможность выполнения у пациентов с высоким операционным риском, возможность проведения операции в условиях отделения реанимации, минимальная седация (нет необходимости в общем обезболивании), небольшое число послеоперационных осложнений, редкие случаи абсолютных противопоказаний, возможность начала питания с первых суток, простота ухода за гастростомой и легкость ее удаления.
На сегодняшний день ЧЭГ стала золотым стандартом среди всех способов гастростомии во всем мире[10, 17, 20]. Как и у любой другой минимально инвазивной хирургической методики, у ЧЭГ есть определенные показания и противопоказания, подробно описанные ниже.
Целью работы явились обобщение опыта использования ЧЭГ у различных категорий пациентов, уточнение показаний и противопоказаний, анализ возникших осложнений и сравнение их с таковыми при лапаротомном наложении гастростом, выработка стандарта ведения пациентов с ЧЭГ.
МАТЕРИАЛЫ И МЕТОДЫ
В клинике ФГБУ «Федеральный научно-клинический центр специализированных видов медицинской помощи и медицинских технологий» ФМБА России за период с 2010 по 2014 г. ЧЭГ была выполнена у 45 больных, которым требовалось проведение длительного энтерального питания. Среди них были 24 женщины и 21 мужчина, возраст пациентов варьировал от 19 до 76 лет (средний возраст — 53 года).
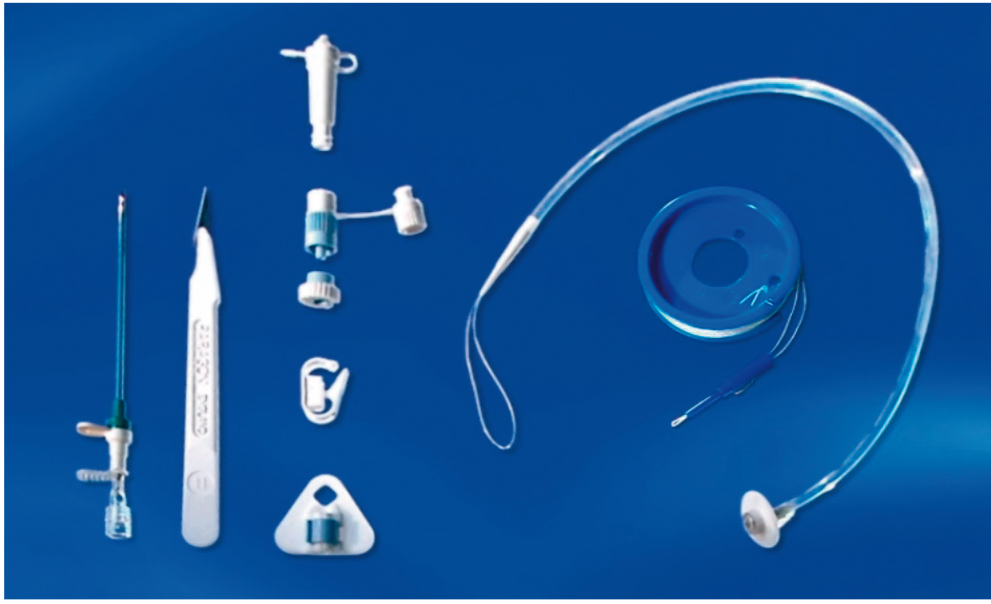
Основную группу составили 38 пациентов с заболеваниями или повреждениями головного мозга, сопровождавшимися нарушением акта глотания, угнетением сознания и прогрессирующими неврологическими расстройствами: 21 больной с острым нарушением мозгового кровообращения; 6 пациентов с тяжелой черепно-мозговой травмой; 6 — с сочетанной травмой головы, груди, живота, конечностей; 5 — с тяжелой полинейропатией с прогрессирующим течением. В этой группе пациентов средний койко-день составил 53,2 ± 8,3 дня. Еще у 7 пациентов ЧЭГ выполнялась в условиях развития постреанимационной болезни. В этой группе средний койко-день составил 61,5 ± 6,2 дня. Все операции проводили в условиях отделения реанимации. Для установления гастростомы использовали набор фирмы Fresenius Kabi (г. Москва, диаметр трубки — 20 Fr) (рис. 1).
Рис. 1. Общий вид набора для выполнения чрескожной эндоскопической гастростомии фирмы Fresenius Kabi. Фото авторов
Методика наложения чрескожной эндоскопической гастростомы
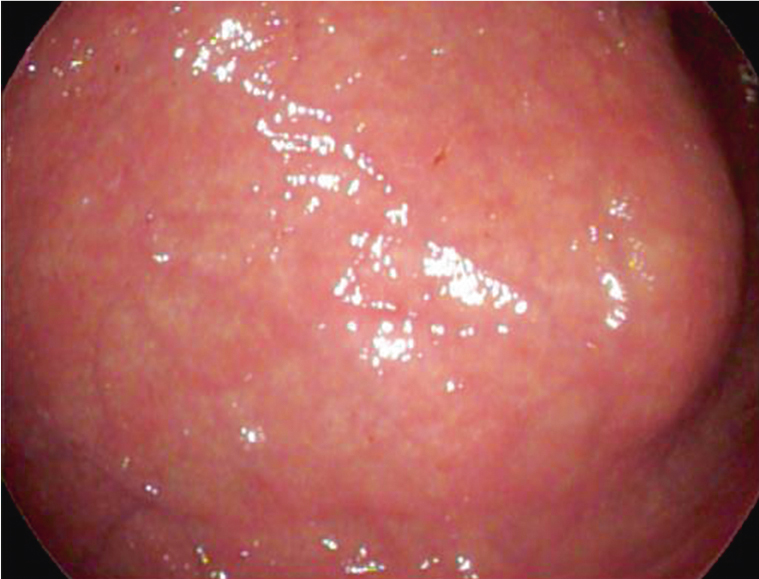
Наложение гастростомы выполнялось двумя врачами: хирургом и эндоскопистом. Больному с целью достижения седативного эффекта внутривенно вводили пропофол (2–2,5 мг/кг). На первом этапе проводили видеоэзофагогастродуоденоскопию. При осмотре желудка выполняли диафаноскопию передней брюшной стенки, в результате которой выявляли и отмечали наиболее яркую точку, что соответствовало месту непосредственного прилежания передней стенки желудка к передней брюшной стенке (рис. 2). Далее проводили второй тест — в отмеченном месте выполняли пальпацию передней брюшной стенки под контролем эндоскопа, при которой в желудке четко определяли выраженное вдавление, образуемое пальцем (рис. 3). Переднюю брюшную стенку обрабатывали антисептическим раствором и обкладывали стерильным материалом.
Рис. 2. Эффект диафаноскопии при фиброгастроскопии. Фото авторов
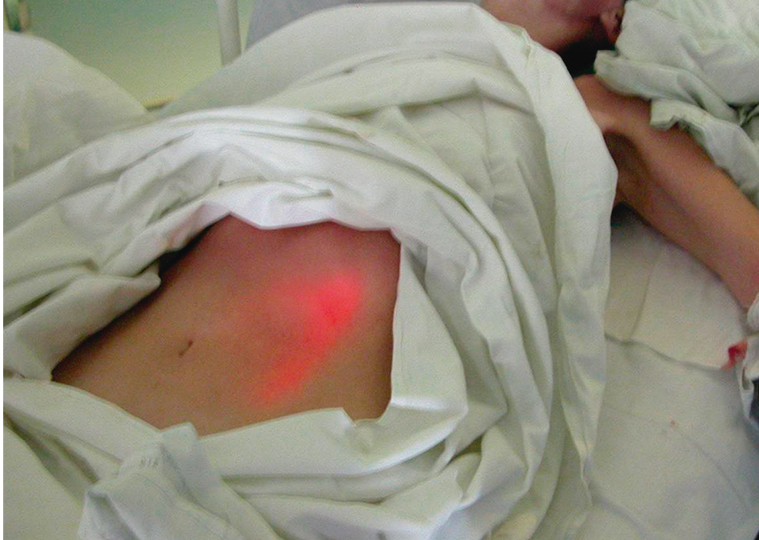
Рис. 3. Вдавление по передней стенке желудка, образуемое пальцем. Фото авторов
Под местной анестезией (10–15 мл 0,5-процентного раствора новокаина) приступали к следующему этапу — производили разрез кожи длиной 0,5–1,0 см. Под контролем эндоскопа производили пункцию передней брюшной стенки и передней стенки желудка пункционной иглой с надетой на нее канюлей из комплекта. Только после четкой визуализации иглы и канюли в просвете желудка иглу извлекали из канюли, через канюлю проводили нить в желудок, в дальнейшем захватывали ее биопсийными щипцами и выводили вместе с эндоскопом наружу через рот (рис. 4–6). Нить после извлечения из ротовой полости обрабатывали стерильной салфеткой, смоченной 70-процентным раствором этилового спирта. К обработанной нити привязывали гастростомическую трубку, имевшую на одном конце диск для внутренней фиксации (рис. 7). Вытягивая нить вместе с канюлей со стороны брюшной стенки, гастростомическую трубку проводили через пищевод, желудок и брюшную стенку до упора стопорного диска на внутреннем конце трубки в стенку желудка. В состоянии умеренного натяжения трубки эластичный диск герметизирует полость желудка и обеспечивает прижатие его стенки к париетальной брюшине. При контрольной гастроскопии следили, чтобы диск для внутренней фиксации плотно прилегал к стенке желудка. В этом состоянии гастростомическую трубку закрепляли наружной фиксирующей пластиной, под которую подкладывали стерильную салфетку (рис. 8). В течение 7 суток она менялась ежедневно, а затем 2–3 раза в неделю.
Рис. 4. Проведение нити в полость желудка через пункционную иглу. Фото авторов
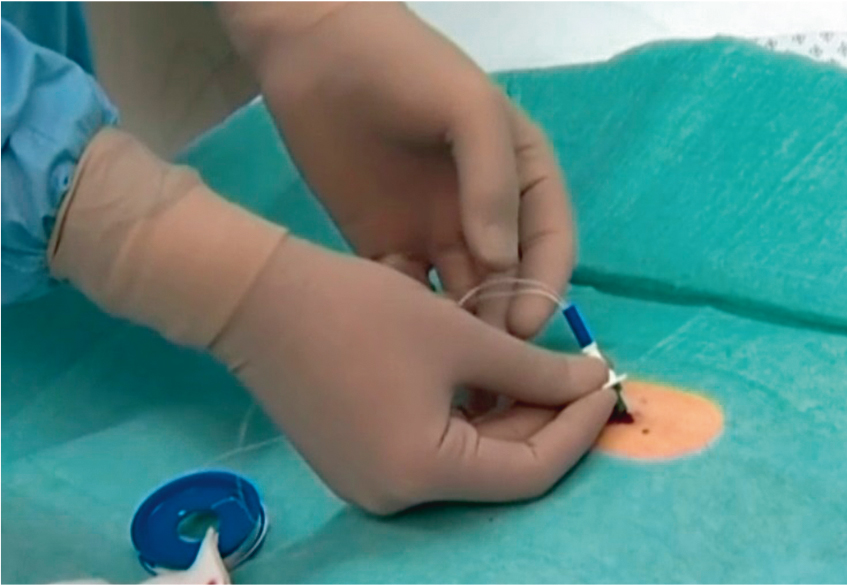
Рис. 5. Захват нити щипцами. Фото авторов
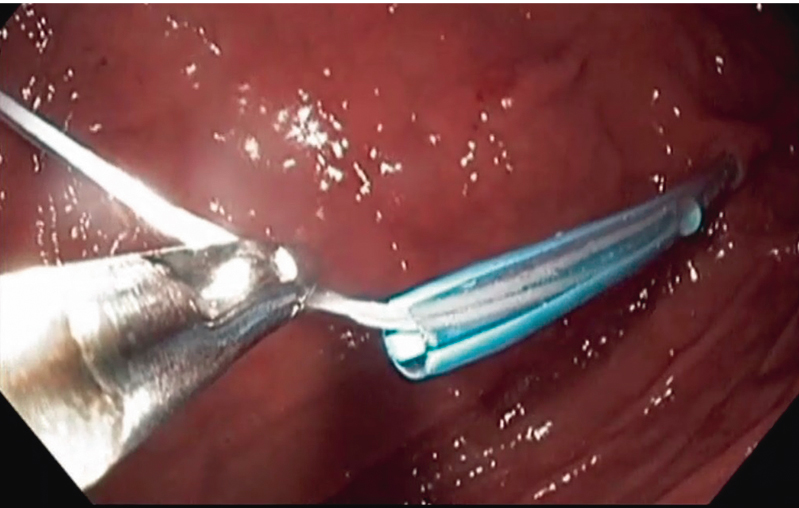
Рис. 6. Извлечение концевой части нити наружу с помощью фиброгастроскопа. Фото авторов
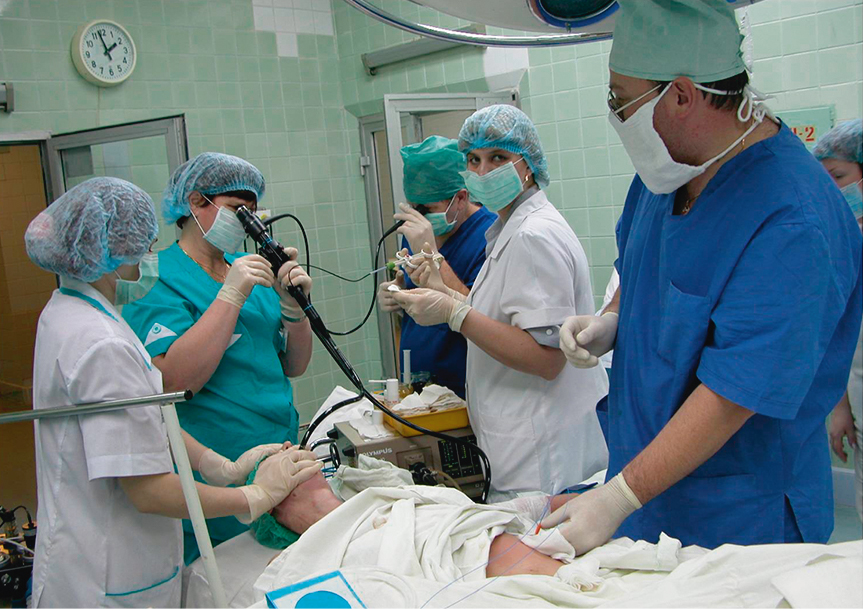
Рис. 7. Фиксация к концу нити гастростомической трубки. Фото авторов
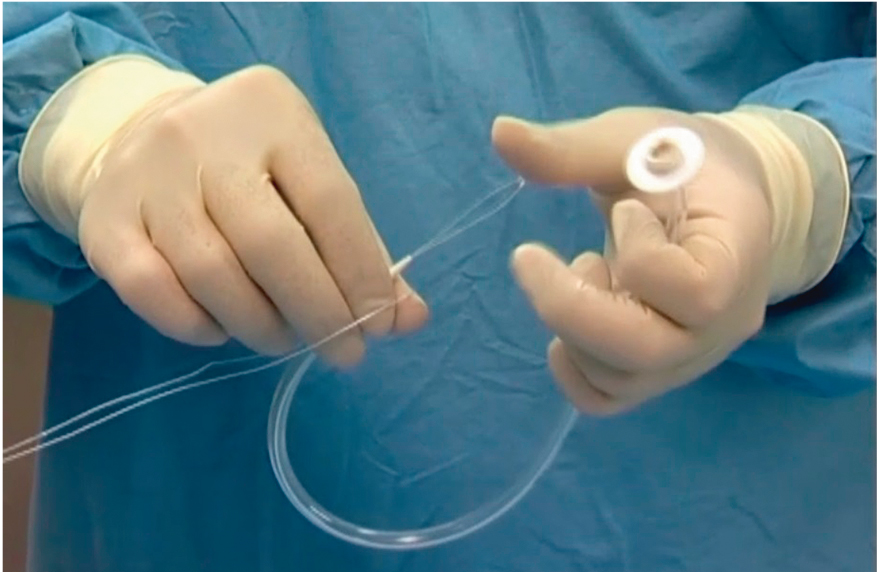
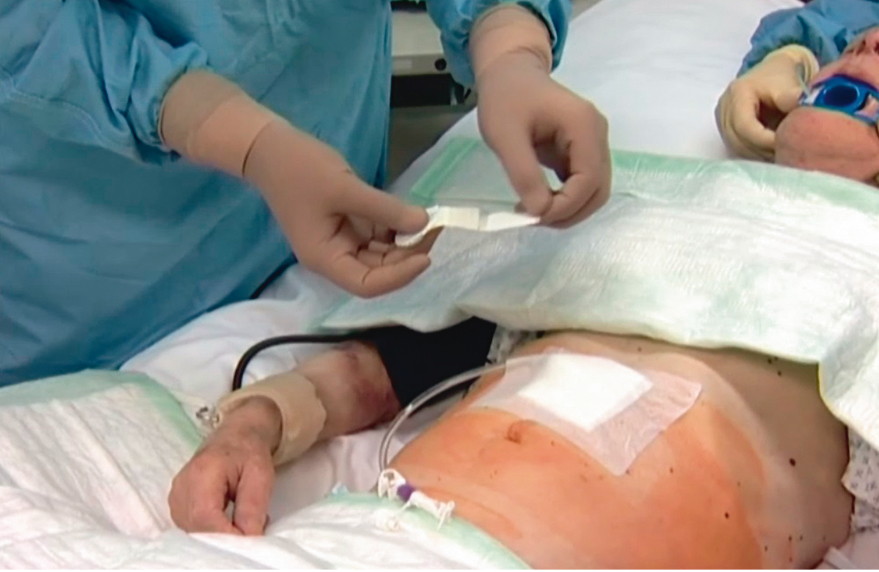
Рис. 8. Общий вид выполненной чрескожной эндоскопической гастростомы. Фото авторов
Длительность эндохирургического вмешательства в период освоения методики составляла в среднем до 25 минут, однако в дальнейшем среднее время проведения операции сократилось до 10 минут.
Удаление гастростомической трубки осуществлял эндоскопическим методом врач-эндоскопист. Больному с целью достижения седативного эффекта внутривенно вводили пропофол (2–2,5 мг/кг). Переднюю брюшную стенку обрабатывали антисептическими растворами и обкладывали стерильным материалом. Под местной анестезией (10–15 мл 0,5-процентного раствора новокаина) гастростому освобождали от наружной фиксирующей пластины, клапана и коннектора. Гастростомическую трубку срезали на уровне передней брюшной стенки. Затем проводили эзофагогастродуоденоскопию, во время которой эндоскопической петлей захватывали диск для внутренней фиксации и вместе с эндоскопом выводили его через рот. Далее накладывали несколько швов для закрытия гастростомического свища и асептическую марлевую повязку.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При выполнении ЧЭГ мы не наблюдали осложнений, связанных с установкой гастростомы. Среди 45 пациентов осложнения после наложения ЧЭГ возникли у 4 (8,4%)человек: у 1 — нагноение операционной раны у 2 — вывихивание стопорного диска из просвета желудка в пространство между париетальной брюшиной и передней стенкой желудка с прекращением функционирования гастростомы; у 1 — преждевременное выпадение гастростомической трубки.
Инфекционные осложнения, вероятно, явились следствием незначительного затека желудочного содержимого в подкожную жировую клетчатку мимо трубки. Выпадение гастростомы произошло из-за случайной сильной тракции трубки самим пациентом. Вывихивание дистального конца гастростомы с опорным диском было связано, на наш взгляд, с чрезмерным натяжением трубки и длительным ее стоянием под косым углом относительно поверхности передней брюшной стенки. Осложнений, связанных с дислокацией гастростомы, при этом не возникло, поскольку после операции прошло более 5 суток и адгезия между желудком и париетальной брюшиной была достаточной. Во всех случаях гастростома была легко восстановлена эндоскопически.
Максимальный срок наблюдений составил 2,5 года. На наш взгляд, ограничений по срокам использования ЧЭГ практически нет, продолжительность искусственного питания определяется только временем восстановления нарушенных функций. При анализе осложнений после ЧЭГ и сравнении их с таковыми при лапаротомных гастростомиях (группа из 40 больных, за период с 1995 по 2005 г.) отмечено что возникшие осложнения в группе больных с ЧЭГ были нетяжелыми, легко излечивались и не приводили к удлинению сроков лечения или дополнительным финансовым затратам. По сравнению с этим в группе больных с лапаротомными гастростомами зафиксировано 6 осложнений (15%): у 1 больного — внутрибрюшное кровотечение из коротких вен желудка, потребовавшее релапаротомии и остановки кровотечения, у 2 — нагноение послеоперационной раны; у 2 — прорезывание швов и выпадение гастростомической трубки (в обоих случаях выполнены повторные операции) и у 1 больного — послеоперационный панкреатит, купированный консервативно. Возникшие осложнения потребовали в большинстве случаев увеличения срока госпитализации и дополнительных финансовых затрат на лечение. Степень тяжести и последствия возникших осложнений в обеих группах несопоставимы.
К преимуществам ЧЭГ необходимо отнести простоту удаления гастростомической трубки, быстрое (в течение нескольких дней) заживление желудочного свища и отсутствие каких-либо негативных последствий даже при длительном сроке существования гастростомы. При ЧЭГ не возникает деформации желудка.
Показаниями для ЧЭГ являются длительные нарушения глотания, обусловленные неврологической патологией, трахеопищеводные или бронхопищеводные свищи. При проведении этой операции необходимо совместить переднюю стенку желудка с передней брюшной стенкой, что затруднительно у пациентов, перенесших ранее операции на верхнем этаже брюшной полости, со значительной гепатомегалией, а также при выраженном ожирении[1, 2].
Выделяют абсолютные и относительные противопоказания для выполнения ЧЭГ[10, 14].
Абсолютные противопоказания: фарингеальная или эзофагеальная непроходимость, не позволяющая проводить гастроскопию; непроходимость желудка или кишечника; противопоказания для энтерального питания (анурия, острый тяжелый панкреатит); коагулопатия (риск значительной кровопотери); выраженный асцит; терминальные состояния.
Относительные противопоказания: осложненные язвы желудка и двенадцатиперстной кишки; субтотальная резекция желудка; вентральные грыжи; выраженная портальная гипертензия (выраженная гепатомегалия, спленомегалия); ожирение высокой степени; перитонеальный диализ.
Для ЧЭГ характерны некоторые осложнения (4,5–5,5% случаев), которые могут возникнуть как во время операции, так и в послеоперационном периоде. Факторами, предрасполагающими к развитию интраоперационных осложнений, являются: тяжелое соматическое состояние больного во время операции; неправильное положение пациента; недостаточная диафаноскопия передней брюшной стенки; ранее выполненные хирургические вмешательства, повлекшие за собой нарушение нормальной анатомии пищевода и желудка, а также развитие гематомы в области гастростомы[6, 17].
Интраоперационные осложнения (до 2,5% случаев): кровотечение, перфорация, аспирация[10].
Послеоперационные осложнения (до 3,0% случаев): гастро-, колоно-, кожные свищи, развивающиеся при случайной пункции ободочной кишки; перистомальные инфекции; развитие травматических эрозий или язв на противоположной от гастростомы стенке и под диском для внутренней фиксации. После установки гастростомической трубки в желудок через сопоставленную с его передней стенкой ободочную кишку может развиться толстокишечная непроходимость либо перитонит как следствие перфорации кишки[4].
Осложнения, развивающиеся вследствие неправильного ухода за стомой (4%): непроходимость зонда (закупорка), являющаяся следствием введения густой смеси или лекарственных веществ; «бампер-синдром» — разрастание слизистой оболочки над диском для внутренней фиксации с полной закупоркой внутреннего отверстия зонда[17].
С нашей точки зрения, для профилактики закупорки гастростомической трубки после каждого введения смеси надо обязательно промывать гастростому кипяченой воды (20 мл). Начинать вводить энтеральное питание мы рекомендуем следующим образом:
- в 1-е сутки после установки гастростомы (на следующий день после операции) вводить пациенту глюкозоэлектролитную смесь в объеме 500 мл капельно со скоростью 100 мл/ч;
- на 2-е сутки объем глюкозоэлектролитной смеси увеличить до 1000 мл и начинать вводить питание в объеме 500 мл со скоростью 60–70 мл/ч;
- на 3-и сутки вводить пациенту питание и глюкозоэлектролитную смесь в полном объеме в виде болюсов (с помощью шприца Жане). Следует подчеркнуть достаточную простоту этих мероприятий, которая позволяет больным или родственникам больных самостоятельно вводить электролитное питание и совершать ежедневный уход за трубкой.
Для профилактики развития «бампер-синдрома» следует один раз в 2–4 дня, ослабив крепление фиксирующей пластины, поворачивать зонд вокруг своей оси на 360°, сдвигая его при этом вперед-назад на 1–2 см.
При выполнении ЧЭГ необходимы дозированная и контролируемая компрессия опорного диска гастростомы на стенку желудка, строго перпендикулярное положение гастростомической трубки по отношению к плоскости передней брюшной стенки в первые 7 суток, отсутствие значимого натяжения при сближении передней стенки желудка с передней брюшной стенкой; наложение гастростомы желательно в верхней или средней трети желудка, ближе к большой кривизне.
Таким образом, ЧЭГ является минимально инвазивным вмешательством, ее можно проводить в отделении реанимации (при условии соблюдения всех правил антисептики).
Выводы
- Среди многочисленных вариантов гастростомии ЧЭГ сопровождается минимальными послеоперационными осложнениями и является наиболее простым, минимально травматичным, безопасным и достаточно эффективным способом обеспечения длительного искусственного питания практически без ограничения его продолжительности.
- ЧЭГ можно считать методом выбора при необходимости длительного (более 4 недель) искусственного энтерального питания у пациентов с заболеваниями или повреждениями головного мозга, сопровождающимися нарушением акта глотания и некоторыми другими выраженными неврологическими расстройствами.
- ЧЭГ создает возможности для более раннего начала питания и не требует повторной операции для закрытия гастростомы, что определяет ее преимущества перед традиционными хирургическими методами энтерального питания.
ЗАКЛЮЧЕНИЕ
Как показывают наш пока еще небольшой опыт и данные других авторов[1, 6, 10, 18], метод чрескожной эндоскопической гастростомии (ЧЭГ) прост и безопасен при выполнении, он не требует применения общей анестезии и использования операционной. ЧЭГ предпочтительна у соматически тяжелых пациентов, когда не только традиционная операция, но и общий наркоз представляют большой риск для больного. Существуют определенные факторы, которые усложняют или даже делают невозможным применение данного метода: ожирение III степени, грубая деформация желудка, оперированный желудок, спаечный процесс брюшной полости, органические сужения пищевода. Кроме того, очень важно, особенно в первую неделю, осуществлять послеоперационный уход за гастростомической трубкой, строго соблюдать правила, в том числе указанные выше, во избежание дислокации трубки, герметичной и дозированной компрессии передней стенки желудка и передней брюшной стенки. Положительной стороной методики является отсутствие грубой деформации передней стенки желудка, что делает ее пригодной в случаях формирования желудочного стебля при реконструктивно-пластических операциях на желудке и пищеводе по поводу рака пищевода. Удаление при необходимости гастростомической трубки не вызывает никаких проблем и может быть осуществлено в амбулаторных условиях.
Метод ЧЭГ можно рекомендовать к широкому применению в клинической практике у пациентов для длительного энтерального питания.







