Пробиотики — это живые микроорганизмы, которые при назначении в адекватных количествах оказывают благотворное влияние на здоровье[26]. Под пробиотиками понимают лекарственные препараты или биологически активные добавки (БАД) к пище, которые содержат штаммы бактерий, являющихся представителями нормальной микрофлоры человека, и способны оказывать положительное влияние на макроорганизм.
Помимо пробиотиков, широко применяются пребиотики, представляющие собой неперевариваемые компоненты пищи, улучшающие здоровье человека путем стимуляции роста или метаболической активности бактерий, населяющих толстый кишечник. Пребиотик не должен перевариваться пищеварительными ферментами человека и абсорбироваться в верхних отделах пищеварительного тракта. При этом он должен быть субстратом для роста определенной группы бактерий, живущих в толстом кишечнике[10]. Основными пребиотиками являются инулин, олигосахариды, лактулоза и т. д.[28, 35]. Необходимо отметить, что пребиотики содержатся во многих продуктах питания, таких как крупы, хлеб, фасоль, бананы и др.
Не так давно в России стали доступны синбиотики, которые объединяют в своем составе пробиотик и пребиотик. За счет наличия в составе синбиотика среды для жизнедеятельности бактерий (пребиотика) улучшается приживаемость микроорганизмов, являющихся пробиотиками[14].
Большинство пробиотиков — это бактерии, представляющие нормальную микрофлору человека и продуцирующие молочную кислоту (бифидобактерии и лактобактерии)[15]. Лактобактерии являются факультативными анаэробами (т. е. могут переносить небольшое количество кислорода во внешней среде, но лучше растут без кислорода), бифидобактерии — облигатными анаэробами (т. е. вообще не переносят кислород). Из других микроорганизмов нужно отметить дрожжевые грибы Saccharomyces boulardii, которые используются в производстве пива и вина[15]. Основные микроорганизмы-пробиотики представлены в таблице 1[26].
Таблица 1
Основные микроорганизмы-пробиотики[26]
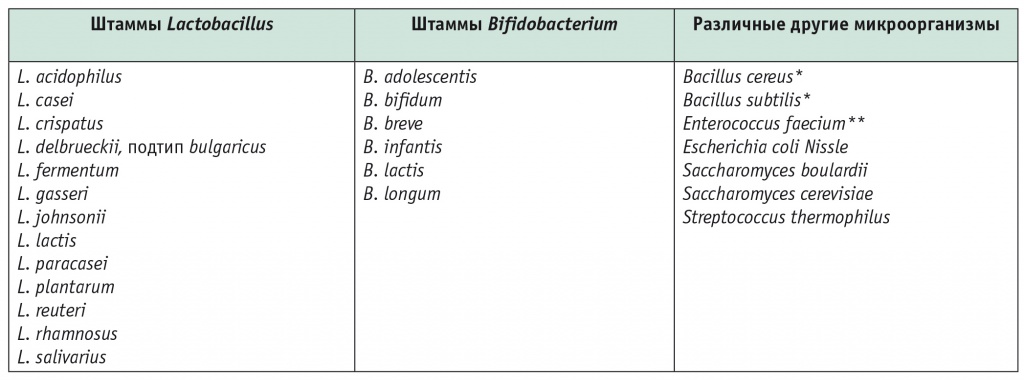
* Пробиотическая активность точно не установлена.
** Остается открытым вопрос о безопасности из-за потенциальной патогенности E. faecium и резистентности энтерококков к ванкомицину[9].
Положительные эффекты пробиотиков реализуются тремя основными путями: усилением барьерной функции организма за счет взаимодействия пробиотиков с эпителиальными клетками и клетками иммунной системы, находящимися в ЖКТ; влиянием на микробиоту кишечника; модуляцией иммунного ответа[27].
Рынок пробиотиков является одним из наиболее активно растущих. Ежегодный объем продаж пробиотиков в мире к 2016 г. достигнет 42 млрд. долларов США[24]/span>, что подтверждает их высокую востребованность.
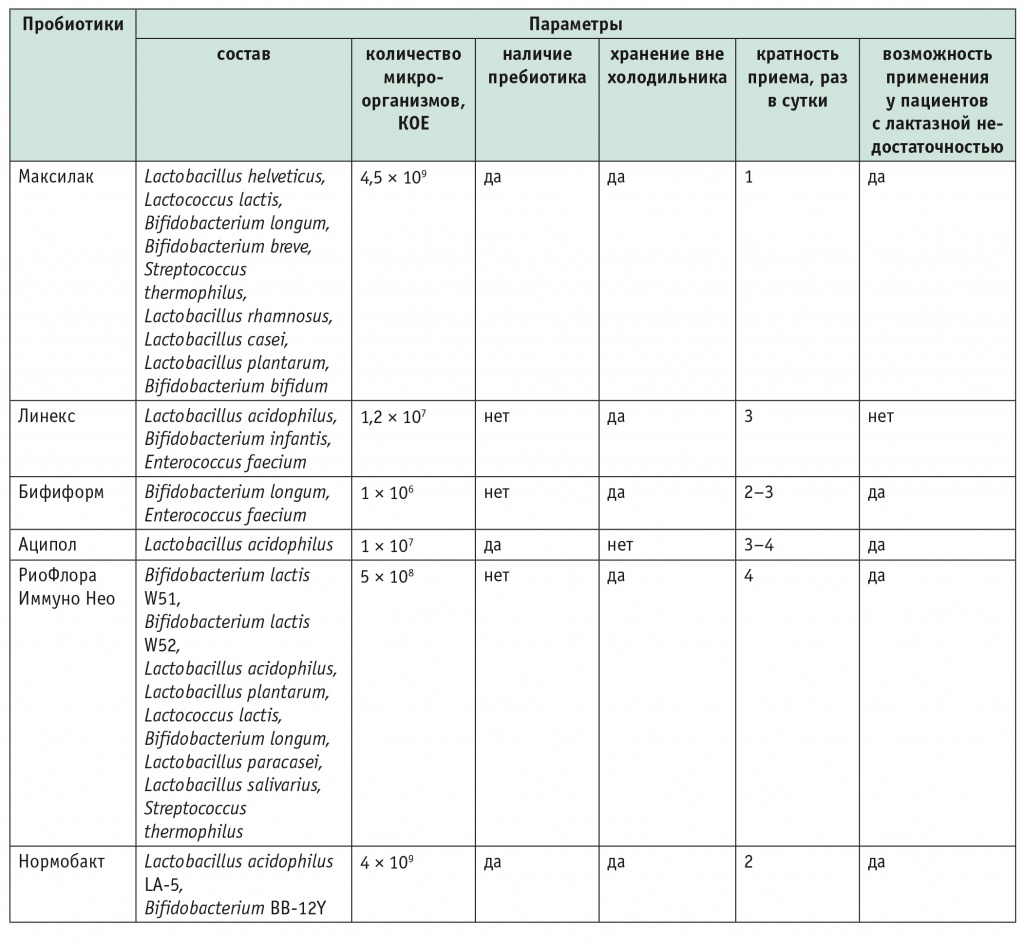
Сегодня пробиотики широко применяются пациентами самостоятельно и назначаются врачами в клинической практике. Необходимо отметить, что пробиотики могут содержаться в пищевых продуктах (таких, как, например, йогурты или кисломолочные продукты), иметь статус БАД (например, Максилак) или лекарственного препарата (например, Энтерол, Линекс и др.). В США, в Великобритании и ряде других стран Европы пробиотики относят к продуктам питания и БАД, а не к лекарственным средствам. В связи с этим в отношении пробиотиков не существует установленных регуляторных требований, касающихся качества доступных коммерческих препаратов. В России, по данным DSM Group (2014), наиболее продаваемыми пробиотиками являются Линекс, Бифиформ, Хилак форте, Аципол, Нормобакт, Максилак и РиоФлора Иммуно Нео (табл. 2)[1].
Таблица 2
Характеристика наиболее продаваемых в России пробиотиков (данные DSM Group, 2014)[1]
ПРИМЕНЕНИЕ ПРОБИОТИКОВ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
Острая диарея
С учетом общемировой тенденции к росту антибиотикорезистентности возбудителей инфекций самой различной локализации особый интерес проявляется к методам лечения и профилактики инфекционных заболеваний без применения антибиотиков.
Одним из наиболее перспективных направлений в лечении инфекций ЖКТ является использование пробиотиков, которые колонизируют стенку кишечника и ограничивают избыточный рост патогенных бактерий, а также конкурируют за рецепторы слизистой, уменьшая тем самым адгезию и рост энтеротоксичных грамотрицательных анаэробов и энтеропатогенных вирусов.
В клинических исследованиях доказана эффективность L. rhamnosus GG, L. reuteri, L. casei и B. lactis при лечении острой ротавирусной диареи[15]. Положительные эффекты лактобактерий и бифидобактерий обусловлены их способностью (1) секретировать вещества, обладающие антибактериальными свойствами, (2) снижать кислотность кишечного содержимого, позволяя полезным бактериям размножаться на поверхности слизистой, и (3) проявлять иммуномодулирующий эффект, уменьшая выраженность воспаления в стенке кишечника[27].
Применение пробиотиков при лечении острой диареи наиболее подробно изучено в клинических исследованиях с участием детей. На сегодняшний день опубликованы результаты более 40 рандомизированных контролируемых исследований (РКИ) и целого ряда метаанализов, посвященных использованию пробиотиков для профилактики и лечения острой диареи у детей[12, 25, 29].
В частности, Европейским обществом педиатрической гастроэнтерологии, гепатологии и питания (European Society of Pediatric Gastroenterology, Hepatology and Nutrition) проведено крупномасштабное исследование по применению L. rhamnosus GG в лечении средне-тяжелой и тяжелой острой диареи у больных детского возраста[12]. В исследовании приняли участие 287 детей из 10 стран в возрасте от 1 до 36 месяцев. Пациенты, получавшие стандартное лечение — регидратационную терапию, были рандомизированы в две группы: дети из первой группы получали L. rhamnosus GG, а из второй — плацебо. Прием лактобактерий способствовал сокращению длительности диареи в среднем на 14 часов, а у детей с ротавирусной этиологией — на 20 часов; кроме того, в группе применения L. rhamnosus GG уменьшались сроки пребывания в стационаре и снижалась вероятность длительной персистенции диареи[12].
В исследовании с похожим дизайном, выполненном отечественными учеными, установлено, что использование L. rhamnosus GG сокращает продолжительность ротавирусной диареи на одни сутки (различия с плацебо статистически значимы)[29]. Еще в одном РКИ применение L. rhamnosus GG у пациентов с водянистой диареей сокращало вероятность ее персистирования на вторые сутки (31% в группе пробиотика и 75% в группе плацебо, р < 0,01) и уменьшало количество эпизодов рвоты[25].
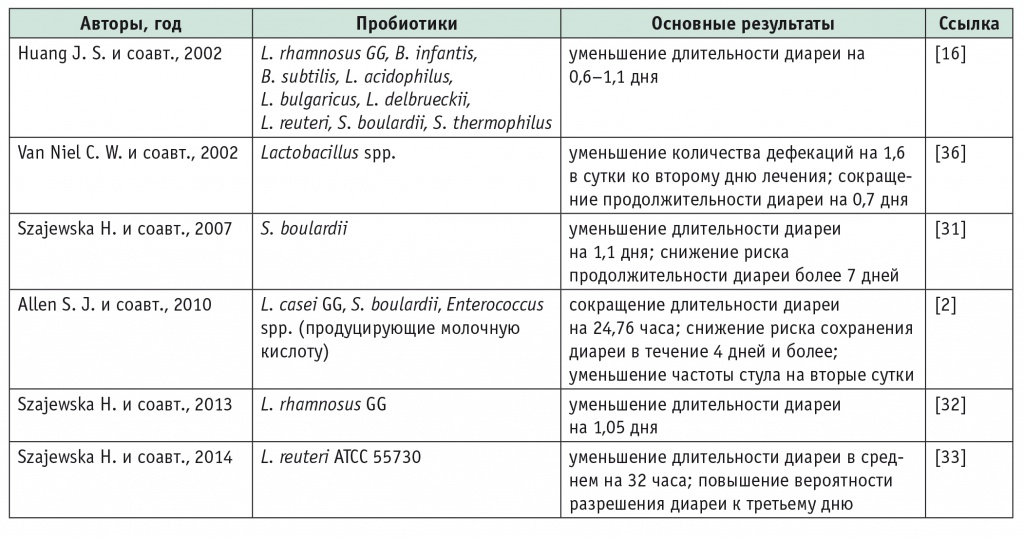
Высокую эффективность пробиотиков в лечении острой диареи подтверждают результаты метаанализов. Так, в 2002 г. опубликован метаанализ 18 РКИ, в которых изучалась эффективность стандартной регидратационной терапии в сочетании с пробиотиками в лечении острой диареи у детей[16]. В числе пробиотиков в исследованиях применялись L. rhamnosus GG, B. infantis, B. subtilis, L. acidophilus, L. bulgaricus, L. delbrueckii, L. reuteri, S. boulardii и S. thermophilus. В большинстве случаев выявлено уменьшение продолжительности диареи на 0,6–1,0 дня, в трех исследованиях — на 1,5–3,0 дня (табл. 3). Следует отметить, что при применении лактобактерий продолжительность диареи сокращалась наиболее значительно — на 1,1 дня[16].
Таблица 3
Метаанализы применения пробиотиков при острой диарее
В другом метаанализе при использовании лактобактерий в сравнении с плацебо выявлены уменьшение количества дефекаций ко второму дню лечения на 1,6 в сутки (различия статистически значимы) и сокращение продолжительности диареи у детей в среднем на 0,7 дня[36].
В рамках Кокрановского сотрудничества выполнен метаанализ, в ходе которого оценивалась эффективность пробиотиков (L. casei GG, S. boulardii, Enterococcus spp.) при доказанной или предполагаемой острой инфекционной диарее у детей и взрослых[2]. Установлено, что пробиотики уменьшают продолжительность диареи, однако выраженность эффекта в разных исследованиях в значительной степени варьировала. Применение пробиотиков статистически значимо влияло на длительность диареи (среднее различие — 24,76 часа; n = 4555; 35 исследований), риск сохранения диареи в течение 4 дней и более (отношение рисков — 0,41; n = 2853; 29 исследований) и частоту стула на вторые сутки (среднее различие — 0,8; n = 2751; 20 исследований). В исследованиях не было зарегистрировано нежелательных явлений (НЯ), связанных с использованием пробиотиков. Данный анализ продемонстрировал, что использование пробиотиков (L. casei GG, S. boulardii, Enterococcus spp.) наряду со стандартной регидратационной терапией безопасно и обладает явным полезным эффектом, сокращая длительность острой инфекционной диареи и снижая частоту стула[2].
В метаанализе, выполненном в 2007 г. и обновленном в 2013 г., оценивалась эффективность L. rhamnosus GG при терапии острого гастроэнтерита у детей[32]. Были изучены результаты 15 РКИ. Комбинированные данные из 11 исследований (n = 2444) показали, что L. rhamnosus GG статистически значимо уменьшает длительность диареи по сравнению с плацебо и отсутствием лечения (среднее различие — 1,05 дня). Кроме того, было установлено, что количество лактобактерий в пробиотике влияет на эффективность лечения: лактобактерии оказались более эффективны, когда использовались в суточной дозе ≥ 1010 КОЕ (среднее различие — 1,11 дня; n = 1488; 8 РКИ), по сравнению с суточной дозой < 1010 КОЕ (среднее различие — 0,9 дня; n = 956; 3 РКИ)[32].
Таким образом, положительные эффекты применения пробиотиков в лечении острой диареи на сегодняшний день подтверждены множеством клинических исследований и метаанализов.
Профилактика и лечение антибиотикоассоциированной диареи
Антибиотикотерапия часто сопровождается изменением качественного и количественного состава кишечной микробиоты, что может проявляться развитием диареи, которая получила название антибиотикоассоциированной диареи (ААД).
Частота ААД может варьировать в значительных пределах — от 3% до 29%[3]. Применение пробиотиков для лечения и профилактики ААД является вполне логичным с точки зрения патогенеза данного состояния.
Механизм действия пробиотиков при лечении и профилактике диареи имеет несколько аспектов: для S. boulardii — это продукция протеолитических ферментов, которые препятствуют связыванию токсинов А и В, вырабатываемых Clostridium difficile, с рецепторами[4]; для Lactobacillus spp. — стимуляция местного иммунитета слизистой кишечника (синтез IgA и IgG, высвобождение ИФН), выработка соединений, обладающих антимикробной активностью, и препятствие адгезии энтеропатогенов к эпителиоцитам[8].
Эффективность пробиотиков в профилактике и лечении ААД продемонстрирована в серии клинических исследований и метаанализов (табл. 4).
Таблица 4
Метаанализы применения пробиотиков для профилактики антибиотикоассоциированной диареи
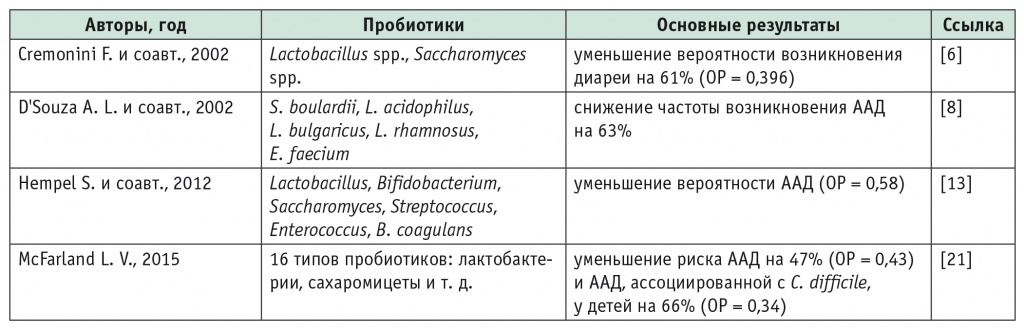
Примечание. ААД — антибиотикоассоциированная диарея, ОР — относительный риск.
В первый метаанализ были включены РКИ по изучению эффективности пробиотиков в сравнении с плацебо для профилактики ААД. Критериям включения в метаанализ (применение Lactobacillus spp. и Saccharomyces spp.) соответствовали 22 исследования, однако только семь из них с общим числом пациентов 881 были гомогенны. По результатам этого метаанализа отмечалась выраженная польза от назначения пробиотиков (обобщенный ОР = 0,396)[6].
Результаты второго метаанализа показали, что пробиотики, в частности дрожжевые грибки и лактобактерии, помогают предотвратить ААД. Из девяти обнаруженных рандомизированных контролируемых исследований, опубликованных в период с 1966 по 2000 г., в двух изучалось применение пробиотиков у детей. В четырех исследованиях использовались дрожжевые грибки (обычно S. boulardii), еще в четырех — лактобактерии (L. acidophilus, L. bulgaricus, L. rhamnosus), и в одном применялись штаммы энтерококков, продуцирующие молочную кислоту (E. faecium). Во всех девяти случаях пробиотики назначались вместе с антибиотиками, в то время как контрольные группы получали антибиотики и плацебо. При анализе данных были выявлены преимущества терапии пробиотиками. Количество случаев диареи, вызванной антибиотиками, при применении пробиотиков было на 63% ниже, чем в контроле, причем прием дрожжевых грибков снизил частоту возникновения диареи на 61% (р < 0,001), а прием лактобактерий — на 66% (р < 0,01)[8].
В ходе третьего систематического обзора и метаанализа (2012) проводилась оценка эффективности и безопасности пробиотиков в профилактике возникновения ААД у детей и взрослых пациентов, получающих антибиотики[13]. Было установлено, что применение пробиотиков (Lactobacillus, Bifidobacterium, Saccharomyces, Streptococcus, Enterococcus, B. coagulans) достоверно уменьшает вероятность возникновения ААД (ОР = 0,58; 95%-й ДИ: 0,5–0,68; p < 0,001)[13].
В метаанализе, опубликованном в 2015 г., показано, что применение пробиотиков (16 различных типов) статистически значимо снижает риск развития ААД (объединенный ОР = 0,43; 95%-й ДИ: 0,33–0,56) и ААД, ассоциированной с C. difficile, у детей (объединенный ОР = 0,34; 95%-й ДИ: 0,16–0,74)[21].
В рандомизированном контролируемом исследовании изучалась эффективность лечения ААД, вызванной C. difficile, при применении стандартных режимов антибиотикотерапии (ванкомицин или метронидазол) в сочетании с пробиотиком S. boulardii или плацебо[23]. Было установлено, что у пациентов с рецидивирующей диареей добавление пробиотика к стандартной терапии сопровождается статистически значимым уменьшением риска рецидива ААД, вызванного C. difficile (ОР = 0,43; 95%-й ДИ: 0,20–0,97), по сравнению с плацебо[23]. Однако в данном исследовании не выявлено значимых различий между пробиотиком и плацебо у пациентов с первым эпизодом диареи, вызванной C. difficile, т. е. в ситуации, когда диарея не была рецидивирующей.
В рандомизированном исследовании, проведенном учеными из Швеции, изучалась способность пробиотика L. plantarum при совместном назначении с антибиотиком предотвращать побочные эффекты со стороны ЖКТ[19]. Пациенты, проходившие лечение инфекции антибиотиками в клинике университетского госпиталя, ежедневно получали либо фруктовый напиток, обогащенный L. plantarum 299v (1010 КОЕ/сут), либо плацебо на протяжении всего курса антибиотиков и в течение одной недели после его завершения. Общий риск развития учащенного или жидкого стула оказался статистически значимо ниже в группе пациентов, получавших L. plantarum (отношение шансов (ОШ) = 0,69; 95%-й ДИ: 0,52–0,92; р = 0,012); то же самое наблюдалось в отношении тошноты (ОШ = 0,51; 95%-й ДИ: 0,30–0,85; р = 0,0097). Однако применение пробиотика не повлияло на риск развития диареи, определявшейся как три или более эпизодов жидкого стула за 24 часа или в течение двух или более последовательных дней (ОШ = 1,4; 95%-й ДИ: 0,33–6,0; р = 0,86). Между группами не было обнаружено также статистически значимых различий в частоте носительства токсинопродуцирующих штаммов C. difficile[19].
Диарея путешественников
Частота возникновения диареи путешественников варьирует от 5% до 50% в зависимости от места путешествия. Необходимо отметить, что наиболее высокий риск ее развития наблюдается у лиц, отправляющихся в тропические и субтропические районы, включая Латинскую Америку, частично Карибы, Южную Азию и Африку.
Учитывая столь высокую заболеваемость, диарея путешественников является значимой областью научных исследований и изысканий, поскольку она поражает миллионы туристов каждый год и наносит глобальный экономический ущерб. Диарея путешественников обычно имеет тенденцию к самостоятельному разрешению с длительностью симптомов менее одной недели и является, несомненно, самым частым расстройством, встречающимся у этой категории граждан[7].
В большинстве случаев данное заболевание вызывается бактериальными энтеропатогенами: Escherichia coli, Shigella, Campylobacter, Salmonella, Aeromonas, Plesiomonas и нехолерными вибрионами. Среди небактериальных патогенов следует выделить норовирусы (РНК-содержащие вирусы семейства Caliciviridae), которые являются частой причиной заболеваний ЖКТ у путешественников[7]. При диарее путешественников основной акцент делается на профилактических мероприятиях, поскольку у всех пациентов с диареей нетрудоспособность сохраняется около 24 часов, а у 5–10% лиц возникают хронические функциональные расстройства кишечника.
Известно, что одним из подходов к профилактике диареи путешественников является назначение антибиотиков, эффективных против ведущих бактериальных возбудителей этого заболевания: энтеротоксигенной E. coli, представителей семейства Enterobacteriaceae, Campylobacter и нехолерных вибрионов[3, 30]. Наряду с высокой эффективностью, антибиотики имеют ряд значимых недостатков, включая потенциальную возможность возникновения аллергических реакций и фоточувствительности (фторхинолоны, тетрациклины), ААД, кандидозного вагинита и развития антибиотикорезистентности. Поэтому их следует применять только у путешественников с иммунодефицитами, неспецифическим воспалительным заболеванием кишечника или в тех ситуациях, когда диарея путешественников грозит серьезными медицинскими и социальными последствиями.
Эффективность пробиотиков для профилактики диареи путешественников продемонстрирована в метаанализе 12 РКИ[22]. Как оказалось, S. boulardii и комбинация L. acidophilus и Bifidobacterium bifidum статистически значимо предотвращают возникновение диареи путешественников (объединенный ОР = 0,85; 95%-й ДИ: 0,79–0,91; p < 0,001) и могут быть предложены в качестве эффективного и безопасного метода профилактики данного заболевания[22]. Пробиотик Lactobacillus GG отличается резистентностью к стерилизации желудочным соком и желчью и способностью к осаждению и колонизации кишки; результаты различных исследований по применению Lactobacillus GG являются многообещающими в отношении использования именно этого пробиотика в качестве средства профилактики диареи путешественников[22].
Эрадикация Helicobacter pylori
Данные многочисленных исследований свидетельствуют о том, что до 50% жителей экономически развитых стран и до 90% людей, проживающих в развивающихся странах, инфицированы H. pylori[17]. На сегодняшний день доказана роль H. pylori в развитии не только заболеваний ЖКТ (гастрит, язва, рак желудка и опухоль желудка, развивающаяся из лимфоидной ткани, ассоциированной со слизистыми оболочками, — MALT-лимфома), но и аллергии, сахарного диабета и его осложнений, кардиоваскулярных, гематологических заболеваний и т. д.[11].
Тройная терапия, включающая в себя ИПП и два антибиотика, широко используется во всем мире для лечения заболеваний, ассоциированных с H. pylori, однако в связи с ростом антибиотикорезистентности отмечается снижение ее эффективности (в ряде стран на 20% и более). Нельзя не отметить также довольно высокую частоту НЯ, сопровождающих тройную терапию (до 30–40%)[11]. В связи с этим в настоящее время ведется поиск методов повышения эффективности и безопасности эрадикационной терапии.
Большинство исследований свидетельствуют об эффективности пробиотиков в лечении инфекции, вызванной H. pylori, однако им свойственны разнородность, небольшое число пациентов, отсутствие единого подхода к оценке эффективности эрадикации, разница в схемах терапии, использование различных штаммов пробиотических микроорганизмов, а также различных комбинаций пробиотиков.
Необходимо отметить, что некоторые пробиотики обладают довольно высокой антихеликобактерной активностью (более 80%). Таким пробиотиком является, например, B. bifidum. Данный штамм снижает способность H. pylori прикрепляться к слизистой оболочке желудка по механизму прямой конкуренции за мишень[5]. Помимо антихеликобактерной активности, B. bifidum обладает способностью восстанавливать поврежденную слизистую желудка. Все вышеперечисленное создает хорошие предпосылки для использования B. bifidum при проведении эрадикации H. pylori.
В 2013–2015 гг. был опубликован ряд метаанализов, продемонстрировавших положительный эффект добавления пробиотиков к стандартным схемам эрадикации H. pylori (табл. 5).
Таблица 5
Метаанализы применения пробиотиков для эрадикации Helicobacter pylori
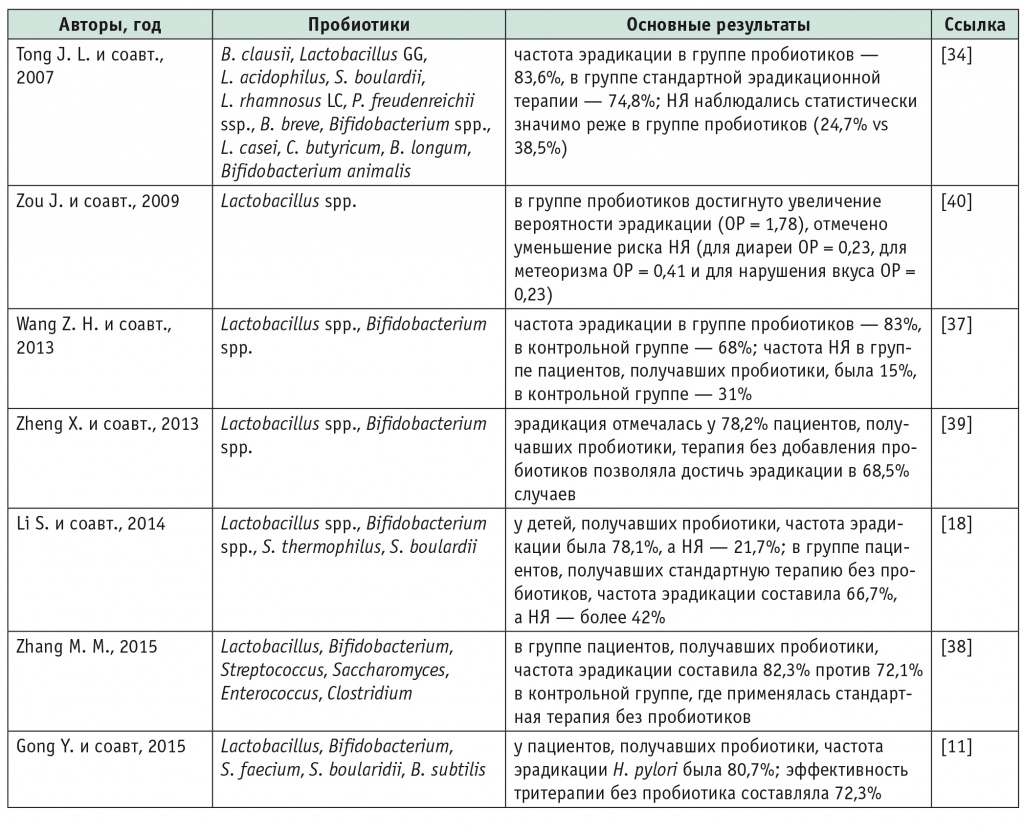
В метаанализе, выполненном Z. H. Wang и соавт. (2013), проанализированы 10 исследований (девять с участием взрослых, одно с участием детей) с общим числом пациентов 1469 человек[37]. В анализ были включены исследования, в которых в параллельных группах сравнивалась эффективность стандартной терапии (ИПП, два антибиотика плюс плацебо) и лечения с пробиотиками (стандартная терапия с добавлением лактобактерий или бифидобактерий вместо плацебо). Частота эрадикации H. pylori у пациентов, получавших пробиотики (83%), была статистически значимо выше, чем при стандартном лечении (68%). При этом использование пробиотиков позволило уменьшить частоту НЯ практически в 2 раза (15% vs 31%)[37].
По данным метаанализа, включавшего девять исследований, добавление пробиотиков, содержащих лактобактерии, к тройной или последовательной терапии позволяло повысить частоту эрадикации H. pylori с 68,5% до 78,2%[39].
Представляют интерес результаты метаанализа семи исследований с участием 508 детей[18]. В исследованиях сравнивались эффективность и безопасность трехкомпонентной схемы эрадикации с пробиотиками (содержавшими несколько видов бактерий — лактобактерии, бифидобактерии, S. thermophilus и S. boulardii) и без них. У детей, получавших пробиотики, частота эрадикации составила 78,1%, а частота НЯ — 21,7%. В группе пациентов, получавших стандартную терапию без пробиотиков, эрадикация H. pylori была достигнута в 66,7% случаев, а частота НЯ превышала 42%[18].
В крупномасштабном метаанализе (45 РКИ, 6997 пациентов) показано, что добавление пробиотиков разных типов способствовало повышению частоты эрадикации H. pylori с 72,1% до 82,3%[38]. Кроме того, в группе пациентов, получавших пробиотики, частота НЯ (21,4%) была ниже, чем при стандартной терапии без пробиотиков (36,3%) (ОР = 0,59; 95%-й ДИ: 0,48–0,71; p < 0,001). Использование пробиотиков практически не влияло на приверженность пациентов лечению (ОР = 0,98; 95%-й ДИ: 0,68–1,39; p = 0,889)[38].
В своем метаанализе Y. Gong и соавт. (2015) показали, что тройная терапия в сочетании с пробиотиками (лактобактериями, бифидобактериями, S. faecium, S. boularidii, Bacillus subtilis) позволяет добиться эрадикации H. pylori в 80,7% случаев, в то время как эффективность тритерапии без пробиотика составляет 72,3% (ОШ = 0,58; 95%-й ДИ: 0,5–0,68)[11]. Применение пробиотиков не влияло на частоту потери аппетита (ОШ = 0,94; 95%-й ДИ: 0,61–1,45). В то же время пробиотики уменьшали частоту развития тошноты (7% vs 11,9%), диареи (6,3% vs 14,7%), боли в эпигастрии (8,9% vs 11,7%), рвоты (2,5% vs 7,2%) и кожной сыпи (3,8% vs 11,5%)[11].
Таким образом, использование пробиотиков при проведении эрадикационной терапии H. pylori у взрослых и детей статистически значимо повышает эффективность лечения и улучшает его переносимость. Положительные эффекты пробиотиков при лечении инфекций, ассоциированных с хеликобактером, нашли отражение в последнем пересмотре рекомендаций по диагностике и лечению инфекции H. pylori — Маастрихт IV, подготовленных Европейской группой по изучению инфекции H. pylori[20]. Так, в данных рекомендациях впервые предложено использовать пробиотики в качестве адъювантной терапии при проведении эрадикации H. pylori за счет их способности повышать эффективность лечения и уменьшать частоту побочных эффектов[20].
ЗАКЛЮЧЕНИЕ
Результаты многочисленных клинических исследований и метаанализов подтверждают высокую эффективность пробиотиков в профилактике и лечении инфекционных заболеваний ЖКТ как у взрослых, так и у детей. Наряду с этим, совместное назначение пробиотиков с антибиотиками при лечении антибиотикоассоциированной диареи и заболеваний, ассоциированных с H. pylori, улучшает переносимость терапии и повышает ее эффективность.







