Однако в длительном динамическом наблюдении за больными целиакией выявлена некоторая часть пациентов, которых даже при строгом следовании АГД продолжают беспокоить такие клинические симптомы, как вздутие живота, метеоризм и неустойчивый стул [6].
Долговременному сохранению симптомов может способствовать медленное восстановление СОТК у больных целиакией, в среднем превышающее 8 лет (медиана — 8,1 года, показатели — от 2,3 до 22,3 года) [10]. Помимо этого, наличие данных симптомов можно связать с нарушением мембранного пищеварения вследствие угнетения карбогидразной активности СОТК. Имеются исследования, свидетельствующие о наличии лактазной недостаточности при целиакии [1, 2, 5]. Сведений о характере изменения активности других карбогидраз (мальтазы, сахаразы и глюкоамилазы) крайне мало. По нашим данным, она снижается у 87,5% больных с впервые выявленным заболеванием [4]. Кроме того, часть исследователей полагают, что у лиц с целиакией, соблюдающих АГД, могут наблюдаться симптомы синдрома раздраженного кишечника (СРК) [11, 18].
Таким образом, у части больных целиакией, соблюдающих АГД, имеются клинические симптомы, подобные СРК, которые могут быть связаны с наличием у них сниженной ферментативной активности кишечных карбогидраз.
Целью настоящей работы явилась оценка активности кишечных карбогидраз (глюкоамилазы, мальтазы, сахаразы и лактазы) у больных целиакией, строго соблюдающих АГД.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении невоспалительной патологии кишечника Московского клинического научно-практического центра Департамента здравоохранения г. Москвы обследовали 36 больных целиакией (25 женщин и 11 мужчин) в возрасте от 18 до 74 лет. Средний возраст пациентов составил 42,0 ± 17,5 года (у мужчин — 35,8 ± 19,1, у женщин — 44,7 ± 17,6). Всем обследованным ранее был установлен диагноз целиакии, в связи с чем они строго соблюдали АГД от 6 месяцев до 35 лет (в среднем 10,6 ± 9,0 года). В зависимости от длительности АГД больные распределились следующим образом: до 1 года — трое больных (8,3%); от 1 года до 5 лет — 13 (36,1%); от 6 до 10 лет — 11 (30,6%) и более 10 лет — 9 (25,0%).
Контрольную группу составили 20 практически здоровых лиц (8 мужчин и 12 женщин, средний возраст — 37,4 ± 13,6 года).
Больных обследовали в соответствии со стандартами диагностики целиакии. Уровни антител иммуноглобулинов А и G к тканевой трансглутаминазе и глиадину определяли с помощью иммуноферментного метода и коммерческих наборов (Orgentec Diagnostics GmbH, Германия). Диагноз целиакии был подтвержден с помощью гистологического исследования биопсийного материала СОТК, полученного из дистального отдела двенадцатиперстной кишки при проведении эзофагогастродуоденоскопии. Оценку гистологических препаратов осуществляли согласно международной классификации по М. Маршу [15]. Препараты окрашивали гематоксилином и эозином.
Активность карбогидраз, расщепляющих лактозу, крахмал и солод, определяли в биоптатах, полученных из залуковичного отдела двенадцатиперстной кишки, по методу А. Далквиста [9] в модификации П. Триндера. Исследование проводилось в два этапа, на первом из которых осуществлялся гидролиз субстрата с выделением глюкозы. Уровень высвободившейся глюкозы оценивали по методу П. Триндера с помощью спектрофотометра [22]. Об активности дисахаридаз судили по интенсивности окраски, которую измеряли на спектрофотометре с длиной волны 495 нм. Активность ферментов выражалась в нанограммах высвобожденной глюкозы на один миллиграмм ткани в минуту (нг глюкозы/мг ткани × мин).
Статистическую обработку данных проводили при помощи компьютерной программы Statistica 6.0 с определением среднего значения и стандартного отклонения, коэффициентов Стьюдента и Манна — Уитни. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
При анализе жалоб у 25,0% больных целиакией, соблюдавших АГД, выявлен нормальный стул. У 63,9% пациентов наблюдались неустойчивый стул или диарея, при этом у большинства больных они сопровождались вздутием и урчанием в животе (табл. 1).
Таблица 1
Клинические симптомы у больных целиакией, строго соблюдавших аглютеновую диету (n = 36)
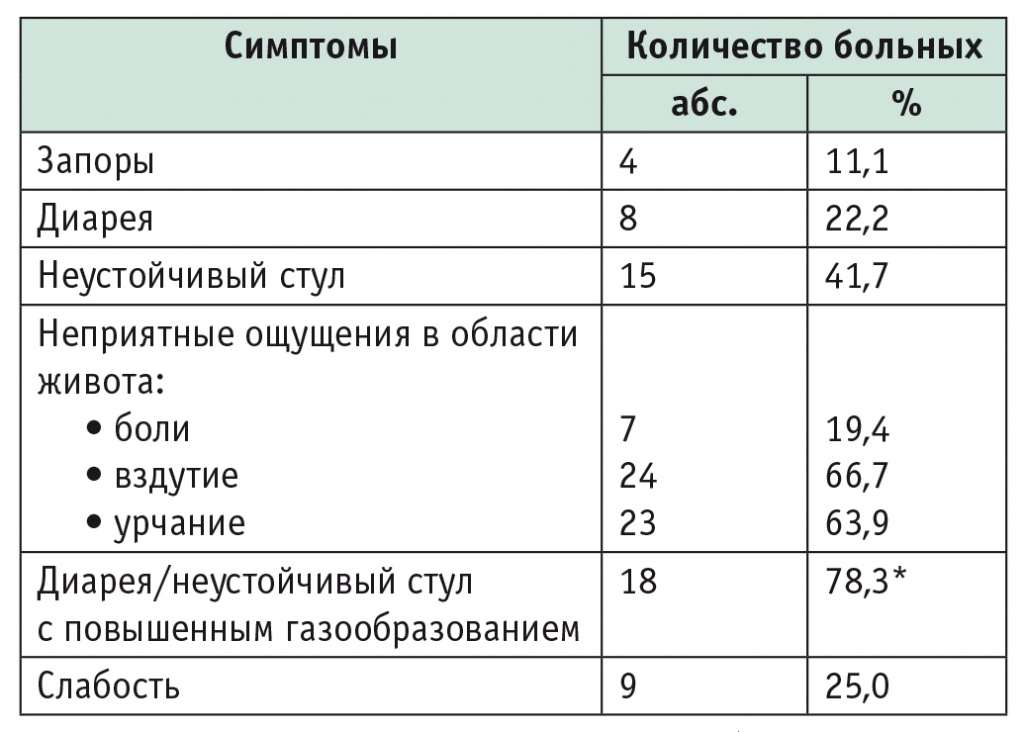
* Проценты рассчитаны от числа больных с диареей и неустойчивым стулом (n = 23).
По результатам изучения активности кишечных карбогидраз у лиц контрольной группы активность глюкоамилазы колебалась в пределах от 320 до 1000 и в среднем равнялась 598,8 ± 184,2 нг глюкозы/мг ткани × мин. У больных целиакией она составляла от 3 до 802, в среднем 239,0 ± 218,2 нг глюкозы/мг ткани × мин, что было достоверно ниже (p < 0,05). Ферментативная активность мальтазы у больных целиакией, соблюдавших АГД, — от 50 до 2530, в среднем 673,0 ± 670,0 нг глюкозы/мг ткани × мин — достоверно уступала показателю у лиц контрольной группы: от 100 до 1571, в среднем 852,4 ± 248,5 нг глюкозы/мг ткани × мин (p < 0,05). Активность сахаразы в контрольной группе составляла от 91 до 348, в среднем 176,2 ± 77,1 нг глюкозы/мг ткани × мин, тогда как у больных целиакией она была достоверно ниже: от 8 до 276, в среднем 73,9 ± 62,5 нг глюкозы/мг ткани × мин (p < 0,05). Уровень активности лактазы у лиц контрольной группы находился в пределах от 17 до 81,2 и в среднем составил 57,6 ± 27,7 нг глюкозы/мг ткани × мин, а у больных целиакией — от 0 до 126, в среднем 20,0 ± 25,1 нг глюкозы/мг ткани × мин, различия также имели статистическую значимость (p < 0,05).
Таким образом, у больных целиакией, несмотря на соблюдение АГД, средние значения активности всех исследуемых кишечных ферментов были достоверно ниже нормы.
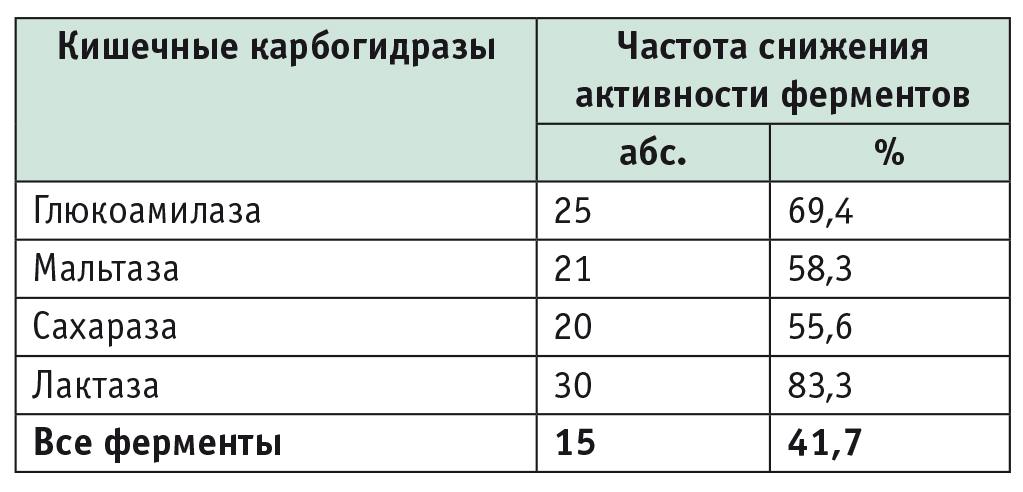
На основании полученных данных у 83,3% больных установлена лактазная недостаточность, у 58,3% — мальтазная, у 55,6% — сахаразная, а у 69,4% — недостаточность глюкоамилазы. Дефицит всех исследованных ферментов выявлен у 41,7% пациентов, строго соблюдавших АГД (табл. 2).
Таблица 2
Частота снижения активности кишечных карбогидраз у больных целиакией, соблюдавших аглютеновую диету (n = 36)
При анализе гистологической структуры СОТК обнаружено, что только у 19 больных в результате соблюдения АГД произошло полное восстановление слизистой оболочки. Остальные пациенты имели атрофию ворсин СОТК различной степени. В соответствии с классификацией по М. Маршу все обследованные больные распределились следующим образом: 19 (52,8%) человек имели нормальную структуру СОТК; у 4 (11,1%) была атрофия, соответствовавшая Marsh II; у 7 (19,4%) — Marsh IIIA и у 6 (16,7%) — Marsh IIIB.
Для более полного понимания механизмов персистенции клинических симптомов у больных целиакией, соблюдающих АГД, представлял интерес анализ группы пациентов с полностью восстановленной СОТК (n = 19).
При изучении клинических симптомов в этой группе получены следующие результаты: 7 (36,8%) больных отмечали неустойчивый стул в виде периодического (1-2 раза в неделю) появления кашицеобразного стула; 3 (15,8%) беспокоили запоры; 17 (89,5%) жаловались на вздутие живота; 12 (63,2%) — на урчание в животе.
Анализ активности кишечных ферментов показал, что в данной группе также наблюдался дефицит кишечных карбогидраз (табл. 3).
Таблица 3
Частота снижения активности кишечных карбогидраз у больных целиакией, соблюдавших аглютеновую диету, с нормальным строением слизистой оболочки тонкой кишки (n = 19)
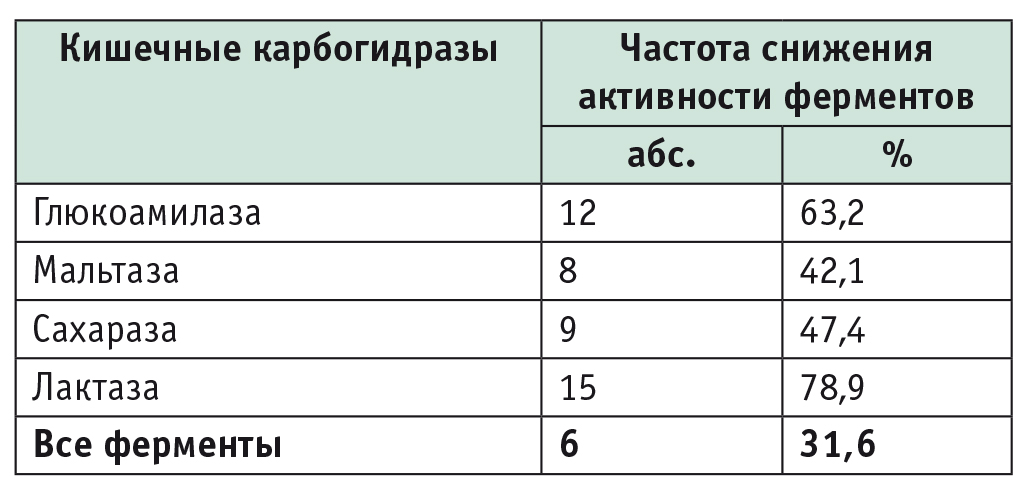
Как видно из представленной таблицы, около половины обследованных больных целиакией с нормальной структурой СОТК имели дефицит того или иного кишечного фермента, а у 31,6% обнаружен недостаток всех исследуемых карбогидраз. Активность всех изучаемых ферментов соответствовала норме лишь у 2 больных, строго соблюдавших АГД на протяжении 9 и 10 лет и имевших нормальное гистологическое строение СОТК.
Таким образом, установлено, что длительное соблюдение АГД не всегда приводит к полному исчезновению клинических симптомов даже у больных целиакией, имеющих нормальную структуру СОТК. Можно предположить, что появление клинических симптомов у лиц, имеющих морфологическую ремиссию заболевания, связано с дефицитом тех или иных кишечных ферментов.
ОБСУЖДЕНИЕ
Проведенное исследование позволило подтвердить тот факт, что у больных целиакией, строго соблюдающих АГД, постепенно происходит восстановление структуры СОТК. Однако нормализация гистологической картины не всегда приводит к клиническому выздоровлению. У таких пациентов часто наблюдаются вздутие живота, урчание в животе и неустойчивый стул. Часть исследователей полагают, что эти симптомы связаны с возникновением у больных целиакией СРК-подобного синдрома [14, 18, 20, 23, 24]. По имеющимся данным, частота выявления симптомов СРК при целиакии может достигать 38% [19], эти симптомы значительно снижают качество жизни больных. Такое утверждение не совсем корректно, так как по определению диагноз функционального заболевания кишечника не может быть установлен при наличии у пациента органических изменений в кишке. Тем не менее имеются работы, указывающие на выявление СРК-подобных симптомов даже у лиц с воспалительными заболеваниями кишечника. По некоторым наблюдениям, 33-46% больных язвенным колитом и 42-60% пациентов с болезнью Крона имеют симптомы СРК в период ремиссии заболевания [7, 12, 13, 16, 21].
По нашим данным, наличие клинических симптомов, сходных с проявлениями СРК, может объясняться нарушением гидролиза углеводов, признаки которого мы обнаружили у большинства больных целиакией, соблюдавших АГД. Подобные результаты получены при обследовании детей с целиакией и атрофией СОТК I-II степени по М. Маршу, у которых выявлено выраженное снижение активности мальтазы, сахаразы и лактазы [8]. Имеются и другие свидетельства сохранения клинических симптомов у больных целиакией, несмотря на соблюдение АГД. Например, по данным J. G. O’Grady и соавт. [17], строгое соблюдение АГД у пациентов с целиакией приводит к повышению активности сахаразы, при этом, однако, активность лактазы у них остается низкой, что свидетельствует о ее дефиците.
Недостаточность карбогидраз у больных целиакией может быть связана с повреждением ультраструктуры апикальной мембраны энтероцитов и гликокаликса, а также с нарушением примембранной (мукозной) симбионтной микрофлоры. Большое количество неутилизированных короткоцепочечных углеводов создает условия для избыточного роста бактерий в тонкой кишке, вторичного повреждения СОТК и еще большего нарушения мембранного пищеварения. Клинически этот тип нарушения пищеварения может проявляться непереносимостью тех или иных пищевых продуктов, а также симптомами, сходными с СРК [3].
Таким образом, для оценки клинической ремиссии у больных целиакией, строго соблюдающих АГД, безусловно важно определять не только степень восстановления структуры СОТК, но и активность кишечных ферментов.
ЗАКЛЮЧЕНИЕ
Дефицит кишечных карбогидраз может быть одной из причин длительного персистирования кишечных симптомов у больных целиакией, строго соблюдающих аглютеновую диету (АГД). Это подтверждается тем, что среди обследованных нами пациентов с целиакией, тщательно соблюдавших АГД и имевших нормальное гистологическое строение слизистой оболочки тонкой кишки (СОТК), 78,9% имели лактазнyю недостаточность, 63,2% — дефицит глюкоамилазы, 47,4% — сахаразы и 42,1% — мальтазы. На основании проведенного исследования можно сделать вывод, что полное восстановление структуры СОТК не всегда может служить маркером клинической ремиссии заболевания.







