Цистаденома печени (билиарная или гепатобилиарная цистаденома) — это доброкачественное образование, располагающееся во внутрипеченочных желчных протоках и представляющее собой истинную кисту. Размер образования может варьировать от 1,5 до 15 см в диаметре, а ее вес иногда может достигать 6 кг. Заболевание достаточно редкое — оно составляет не более 4–5% всех новообразований печени и желчных протоков. Наблюдается преимущественно у женщин (80–85% случаев), средний возраст пациентов к моменту диагностики равен 40–55 годам [1].
Патофизиологически цистаденома печени представляет собой многокамерную кисту, окруженную гладкой плотной фиброзной капсулой. Образование содержит многочисленные внутренние перегородки и внутрипросветные папиллярные выступы, которые выстланы кубическим или цилиндрическим эпителием, секретирующим муцин. Этот эпителий иногда окружен плотной мезенхимальной стромой, содержащей гладкомышечные клетки. Свободный слой коллагенсодержащих кровеносных сосудов, нервов и желчных протоков дополнительно окружает область цистаденомы. Описаны два типа печеночных цистаденом: муцинозный и серозный. Муцинозная цистаденома является преобладающим типом (около 95% случаев), обнаруживается обычно во внутрипеченочной области (84%), реже в общем желчном протоке (6%), печеночных протоках (4%) и желчном пузыре (2%) [2, 3].
Точная этиология цистаденомы печени неизвестна. Традиционно считается, что цистаденомы происходят из эпителия желчных протоков, возможно, из врожденного аберрантного желчного протока. Сходство эмбриональных структур, таких как желчный пузырь и желчные протоки, происходящие из каудального зачатка печеночного мешка первичной передней кишки, позволяет предположить, что цистаденомы могут возникать из эктопических остатков. Существует также возможность того, что цистаденомы возникают непосредственно из эмбриональных клеток первичной передней кишки или перибилиарных эндокринных клеток. Тот факт, что цистаденомы описаны уже в первом десятилетии жизни, поддерживает эти теории. Значимую роль могут играть факторы окружающей среды, поскольку большинство опухолей появляется во второй половине жизни. Учитывая заметное преобладание женщин, можно предположить роль гормонального воздействия [4, 5].
Клиническая картина. В начальной стадии развития цистаденомы печени пациенты жалоб не предъявляют. Несколько позже возникают неспецифические жалобы, такие как дискомфорт в правом подреберье, тошнота, отрыжка воздухом, горький привкус во рту. По мере роста опухоли могут появляться симптомы, обусловленные увеличением размеров печени, формированием печеночной недостаточности, сдавлением соседних структур: боли в правом подреберье и эпигастрии, желтушность кожи и склер, увеличение живота, снижение аппетита, снижение массы тела. Клиническая картина острого живота является редким проявлением и может быть вызвана разрывом стенки кисты, внутренним кровотечением или перекрутом кисты [6].
К основным осложнениям заболевания относятся кровотечение из стенки кисты в ее полость, нагноение кисты, разрыв кисты, механическая желтуха, формирование печеночной недостаточности, малигнизация опухоли, экзоорганная обструкция выходного отдела желудка, сдавление нижней полой вены, асцит. При длительном течении заболевания возможно злокачественное перерождение цистаденомы печени в цистаденокарциному (по некоторым данным, частота таких случаев составляет до 30%) с дальнейшим стремительным ростом и летальным исходом. Учитывая злокачественный потенциал цистаденомы, своевременная диагностика и радикальное хирургическое вмешательство — это предпочтительная тактика, что отличает цистаденому от ряда распространенных доброкачественных образований печени, таких как очаговая нодулярная гиперплазия, аденома и гемангиома, где возможно длительное динамическое наблюдение [7].
Диагностика. Лабораторные тесты позволяют получить общее представление о функции печени, но выявляемые отклонения неспецифичны для цистаденомы. Признаки цитолиза, холестаза, нарушения белково-синтетической функции печени зависят от размеров, локализации и количества опухолевых узлов, а также от степени нарушения магистрального кровотока и оттока желчи. Цистаденомы часто выявляются случайно во время обычного осмотра или в процессе исследования такими методами, как УЗИ или КТ [8].
При УЗИ цистаденомы печени визуализируются в виде анэхогенных образований с внутренними перегородками. Локальные гиперэхогенные включения в пределах опухоли могут быть участками фиброза стенки, внутрикистозными кровоизлияниями или папиллярными разрастаниями. На КТ-снимках опухоль проявляется в виде очагов жидкостной плотности с локальным накоплением контрастного препарата. Часто визуализируются перегородки и пристеночные узлы. Характерными признаками цистаденом печени, отличающими их от простых кист, являются васкуляризация перегородок внутри кисты, а также наличие папиллярных разрастаний стенок [9].
При проведении МРТ цистаденома выявляется в виде гиперинтенсивных образований на Т2-взвешенных изображениях и гипоинтенсивных — на T1-взвешенных изображениях, иногда с периопухолевым понижением интенсивности сигнала на Т2-взвешенных изображениях.
Методы объективной визуализации (мультифазная контрастная КТ, динамическая контрастная МРТ) позволяют оценить сосудистый профиль объемного образования, выявить типичные для озлокачествления особенности васкуляризации: усиление в артериальную фазу и вымывание в портальную фазу. В отличие от окружающей неизмененной паренхимы печени, которая питается из системы портальной вены, злокачественные опухоли кровоснабжаются преимущественно из системы печеночной артерии, поэтому в типичных случаях они характеризуются диффузным, гетерогенным усилением в артериальную фазу (как при КТ, так и при МРТ) с последующим вымыванием контрастного препарата в венозную и отсроченные фазы, что считается классическим отображением онкопроцесса. Предварительные инструментальные методы визуализации должны сопровождаться биопсией печени, которая может помочь получить важную информацию о природе опухолевого поражения [10, 11].
Лечение. Как правило, медикаментозное лечение цистаденомы не проводится. Исключение составляют подготовительный период перед оперативным вмешательством и ярко выраженная симптоматика. Благоприятный прогноз печеночных цистаденом обеспечивает только полная хирургическая резекция образования. Такие способы лечения, как марсупиализация, наложение внутренних или чреcкожных дренажей, пункционная алкоголизация, сопряжены с высокой частотой рецидивов заболевания. Операция должна выполняться по типу анатомической резекции, что продиктовано высокой частотой малигнизации цистаденом и развитием рецидивов при сохранении части эпителиальной выстилки кисты [12].
Симптоматическая терапия при цистаденомах печени направлена на снижение проявлений внутрипеченочного холестаза, коррекцию портальной гипертензии и печеночно-клеточной недостаточности.
Наиболее эффективным средством для лечения холестатических заболеваний является урсодезоксихолевая кислота (УДХК). УДХК — конкурент токсичных желчных кислот при абсорбции в тонкой кишке, а также на мембране гепатоцитов и холангиоцитов. Считается, что положительное влияние УДХК на течение хронического холестаза прежде всего связано со снижением повреждения холангиоцитов токсичными желчными кислотами (за счет подавления их секреции и уменьшения пула путем снижения их всасывания в подвздошной кишке). Кроме того, УДХК стимулирует транспорт желчных кислот и органических анионов в гепатоцитах и холангиоцитах. Она влияет на ряд процессов, связанных с белками-транспортерами гепатоцита (их транскрипционную регуляцию; включение в апикальную мембрану; фосфорилирование и дефосфорилирование в местах действия), а также воздействует на процессы экзоцитоза (путем активации кальцийзависимой альфа-протеинкиназы) и на экспрессию транспортных систем в билиарном эпителии (бикарбонатный холерез). Собственно цитопротективное действие УДХК при холестазе определяется ее способностью, образуя двойные молекулы, взаимодействующие с липофильными мембранными структурами, встраиваться в клеточную мембрану и тем самым повышать устойчивость к токсическим воздействиям гепатоцитов, холангиоцитов и эпителиоцитов ЖКТ [13].
Согласно рекомендациям Российской гастроэнтерологической ассоциации и Российского общества по изучению печени, добавление к УДХК S-аденозил-L-метионина (SAMe) снижает клиническую симптоматику и улучшает биохимические показатели у пациентов с внутрипеченочным холестазом [14]. SAMe представляет собой природное вещество, производное L-метионина и аденозинтрифосфорной кислоты, которое синтезируется в печени. Это вещество воздействует на основные звенья развития и прогрессирования внутрипеченочного холестаза. SAMe участвует в трех наиболее важных метаболических процессах: трансметилировании, транссульфурировании и аминопропилировании, — в которых выступает либо как донор метильной группы, либо как индуктор ферментов. Участие SAMe в процессах сульфатирования, в том числе желчных кислот и таурина, приводит к уменьшению пула токсичных свободных желчных кислот, что улучшает выведение последних из гепатоцитов и способствует их элиминации почками. Участие SAMe в синтезе структурных белков и фосфолипидов обеспечивает стабилизацию мембран клеток и митохондрий, благодаря чему улучшается функционирование транспортных систем. Имеются экспериментальные данные о том, что SAMe уменьшает апоптоз, индуцированный желчными кислотами, хотя и в меньшей степени, чем УДХК. Таким образом, применение лекарственных средств на основе SAMe можно считать, по сути, заместительной терапией дефицита SAMe, который наблюдается у пациентов с хроническими заболеваниями печени. Немаловажным преимуществом таких препаратов является доказанное наличие противоастенического и антидепрессивного эффектов [15].
Для иллюстрации приведенного обзора продемонстрируем собственное клиническое наблюдение.
Пациентка Н., 60 лет, 20.05.2013 обратилась в Медико-санитарную часть ГУП «Водоканал Санкт-Петербурга» с жалобами на рези в животе, тяжесть в правом подреберье. При пальпации живота выявлена увеличенная в размерах за счет правой доли, болезненная, плотная печень, выступавшая из-под реберной дуги на 4–5 см.
В анализах крови: функциональные пробы печени, раково-эмбриональный антиген, альфа-фетопротеин — в пределах референсных значений; СОЭ увеличена до 47 мм/ч.
По данным УЗИ от 06.06.2013: печень увеличена, передне-задний косой размер правой доли — 189 мм; по передней поверхности правой доли печени в S4–5 лоцируется тканевое образование с неровными контурами, гетерогенной структуры, с зонами повышенной и пониженной эхогенности, размерами не менее 87 × 67 мм; желчный пузырь оттеснен описанным образованием кзади, не напряжен, стенки его уплотнены, контуры ровные, содержимое однородное, конкрементов не содержит.
На КТ органов брюшной полости от 21.06.2013 в S4–5 и умеренно в S6 определено образование с четкими неровными контурами, неоднородной структуры, которое распространялось за границы печени до передней брюшной стенки, оттесняя желудок, двенадцатиперстную кишку, желчный пузырь. Размеры образования — 115 × 75 × 124 мм. Плотность нативно +18–45 HU, в артериальную фазу плотность образования неоднородно повышалась до +115 HU, в венозную — до +100 HU, в отсроченную фазу она составляла +45–60 HU. В S2 определялся гиподенсный очаг (+50–55 HU), визуализировавшийся в венозную фазу, размером 9 мм.
Пациентка была направлена на консультацию в городской онкологический центр, где ей провели биопсию печени. Гистологическое заключение: гепатобилиарная цистаденома; по результатам иммуногистохимического исследования — аденома из желчного протока. При ангиографии сосудов печени в VIa–VII сегментах печени выявлено крупное патологическое конгломератное образование со смешанной васкуляризацией размерами 125,2 × 157,0 × 142,5 мм, расположенное кпереди от воротной вены.
Таким образом, пациентке был установлен диагноз цистаденомы печени. Учитывая локализацию и размеры образования, от хирургического лечения было решено воздержаться, рекомендовалось динамическое наблюдение.
13.01.2014 пациентка обратилась для контрольного обследования, активных жалоб на момент обращения не предъявляла. При биохимическом анализе крови обнаружены признаки внутрипеченочного холестаза: повышение уровня щелочной фосфатазы до 407 Ед/л, гамма-глутамилтранспептидазы — до 531 Ед/л. По данным УЗИ органов брюшной полости выявлен рост образования до 106 × 94 × 99 мм. На серии МРТ брюшной полости от 31.01.2014: печень увеличена в размерах за счет объемного образования неоднородной дольчатой структуры с неровным контуром размером 185 × 170 × 130 мм; образование муфтообразно охватывает желчевыводящие протоки без признаков инвазии и компрессии последних, оттесняет каудально правую почку. Кроме того, во II сегменте печени определялся аналогичный по сигнальным характеристикам очаг размером до 11 мм в диаметре.
Учитывая биохимические признаки внутрипеченочного холестаза, пациентке был рекомендован прием УДХК в дозировке 750 мг/сут.
В связи со значительным ростом образования больная была направлена для выполнения позитронно-эмиссионной томографии. По результатам обследования от 03.03.2014 выявлены признаки метаболически активного объемного образования в печени, злокачественная природа которого представлялась наиболее вероятной. 31.03.2014 была выполнена лапароскопия с биопсией опухоли печени. Гистологическое заключение: билиарная аденома без признаков малигнизации. 10.04.2014 были проведены верхняя мезентерикография, целиакография, селективная ангиография и химиоэмболизация. Заключение: ангиографическая картина может соответствовать первичной опухоли печени. Пациентке рекомендован прием тамоксифена.
Результаты контрольной КТ от 12.05.2014: печень увеличена в размерах, деформирована, имеет крупнобугристый контур; паренхима обеих долей печени субтотально (около 70%) заменена объемным мультифокусным образованием размерами 208 × 127 × 185 мм (рост) с неровными бугристыми контурами и неоднородной гиподенсной плотности (рис.). При проведении ангиографии обнаружено, что образование активно, выраженно неравномерно, преимущественно по периферии, накапливает контрастное вещество до +130 HU с сохранением зон отсутствия контрастирования (некрозы).
Рис. Компьютерно-томографическая картина гигантской цистаденокарциномы печени. Фото авторов
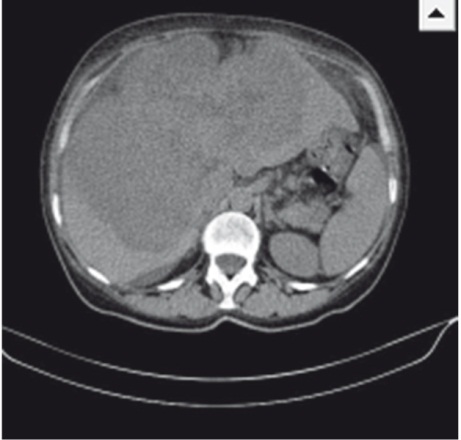
При осмотре от 10.06.2014 отмечены жалобы на боли в правом подреберье, пожелтение кожи, склер, кожный зуд. Объективно: кожный покров желтушный, обычной влажности, склеры иктеричные; язык обложен желтоватым налетом, влажный; живот не вздут, мягкий, увеличен в размерах за счет гепатомегалии; печень значительно увеличена в размерах, безболезненная, плотная, выступает из-под реберной дуги на 8–10 см; стул периодически гипохоличный. В анализах крови — повышение уровня СА 19-9 до 897 Ед/мл. По данным УЗИ: вся брюшная полость, включая боковые фланки и позадиматочное пространство, заполнена свободной жидкостью с небольшим количеством мелкодисперсной взвеси — асцит; печень увеличена (краниокаудальный размер — 225 мм), деформирована, имеет крупнобугристый контур; паренхима обеих долей печени субтотально (свыше 70%) заменена объемным мультифокусным образованием с неровными бугристыми контурами размерами 218 × 151 × 193 мм; аналогичное по плотностным характеристикам образование визуализируется в S8 (20 × 22 × 22 мм), появилось новое аналогичное образование в S3 (12 × 12 мм).
Дополнительно к УДХК пациентке был рекомендован прием SAMe в дозировке 1200 мг/сут. Больная находилась под наблюдением еще в течение года, получала симптоматическую поддерживающую терапию. Летальный исход наступил на фоне тяжелой полиорганной недостаточности.
Приведенный клинический пример иллюстрирует типичные клинические особенности течения цистаденомы печени: бессимптомное начало заболевания, стремительный рост образования с формированием признаков внутрипеченочного холестаза, портальной гипертензии и гепатодепрессии, озлокачествление опухоли, неблагоприятный исход.
ЗАКЛЮЧЕНИЕ
Гепатобилиарная цистаденома составляет не более 4–5% всех новообразований печени и желчных протоков. Наблюдается преимущественно у женщин трудоспособного возраста и представляет собой многокамерную кисту, окруженную гладкой плотной фиброзной капсулой. Медико-социальная значимость данной патологии обусловливается ее длительным бессимптомным течением с последующим стремительным развитием осложнений, злокачественным перерождением и летальным исходом. Редкость гепатобилиарной цистаденомы в структуре новообразований, отсутствие специфичных для нее диагностических признаков и эффективных способов радикального лечения делают актуальным накопление данных о клинических особенностях заболевания.







