ВВЕДЕНИЕ
Хронический вирусный гепатит С (ХВГС), несмотря на тенденцию к снижению заболеваемости, является одной из ведущих проблем здравоохранения на планете и одной из ведущих причин заболеваний печени. В 2020 г. противовирусное лечение ХВГС было проведено у 641 000 больных, а общее количество пациентов с этой патологией составило 56,8 млн человек[1]. ХВГС нередко приводит к развитию цирроза печени, гепатоцеллюлярного рака, печёночной недостаточности[2, 3].
Существуют 8 основных генотипов вируса гепатита С (HCV)[4], которые не только детерминируют ответ на лечение, но и являются предикторами прогресса заболевания[5]. Наиболее часто встречаются генотипы 1 и 3 HCV[6]. В последнее время возникла дискуссия о том, какой генотип чаще ассоциируется с неблагоприятным течением ХВГС[7]. Одни авторы полагают, что наиболее агрессивное течение имеет генотип 1[8, 9]. Другие исследователи выделяют генотип 3 HCV как фактор, определяющий высокую активность патологического процесса[10]. В этой связи сравнительное изучение клинических проявлений ХВГС у пациентов с генотипами 1 и 3 в зависимости от выраженности ФП является актуальным.
Цель исследования — сопоставить клинические проявления у пациентов с генотипами 1 и 3 HCV в зависимости от выраженности ФП.
Дизайн исследования: сравнительное исследование случайных групп пациентов, находившихся на стационарном или амбулаторном лечении.
МАТЕРИАЛ И МЕТОДЫ
Исследование проводилось на базе гастроэнтерологического отделения клиники НИИ медицинских проблем Севера ФИЦ КНЦ СО РАН и ООО «Институт клинической иммунологии» (г. Красноярск). Всего было обследовано 528 больных ХВГС, из них 297 пациентов с генотипом 1 HCV (159 мужчин и 138 женщин, средний возраст 43,8 года) и 231 человек с генотипом 3 HCV (128 мужчин и 103 женщин, средний возраст 43,6 года). Исследование проводилось с разрешения этического комитета ФИЦ КНЦ СО РАН (протокол № 4 от 02.08.2019). Каждый участник подписывал форму информированного согласия на обследование согласно Хельсинкской декларации Всемирной медицинской ассоциации, регламентирующей проведение научных исследований.
Критериями включения явились объективно диагностированный ХВГС c генотипом 1 или 3 HCV при исключении других генотипов HCV и других этиологических факторов заболеваний печени; пациенты в возрасте 18–60 лет, подписавшие информированное согласие на обследование. Критерии исключения из исследования: возраст младше 18 лет и старше 60 лет; пациенты, получавшие раньше противовирусное лечение ХВГС; ВИЧ-инфекция; онкологические заболевания; другие хронические заболевания печени различной этиологии (другие вирусные гепатиты, описторхоз, алкогольная болезнь печени, неалкогольная жировая болезнь печени, болезнь Вильсона–Коновалова, гемохроматоз, аутоиммунный гепатит и др.); туберкулез; беременность; выраженные хронические заболевания различных органов и систем; пациенты, отказавшиеся принять участие в научном исследовании.
Клиническая симптоматика изучалась с применением стандартной анкеты, разработанной на основании действующих международных классификаций. Диагноз ХВГС устанавливали при помощи эпидемиологических и клинико-лабораторных данных при обнаружении специфических серологических маркеров и РНК HCV по рекомендациям Европейской ассоциации по изучению печени[11, 12]. Определение содержания РНК HCV осуществляли методом количественной полимеразной цепной реакции в реальном времени на приборе Biorad CFX96 Real Time System (BioRad Laboratories, США) с помощью тест-системы Abbott RealTime HCV test® (Abbott, США). Генотип вируса определяли с помощью набора VERSANT® HCV Amplification 2.0 (LiPA) (Siemens, Германия).
Для диагностики сопутствующих изменений и осложнений всем пациентам выполняли клинический и биохимический анализы крови, а также ультразвуковое исследование (УЗИ) печени и поджелудочной железы. Биохимическое исследование крови включало определение аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы, щелочной фосфатазы, гамма-глутамилтранспептидазы, общего и прямого билирубина, общего белка, альбумина, железа, меди, при необходимости осуществлялось определение церулоплазмина. Уровень активности ХВГС определяли по содержанию трансаминаз в крови на основании Лос-Анджелесской классификации гепатита[13]. При подозрении на наличие аутоиммунного гепатита в крови измеряли концентрации IgG и специфических аутоантител (ASMA; LKM-1; anti-LC1).
ФП определяли методом сдвиговолновой транзиторной эластометрии с применением ультразвуковых систем Aixplorer (Франция) или Siemens Acuson S2000 (Германия). Оценка степени ФП осуществляли по шкале METAVIR[14] в зависимости от выявляемых показателей эластичности печени: F0 — ФП отсутствует (≤ 5,8 кПа); F1 — портальный и перипортальный ФП без септ (5,9–7,2 кПа); F2 — портальный и перипортальный ФП с единичными септами (7,3–9,5 кПа); F3 — портальный и перипортальный ФП с множественными септами (мостовидными), с порто-портальными и портоцентральными септами (9,6–12,5 кПа); F4 — цирроз печени (≥ 12,6 кПа).
Статистическую обработку данных проводили с помощью пакетов прикладных программ Statistica for Windows 8.0 (StatSoft Inc., США) и Microsoft Excel (Microsoft, США). Результаты исследования были представлены для выборок, не подчиняющихся нормальному закону распределения, медианой (Ме) и интерквартильным интервалом (Q25–Q75). Достоверность между количественными показателями независимых выборок оценивали с помощью дисперсионного анализа (ANOVA), критериев Краскела–Уоллиса (рКУ) и Манна–Уитни. Для определения достоверности различий качественных признаков применяли вычисление отношение шансов (ОШ) и доверительный интервал (ДИ) для ОШ. Критический уровень значимости при проверке статистических гипотез принимали равным 0,05.
РЕЗУЛЬТАТЫ
Частота ФП F2 и F3–F4 стадий была выше у больных ХВГС с генотипом 3 HCV в сравнении с пациентами с генотипом 1 HCV, что само по себе является интересным фактом и предполагает некоторые клинико-лабораторные отличия при сопоставлении пациентов с этими генотипами (табл. 1).
Таблица 1
Частота различных стадий фиброза печени у больных хроническим вирусным гепатитом С (ХВГС) с генотипами 1 и 3 HCV
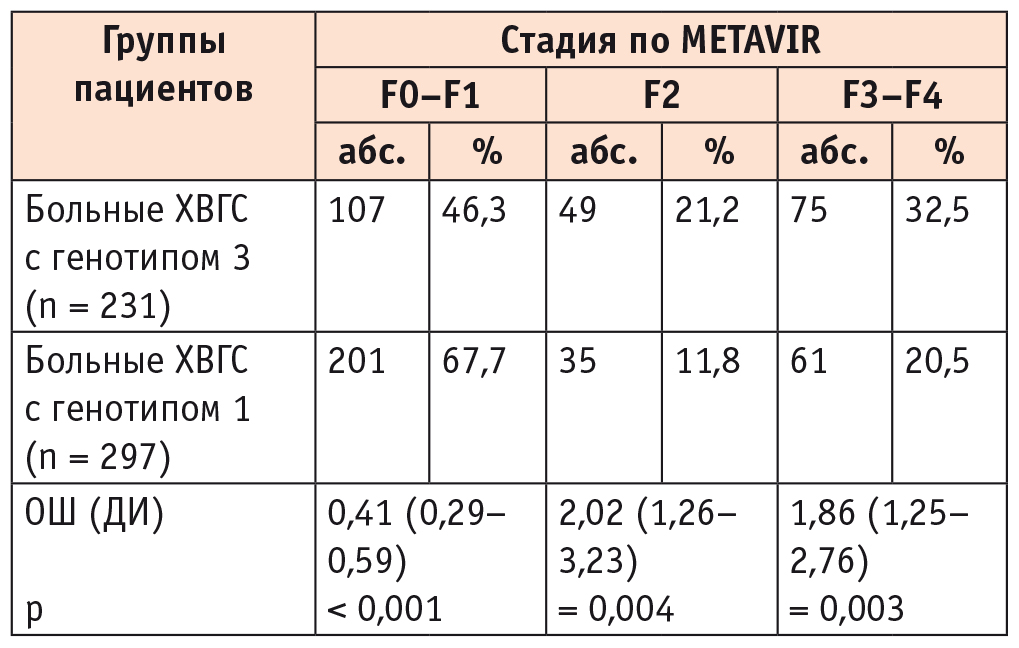
Примечание. Достоверность различий показателей вычислена при помощи отношения шансов (ОШ) и доверительного интервала (ДИ) для ОШ.
Частота дисгевзии, астеновегетативного синдрома и иктеричности нарастала при увеличении стадии ФП у пациентов с обоими генотипами HCV. Частота жалоб на артралгию и миалгию увеличивалась в группе больных ХВГС с генотипом 3 HCV среди лиц с ФП F3–F4 стадии в сравнении с пациентами с ФП F0–F1 стадии в 7,6 раза, тогда как в аналогичных группах больных с генотипом 1 HCV — только в 3,3 раза (табл. 2).
Таблица 2
Частота клинических проявлений в зависимости от стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV
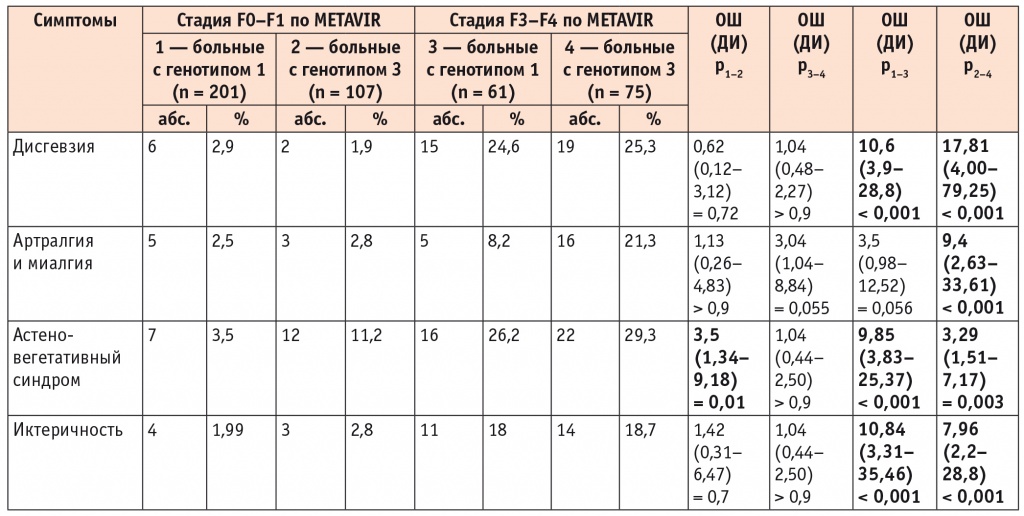
Примечание. Достоверность различий показателей вычислена при помощи ОШ.
По данным УЗИ частота гепатомегалии и спленомегалии отчетливо возрастала у пациентов с ФП F3–F4 стадии в сравнении с лицами с ФА F0-F1 стадии у пациентов с обоими генотипами HCV (табл. 3).
Таблица 3
Данные ультразвукового исследования в зависимости от стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV
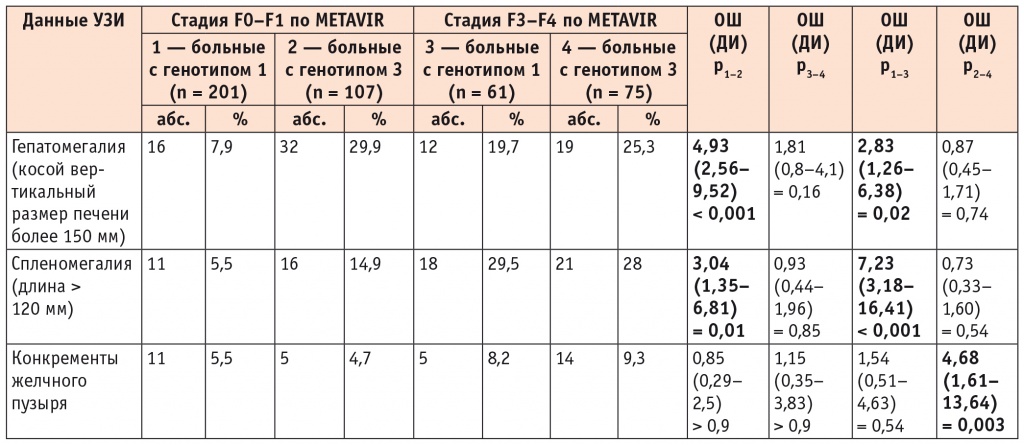
Примечание. Достоверность различий показателей вычислена при помощи ОШ.
Показатели вирусной нагрузки в крови не изменялись у больных с генотипом 1 HCV при различных стадиях ФП (рКУ = 0,84). У лиц с генотипом 3 HCV определялись другие закономерности. Уровень вирусной нагрузки в крови у лиц с ФП F3–F4 стадий значительно увеличивался в сравнении с пациентами с ФП F0–F2 стадий (рКУ = 0,04). Сравнение графиков вирусной нагрузки в зависимости от стадии ФП демонстрировало достоверные отличия при сопоставлении больных с генотипами 1 и 3 HCV (критерий ANOVA р = 0,02).
Мы изучили изменения количественных данных развернутого анализа крови в зависимости от выраженности ФП. Как среди пациентов с генотипом 3 HCV, так и у больных с генотипом 1 HCV анализ с применением критерия Краскела–Уоллиса не показал достоверных отличий при включении данных при ФП F0–F4 стадий (для генотипа 1 рКУ = 0,5; для больных с генотипом 3 рКУ = 0,4). Вместе с тем в обеих группах пациентов регистрировалось достоверное снижение абсолютного количества лейкоцитов в крови у пациентов с ФП F3–F4 стадии в сравнении с лицами с ФП F2 стадии (для генотипа 1 — p = 0,04, для генотипа 3 — p = 0,02). Критерий ANOVA, характеризующий связь показателей, при сравнении генотипов 1 и 3 не показывал отличий (p = 0,36).
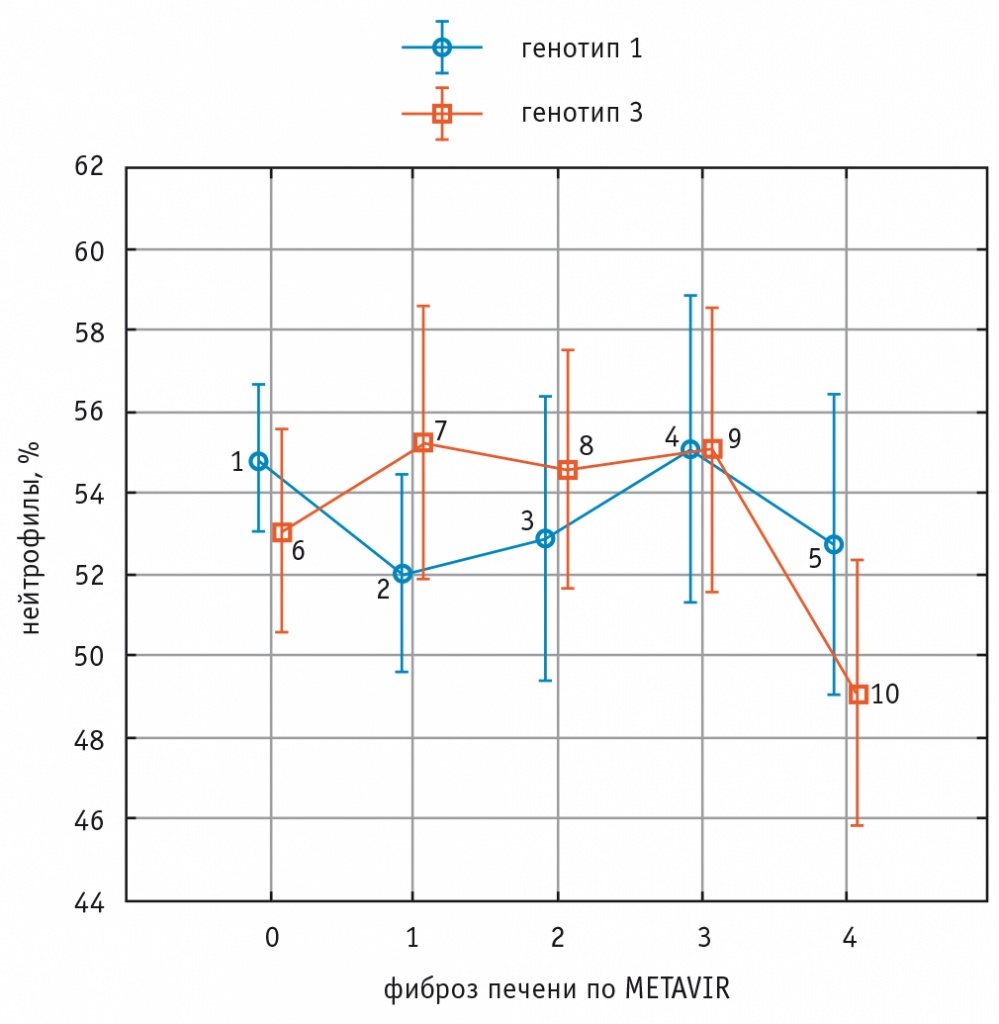
У больных с генотипом 3 HCV отмечалось снижение относительного количества нейтрофилов среди лиц с ФП F4 стадии в сравнении с лицами с ФП F0, F1, F2, F3 стадий (критерий Краскела–Уоллиса 0,09), т.е. для генотипа 3 HCV определялась тенденция с снижению количества нейтрофилов в крови при увеличении стадии ФП. У пациентов с генотипом 1 HCV очевидных закономерностей связи количества нейтрофилов в крови и выраженности ФП не наблюдалось (рис. 1).
Рис. 1. Изменения доли нейтрофилов крови при увеличении стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV.
Примечание. Для генотипа 1 HCV (показатели 1–2–3–4–5) — рКУ = 0,39.
Для генотипа 3 HCV (показатели 6–7–8–9–10) — рКУ = 0,09.
Критерий ANOVA (сравнение показателей генотипов 1 и 3 HCV) — p = 0,18.
Критерий Манна–Уитни: p1–2 = 0,07; p1–3 = 0,28; p1–4 = 0,87; p1–5 = 0,22; р6–10 = 0,03; р7–10 = 0,01; р8–10 = 0,02; р9–10 = 0,02; р1–5 = 0,29; p2–5 = 0,72; p3–5 > 0,9; p4–5 = 0,34; p5–10 = 0,04
В биохимическом анализе содержание общего билирубина в крови увеличивалось при возрастании степени ФП в обеих группах пациентов с ХВГС (для генотипа 3 HCV — рКУ = 0,002; для генотипа 1 — рКУ = 0,04). Существенной разницы при сравнении графиков больных с генотипом 1 или 3 не регистрировалось (критерий ANOVA p = 0,13) со слабой тенденцией более значительного увеличения показателей общего билирубина крови при выраженном ФП у больных с генотипом 3 HCV.
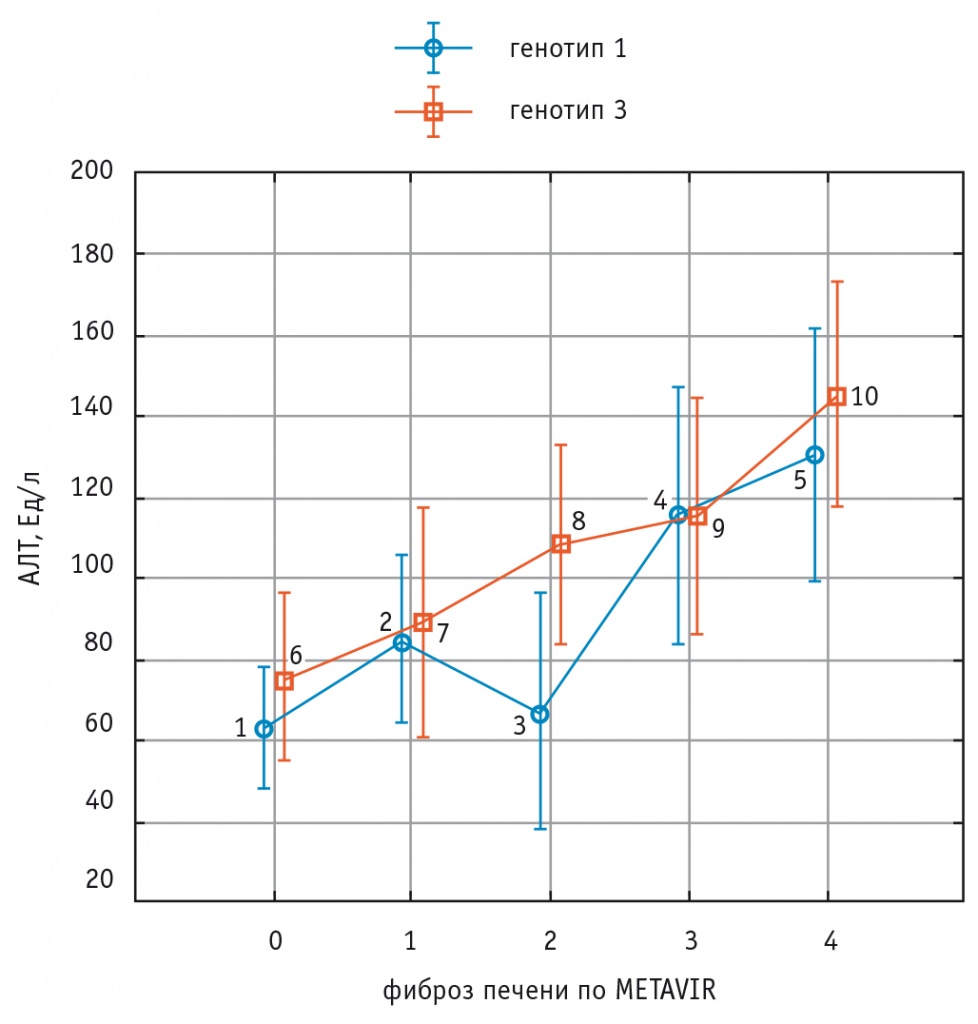
Содержание АЛТ в крови значительно увеличивалось у пациентов с ФП F3–F4 степени в сравнении с лицами с ФП F0–F1 степени как у больных с генотипом 1 HCV, так и у лиц с генотипом 3 HCV (рис. 2).
Рис. 2. Изменения уровня аланинаминотрансферазы в крови при увеличении стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV.
Примечание. Для генотипа 1 HCV (показатели 1–2–3–4–5) — рКУ = 0,002.
Для генотипа 3 HCV (показатели 6–7–8–9–10) — рКУ < 0,001.
Критерий ANOVA (сравнение показателей пациентов с генотипами 1 и 3 HCV) — p = 0,33
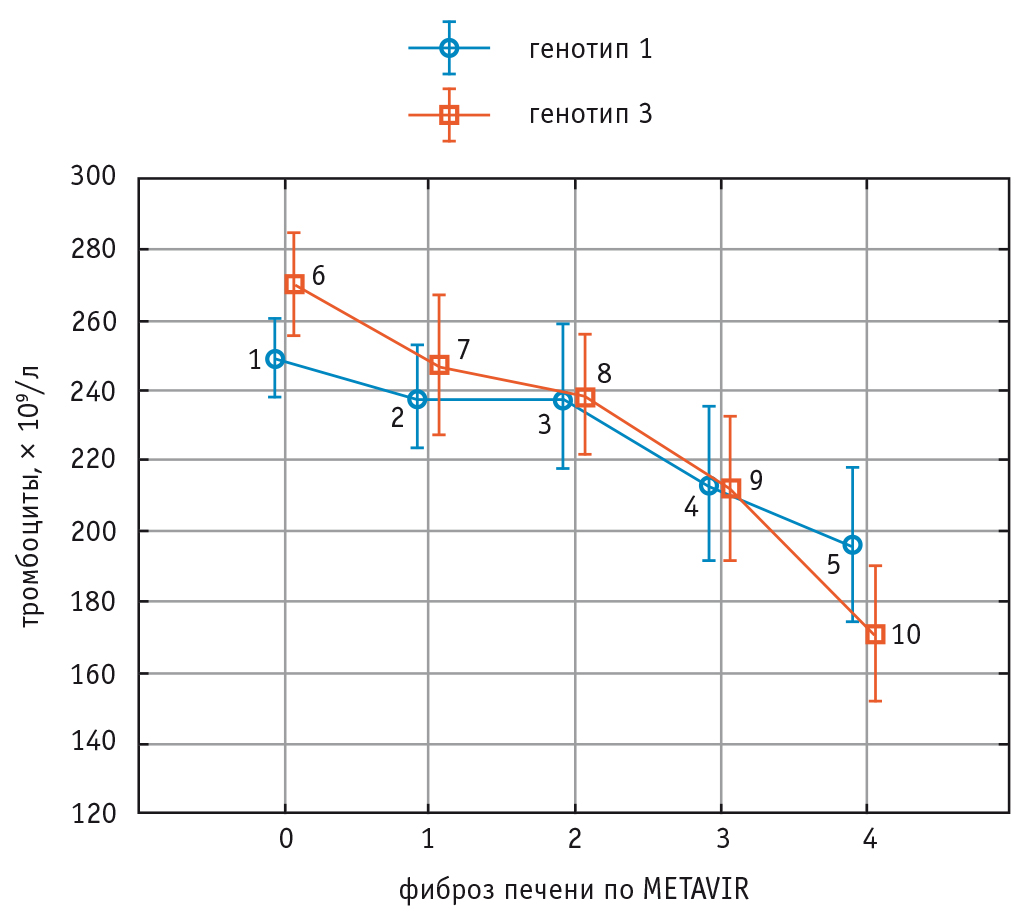
Содержание альбумина и количества тромбоцитов в крови уменьшалось у пациентов с ФП F3 и F4 стадий в сравнении с пациентами с ФП менее выраженных стадий без значительных отличий между носителями генотипов 1 и 3 HCV (рис. 3 и рис. 4).
Рис. 3. Изменения содержания альбумина в крови при увеличении стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV.
Примечание. Критерий Краскела–Уоллиса для генотипа 1 HCV (показатели 1–2–3–4–5) — p = 0,04.
Критерий Краскела–Уоллиса для генотипа 3 HCV (показатели 6–7–8–9–10) — p = 0,03.
Критерий ANOVA (сравнение показателей пациентов с генотипами 1 и 3 HCV) — p > 0,9
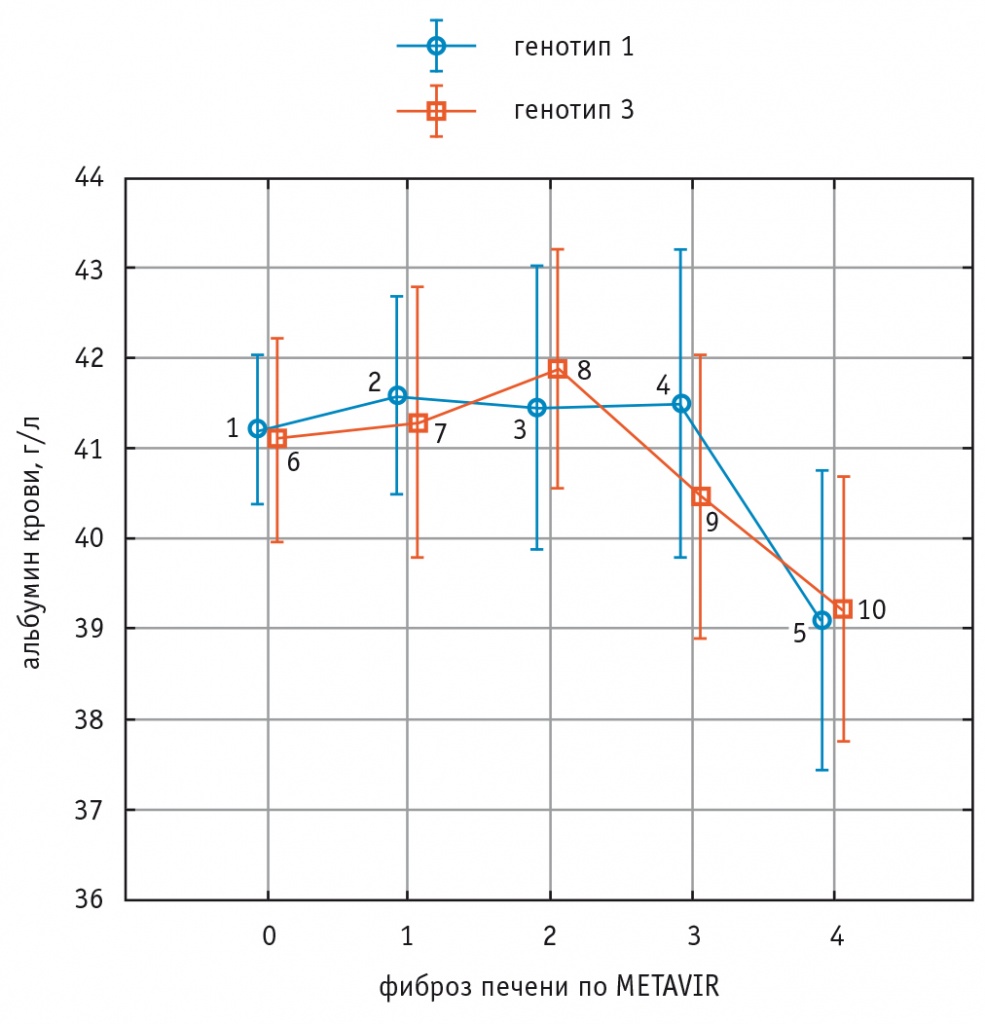
Рис. 4. Изменения количества тромбоцитов крови при увеличении стадии фиброза печени у больных хроническим вирусным гепатитом С с генотипами 1 и 3 HCV.
Примечание. Критерий Краскела–Уоллиса для генотипа 1 HCV (показатели 1–2–3–4–5) — p = 0,02.
Критерий Краскела–Уоллиса для генотипа 3 HCV (показатели 6–7–8–9–10) — p = 0,005.
Критерий ANOVA (сравнение показателей пациентов с генотипами 1 и 3 HCV) — p = 0,11
ОБСУЖДЕНИЕ
Несмотря на успехи в лечении[15], проблема ХВГС остается для России весьма актуальной в связи с сохраняющимся значительным пулом больных[16]. Достижения в противовирусной терапии ХВГС позволили обратить внимание на лечение гепатоцеллюлярной карциномы (ГЦК)[17]. Европейская ассоциация по изучению печени и Американская ассоциация по исследованию заболеваний печени считают эту проблему весьма значительной[18, 19]. В современных работах подчеркивается риск развития ГЦК после успешной противовирусной терапии при наличии выраженного ФП[20]. Пациенты с генотипом 3 HCV привлекают в этом плане особенное внимание в связи с агрессивностью течения, резистентностью к терапии, более высокой частотой ФП и реальной вероятностью развития осложнений[21–25]. Необходимо подчеркнуть, что в доступной литературе работы по изучению зависимости клинических проявлений ХВГС с разными генотипами от выраженности ФП немногочисленны[26, 27], что затрудняет определение маркеров риска развития ГЦК.
ЗАКЛЮЧЕНИЕ
Сравнительное обследование 297 больных с генотипом 1 HCV и 231 пациентов с генотипом 3 HCV показало превалирование ФП F3–F4 стадий у лиц с генотипом 3. Выраженный ФП был ассоциирован в обеих группах пациентов с увеличением частоты печеночных жалоб, частоты гепатомегалии и спленомегалии на УЗИ, увеличением содержания билирубина и АЛТ в крови, снижением количества тромбоцитов и концентрации альбумина в крови. Только у пациентов с генотипом 3 HCV определялись повышение вирусной нагрузки и тенденция к снижению доли нейтрофилов в крови у лиц с ФП F3–F4 стадий в сравнении с ФП F0–F2 стадий. Мы полагаем, что объяснение более высокой частоты выраженного ФП у больных с генотипом 3 HCV, вероятно, заключается в более значительной деформации иммунного ответа, приводящего к увеличению вирусной нагрузки и агрессивному течению патологии. Мы считаем, что пациенты с генотипом 3 HCV нуждаются в активном диспансерном наблюдении для профилактики развития цирроза печени и ГЦК. Маркерами, указывающими на опасность прогрессирования заболевания, следует считать содержание нейтрофилов в крови и высокий уровень вирусной нагрузки.
Поступила: 16.01.2023
Принята к публикации: 27.02.2023







