В настоящее время в ургентной хирургии органов брюшной полости выбор лечебной тактики при остром панкреатите является одной из наиболее актуальных проблем [1, 2]. Известно, что больные острым панкреатитом составляют не менее 10% от всех пациентов с острыми абдоминальными болями, а по данным Департамента здравоохранения города Москвы в 2014–2015 гг. воспалительные заболевания поджелудочной железы регистрировались даже чаще — не менее чем у четверти всех ургентных абдоминальных хирургических больных [1–3]. Увеличение доли пациентов с воспалительными заболеваниями поджелудочной железы закономерно привело к росту частоты регистрации тяжелых форм острого панкреатита: на территории нашей страны они составляют 25–44% [4, 5].
По современным представлениям, лечение тяжелого острого панкреатита является мультидисциплинарной и весьма непростой задачей. При этом обязателен комплаенс в работе хирургической службы, отделений интенсивной терапии, параклинических служб и смежных специалистов. Одними из ключевых звеньев патогенеза и прогрессии деструктивного процесса в поджелудочной железе, реализации синдрома полиорганной недостаточности и формирования «порочных кругов» следует считать моторно-эвакуаторные нарушения пищеварительного тракта в виде динамической кишечной непроходимости и внутрибрюшную гипертензию, нарастающую при реализации закона Паскаля на фоне висцерального отека и пареза [2, 5]. Доказана прямая корреляция между инфицированием панкреонекроза и ростом внутрибрюшного давления, что проявляется в риске инфицирования более чем у 90% пациентов при экспозиции внутрибрюшного давления 2-й степени и выше на протяжении 72 часов [6].
Безусловно, в современном хирургическом арсенале имеется возможность применения механической гастроинтестинальной декомпрессии при помощи назогастрального, назоинтестинального зондов или ректальных трубок с активной аспирацией желудочного (кишечного) содержимого, что позволит снизить внутрипросветное внутрикишечное давление [7, 8]. Подобные манипуляции приводят к улучшению венозного оттока стенки кишки, сохранению барьерной функции энтероцитов, предотвращают транслокацию кишечной флоры и эндотоксемию [7, 9], однако в условиях длительной персистенции повышенного давления они теряют свою эффективность [10].
При паралитическом илеусе как одной из причин роста внутрибрюшного давления возможно применение лекарственной стимуляции, это доказывается успешным использованием ингибиторов ацетилхолинэстеразы [11–16]. Усилению перистальтики способствует также применение слабительных препаратов, что, однако, не находит своего отражения в доказательных исследованиях по лечению внутрибрюшной гипертензии по данным литературы [17, 18].
Таким образом, коррекция явлений внутрибрюшной гипертензии необходима для улучшения показателей лечения у данных больных и достигается при мониторинге давления с патогенетически подобранной терапией [16, 19].
Целью пилотного исследования являлось изучение эффективности и возможности внедрения в лечебный арсенал неинвазивной методики мониторинга и стимуляции перистальтической активности пищеварительного тракта у пациентов с тяжелым острым панкреатитом для коррекции моторно-эвакуаторных нарушений и снижения внутрибрюшного давления.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе работы проанализирован исход лечения 43 пациентов с острым панкреатитом тяжелого течения, которые находились на стационарном лечении в городских клинических больницах № 50 им. С. И. Спасокукоцкого и № 81 им. В. В. Вересаева, являющихся базами кафедры хирургических болезней и клинической ангиологии Московского государственного медико-стоматологического университета имени А. И. Евдокимова Минздрава России, в период 2016–2017 гг.
В качестве критериев включения пациентов в исследование были выделены картина тяжелого острого панкреатита без инфицирования, без признаков нарушения желчеоттока и онкоанамнеза; отсутствие «фекалойдной» рвоты и декомпенсированной кишечной непроходимости динамического генеза; возраст в диапазоне 18–60 лет (для минимизации рисков присоединения моторно-эвакуаторных нарушений ввиду снижения спланхнического кровотока вследствие возрастных изменений и сосудистого компонента); верхняя граница внутрибрюшного давления, равная 20 мм рт. ст.
Критерием исключения считали отказ пациента как от самого исследования, так и от интравезикальной манометрии внутрибрюшного давления.
Тяжесть течения острого панкреатита оценивали по критериям и рекомендациям Российского общества хирургов (РОХ) и Ассоциации гепатопанкреатобилиарных хирургов стран СНГ. При этом при наличии 9 баллов и более по шкале APACHE II (англ. Acute Physiology and Chronic Health Evaluation — Шкала оценки острых физиологических расстройств и хронических нарушений состояния) диагноз тяжелого острого панкреатита считали правомочным.
Средний возраст больных составил 42,7 ± 3,8 года, что подчеркивает актуальность изучаемой проблемы у пациентов трудоспособного возраста. В исследуемой группе преобладали лица мужского пола в соотношении 6–7 : 1. У абсолютного большинства пациентов (n = 42; 97,7%) была алиментарно-алкогольная форма острого панкреатита.
Группа больных набиралась проспективно с 2016 по 2017 г., при этом полностью соблюдались протоколы лечебной тактики при тяжелом остром панкреатите согласно нормативным документам Департамента здравоохранения города Москвы и НКР РОХ с использованием стандартного набора лабораторных и инструментальных методов диагностики: УЗИ, МСКТ с болюсным усилением. У 2/3 пациентов выполняли видеолапароскопию при наличии более 250 мл выпота в брюшной полости и сальниковой сумке с эвакуацией содержимого и полипозиционным дренированием брюшной полости.
Одним из основополагающих компонентов лечебной тактики мы считали мультимодальный подход с содружественной работой хирургической, эндоскопической, рентгенологической и реанимационной служб стационара, а также включением в лечебный арсенал методов эфферентной терапии при индексе APACHE II 15 баллов и выше, II–III степени эндотоксикоза по В. К. Гостищеву.
С учетом тяжести состояния все пациенты исходно госпитализировались в отделения реанимационного типа с обязательной установкой назогастрального или назоеюнального зонда. В последнем случае установка осуществлялась под эндоскопическим контролем с выполнением щипцевой биопсии слизистой за областью дуоденоеюнального перехода из проксимальной порции тощей кишки. Морфологическая оценка состояния слизистой оболочки проксимальных отделов тощей кишки проводилась на старте лечения и на 7-е сутки у 1/2 (n = 23; 53,5%) пациентов (для легитимности подобных манипуляций получено положительное заключение межвузовского комитета по этике).
Измерение параметров внутрибрюшного давления выполняли методом непрямой манометрии трансвезикально [11], а на основании полученных данных рассчитывали также значения абдоминального перфузионного давления (дельту между средним артериальным и внутрибрюшным давлением). Последний аспект следует считать достаточно важным показателем висцеральной перфузии [20], в том числе в связи с тем, что он является критерием инфузионной терапии [11], так как уровень абдоминального перфузионного давления ниже 60 мм рт. ст. напрямую коррелирует с выживаемостью пациентов с синдромом внутрибрюшной гипертензии [21]. В ходе терапии внутрибрюшное давление и расчетные показатели мониторировались ежесуточно за 1,5–2 часа до сеанса стимуляции и сразу же после его прекращения, а также соотносились с балльной оценкой по шкале APACHE II на 1, 3, 5, 7-й день лечения.
Полученные в ходе исследования данные обработаны статистически с расчетом средней арифметической (М), средней ошибки (m). Результаты считали статистически значимыми при p ≤ 0,05.
Методика резонансной стимуляции и техника исследования
На старте лечения всем пациентам была проведена оценка перистальтической активности методом электрогасто-, электроэнтеро-, электроколографии на «Селективном полиграфе ЖКТ» (патент РФ № 2023419) [22], что позволяло регистрировать полученные сигналы в виде синусоид с последующей их математической оценкой.
В дальнейшем с целью коррекции внутрибрюшной гипертензии и профилактики прогрессирования динамической кишечной непроходимости наряду с базисной терапией острого панкреатита тяжелого течения проводились сеансы последовательной резонансной стимуляции пищеварительного тракта. Использовали «Резонансный стимулятор ЖКТ» [22], формирующий синусоидальные колебания с различной задаваемой частотой. При данном виде электровоздействия применяли метод стимуляции в индивидуально корригируемых режимах последовательно: желудок → дуоденум → тонкая кишка → толстая кишка (патент РФ № 2648819). Электроды располагались на передней брюшной стенке, при этом их локализация строго соответствовала зональному расположению в проекции обоих фланков живота. Сама стимуляция проводилась токами малой силы (это позволяло исключить явления дискомфорта для пациента без снижения клинической эффективности метода) на все отделы пищеварительной трубки последовательно до достижения синхронизации всех спектров колебаний (рис. 1); режим стимуляции осуществлялся с первых часов пребывания пациентов в отделениях интенсивной терапии.
Рис. 1. Этап достижения синхронизации спектров перистальтической активности
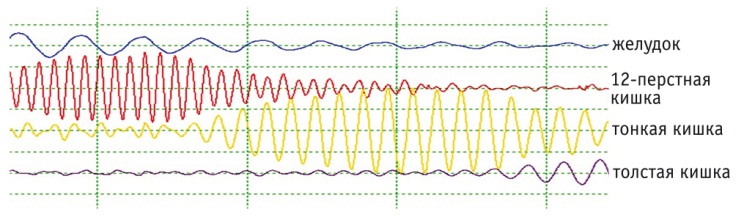
В последующем была выполнена математическая обработка полученных данных (амплитуд осцилляций в мкВ) с расчетом средних значений (M ± m) для анализа кривых и оценки эффективности процедуры.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
После старта базисной терапии согласно нормативным документам был проведен анализ исходной перистальтической активности на «Селективном полиграфе ЖКТ»: выявлены низкоамплитудные спектры колебаний (10,7 ± 4,2 мкВ), соответствующие снижению моторно-эвакуаторной функции и парезу кишечной стенки (рис. 2А).
Рис. 2. Электрогастроэнтерограммы.
А — исходные данные; Б — после завершения сеанса стимуляции (фоновый режим)
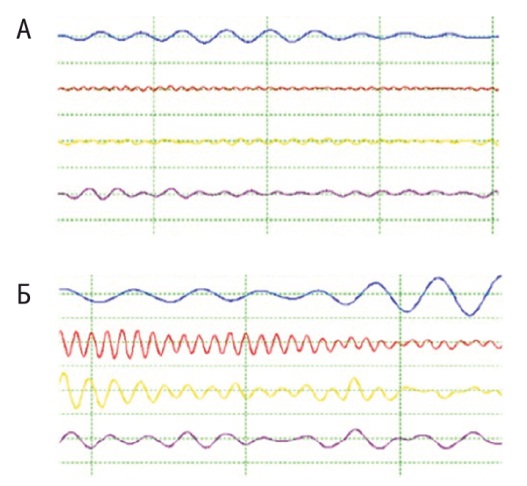
С первого сеанса резонансной терапии у абсолютного большинства пациентов (n = 42; 97,7%) получены ответы всех стимулированных отделов пищеварительного тракта с синхронизацией спектров чувствительности указанных отделов (см. рис. 1) и увеличением вольтажа до 76,2 ± 7,9 мкВ, при последующих ежесуточных сеансах наблюдался дальнейший рост осцилляций до 138,3 ± 29,1 мкВ. Со второго-третьего сеанса отмечалось стойкое сохранение амплитудности в фоновых режимах (при отключении электровоздействия) со статистически значимыми (p ≤ 0,05) отличиями от параметров старта лечения (рис. 2Б). Суммарная продолжительность подобной электротерапии составила 4,1 ± 1,9 суток при экспозиции сеансов 101 ± 38 минут. Для оценки эффективности терапии анализировались кривые спектров, а критериями прекращения воздействия явились получение самостоятельного стула, отчетливая аускультативная картина перистальтических шумов и отсутствие признаков сохранения пареза кишечника (клинически, инструментально, по данным селективного полиграфа).
Динамика показателей внутрибрюшного давления и абдоминального перфузионного давления, а также баллов по шкале APACHE II представлена в таблице. Отмечена статистическая значимость различий между значениями этих показателей на старте лечения и на его 7-е сутки (р ≤ 0,05).
Таблица
Изменение показателей внутрибрюшного давления, абдоминального перфузионного давления и баллов по шкале APACHE II в ходе лечения
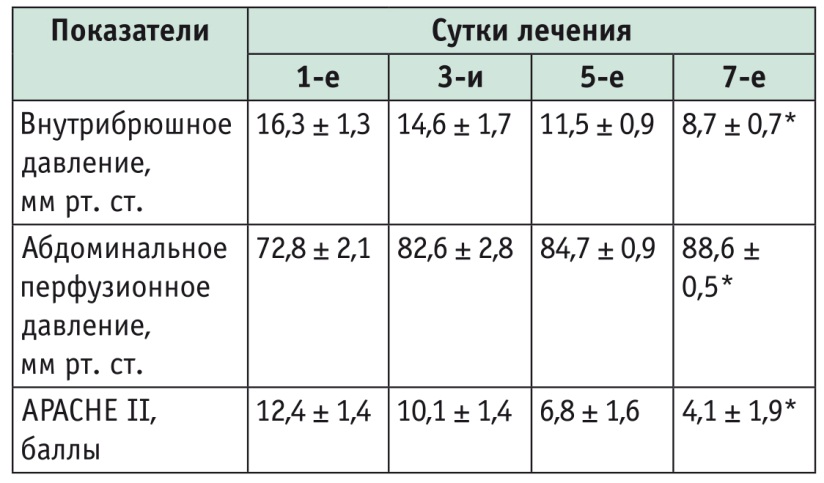
* P ≤ 0,05 при сравнении со стартовым показателем.
Важно отметить, что параметры внутрибрюшного давления анализировались нами как до начала конкретного сеанса терапии, так и сразу по его окончании. При этом для первых трех сеансов получена разность значений в 1,2 ± 0,8 мм рт. ст., а в дальнейшем — порядка 2,5 мм рт. ст. за сеанс, что позволяет с определенной долей вероятности прогнозировать эффект лечения с учетом вышеприведенного способа коррекции моторно-эвакуаторных нарушений пищеварительного тракта.
Самостоятельный стул получен к исходу 72 часов лечения у 100% пациентов, а полное восстановление моторно-эвакуаторной функции пищеварительного тракта (отсутствие вздутия и метеоризма, ретроградного сброса по желудочному зонду, активная аускультативная картина перистальтики и электрогастроэнтерографически регистрируемая пропульсивность должной амплитуды, отхождение газов и самостоятельный регулярный стул) отмечено к 5-м суткам лечения у 42 (97,7%) пациентов.
Эффективность комплексного лечения доказывалась также результатами морфологических исследований слизистой оболочки проксимальных порций тощей кишки, взятых на 1-е и 7-е сутки лечения посредством внутрипросветной биопсии во время установки назоеюнального зонда или проведения гастродуоденоскопии с заведением аппарата за область дуоденоеюнального перехода. Морфологические исследования были выполнены 23 пациентам (53,5%). При этом исходно имел место выраженный отек слизистого и подслизистого слоев стенки кишки, просвет вен был расширен, в просвете отмечались стазы. Наблюдались очаговые кровоизлияния, диффузная лимфолейкоцитарная воспалительная инфильтрация, атрофия крипт, участки слущивания эпителия кишки (рис. 3А).
Рис. 3. Морфологическая картина слизистой оболочки проксимальной порции тощей кишки на 1-е (А) и 7-е (Б) сутки лечения.
Окраска гематоксилин-эозином, ув. × 100. Фото авторов
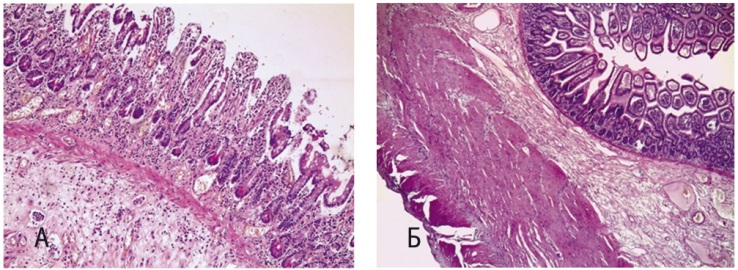
На 7-е сутки сохранялся умеренный отек, преимущественно подслизистого слоя стенки кишки. Воспалительная инфильтрация имела слабовыраженный, очаговый характер и была представлена преимущественно лимфоцитами. Слущивания эпителия не наблюдалось (рис. 3Б).
К исходу лечения инфицирование панкреонекроза наступило у 9 (20,9%) пациентов. Оно потребовало использования всего спектра оперативных, в том числе малоинвазивных, методов: оментобурсостомии (дополнявшейся по показаниям люмботомией); транскутанного дренирования острых жидкостных скоплений под ультразвуковым контролем; некрэктомии, в том числе проводившейся видеолапароскопически. Отмечены 3 летальных исхода, во всех наблюдениях причина exitus letalis была экстрапанкреатической.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют о том, что именно внутрибрюшная гипертензия является своеобразным триггером в каскаде «поломок», приводящих к полиорганной недостаточности. Своевременная коррекция внутрибрюшной гипертензии и скорейшее разрешение пареза составляют один из основополагающих моментов в лечебном арсенале у больных с тяжелым острым панкреатитом.
Методика неинвазивной транскутанной резонансной стимуляции является доступной, легко воспроизводимой, удовлетворительно переносится пациентами без явлений дискомфорта, что позволяет рекомендовать подобные виды терапии для больных тяжелым острым панкреатитом с явлениями моторно-эвакуаторных нарушений перистальтики кишечника и синдромом внутрибрюшной гипертензии.







