Основная задача лечения ПГ — предотвращение кровотечений из воротной вены. Благодаря новым возможностям хирургического лечения в последние годы тактика ведения детей с ПГ изменилась. Широкое внедрение сосудистых операций — портосистемного шунтирования — позволяет эффективно контролировать кровотечения у большой группы пациентов [4–6]. Если выполнение портосистемного шунтирования невозможно или противопоказано, то используют эндоскопические методы профилактики кровотечений: склерозирование и лигирование варикозных вен [7–9]. В качестве более агрессивной альтернативы эндоскопическим методам некоторые авторы предлагают операции деваскуляризации [10–12]. Переворотом в тактике хирургического лечения ВПГ стали работы J. de Ville de Goyet, разработавшего способ радикальной коррекции порока с восстановлением портальной перфузии печени (ППП) [13, 14].
В статье обобщен 28летний опыт хирургического лечения детей с ПГ. По мнению авторов, одно из важнейших направлений научного анализа — изучение отдаленных результатов операции. Проведенные исследования позволили разработать эффективный алгоритм хирургического лечения различных форм ПГ в детском возрасте.
Цель исследования: улучшение результатов хирургического лечения детей с ПГ.
МАТЕРИАЛЫ И МЕТОДЫ
С 1989 по 2017 г. в ДГКБ № 13 им. Н. Ф. Филатова наблюдали 789 больных ПГ в возрасте от 2,5 мес до 17 лет, 23,5% которых составили дети младше 3 лет. У 718 (91,0%) участников была ВПГ, у 66 (8,4%) — внутрипеченочная ПГ и у 5 (0,6%) пациентов — надпеченочная форма ПГ (синдром Бадда — Киари). В группу больных внутрипеченочной ПГ вошли 39 детей с различными вариантами цирроза печени, 27 — с врожденным фиброзом печени.
Ранее 23,7% детей проходили лечение в других учреждениях. Восемьдесят два ребенка перенесли различные виды паллиативных процедур: спленоэктомию, прошивание варикозных вен желудка и др. У 18 детей ранее были выполнены различные шунтирующие операции, у 20 — неоднократные повторные курсы эндоскопического склерозирования (ЭС).
Всего проведена 791 операция у 764 детей, в том числе 27 повторных хирургических вмешательств при неэффективности первого: сохранении угрозы кровотечения, выявленной при контрольном исследовании, или в случае рецидива кровотечения. Еще 25 детей находятся под динамическим наблюдением, угроза кровотечения у них отсутствует.
Больным с кровотечениями в анамнезе выполняли плановые операции (n = 504, 63,9%). У детей с высоким риском кровотечения из варикозных вен по данным фиброэзофагогастродуоденоскопии (ФЭГДС) проводили хирургическое вмешательство по профилактическим показаниям (n = 194, 24,6%).
Тактика лечения острых кровотечений. По экстренным показаниям в связи с продолжающимся пищеводножелудочным кровотечением в клинику поступили 252 (31,9%) ребенка. В этом случае тактика остановки кровотечения была следующей:
- полностью исключали кормление через рот;
- устанавливали желудочный зонд для декомпрессии желудка и контроля кровотечения;
- назначали седативные препараты и строгий постельный режим;
- вводили гемостатические препараты (этамзилат, транексамовую кислоту, апротинин, октреотид);
- переливали эритроцитарную массу, свежезамороженную плазму крови;
- инфузионную терапию проводили в объеме 50% долженствующего возрастного объема.
Портосистемное шунтирование. Хирургические вмешательства, выполненные в ДГКБ № 13 им. Н. Ф. Филатова г. Москвы с 1989 по 2017 г., представлены в таблице. Техника оперативных вмешательств описана ранее [15–17].
Таблица
Спектр хирургических операций, выполненных у детей с портальной гипертензией в 1989–2005 гг.
В большинстве случаев выполняли различные виды спленоренального шунтирования или мезокавального Ншунтирования по методике, описанной ранее [4, 18]. Выбор метода шунтирования во многом определялся особенностями анатомии сосудов брюшной полости и предыдущими оперативными вмешательствами. Авторы отдают предпочтение спленоренальным анастомозам.
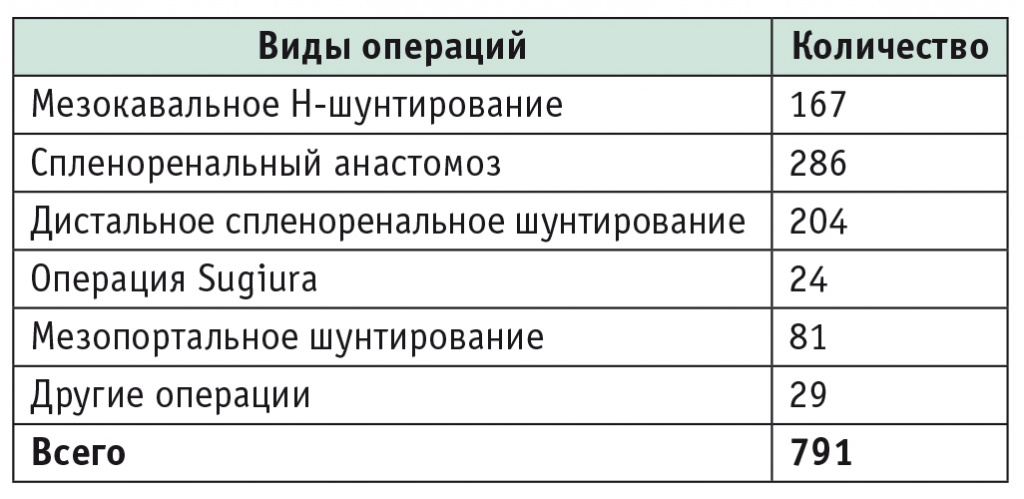
Деваскуляризация и эндоскопическое склерозирование. У 24 больных проводили операцию Sugiura. В эту группу вошли дети, которым было невозможно выполнить сосудистое шунтирование изза предыдущих операций, а также пациенты с внутрипеченочной ПГ. Операция Sugiura включает деваскуляризацию пищевода и желудка, спленоэктомию и эзофаготомию с последующим эзофагоэзофагоанастомозом [12, 18] (рис. 1).
Рис. 1. Схема операции Sugiura
Операцию проводили в один этап из лапаротомного доступа. С 2001 г. деваскуляризацию дополняли ЭС в послеоперационном периоде: через 6–12 месяцев после вмешательства во время контрольной ФЭГДС. Использовали натрия тетрадецилсульфат. С помощью эндоскопической иглы препарат вводили в остаточные после деваскуляризации варикозные венозные стволы пищевода в объеме 0,6–1,5 мл. В дальнейшем, если выявляли сохраняющиеся варикозные вены пищевода, процедуру повторяли до полной редукции варикозных стволов.
У 8 детей с билиарным циррозом печени ЭС использовали для профилактики кровотечений на период ожидания трансплантации печени.
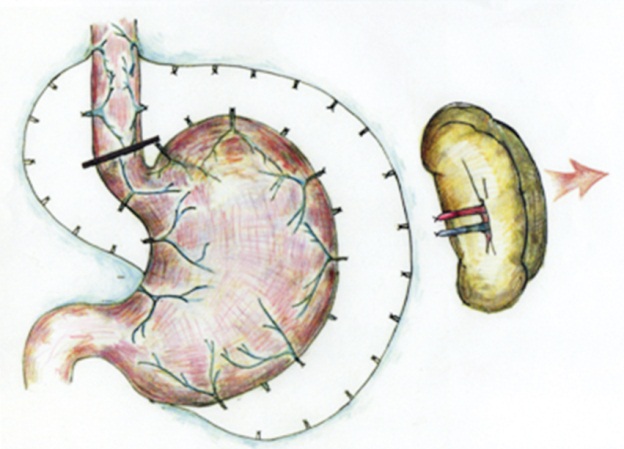
Мезопортальное шунттрование (МПШ). С февраля 2000 г. мы выполняем операции МПШ, направленные на восстановление ППП.
Основные принципы этой операции описаны ранее [19, 20].
1. Операцию начинают с поиска по ходу пупочной вены и выделения левой ветви воротной вены в паренхиме печени. При этом часто пересекают паренхиматозный мостик между III и IV сегментами печени.
2. В случае облитерации левой ветви воротной вены выполняют один из вариантов портосистемного шунтирования.
3. Если левая ветвь воротной вены проходима, то ее временно пережимают сосудистым зажимом и формируют в ее стенке отверстие не менее 1 см для создания сосудистого анастомоза.
4. Затем выделяют верхнюю брыжеечную вену сразу ниже поджелудочной железы.
5. Для соединения верхней брыжеечной вены и левой ветви воротной вены используют аутовенозную вставку из внутренней яремной вены, чаще левой. У одного ребенка в связи с тромбозом внутренних яремных вен с двух сторон в качестве аутовенозной вставки использован фрагмент нижней полой вены (рис. 2).
Рис. 2. Схема операции мезопортального шунтирования
Методы обследования. Некоторым детям, помимо рутинного обследования, включающего ФЭГДС и УЗИ с доплерографией, выполняли селективную цифровую ангиографию [21]. Эти исследования целесообразны после введения новых хирургических методик шунтирования, а также при сомнительных результатах функционирования сосудистых анастомозов.
Для оценки качества жизни ребенка проводили психоневрологическое обследование. Все дети обследованы через год после операции. Для изучения отдаленных результатов хирургического лечения 172 пациента в возрасте от 6 до 32 лет обследованы в сроки более 5 лет после хирургического вмешательства. Помимо анкетирования, помогающего оценить качество жизни больных в отдаленные сроки после операции, проведено комплексное обследование, позволяющее объективизировать результаты.
РЕЗУЛЬТАТЫ
Из 252 детей, поступивших в клинику на высоте кровотечения, у 160 (63,5%) оно было остановлено с помощью консервативной терапии. На высоте кровотечения оперированы 92 пациента.
У 737 (96,5%) детей риск кровотечения из варикозных вен ликвидирован после первой операции. Общая летальность составила 0,9% (7 больных).
Результаты портосистемного шунтирования. Всего проведены 767 операций портосистемного шунтирования (включая повторные). Отсутствие эффекта отмечено у 15 детей (1,9% больных в группе с шунтирующими операциями). Все эти пациенты оперированы повторно. При этом у 12 участников выполнены различные виды портосистемного шунтирования, у 3 — операция Sugiura.
Результаты деваскуляризации и эндоскопического склерозирования. Рецидив кровотечения развился у 6 (25,0%) из 24 перенесших операцию Sugiura.
Детей, которым делали операцию деваскуляризации, можно разделить на две группы. Первая группа включала 11 пациентов, прооперированных до 2001 г. Рецидив кровотечения развился у 4 (36%) из них, и они были оперированы повторно: в 2 случаях выполнили операцию перевязки левой желудочной вены, а 2 детям с врожденным фиброзом печени (ВФП) — мезокавальный анастомоз.
Вторая группа — 13 детей, которым после операции Sugiura дополнительно проводили ЭС. Рецидив кровотечения возник у 2 (15,4%) детей. У 1 пациента с ВФП выполнен спленоренальный анастомоз и у 1 ребенка с ВПГ, вызванной пороком развития висцеральных сосудов и синдромом Элерса — Данло, — мезокавальный анастомоз. Угроза кровотечения ликвидирована.
Среднее количество процедур ЭС составило 3,5. Осложнений склерозирования не выявлено.
Результаты мезопортального шунтирования. Впервые МПШ мы выполнили в феврале 2000 г. С тех пор детям с ПГ проведены 234 шунтирующие операции. У 81 ребенка в ходе ревизии воротной вены выявлены проходимая левая ветвь и ретроградный кровоток из нее. Им сделана операция МПШ.
У 74 (91,4%) больных достигнут отличный результат — редукция варикозных вен. У 5 детей в послеоперационном периоде отмечен рецидив кровотечения из варикозных вен, у 3 пациентов — отсутствие редукции варикозных вен. УЗИ и ангиографическое исследование подтвердили неадекватную функцию мезопортального анастомоза. Все дети после неэффективного МПШ оперированы повторно — выполнены различные виды портосистемных анастомозов. Риск кровотечения ликвидирован.
Из специфических осложнений операции МПШ в 3 случаях отмечали развитие желчного перитонита, связанного с повреждением сегментарных внутрипеченочных желчных путей при выделении левой ветви воротной вены. Один ребенок был оперирован — выполнен анастомоз по Ру. В 2 случаях брюшная полость была дренирована, что привело к выздоровлению детей.
Таким образом, выполнение МПШ стало возможным у 81 (34,6%) ребенка из 234. У остальных 153 либо ветви воротной вены были облитерированы, либо ретроградный кровоток был незначителен. Этим детям проведены другие операции: 108 — спленоренальное шунтирование, 42 — мезокавальный анастомоз, 3 — операция Sugiura.
Результаты, полученные с помощью инструментальных методов исследования. По данным ФЭГДС, у 700 (91,6%) из 764 оперированных отмечена выраженная регрессия варикозных вен пищевода (в том числе после повторных операций). У 74,2% пациентов варикозные вены пищевода редуцировались полностью. У 17,4% детей есть варикозные вены 1й степени. Однако у всех в этой группе риск кровотечения отсутствует.
По данным УЗИ с доплерографией, в настоящий момент у всех наблюдаемых пациентов созданные сосудистые шунты функционируют. Средняя скорость кровотока по анастомозу составляет 45,75 см/с.
Представляют несомненный интерес данные исследования ППП. До операции, несмотря на блок кровотока по воротной вене, в гепатопетальных коллатералях регистрировали кровоток со средней скоростью 11 см/с (у здоровых детей скорость кровотока по воротной вене составляет 29 см/с). После операций портосистемного шунтирования зафиксировано значительное снижение ППП (до полного прекращения кровотока по коллатералям) (рис. 3). После «селективных» спленоренальных анастомозов в послеоперационном периоде сохранялась ППП со средней скоростью 8,5 см/с. Однако в отдаленные сроки кровоток по гепатопетальным коллатералям практически полностью прекращался.
Рис. 3. Скорость портальной перфузии печени в раннем послеоперационном периоде и в отдаленные сроки после операции
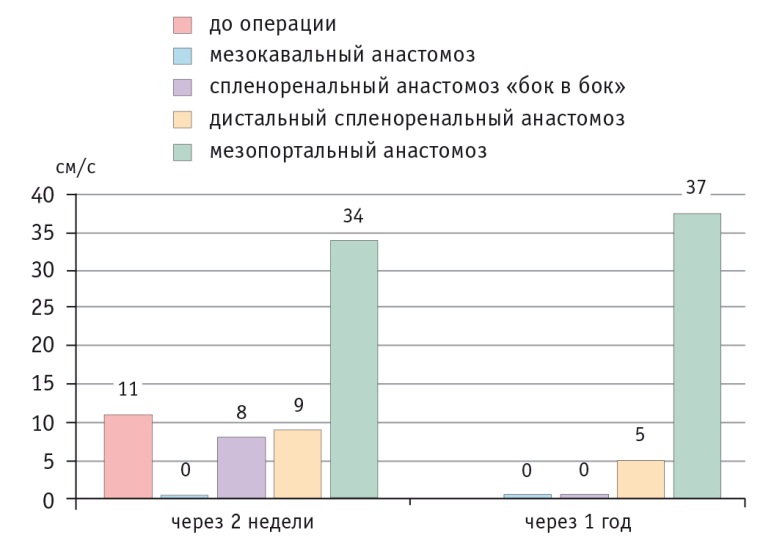
В отличие от портосистемных анастомозов, после операции МПШ ППП значительно увеличивается, и в отдаленные сроки ее скорость возрастает до 37 см/с.
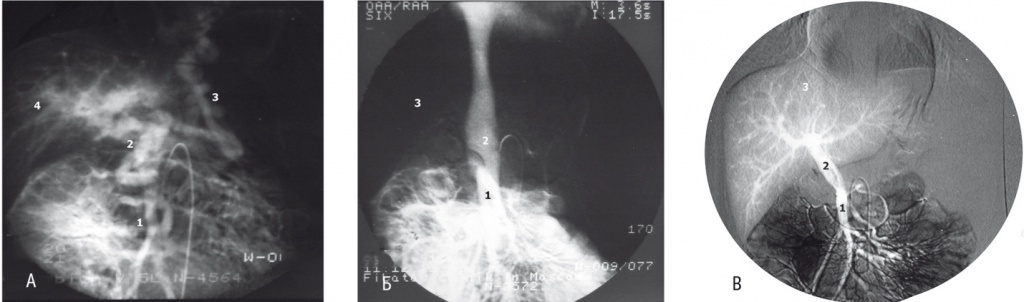
До операции цифровая ангиография позволяла оценить анатомию сосудов брюшной полости и выраженность сброса венозной крови на вены пищевода, возможность выполнения сосудистого анастомоза у детей после предыдущих операций (рис. 4А). После стандартного шунтирования ангиография наглядно демонстрирует функцию сосудистого анастомоза (рис. 4Б). После МПШ она подтверждает восстановление ППП (рис. 4В).
Рис. 4. Возвратная мезентерикопортография. Фото авторов.
А — при внепеченочной портальной гипертензии. Интенсивное контрастирование печени из бассейна верхней брыжеечной вены (I степень портальной перфузии печени): 1 — верхняя брыжеечная вена, 2 — «портальная кавернома» в воротах печени, 3 — сброс крови на варикозные вены желудка и пищевода, 4 — контрастированы ветви воротной вены 4-го порядка до периферии печени.
Б — после мезокавального Н-шунтирования. Вся кровь из верхней брыжеечной вены (1) через Н-шунт поступает в нижнюю полую вену (2). При этом полностью отсутствует контрастирование воротной вены (3).
В — после мезопортального шунтирования. Все контрастное вещество, введенное в верхнюю брыжеечную вену (1), поступает через мезопортальный шунт (2) в печень (3). Портальная перфузия печени в полном объеме
Психоневрологическое обследование 108 детей проведено спустя более года после операции. В отделенные сроки после портосистемных сосудистых анастомозов 78% детей жаловались на головные боли, эмоциональную лабильность, снижение памяти, быструю утомляемость, нарушение контакта со сверстниками. После МПШ у 82% пациентов отмечены улучшения памяти и успеваемости, а также в психоэмоциональной сфере, исчезновение головных болей.
ОБСУЖДЕНИЕ
Возможности оперативного лечения ПГ у детей до сих пор широко обсуждаются. В последнее время принципы хирургического лечения ПГ значительно изменились [18–20, 22].
Основной причиной ПГ в нашей стране служит внепеченочный блок портального кровотока, развившийся либо вследствие тромбоза воротной вены (после катетеризации пупочных сосудов в периоде новорожденности, пупочного сепсиса, омфалита и т. д.), либо вследствие порока развития воротной вены [1, 4, 15]. Характерной особенностью этой формы заболевания является интактность печеночной паренхимы — сохранность печеночных функций. В наших исследованиях дети с ВПГ составили большинство (91,0%). Прогноз хирургического лечения таких детей наиболее благоприятен, что связано в первую очередь с отсутствием риска развития печеночной недостаточности — основной причины летальных исходов у больных циррозом печени.
Безусловно, основная задача лечения ПГ состоит в предотвращении кровотечений из варикозных вен пищевода [23–25]. Острое кровотечение необходимо купировать, по возможности консервативными методами. Применение описанного выше алгоритма позволило остановить кровотечение у 63% детей, поступивших в клинику с острым кровотечением из варикозных вен пищевода. Показанием для оперативного вмешательства служит неэффективность консервативной терапии — продолжающееся кровотечение. При этом больным, оперированным на высоте кровотечения, были выполнены только операции портосистемного шунтирования, такие же, как и детям, оперированным в плановом порядке. В нашей практике не используют ЭС или лигирование варикозных вен пищевода для остановки острого кровотечения.
Бесспорно, вопрос о показаниях к оперативному вмешательству нельзя считать предметом дискуссии, если ребенок поступил на высоте кровотечения или перенес кровотечения в анамнезе. Однако в случае, когда манифестирующим симптомом ПГ являются спленомегалия и гиперспленизм, ставят вопрос об операции по профилактическим показаниям. По нашему мнению, у больных с ВПГ без кровотечения в анамнезе, но с выраженными варикозными венами оперативные вмешательства оправданы, особенно если ребенок проживает в районе, отдаленном от крупных медицинских центров [4, 18]. В наших исследованиях доля таких больных превысила 24%. Это избавляет ребенка от опасности внезапного кровотечения из варикозных вен и выполнения паллиативных процедур (прошивания вен, спленоэктомии и др.) по месту жительства.
До поступления в нашу клинику многие пациенты (до 23%) были оперированы несколько раз без эффекта. Несомненно, каждая безуспешная операция ограничивает возможности хирургического лечения и увеличивает риск послеоперационных осложнений. Надо отметить более высокий риск рецидива кровотечения в группе детей с ранее выполненными безуспешными операциями.
Так же, как и другие авторы, мы считаем операции портосистемного шунтирования наиболее эффективным методом предотвращения кровотечений из варикозных вен [17, 25–28]. Все операции шунтирования (кроме МПШ) направлены на декомпрессию портальной системы с высоким давлением за счет создания сосудистого анастомоза с системой нижней полой вены с низким давлением. Эффективность таких вмешательств очень высока. В нашей группе больных успехом увенчались 96,5% первичных операций, а после повторных хирургических вмешательств в случае неадекватной работы сосудистого анастомоза мы добились контроля кровотечения в 100% случаев.
Ограничениями операций портосистемного шунтирования следует признать отсутствие висцеральных вен, пригодных для выполнения сосудистого анастомоза, и внутрипеченочную форму ПГ. В этом случае альтернативой ему может служить деваскуляризация [11, 12, 29]. Операция Sugiura разработана в Японии в 1978 г., в первую очередь для лечения больных циррозом печени. Сообщения о ее применении у детей малочисленны. Несомненно, эффективность этого хирургического вмешательства для предотвращения кровотечений ниже, чем шунтирующих операций (рецидив кровотечений у 27,7% против 3,5% в группе сосудистых операций в других наших исследованиях) [18]. По нашему мнению, показаниями для операции Sugiura служат невозможность выполнения шунтирования (отсутствие вен, пригодных для наложения анастомоза) у детей с ВПГ и внутрипеченочная ПГ с явлениями нарушения печеночных функций.
Опыт применения ЭС у детей в нашей стране ограничен [7, 8]. Бесспорно, этот метод привлекателен малоинвазивностью, но риск рецидива кровотечений у детей с ВПГ значителен (до 35%) [21, 30]. В нашей группе было 15 больных, перенесших многократные курсы склеротерапии по месту жительства без эффекта. В связи с тяжелыми рецидивирующими кровотечениями из варикозных вен мы выполнили этим детям портосистемное шунтирование. По нашему мнению, ЭС у детей с ВПГ как основной метод лечения малоэффективно. Представляется целесообразным дополнять операцию Sugiura ЭС для улучшения результатов. Именно это позволило сократить риск рецидива кровотечений до 15,4%. Кроме того, мы используем ЭС у детей с билиарным циррозом печени для предотвращения кровотечений в период ожидания трансплантации печени.
Наши исследования подтвердили наблюдения других авторов: после операций портосистемного шунтирования ППП прогрессивно снижается даже в случае так называемых селективных спленоренальных анастомозов [15, 31, 32]. Это один из факторов, ограничивающих применение таких операций у детей с внутрипеченочной ПГ изза риска развития портосистемной энцефалопатии и печеночной недостаточности.
Революцией в хирургии ПГ стала операция МПШ, предложенная J. Ville de Goye в 1998 г., которая направлена именно на восстановление ППП у детей с ВПГ [13, 14, 33].
По нашим данным, левая ветвь воротной вены, пригодная для выполнения сосудистого анастомоза, выявлена у 34,6% детей. Надо отметить, что наши результаты отличаются от полученных исследователями из Западной Европы и США. В США и Великобритании вероятность выполнения МПШ составляет 85–90%, в Западной Европе — 75–80%, в Восточной Европе — 40–50% [3, 5, 14, 34]. Эта статистика отражает причину ВПГ: катетеризации пупочных вен, пупочный сепсис и т. д. в разных популяциях. Таким образом, у детей, живущих в России, возможность полного восстановления портального кровотока при ВПГ составляет 30–35% общего числа больных детей. Во всех остальных случаях посттромботические изменения ствола воротной вены распространялись и на внутрипеченочные ветви.
На этапе становления методики у 4 пациентов в ходе операции мы обнаружили незначительный ретроградный кровоток из левой ветви воротной вены. При этом диаметр выделенного сосуда был равен 3–4 мм. Мы предположили, что такой диаметр достаточен для выполнения анастомоза и что с течением времени интенсивность кровотока по воротной системе возрастет. Однако эти предположения не подтвердились. Неадекватный кровоток по созданному шунту стал причиной рецидива кровотечений у наших больных. В настоящее время мы считаем, что МПШ можно выполнять при достаточном ретроградном кровотоке из выделенного сосуда и при диаметре выделенной ветви воротной вены около 10 мм. Еще у 3 пациентов причиной рецидива кровотечения стал тромбоз аутовенозной вставки.
Частота послеоперационных осложнений МПШ не выше, чем стандартных шунтирующих операций. Наибольшие сложности связаны с выделением ветвей воротной вены у детей, перенесших пупочный сепсис, а также в случае, если для выделения сосудов приходится пересекать паренхиматозный мостик между III и IV сегментами. При этом возрастает риск повреждения сегментарных желчных протоков, ставшего причиной развития желчного перитонита у 3 больных. В настоящее время мы стараемся избегать электрокоагуляции при выделении ветвей воротной вены в паренхиме печени.
Результаты УЗИ и ангиографии наиболее наглядно демонстрируют эффект МПШ. По данным УЗИ, скорость ППП после операции сравнима с таковой у здорового ребенка. При ангиографии четко видно восстановление нормального анатомофизиологического строения портальной системы.
О восстановлении ППП свидетельствуют и данные психоневрологического исследования. Нормализация неврологических и психоэмоциональных показателей после МПШ говорит об усилении дезинтоксикационной функции печени [13, 31].
ЗАКЛЮЧЕНИЕ
На современном этапе возможности хирургического лечения портальной гипертензии позволяют не только избавить ребенка от угрожающих жизни кровотечений, но и нередко полностью восстановить нормальную анатомию и физиологию портальной системы. Операции деваскуляризации показаны при невозможности выполнения сосудистых операций.







