Колоректальный рак (КРР) является важной медицинской проблемой, особенно в развитых странах[1]. Ежегодно в мире выявляется около 1,36 млн случаев КРР, что составляет 10% всех впервые диагностированных злокачественных новообразований. В 2012 г. у мужчин КРР стал третьим по распространенности онкологическим заболеванием (10,0%), уступив только раку легких (16,7%) и предстательной железы (15,0%). У женщин он находился на втором месте по частоте выявления (9,2%) после рака молочной железы (25,2%)[2].
Для КРР характерен длительный доклинический период, начинающийся с появления колоректальной аденомы, нарастания тяжести ее дисплазии и заканчивающийся формированием карциномы. Удаление колоректальной аденомы уменьшает заболеваемость КРР на 76–90%. У пациентов с удаленными полипами в последующие 16 лет летальность от КРР снижается на 53% по сравнению с ожидаемой смертностью от КРР населения в целом[3]. Возможность обнаружения и удаления аденоматозных полипов делает КРР идеальным кандидатом для скрининга[4].
Скрининг КРР является одним из немногих эффективных скринингов на наличие онкологических заболеваний, уступая только скринингу рака шейки матки, который способен снизить заболеваемость на 60–90% и летальность на 90%[5]. Скрининг и профилактика КРР, как мы покажем далее, являются экономически эффективными и сокращают расходы на здравоохранение.
В настоящее время в программах скрининга КРР применяются два основных типа тестов на скрытую фекальную кровь: гваяковая проба (guaiac fecal occult blood test, gFOBT) и фекальные иммунохимические тесты (fecal immunochemical test, FIT).
ПРОГРАММЫ СКРИНИНГА КОЛОРЕКТАЛЬНОГО РАКА В СТРАНАХ МИРА
В течение последних двух десятилетий во многих странах мира были реализованы программы популяционного скрининга. В 2003 г. Совет Европы рекомендовал всем государствамчленам разработать программы скрининга КРР для мужчин и женщин в возрасте от 50 до 74 лет с обследованиями на основе gFBOT ежегодно или с интервалом в 2 года и проведением колоноскопии у лиц с положительными результатами[6].
В 2015 г. 24 страны Евросоюза уже внедрили общенациональные программы скрининга КРР или находились в процессе их развертывания. Например, Финляндия, Франция, Словения и Великобритания полностью завершили внедрение организованного скрининга. В Бельгии, Нидерландах, Дании, Ирландии, Италии, на Мальте, в Польше и Испании его развертывание продолжается. В Норвегии, Португалии и Швеции внедрение скрининга КРР находится на стадии пилотных проектов (табл. 1).
Таблица 1
Основные характеристики скрининга на наличие колоректального рака в странах мира [10]
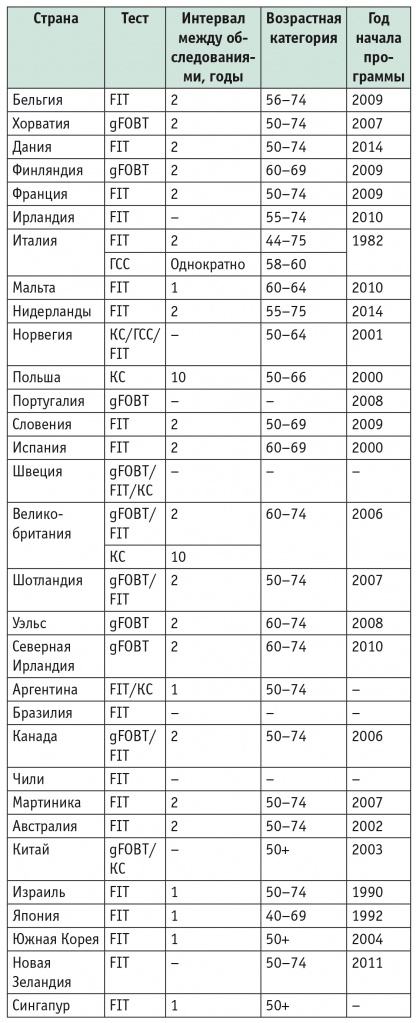
Примечание: FIT — fecal immunochemical test (фекальный иммунохимический тест); gFOBT — guaiac fecal occult blood test (гваяковая проба на скрытую кровь); ГСС — гибкая сигмоидоскопия; КС — колоноскопия.
Другие страны, включая Словакию с самой высокой заболеваемостью КРР в Европе, не имели национальных программ скрининга. К таким странам относятся Болгария, Албания, Босния и Герцеговина, Косово, Македония, Черногория, Румыния, Сербия и Россия[7].
В Канаде в настоящее время все 10 провинций уже внедрили организованные программы скрининга КРР. В большинстве провинций в качестве скринингового теста используют FIT у лиц 50–74 лет со средним риском КРР[8]. В США охват скринингом в соответствии с рекомендациями Рабочей группы профилактических программ США (U.S. Preventive Services Task Force) среди взрослых в возрасте 50 лет и старше увеличился с 34% в 2000 г. до 63% в 2015 г. Самыми распространенными методами скрининга КРР являются колоноскопия и гибкая сигмоидоскопия. В 2015 г. только 7% американцев в возрасте 50 лет и старше сообщили о прохождении в предыдущем году скрининга с применением gFOBT или FIT, при этом 60% опрошенных прошли гибкую сигмоидоскопию в последние 5 лет или колоноскопию в предыдущие 10 лет[9].
В Латинской Америке только Бразилия (в регионе СанПаулу), Уругвай, Чили и Аргентина имеют программы популяционного скрининга КРР, которые находятся в стадии пилотных проектов и охватывают лишь городские районы. На Кубе, в Эквадоре, Мексике и ПуэртоРико проводится оппортунистический скрининг[7, 10] (см. табл. 1).
В Израиле программа организованного скрининга КРР для лиц в возрасте 50–74 лет реализуется четырьмя поставщиками медицинских услуг, при этом правительство осуществляет контроль их деятельности и качества услуг. Застрахованные лица проходят ежегодный скрининг на основе FIT по направлению врачей общей практики[7] (см. табл. 1).
Рабочая группа по борьбе с раком толстой кишки АзиатскоТихоокеанского региона разработала рекомендации по скринингу КРР в регионе, которые недавно были обновлены. Согласно рекомендациям, скрининг должен проводиться у лиц 50–75 лет со средним риском КРР с использованием количественного FIT в качестве предпочтительного метода[11]. В Японии программа скрининга КРР действует с 1992 г. для включенных в систему национального медицинского страхования. Застрахованным японцам в возрасте 40–69 лет предлагается скрининг с использованием FIT[12]. В Южной Корее общенациональный скрининг КРР для населения старше 50 лет был введен в 2004 г. В соответствии с программой скрининга лица, попадающие в целевую категорию, в начале года получают письмо с рекомендацией пройти ежегодный скрининг на основе FIT, а пациентам с положительным результатом предлагается пройти колоноскопию или ирригоскопию с двойным контрастированием[13].
В Австралии пилотный проект в рамках Национальной программы скрининга КРР стартовал в 2002 г., обследование лиц 55–74 лет с применением FIT проводится с интервалом в 2 года[14] (см. табл. 1).
Как видно из таблицы 1, в программах скрининга разных стран используются оба типа тестов — gFOBT и FIT, причем некоторые страны отдают предпочтение одному из них, а другие рассматривают их как равноценные, взаимозаменяемые. Ниже будут освещены причины данных различий.
В России клинические рекомендации по скринингу КРР отсутствуют. Более того, ни одно профессиональное сообщество не утвердило на российском уровне ни рекомендации по организации скрининга КРР, ни требования к проведению диагностических исследований (колоноскопии). На федеральном уровне Минздрав России не обозначил свою позицию относительно организации работ по скринингу КРР. Тесты на скрытую кровь в кале и колоноскопия до настоящего времени в большинстве субъектов Российской Федерации не включены в программы диспансеризации. Таким образом, разработка российских рекомендаций по скринингу КРР остается крайне актуальным направлением дальнейших исследований.
При разработке программы скрининга необходимо учитывать общие критерии ее эффективности и целесообразности[15]. Одной из важных составляющих деятельности в этом направлении является сравнение эффективности gFOBT и FIT.
СОВРЕМЕННЫЕ РЕКОМЕНДАЦИИ США ПО СКРИНИНГУ НА НАЛИЧИЕ КОЛОРЕКТАЛЬНОГО РАКА
В настоящее время наиболее полный анализ эффективности различных методов скрининга имеется в рекомендациях Объединенной рабочей группы США по КРР (U.S. MultiSociety Task Force on Colorectal Cancer)[16] и рекомендациях Рабочей группы профилактических программ США (U.S. Preventive Services Task Force)[17] (табл. 2).
Таблица 2
Скрининговые исследования и межскрининговые интервалы, рекомендуемые Объединенной рабочей группой США по колоректальному раку и Рабочей группой профилактических программ США
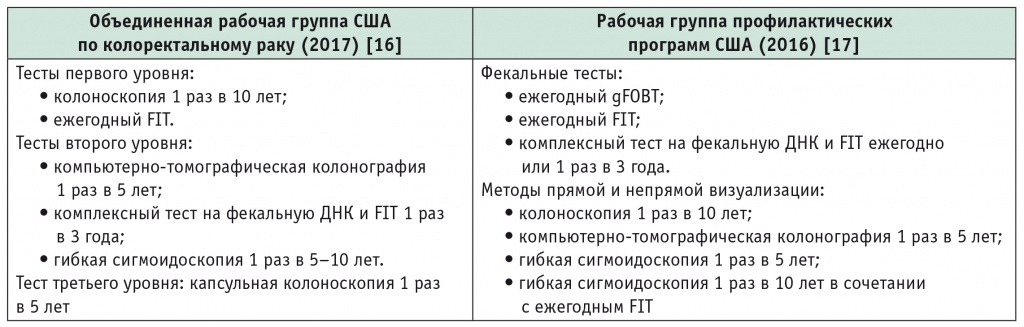
Примечание: FIT — fecal immunochemical test (фекальный иммунохимический тест); gFOBT — guaiac fecal occult blood test (гваяковая проба на скрытую кровь).
В отношении одобренных методов скрининга эти рекомендации во многом совпадают, но есть и одно важное отличие: в рекомендациях Объединенной рабочей группы США по КРР отсутствует gFOBT. Кроме того, если рекомендации Объединенной рабочей группы США по КРР ранжируют все включенные в них методы скрининга КРР на 3 уровня в зависимости от их эффективности, то в рекомендациях Рабочей группы профилактических программ США они делятся на фекальные тесты и методы прямой и непрямой визуализации (см. табл. 2).
СРАВНЕНИЕ ЭФФЕКТИВНОСТИ ФЕКАЛЬНЫХ ТЕСТОВ НА СКРЫТУЮ КРОВЬ
Исследование кала на скрытую кровь (гемоккультный тест) позволяет обнаруживать в кале кровь, которая не определяется визуально и не изменяет цвет кала, т. е. при содержании в нем гемоглобина менее 50 мг на 1 г. В норме с калом ежедневно выделяется менее 2 мл крови, что эквивалентно 2 мг гемоглобина на 1 г кала.
Гваяковый тест. Первоначально gFOBT применялся для диагностики кровотечений из верхних отделов ЖКТ, но в 1970х гг. его начали широко использовать для популяционного скрининга КРР. Он основан на выявлении в кале гема по его пероксидазной активности.
Главный недостаток метода заключается в том, что он не является специфичным, т. е. дает одну и ту же реакцию с гемоглобином и человека, и животных. В связи с этим при подготовке к исследованию требуется в течение нескольких дней соблюдать диету, исключающую продукты, которые могут содержать кровь (мясо, рыбу, птицу). В этот период приходится прекращать и употребление сырых овощей, так как содержащаяся в них пероксидаза также дает ложноположительный результат. Витамин С, напротив, блокирует реакцию с пероксидазой, приводя к ложноотрицательным результатам[18]. По причине диетических ограничений и необходимости взятия трех разных образцов стула в течение трех дней подряд приверженность к скринингу на основе gFOBT, как правило, низкая[18, 19].
Основными преимуществами данного метода являются простота в применении и относительно низкая стоимость, но эти достоинства нивелируются слабыми операционными характеристиками. Хотя gFOBT обладает высокой клинической специфичностью, он имеет низкую аналитическую и клиническую чувствительность, то есть не обнаруживает гемоглобин в концентрации ниже примерно 600 мкг/г (аналитическая чувствительность), а при однократном тестировании в рамках скрининга КРР дает довольно много ложноотрицательных результатов (низкая клиническая чувствительность). Тест gFOBT может выполняться с регидратацией образцов, которая уменьшает число ложноотрицательных результатов (повышает чувствительность), но в то же время увеличивает количество ложноположительных (снижает специфичность)[20].
Для повышения эффективности gFOBT были разработаны его высокочувствительные модификации — Hemoccult Sensa и Hemoccult ICT, позволяющие обнаруживать более низкие концентрации гемоглобина.
Влияние скрининга с применением gFOBT на заболеваемость и смертность от КРР изучалось в нескольких крупных рандомизированных контролируемых исследованиях (РКИ). Они показали, что скрининг на основе gFOBT, проводимый ежегодно или с двухлетним интервалом, снижает смертность от КРР примерно на 32–33% и 6–18% соответственно.
В Миннесотском исследовании (Minnesota Colon Cancer Control Study) участники в возрасте от 50 до 80 лет (n = 46 551) были случайным образом распределены в группы контроля и скрининга КРР на основе регидратированного gFOBT, который проводился в 1976–1982 и 1986–1992 гг. ежегодно или с интервалом в 2 года. Согласно опубликованным в 2013 г. 30летним результатам этого РКИ, ежегодный скрининг и скрининг с двухлетним интервалом привели к снижению смертности от КРР на 32% и 22% соответственно по сравнению с контролем, но не отразились на общей смертности[21].
Из-за низкой чувствительности теста и слабой приверженности целевой популяции скрининг КРР на основе gFOBT сопровождается большим количеством интервальных раков [19]. В шотландской популяционной программе скрининга доля интервальных раков увеличилась с 31,2% после первого до 58,9% после третьего скринингового раунда[22].
В связи со всеми этими недостатками gFOBT в странах Европы, внедривших скрининг КРР, происходит постепенный переход на применение FIT[10], а Объединенная рабочая группа США по КРР исключила gFOBT из перечня рекомендуемых методов скрининга[16].
Фекальные иммунохимические тесты основаны на выявлении человеческого гемоглобина в кале посредством взаимодействия глобина, входящего в состав гемоглобина, и специфических моноклональных антител. FIT выявляет, в отличие от gFOBT, только гемоглобин человека, поэтому не требует диетических ограничений при подготовке к анализу и не дает ложноотрицательных результатов при употреблении витамина С. FIT более специфичен в диагностике кровотечений из дистальных отделов ЖКТ, в частности колоректальных аденом и КРР. Это объясняется тем, что при кровотечениях из проксимальных отделов ЖКТ глобин расщепляется пищеварительными ферментами. Наконец, взятие образцов кала для FIT менее обременительно, чем для gFOBT, что делает его более удобным для пациента.
В связи с существованием множества различных марок FIT, результаты которых нельзя сравнить, было предложено стандартизировать представление результатов FIT и использовать единую единицу измерения — мкг/г[23]. Однако даже при использовании единой единицы измерения концентрациb фекального гемоглобина различные марки FIT при массовом скрининге имеют разные операционные характеристики[24]. Эти различия наблюдаются и среди качественных, и среди количественных FIT[18]. На сегодня нет доказательств того, что какаялибо марка FIT превосходит другие[19].
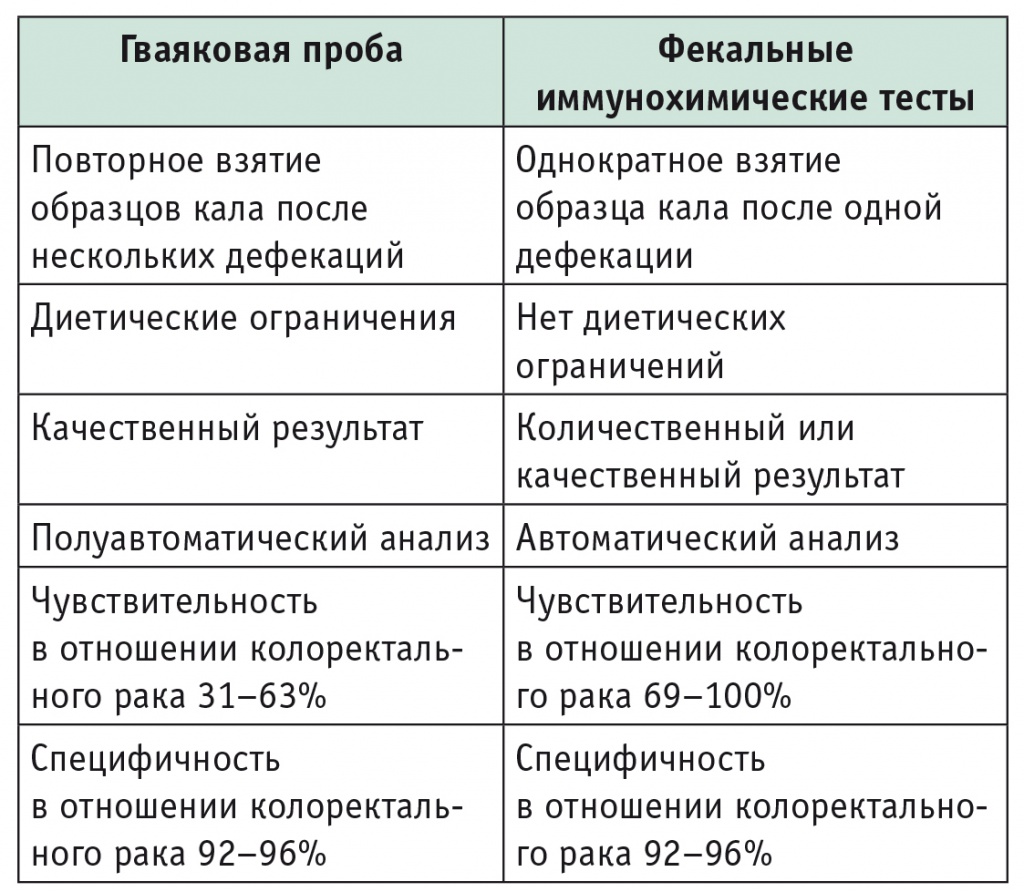
В настоящее время отсутствуют данные о крупных проспективных РКИ по оценке влияния скрининга с применением FIT на заболеваемость КРР и смертность от него. Несмотря на это, как европейские, так и некоторые североамериканские клинические рекомендации по скринингу КРР относят FIT к предпочтительным методам скрининга[8, 16, 25]. Скрининг на основе FIT имеет ряд преимуществ перед таковым с применением gFOBT (табл. 3).
В сочетании эти преимущества приводят к более высоким показателям выявления КРР и аденом с тяжелой дисплазией. При тяжелой неоплазии[1] FIT оказался в 2–3 раза более чувствителен к фекальному гемоглобину, чем gFOBT [26]. При сравнении экономической эффективности FIT и gFOBT установлено, что скрининг на основе FIT более рентабелен. При той же потребности в последующих колоноскопиях скрининг на основе FIT приводит к более значительному снижению затрат и увеличению числа сохраненных лет жизни, чем gFOBT.
На эффективность FIT влияет локализация неопластических образований в толстой кишке. В некоторых исследованиях показана более высокая чувствительность FIT при выявлении левосторонних аденом по сравнению с правосторонними[27]. Чувствительность FTT оказалась также выше у лиц, регулярно принимающих ацетилсалициловую кислоту, по сравнению с непринимающими. При той же пороговой концентрации (точке разделения) фекального гемоглобина частота положительных результатов FIT у мужчин выше, чем у женщин[28]. Это отражает более высокую распространенность тяжелой неоплазии у мужчин, а также более частую у них дистальную локализацию[29].
Кроме FIT для выявления фекального гемоглобина, был разработан FIT для обнаружения в кале комплекса человеческого гемоглобина с гаптоглобином (hHb/Hp). Этот комплекс не расщепляется под действием пищеварительных ферментов ЖКТ, в связи с чем, по мнению разработчиков теста на hHb/Hp, его использование могло бы обнаруживать гемоглобин в кале при кровотечениях не только из нижних, но и из верхних отделов ЖКТ. Теоретически эта особенность FIT на основе hHb/Hp делает его менее специфичным для скрининга КРР, так как диагностика заболеваний, вызывающих кровотечения из верхних отделов ЖКТ, не является целью скрининга КРР. В настоящее время отсутствуют данные о крупных РКИ по эффективности FIT на основе hHb/Hp как метода скрининга КРР.
Комплексный тест на фекальную ДНК и FIT (FITDNA). Новый тест под торговой маркой Cologuard (Exact Sciences Corporation, США) объединяет молекулярный анализ ДНК для выявления мутаций и биомаркеров метилирования, связанных с колоректальной неоплазией, и иммунохимический анализ на наличие человеческого гемоглобина, т. е. FIT. Молекулярный анализ основан на обнаружении ДНК в неопластических клетках, попадающих в просвет толстой кишки из предраковых полипов и/или карцином, с последующим выявлением мутантных или эпигенетически измененных маркеров ДНК.
Таблица 3
Различия между скринингом с применением гваяковой пробы и фекальных иммунохимических тестов у лиц среднего риска[30]
Cologuard является неинвазивным тестом, использующим один образец кала и не требующим диетических или лекарственных ограничений. В 2014 г. он был одобрен Food and Drug Administration для скрининга КРР. В многоцентровом исследовании с участием 9989 человек сравнили результаты скрининга с помощью FITDNA и FIT. В качестве «золотого стандарта» всем участникам была проведена колоноскопия. Результаты исследования показали, что FITDNA имел более высокую чувствительность, чем FIT, при выявлении КРР (92% против 74%), аденом с тяжелой дисплазией (69% против 46%) и «сидячих» зубчатых полипов (42% против 5%). Однако специфичность FITDNA (87–90%) была ниже, чем FIT (95–96%) [32]. В большом многоцентровом исследовании типа «случай — контроль» скрининг с применением FITDNA точно обнаруживал КРР независимо от его локализации и стадии с общей чувствительностью более 98%. Чувствительность к предраковым образованиям увеличивалась пропорционально их размеру с 57% при полипах размером более 1 см до 83% при их размерах более 3 см [33]. Недостатками FITDNA являются высокая стоимость, а также неудобная процедура взятия образца кала и отправки в лабораторию. В настоящее время Cologuard доступен только на фармацевтическом рынке США.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ СКРИНИНГА КОЛОРЕКТАЛЬНОГО РАКА С ПРИМЕНЕНИЕМ ФЕКАЛЬНОГО ИММУНОХИМИЧЕСКОГО ТЕСТА
Качественные и количественные FIT — это два типа FIT, которые используют различные аналитические методы для обнаружения человеческого гемоглобина[34]. Качественные FIT имеют заданную пороговую концентрацию фекального гемоглобина, который определяется с помощью латерального проточного иммунохроматографического анализа. В отличие от них количественные FIT для измерения уровня фекального гемоглобина используют иммунотурбидиметрические методы, а пороговая концентрация фекального гемоглобина (точка разделения) может быть установлена конечным пользователем. Установка более высокой точки разделения снижает чувствительность теста и приводит к уменьшению числа положительных результатов, но доля истинноположительных увеличивается. Это сокращает потребность в дополнительных обследованиях, что особенно важно при скрининге КРР в условиях ограниченного доступа к колоноскопии, там, где программы скрининга нацелены на максимальный диагностический выход при ограниченных эндоскопических ресурсах[35].
Что касается сравнительной эффективности, то в метаанализе по оценке эффективности четырех качественных и четырех количественных марок FIT установлено, что операционные характеристики обоих типов тестов при выявлении КРР сходны[36]. Объединенная чувствительность количественных FIT для КРР составляла 77% по сравнению с 85% у качественных. Специфичность обоих типов FIT — 94%.
В двух недавних исследованиях, не вошедших в этот метаанализ, напрямую сравнивалась эффективность качественных и количественных FIT в условиях скрининга[37, 38]. В обоих исследованиях показатель выявления колоректальных неопластических образований и прогностическая ценность положительного результата у количественных FIT были выше по сравнению с качественными.
У качественных FIT есть и другие значительные ограничения. При их применении визуальная интерпретация теста как отрицательного или положительного может быть более субъективной, чем у количественных тестов, которые используют автоматический метод регистрации результатов. Кроме того, J. Cubiella и соавт. показали, что операционные характеристики при выявлении аденомы с тяжелой дисплазией значительно различаются у разных качественных FIT при анализе одних и тех же образцов стула[39]. Опубликованы исследования, выявившие проблемы при осуществленииконтроля качества выполнения некоторых качественных FIT[40, 41]. Таким образом, автоматизированные и хорошо изученные количественные FIT, повидимому, превосходят качественные в операционных характеристиках при скрининге КРР и аденомы с тяжелой дисплазией, в эффективности и контроле качества.
Оптимальная точка разделения. Определение пороговой концентрации фекального гемоглобина для FIT имеет решающее значение для любой программы скрининга КРР. Она влияет как на количество выявленных случаев КРР и тяжелых неоплазий, так и на потребность в колоноскопии, необходимой для дополнительного обследования при положительных результатах теста. В метаанализе J. K. Lee и соавт.[36] показано, что изменение точек разделения, используемых для интерпретации результата теста, повлияло на операционные характеристики FIT при скрининге КРР. При повышении точки разделения чувствительность FIT при однократном применении снижалась с 0,86 (95%ный ДИ: 0,75–0,92) при точке разделения 20 мг/г до 0,67 (95%ный ДИ: 0,59–0,74) при точке разделения более 50 мг/г. Вместе с тем это привело к повышению специфичности с 0,91 (95%ный ДИ: 0,89–0,93) до 0,96 (95%ный ДИ: 0,94–0,98). Этот компромисс между чувствительностью и специфичностью при различных точках разделения также влияет на точность FIT в обнаружении тяжелой неоплазии в целевых для скрининга КРР популяциях[33].
В метаанализе J. K. Lee и соавт. пороговая концентрация результата FIT менее 20 мг/г имела наилучшую комбинацию чувствительности и специфичности для выявления КРР по сравнению с точкой разделения от 20 мг/г до 50 мг/г и более. Важными факторами при выборе точки разделения являются доступность и качество проведения колоноскопии. Во включенных в метаанализ исследованиях при применении FIT с точкой разделения менее 20 мг/г частота положительных результатов составляла 5,3–14,2% против 1,4–7,5% при точке разделения от 20 до 50 мг/г[36].
В исследовании J. A. Wilschut и соавт.[42] на основе имитационного моделирования с применением количественного FIT (OCSensor, Eiken Chemical, Япония) проводилось сравнение множества различных вариантов точек разделения от 10 мг/г до 150 мг/г. Результаты исследования показали, что применение точки разделения 10 мг/г было самой эффективной и рентабельной стратегией для скрининга КРР при специфичности 95,8%. Изучение результатов скрининга КРР среди 14 289 жителей Южной Кореи с использованием прибора OCSensor не обнаружило существенной разницы в частоте выявления тяжелой неоплазии при точках разделения 20 мг/г (29,9%) и 10 мг/г (30,8%)[43]. Основываясь на этих исследованиях, можно считать, что низкая пороговая концентрация результата FIT (менее 20 мг/г) не только обеспечивает наилучшие операционные характеристики (сочетание чувствительности, специфичности и общей точности диагностики) для обнаружения КРР, но и делает скрининг экономически эффективным. Однако при выборе оптимальной пороговой концентрации результата FIT необходимо учитывать такие факторы, как частота положительных результатов, доступные колоноскопические ресурсы и марка FIT.
Количество образцов стула, необходимое для проведения FIT, является важным фактором для оптимизации скрининга КРР. В голландском исследовании A. H. van Roon и соавт.[44] изучался охват целевой популяции и клинические исходы скрининга КРР при использовании 1 или 2 образцов стула для FIT (OCSensor, точка разделения 10 мг/г). Не обнаружены различия в охвате целевой популяции, но частота выявления тяжелой неоплазии была выше при использовании для FIT 2 образцов стула — 4,1% (95%ный ДИ: 3,3–5,1%) против 3,1% (95%ный ДИ: 2,5–3,8%) при 1 образце. В корейском исследовании M. J. Park и соавт., изучавших диагностическую точность FIT в зависимости от числа образцов, было показано, что FIT с 2 образцами стула (OCSensa Micro, точка разделения 15 мг/г) имел более высокую чувствительность в выявлении КРР, чем FIT с применением 1 образца (92,3% против 76,9%), при почти одинаковой специфичности (91,4% и 93,3% соответственно).
Однако если целью скрининга было выявление колоректальных аденом с тяжелой дисплазией, то операционные характеристики FIT не зависели от количества образцов, т. е. FIT с использованием 1 образца стула был эквивалентен FIT с 2 образцами[37]. Аналогичным образом исследователи из Гонконга[45], Франции[46] и Испании[47] не обнаружили преимуществ FIT на основе 2 образцов стула при выявлении тяжелой неоплазии.
В метаанализе[36] также показано, что объединенные характеристики FIT в обнаружении КРР не зависели от количества тестируемых образцов. При использовании FIT с применением 1, 2 и 3 образцов стула для скрининга КРР в бессимптомной популяции с высоким уровнем риска объединенная чувствительность составила 0,79 (95%ный ДИ: 0,65–0,89), 0,77 (95%ный ДИ: 0,59–0,89) и 0,80 (95%ный ДИ: 0,66–0,89) соответственно. Объединенная специфичность для этих трех групп — 0,94 (95%ный ДИ: 0,92–0,95), 0,93 (95%ный ДИ: 0,90–0,95) и 0,93 (95%ный ДИ: 0,89–0,95) соответственно.
Результаты метаанализа[36] и анализа экономической эффективности[48] предполагают, что более простая схема скрининга КРР с FIT с 1 образцом стула дает результаты, аналогичные схемам с применением нескольких образцов, особенно если интервалы между исследованиями короткие (1 год).
Межскрининговые интервалы при использовании FIT. Ежегодный программный скрининг с применением gFOBT снижает смертность от КРР на 33%[21]. Однако оптимальный межскрининговый интервал при использовании FIT остается неясным. Результаты исследования различных стратегий скрининга КРР[49] показали, что ежегодный скрининг на основе FIT приводит к такому же увеличению числа сохраненных лет жизни, как и колоноскопия, выполняемая 1 раз в 10 лет. В голландской программе скрининга КРР на основе FIT выявление тяжелой неоплазии не зависело от интервала между обследованиями при его изменении от 1 до 3 лет[50]. Как отмечалось ранее, анализ экономической эффективности скрининга КРР с применением 1 и 2 образцов стула для FIT показал, что ежегодное проведение FIT c использованием 1 образца стула было оптимальным[48].
ЗАКЛЮЧЕНИЕ
Исходя из сравнения двух основных разновидностей фекальных тестов и одного комплексного, можно сделать вывод о том, что в современных условиях при выборе метода для популяционного скрининга колоректального рака предпочтение следует отдать качественным и количественным фекальным иммунохимическим тестам.







