Панкреатодуоденальная резекция (ПДР), выполненная впервые W. Kaush (Германия) в 1909 г. и популяризированная A. O. Whipple (США) в 1935 г., считается одним из наиболее сложных вмешательств в хирургии органов брюшной полости. В 1994 г. M. Gagner и A. Pomp (Канада) произвели лапароскопическую пилоросохраняющую ПДР, однако этот вариант операции до настоящего времени применяется в ограниченном числе клиник [2, 15, 18, 20]. Сообщение о первых резекционных операциях на поджелудочной железе, выполненных P. Giulianotti с использованием роботического комплекса da Vinci (Intuitive Surgical Inc., США), было опубликовано в 2003 г. [12, 13].
В нашей стране роботический комплекс da Vinci появился в 2008 г. В настоящее время он имеется в 22 клинических центрах Российской Федерации, однако публикаций из российских клиник о резекционных операциях на поджелудочной железе мы не обнаружили. Техника выполнения пилоросохраняющей ПДР в робот-ассистированном варианте имеет особенности, специфичные для роботических операций. Полноценного описания методики выполнения робот-ассистированной ПДР, ее обоснованности, а также преимуществ и недостатков по сравнению с традиционной методикой до сих пор не дано. В настоящем сообщении представлена методика выполнения робот-ассистированной ПДР и приведены ее результаты в сравнении с традиционным вариантом операции.
Цель исследования: сравнение роботизированной и традиционной технологий при выполнении ПДР.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 14 больных с опухолями головки поджелудочной железы и периампулярной зоны. Проведена ретроспективная оценка результатов робот-ассистированной пилоросохраняющей ПДР (n = 7) и традиционного варианта этой операции (n = 7). Принцип выполнения пилоросохраняющей ПДР при робот-ассистированной и традиционной операциях был одинаковым и заключался в экстрафасциальном удалении комплекса органов с первичной перевязкой артерий и вен, кровоснабжающих головку поджелудочной железы и двенадцатиперстную кишку, а также в строгом соблюдении техники no touch [7, 14, 19, 22]. Состав операционной бригады при всех вмешательствах был одинаковым. В традиционном варианте операцию производили через двуподреберный лапаротомный доступ.
В предоперационном периоде выполняли мультиспиральную КТ и МРТ с болюсным усилением, обычное и эндоскопическое УЗИ с оценкой состояния воротной и верхней брыжеечной вен. Признаков инвазии опухолей в луковицу двенадцатиперстной кишки не было выявлено ни в одном случае, что оправдывало выполнение пилоросохраняющей ПДР. Соматический статус больных был оценен по шкале Американского общества анестезиологов (англ. American Society of Anesthesiologists — ASA). Всем больным в обеих группах установлен статус ASA III.
В соответствии с рекомендациями Европейского общества по ускоренной реабилитации в хирургии (англ. Enhanced Recovery After Surgery (ERAS) Society, 2013) при повышении уровня общего билирубина крови более 250 ммоль/л перед оперативным вмешательством производили билиарное дренирование [17]. Объективная информация о больных приведена в таблице 1.
Таблица 1
Характеристика больных обследуемых групп
При морфологическом исследовании удаленного образования у 6 из 7 больных, оперированных робот-ассистированным методом, были выявлены аденокарциномы головки поджелудочной железы, большого сосочка двенадцатиперстной кишки и терминального отдела холедоха. У одной больной при предоперационном обследовании была диагностирована внутрипротоковая папиллярная муцинозная карцинома, однако при гистологическом исследовании удаленного препарата выявлена микрокистозная форма серозной цистаденомы. У всех больных, оперированных традиционным способом, при морфологическом исследовании были верифицированы аденокарциномы. Степень дифференцировки и размер опухолей, а также частота поражения лимфатических узлов представлены в таблице 2.
Таблица 2
Морфологическая характеристика аденокарцином у обследованных больных, n (%)
Примечание. У одной из 7 больных, оперированных робот-ассистированным методом, при гистологическом исследовании удаленного препарата была диагностирована микрокистозная форма серозной цистаденомы.
При оценке результатов операции учитывали длительность вмешательства, объем интраоперационной кровопотери, количество удаленных лимфатических узлов и интраоперационные осложнения. В послеоперационном периоде принимали во внимание осложнения по классификации Клавьена — Диндо, возникновение панкреатических свищей по классификации международной группы экспертов ISGPF (англ. International Study Group on Pancreatic Fistula). Кроме того, оценивали длительность дренирования брюшной полости и срок пребывания в стационаре после операции [1, 4, 6, 9, 11].
Техника робот-ассистированной пилоросохраняющей панкреатодуоденальной резекции
При робот-ассистированных операциях больной располагался на операционном столе в положении на спине с разведенными ногами. Тележку пациента (робот) устанавливали со стороны головы пациента. Ассистент располагался между ног пациента.
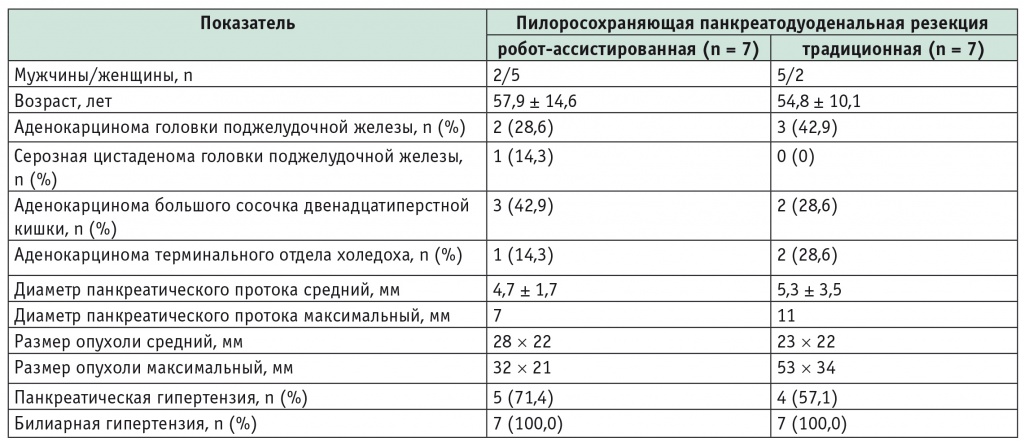
Операцию выполняли четырьмя роботическими манипуляторами, несшими три инструмента и видеолапароскоп, и двумя ассистентскими инструментами. Использовались следующие роботические инструменты: двуокончатый зажим, биполярный зажим «Мэриленд», монополярные ножницы, ультразвуковые ножницы Harmonic ACE, иглодержатель. Арсенал ассистента состоял из мягкого кишечного зажима и отсосной трубки. Схема расположения роботических и ассистентских портов изображена на рисунке 1.
Рис. 1. Расположение инструментальных портов при робот-ассистированной панкреатодуоденальной резекции.
Примечание. Р1, Р2, Р3 — роботические манипуляторы; К — камера; А — ассистентские порты
Вмешательство начинали с диагностической лапароскопии, во время которой исключали наличие имплантационных метастазов. Первым этапом выполняли холецистэктомию. Далее двуокончатым зажимом в третьем манипуляторе оттесняли правую долю печени вверх таким образом, чтобы гепатодуоденальная связка была в натянутом состоянии. Рассекали брюшину вдоль правой стенки гепатикохоледоха от ворот печени до стенки двенадцатиперстной кишки. Отделяли жировую клетчатку с лимфатическими узлами (группы лимфатических узлов 12а, 12в, 12р по классификации Японского панкреатического общества — англ. Japanese Pancreatic Society, JPS), окружающую гепатикохоледох, печеночные артерии и воротную вену, от уровня ворот печени до двенадцатиперстной кишки. Выделяли устье гастродуоденальной артерии. Клетчатку с лимфатическими узлами смещали в сторону удаляемого комплекса, а в случаях их полного отделения — извлекали из брюшной полости.
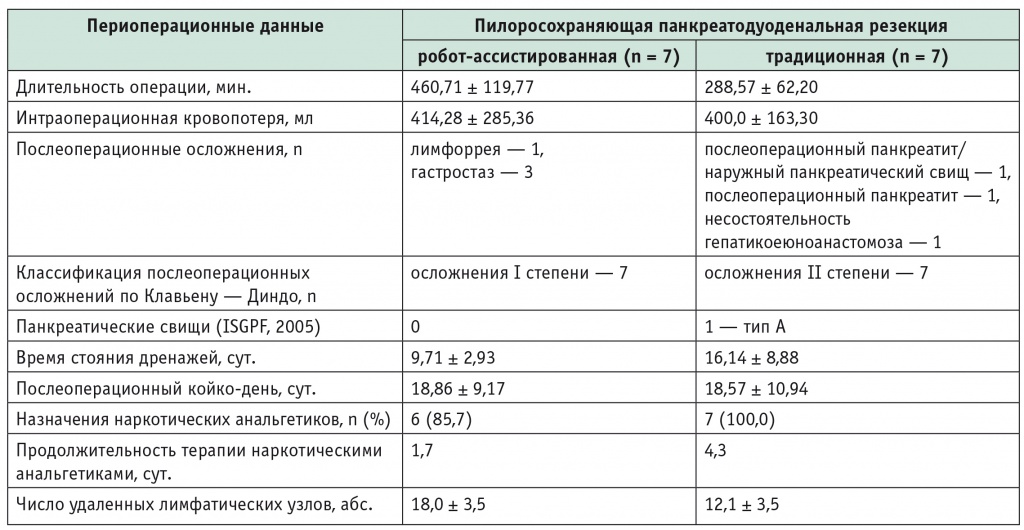
На общий печеночный проток накладывали малый сосудистый зажим (бульдожку) тотчас выше устья пузырного протока. Для наложения зажима применяли следующий прием. Вне брюшной полости связывали бранши зажима толстой лигатурой таким образом, чтобы их кончики были фиксированы в раскрытом состоянии. Далее зажим вводили в брюшную полость через просвет 12-миллиметрового ассистентского порта. Раскрытые бранши зажима заводили на общий печеночный проток и ножницами пересекали фиксировавшую их лигатуру, что обеспечивало сжимание браншей (рис. 2).
Рис. 2. Схематическое изображение временного клипирования общего печеночного протока при робот-ассистированной панкреатодуоденальной резекции.
Примечание. А — наложение зажима на печеночный проток; Б — фиксация зажима на печеночном протоке (оригинальная методика)
Общий печеночный проток пересекали ножницами под наложенным зажимом. Дистальную культю желчного протока фиксировали зажимом и смещали в сторону двенадцатиперстной кишки и латерально. Клипировали и пересекали гастродуоденальную артерию у устья. Выполняли лимфодиссекцию вдоль общей печеночной артерии вплоть до чревного ствола (группы лимфатических узлов 8а, 8р).
На следующем этапе операции рассекали желудочно-ободочную связку от средней трети большой кривизны желудка до привратника. Выполняли мобилизацию антрального отдела желудка и луковицы двенадцатиперстной кишки с прилежащей клетчаткой и лимфатическими узлами (группа лимфатических узлов 6). Отступив 3 см от привратника, двенадцатиперстную кишку пересекали аппаратом Endo GIA (Covidien, США) с синей кассетой.
По нижнему краю поджелудочной железы в области перешейка вскрывали брюшину. Зажимом «Мэриленд», используя биполярную коагуляцию, разделяли жировую клетчатку в проекции верхней брыжеечной вены. Идентифицировали переднюю поверхность вены и формировали тоннель над конфлюенсом верхней брыжеечной и селезеночной вен.
Перешеек железы пересекали аппаратом Endo GIA с синей кассетой. Скрепочный шов на дистальной культе поджелудочной железы отсекали ножницами с монополярной коагуляцией мелких кровоточащих сосудов. Определяли локализацию культи панкреатического протока. Дистальную культю поджелудочной железы дополнительно мобилизовывали на протяжении 10-15 мм.
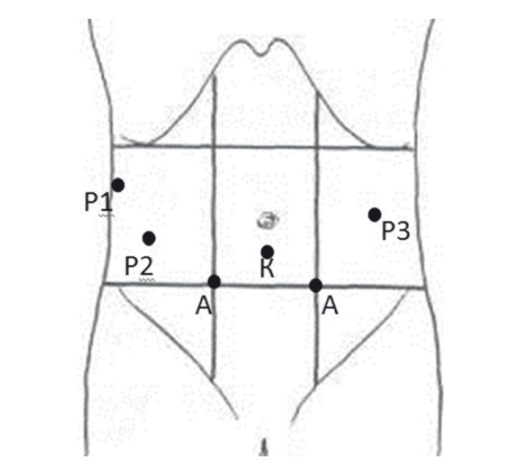
Проксимальную культю поджелудочной железы смещали вправо двуокончатым зажимом. Если это не приводило к необходимому натяжению тканей, то головку железы прошивали 8-образным швом и обеспечивали тракцию за счет натяжения лигатуры (рис. 3).
Рис. 3. Схематическое изображение осуществления оптимальной тракции проксимальной культи поджелудочной железы при робот-ассистированной панкреатодуоденальной резекции
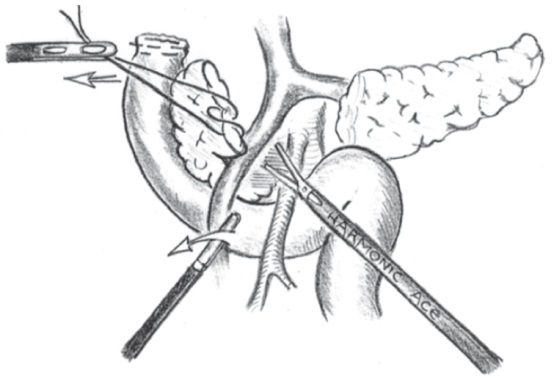
Верхнюю брыжеечную вену по ее правому контуру сверху вниз отделяли от паренхимы головки и крючковидного отростка поджелудочной железы. При этом клипировали и пересекали верхнюю панкреатодуоденальную вену и, при необходимости, ствол Генле; мелкие венозные сосуды, самостоятельно впадающие в верхнюю брыжеечную вену, коагулировали биполярным зажимом. После этого верхнюю брыжеечную вену смещали влево, рассекали заднюю стенку ее соединительнотканного ложа и выделяли верхнюю брыжеечную артерию. Правую полуокружность артерии от уровня ее устья до первой еюнальной артерии обнажали параадвентициально, отделяя от нее жировую клетчатку, нервные стволы и лимфатические узлы (группа лимфатических узлов 14р), входящие в состав mesopancreas (рудиментарная брыжейка поджелудочной железы). Нижнюю панкреатодуоденальную артерию клипировали и пересекали. В результате головка и крючковидный отросток поджелудочной железы лишались магистрального артериального кровоснабжения и венозного оттока. Лишь после этого начинали манипулировать на тканях, непосредственно прилежавших к опухоли.
На следующем этапе операции производили мобилизацию двенадцатиперстной кишки по Кохеру. Париетальную брюшину по латеральному контуру «подковы» двенадцатиперстной кишки рассекали монополярными ножницами. Вертикальную часть двенадцатиперстной кишки с головкой поджелудочной железы при опухоли Т2 отделяли с фасцией Трейца — Тольда от фасции Герота, что обеспечивало выделение задней поверхности mesopancreas. При опухолях Т3 мобилизацию проводили ниже фасции Герота, обнажая нижнюю полую и почечную вены, аортокавальный промежуток. Брыжейку ободочной кишки в области печеночного изгиба отделяли по бессосудистой зоне и смещали вниз. Крючковидный отросток поджелудочной железы вместе с вертикальной и начальным отделом нижней горизонтальной части двенадцатиперстной кишки смещали вверх от нижней полой вены. Выделяли нижнюю горизонтальную часть двенадцатиперстной кишки, создавая тоннель в корне брыжейки между фасциями Трейца — Тольда и Герота. Продвигаясь между листками фасций, достигали париетального листка брюшины с левой стороны от аорты. Париетальную брюшину по периметру начальной части тощей кишки вскрывали через образованное окно в корне брыжейки. В результате мобилизации mesopancreas и mesoduodenum (рудиментарная брыжейка дуоденоеюнального перехода) приобретали подвижность, образуя единую брыжейку с тощей кишкой.
Тощую кишку перемещали через сформированное окно в корне брыжейки слева направо на протяжении 30-50 см и пересекали аппаратом Endo GIA на уровне первой сосудистой аркады.
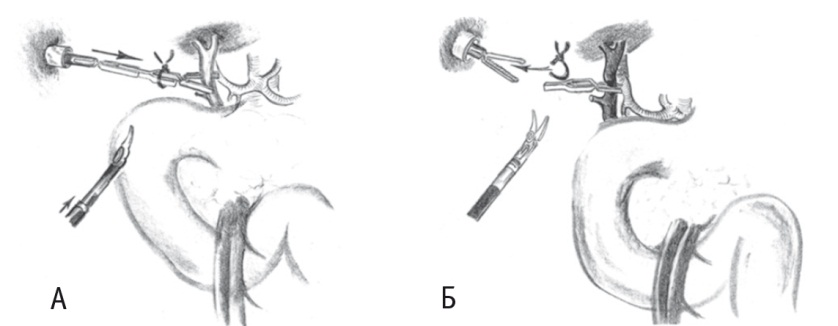
Аборальную культю тощей кишки оставляли на правой стороне корня брыжейки. Mesopancreas и mesoduodenum послойно пересекали ультразвуковыми и монополярными ножницами вдоль верхней брыжеечной артерии. В результате завершали выделение панкреатодуоденального комплекса (рис. 4). При опухолях Т3 удаляли жировую клетчатку с лимфатическими узлами из аортокавального промежутка (группа лимфатических узлов 16а2).
Рис. 4. Схематическое изображение пересечения mesopancreas и mesoduodenum на финальном этапе мобилизации панкреатодуоденального комплекса при робот-ассистированной панкреатодуоденальной резекции

Культю тощей кишки смещали к культе поджелудочной железы и подшивали тремя швами к ее задней поверхности, отступив 10-15 мм от края культи. Вскрывали ножницами просвет кишки на 5-7 мм меньше диаметра культи поджелудочной железы. Панкреатоеюноанастомоз формировали конец-в-бок непрерывным швом монофиламентной рассасывающейся нитью 4/0 или 5/0.
С культи общего печеночного протока снимали зажим-«бульдожку», извлекали его из брюшной полости. На расстоянии около 10 см от панкреатоеюноанастомоза стенку тощей кишки рассекали ножницами и накладывали гепатикоеюноанастомоз непрерывным швом монофиламентной рассасывающейся нитью 5/0.
Контролировали гемостаз в ложе удаленного панкреатодуоденального комплекса и зон лимфодиссекции. Делали минилапаротомию по средней линии живота. Длина разреза (5-6 см) обеспечивала свободное извлечение удаленных органов. Панкреатодуоденальный комплекс и желчный пузырь извлекали из брюшной полости, предварительно поместив их в пластиковый контейнер.
В рану выводили антральный отдел желудка с культей двенадцатиперстной кишки и тощую кишку. Отступив 60-70 см от гепатикоеюноанастомоза, накладывали дуоденоеюноанастомоз конец-в-бок однорядным швом монофиламентной рассасывающейся нитью 5/0. Желудок с тощей кишкой погружали в брюшную полость. Операцию завершали обязательным дренированием подпеченочного пространства.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты хирургического лечения отражены в таблице 3.
Таблица 3
Результаты робот-ассистированной и традиционной пилоросохраняющей панкреатодуоденальной резекции
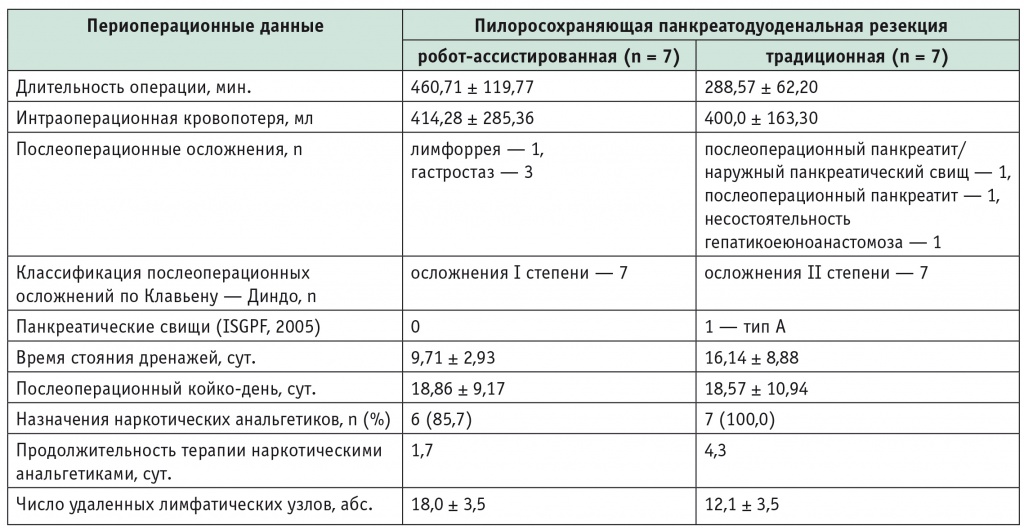
Примечание. ISGPF (англ. International Study Group on Pancreatic Fistula) — Международная группа по изучению недостаточности панкреатических анастомозов.
Длительность робот-ассистированной пилоросохраняющей ПДР варьировала от 305 до 670 минут и составила в среднем 460,71 ± 119,77 минуты, что превысило временны́е затраты при традиционной пилоросохраняющей ПДР (от 220 до 385 минут, в среднем 288,57 ± 62,20 минуты). Как при робот-ассистированном, так и при традиционном вмешательстве интраоперационные осложнения отсутствовали. Потери крови возникали за счет капиллярного кровотечения во время лимфодиссекции. Конверсий при робот-ассистированной пилоросохраняющей ПДР не было.
Использование роботического комплекса da Vinci в оперативном лечении поджелудочной железы является дальнейшим развитием лапароскопической хирургии. R. Cirocchi и соавт. в 2013 г. при анализе литературы с 2003 по 2012 г. сообщили о 207 роботических ПДР [8]. Чаще (в 70% случаев) выполняют гастропанкреатодуоденальную резекцию, а не пилоросохраняющий вариант операции [13, 16, 22].
Стандартная техника робот-ассистированной операции в настоящее время отсутствует. Ряд хирургов используют роботический комплекс лишь на завершающем этапе операции — при формировании анастомозов, — а мобилизацию органов осуществляют лапароскопическим методом, в том числе с использованием «руки помощи» [10, 19, 21]. При этом принцип no touch не применяется, что, на наш взгляд, является слабым местом таких методик с онкологической позиции.
Наибольшим опытом выполнения робот-ассистированных ПДР обладает хирургический коллектив, возглавляемый P. C. Giulianotti, в 2010 г. эти авторы опубликовали результаты 60 ПДР с использованием роботического комплекса [13]. Время операции колебалось от 240 до 660 минут (в среднем 421 минута), объем кровопотери — от 80 до 1500 мл (в среднем 394 мл). При малом диаметре панкреатического протока или мягкой железе производили окклюзию протока биологическим клеем. Конверсии потребовались у 11 больных (18,3%), в основном из-за трудностей выделения верхней брыжеечной вены или артерии. Релапаротомии были выполнены 4 больным. Панкреатические свищи после формирования панкреатикоеюноанастомоза возникли у 4 (21,1%) из 19 больных, после окклюзии панкреатического протока — у 15 (36,6%) из 41 больного. Умерли трое больных [13].
Сравнительный анализ результатов роботических и традиционных ПДР был проведен в 2011-2014 гг. различными авторами [3, 5, 7]. Учитывая отсутствие рандомизации, можно говорить о предварительных данных, свидетельствующих о прецизионности и онкологической адекватности робот-ассистированных ПДР. Показано, что длительность операции в роботическом варианте, как правило, превышает таковую при традиционном способе оперирования, однако объем кровопотери при робот-ассистированной ПДР несколько меньше, как и длительность пребывания в стационаре.
Наш небольшой опыт ПДР с использованием роботического комплекса дал обнадеживающие результаты. Обязательным условием должно являться доскональное предоперационное обследование, позволяющее определить расположение и размеры опухоли, а также исключить опухолевую инвазию в верхнебрыжеечные сосуды.
Первая проведенная нами робот-ассоциированная ПДР заняла около 11 часов (670 минут). По ходу операции мы столкнулись с целым рядом технических трудностей, несвойственных открытому варианту. В частности, ограниченная площадь работы манипуляторов затрудняла идентификацию начальной части тощей кишки. Но основная проблема заключалась в сложности достижения гемостаза. При традиционном способе оперирования хирург обеспечивает гемостаз из мелких сосудов с минимальной потерей времени, не теряя ориентации в хирургическом поле. При робот-ассистированной операции даже незначительное количество крови, поступающее из мелкого сосуда, «закрывает» поле зрения, существенно ухудшает видимость. Для обнаружения кровоточащего сосуда требуется дополнительное время, что увеличивает объем кровопотери. Для исключения возникновения кровотечения при робот-ассистированной операции диссекция тканей, даже выполняемая в бессосудистых зонах межфасциальных пространств, требует использования коагуляции и работы с малыми порциями тканей, что увеличивает время операции.
По мере накопления опыта робот-ассистированных операций вообще и ПДР в частности время хирургических вмешательств уменьшается. Последние ПДР мы выполняли за 5-6 часов. Очевидным преимуществом робот-ассистированного варианта операции являлась прецизионность выделения магистральных сосудов, лимфатических узлов и формирования анастомозов.
Преимущества роботического варианта утрачиваются, когда размеры патологического образования превышают 2-3 см, имеется прорастание опухоли за пределы фасции Трейца — Тольда. В таких случаях существенно затрудняются фиксация тканей роботическими инструментами и создание необходимой тракции и противотракции для обеспечения работы в «слое». Именно поэтому робот-ассистированные операции целесообразно выполнять при опухолях, соответствующих Т1-2 [7, 16, 21].
Учитывая небольшое количество пациентов, у которых опухоли головки поджелудочной железы диагностируются на стадии Т1-2, робот-ассистированные операции удается делать нечасто. В результате накопление материала, достаточного для проведения статистического исследования, растягивается на длительное время.
ЗАКЛЮЧЕНИЕ
Робот-ассистированная панкреатодуоденальная резекция (ПДР) позволяет получить результаты, аналогичные традиционному варианту операции, обеспечивая прецизионность удаления лимфатических узлов и формирования анастомозов. За счет минимальной травматизации тканей послеоперационный период протекает более комфортно для больных. Показаниями к робот-ассистированной ПДР являются аденокарциномы головки поджелудочной железы, большого сосочка двенадцатиперстной кишки, терминального отдела холедоха, нейроэндокринные неоплазии и кистозные опухоли головки поджелудочной железы, стадируемые как Т1-2. Количество послеоперационных осложнений пока остается на том же уровне, что и при традиционном варианте операции.







