Синдром поликистозных яичников (СПКЯ) является наиболее распространенной эндокринопатией среди женщин репродуктивного возраста. Частота его встречаемости, по сводным данным, достигает 15–20%[1, 2]. Согласно Роттердамскому консенсусу 2003 года, СПКЯ диагностируется при наличии по меньшей мере двух из трех критериев: гиперандрогении, олиго-/ановуляции и поликистозной морфологии яичников[3].
Проявления СПКЯ не ограничиваются нарушениями функции репродуктивной системы. Пациентки с СПКЯ подвержены высокому риску метаболических нарушений, таких как инсулинорезистентность (ИР), гиперинсулинемия (ГИ), нарушение толерантности к глюкозе, СД 2 типа, ожирение, дислипидемия, АГ, которые составляют основу метаболического синдрома[4, 5]. При этом ИР может наблюдаться у женщин с СПКЯ как с избыточной, так и с нормальной массой тела. Согласно имеющимся данным, ИР диагностируется у 30–40% пациенток с нормальной массой тела и у 60–70% с ожирением[2, 6].
Несмотря на длительную историю изучения, этиологические факторы и патогенетические механизмы развития СПКЯ до сих пор до конца не ясны[7]. Результаты полногеномных исследований, проведенных на разных популяциях, свидетельствуют о важной роли генетических нарушений в формировании СПКЯ[8].
Наряду с генетической предрасположенностью в развитии СПКЯ имеют значение и эпигенетические нарушения, к их числу относят ожирение и ИР. Инсулиновую резистентность рассматривают как патологическое состояние, связанное с нарушениями способности инсулина стимулировать захват глюкозы клетками-мишенями и снижать ее уровень в сыворотке крови. Ответное усиление секреции инсулина поджелудочной железой и ГИ являются компенсаторными реакциями организма[9].
Точный механизм развития ИР при СПКЯ до сих пор остается неизвестным, хотя имеется ряд научных гипотез. Предполагают, что ИР может возникнуть в результате нарушений на одном из трех уровней: пререцепторном, рецепторном и пострецепторном. ИР на пререцепторном уровне может развиваться вследствие мутаций кодирующего гена инсулина, наличия аутоантител к инсулину либо из-за синтеза проинсулина вместо инсулина поджелудочной железой[10, 11]. Однако до сих пор остается неясным, является ли дисфункция поджелудочной железы при СПКЯ первичной или вторичной по отношению к ИР.
На рецепторном уровне ИР может быть результатом нарушения передачи сигнала от инсулинового рецептора, что разобщает действие инсулина и соответствующую реакцию клеток на уровне субстрата инсулинового рецептора — белка IRS.
Для инсулин-резистентных клеток характерно повышенное фосфорилирование IRS по остаткам серина. Оно препятствует фосфорилированию IRS по остаткам тирозина, которое необходимо для проведения сигнала от рецептора внутрь клетки. В исследованиях in vitro показано, что ИР при СПКЯ также может развиваться в висцеральной жировой ткани на пострецепторном уровне, что характеризуется уменьшением количества белка-переносчика глюкозы 4-го типа (GLUT4) в адипоцитах[12].
Хорошо известно, что ИР и ГИ играют важную роль в развитии гиперандрогении и овуляторной дисфункции при СПКЯ. Повышенный уровень инсулина увеличивает секрецию ГнРГ, что приводит к нарушению действия ЛГ и ФСГ[13].
Инсулин стимулирует секрецию андрогенов в яичниках как опосредованно через ЛГ, так и напрямую, повышая экспрессию гена СYР-17 и, соответственно, активность ферментов, участвующих в синтезе андрогенов клетками теки[14–16]. Известно, что повышенный уровень инсулина ингибирует синтез глобулина, связывающего половые стероиды, что приводит к увеличению концентрации биологически активных фракций свободных андрогенов[17]. Имеются данные о том, что состояние ИР при СПКЯ характеризуется повышенными уровнями конечных продуктов гликолиза даже у женщин с исходной нормогликемией. Конечные продукты гликолиза принимают участие в оксидативном стрессе, а также могут нарушать передачу сигналов инсулина, ЛГ и ФСГ, тем самым способствовать ановуляции и повышать риски возникновения сердечно-сосудистых заболеваний[18].
С учетом значимой роли ИР в этиопатогенезе СПКЯ в течение многих лет для коррекции метаболических и гормональных нарушений применяют инсулиносенситайзеры, наиболее признанным из них считается метформин (МФ)[19, 20]. Он повышает чувствительность тканей к инсулину за счет торможения глюконеогенеза в печени и улучшения утилизации глюкозы в периферических тканях[21].
Одним из основных молекулярных механизмов действия МФ является индукция экспрессии АМФ-активируемой протеинкиназы. Это приводит как к ингибированию m-TOR и Akt-пути, так и к активации Rab4 (семейство мономерного G-белка), вследствие чего ускоряется переход GLUT4 в мембрану клетки. Кроме того, МФ оказывает влияние на инсулиновый рецептор путем его аутофосфорилирования, что приводит к активации фосфатидилинозитол-3-киназы (PI3K)[22].
Однако, несмотря на высокую эффективность МФ, его применение часто связано с нежелательными побочными эффектами (метеоризмом, диареей и тошнотой), зачастую приводящими к снижению приверженности к данному варианту лечения[23, 24]. Это определяет необходимость разработки и поиска новых препаратов с меньшей частотой побочных эффектов, но схожей эффективностью. Данные о том, что нарушение передачи инсулиновых сигналов может быть связано с дефектом инозитолфосфогликана (IPG), вторичного мессенджера инсулинового пути, открыло новые горизонты в лечении пациенток с СПКЯ с использованием инозитолов[18].
Инозитол и его 9 стереоизомеров представляют собой полиолы — сахарные спирты, которые ранее относили к семейству витамина В. Позже это положение было опровергнуто, так как около 75% суточной потребности инозитола продуцируется клетками организма из глюкозы[25, 26].
Инозитол содержится во многих продуктах питания в форме фитиновой кислоты или ее солей (фитатов). Однако фитиновая кислота плохо усваивается в ЖКТ. Фитаты же способны превращать в нерастворимую форму многие минералы (кальций, магний, железо, цинк), что приводит к их дефициту и нарушению электролитного баланса[27]. В связи с этим в мировой практике для коррекции дефицита инозитолов используют очищенные от фитатов субстанции, среди которых наиболее изучен мио-инозитол (МИ). Участие МИ в передаче инсулинового сигнала позволило рассматривать его в качестве эффективного средства коррекции метаболических и гормональных нарушений при СПКЯ.
МЕХАНИЗМЫ ВЛИЯНИЯ ИНОЗИТОЛОВ НА МЕТАБОЛИЧЕСКИЙ И ГОРМОНАЛЬНЫЙ ПРОФИЛЬ
МИ составляет до 99% всего инозитола в клетках человека, оставшийся 1% представлен другим стереоизомером — D-хиро-инозитолом (ДХИ). МИ может превращаться в ДХИ под действием NAD/NADН-эпимеразы. Активность этого инсулин-зависимого фермента оказывает существенное влияние на внутриклеточное соотношение МИ/ДХИ в адипоцитах, гепатоцитах и миоцитах[28].
Поступление инозитола в организм регулируется посредством обменников Na+/МИ и Н+/МИ, локализованных в плазматических мембранах большинства клеток. Инозитолы в клетках присутствуют как в свободной форме, так и в составе фосфолипидов клеточной мембраны и играют структурную и функциональную роль[29].
В фосфолипидах МИ и ДХИ представлены в виде фосфатидилинозитолов (MI Pls, DCH Pls), главным образом фосфатидилинозитолфосфата (PIP) и его производного фосфатидилинозитолбифосфата (PIP2). PIP2 может выступать в качестве отправной точки для разных сигнальных путей посредством активации фосфолипаз (PLPs), фосфатаз и PI3K[30].
МИ и ДХИ являются вторичными мессенджерами инсулина и принимают участие в передаче сигналов в инсулиновом каскаде[31]. В поглощении глюкозы клетками участвует в основном МИ. Наибольшая его концентрация содержится в органах с высоким уровнем потребления глюкозы — мозге и сердце. Кроме того, МИ ингибирует аденилатциклазу, тем самым снижая выделение свободных жирных кислот из жировой ткани. Высокая концентрация ДХИ наблюдается в тканях, депонирующих гликоген (печени, мышцах, жировой ткани), а низкая — в тканях с высоким потреблением глюкозы (мозге, сердце)[32]. Роль ДХИ как вторичного мессенджера инсулина и инсулиносенситайзера подтверждается данными о том, что ИР коррелирует со снижением биодоступности ДХИ и с повышенной экскрецией ДХИ с мочой у женщин с СПКЯ[33].
РОЛЬ МИО-ИНОЗИТОЛА И D-ХИРО-ИНОЗИТОЛА В КЛЕТОЧНОМ МЕТАБОЛИЗМЕ ГЛЮКОЗЫ
Предполагается, что существует четыре основных пути передачи сигнала инсулина: путь PI3K, путь протеинкиназы С (РСК), путь митоген-активируемой протеинкиназы (МАРК) и активация гетеротримероного G-белка (рис.).
Рис. Роль мио-инозитола и D-хиро-инозитола в клеточных инсулин-регулируемых путях метаболизма глюкозы[35].
Примечание: AC — аденилатциклаза, DCI — D-хиро-инозитол, E2 — эстрадиол, ER — эндоплазматический ретикулум, Gas — субъединица гетеротримерного Gs-белка, Gaq — субъединица гетеротримерного Gq-белка, HMIT — обменник H+/мио-инозитола, IPG — инозитолфосфогликан, MI — мио-инозитол, P — фосфат, SMIT — обменник Na+/мио-инозитола, АТФ — аденозинтрифосфат
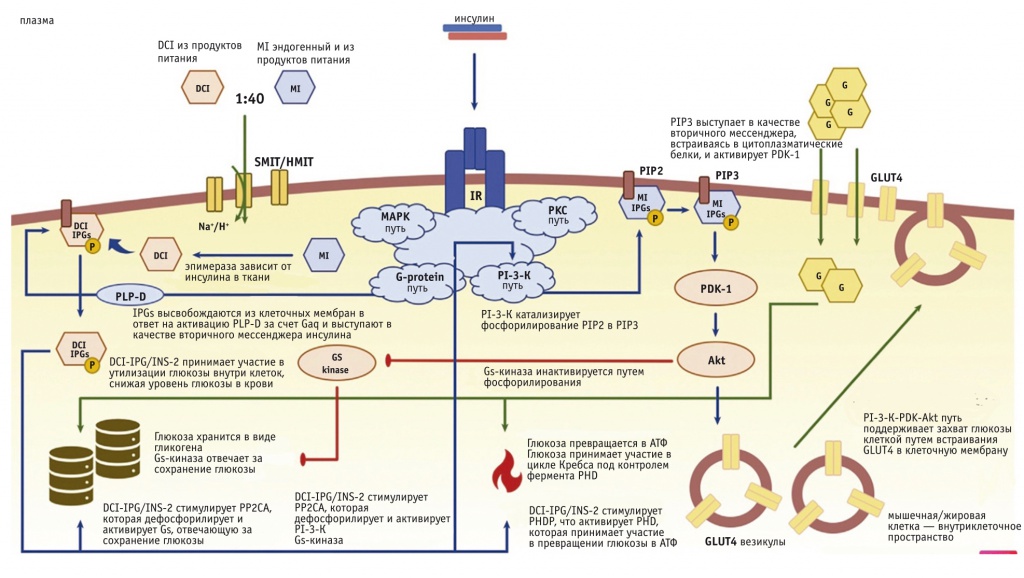
Основной путь, в котором принимает участие МИ, представлен PI3K, она катализирует фосфорилирирование PIP2 в PIP3 с помощью фосфатидилинозитол-зависимой киназы 1 (PDK-1). Она выступает также в качестве вторичного мессенджера активации Akt-пути. Все это приводит к повышению потребления глюкозы клеткой за счет стимуляции встраивания переносчика GLUT4 из цитозоля в плазматическую мембрану[12, 30, 31, 34]. Происходит трансмембранный перенос глюкозы в мио- и адипоциты, а также инактивация киназы гликогенсинтазы (GSK), что приводит к повышению активности GS, отвечающей за сохранение глюкозы в виде гликогена.
Альтернативным путем передачи инсулинового сигнала является индукция гетеротримерного G-белка. Он активирует фосфолипазу D (PLP-D), которая гидролизирует фосфатидилинозитолы (PIs) в плазматической мембране с образованием инозитолфосфогликанов (IPGs). Один из таких IPG — ДХИ. Он, как и МИ, выступает в качестве вторичного мессенджера инсулина (INS-2) и инсулиносенситайзера. DCI-IPG/INS-2 связывается с протеинфосфатазой 2Са (РР2Са), которая дефосфорилирует и активирует GS и PI3K, стимулируя поглощение глюкозы в инсулин-чувствительных тканях. ДХИ-IPG стимулирует гликолиз путем синтеза фермента фосфатазы пируватдегидрогеназы (PDHР), который активирует пируватдегидрогеназу (PDH), поддерживая продукцию АТФ с помощью стимуляции окислительного катаболизма глюкозы через цикл Кребса[12, 36].
Помимо влияния на углеводный обмен, МИ и ДХИ оказывают существенное воздействие на репродуктивную функцию. В яичниках МИ играет роль вторичного мессенджера ФСГ и ЛГ. Сигнальные пути ФСГ и ЛГ влияют на пролиферацию клеток теки и гранулезы[29, 34]. Так, ФСГ активирует цАМФ-зависимую протеинкиназу А (РКА), что приводит к пролиферации клеток гранулезы и стероидогенезу через индукцию экспресии ароматазы. Более высокая плотность ФСГ- и ЛГ-рецепторов воздействует на Са2+-зависимые пути посредством высвобождения Са2+ из внутриклеточных источников или посредством поступления Са2+
через каналы плазматической мембраны[29, 37, 38]. Этот путь включает фермент фосфолипазу С (PLP-C), которая гидролизует PIP2 до инозитолтрифосфата (IP3) и диацилглицерола. МИ влияет на активность ЛГ/ФСГ через IP3, он активирует выход Са2+ из внутриклеточных источников. В яйцеклетках МИ, действуя на специфический IP3-R1-подтип рецептора IP3, играет ключевую роль в созревании ооцитов, способствует прогрессии мейоза при оогенезе, когда яйцеклетки обладают максимальной чувствительностью к уровню кальция. Производные МИ участвуют в регуляции перестроек цитоскелета и модулируют уровень антимюллерова гормона в сыворотке крови[12, 37, 38].
ВЛИЯНИЕ ИНОЗИТОЛОВ НА КЛИНИКО-ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ БОЛЬНЫХ С СИНДРОМОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Началом истории применения стереоизомеров инозитола при СПКЯ стали исследования 1999 года. J.E. Nestler и соавт. изучали влияние ДХИ на метаболический и гормональный профиль женщин с избыточной массой тела и СПКЯ. Через 8 недель приема 1200 мг в сутки ДХИ наблюдалось повышение чувствительности тканей к инсулину и снижение уровня свободного тестостерона, что сопровождалось восстановлением овуляции у 86% пациенток[38]. M.J. Iuоrno и соавт. получили аналогичные результаты у пациенток с нормальным ИМТ и СПКЯ[39].
В тот период предполагали, что применение ДХИ может стать перспективным направлением в коррекции эндокринологических нарушений при СПКЯ. Однако последующие исследования показали, что при увеличении дозы ДХИ до 2400 мг у пациенток не только отсутствовал эффект от терапии в отношении чувствительности тканей к инсулину, но и наблюдались ухудшение качества ооцитов, эмбрионов и снижение ответа яичников на ФСГ[40, 41]. Поэтому последующие исследования были направлены на более глубокое изучение пост-рецепторного механизма передачи инсулинового сигнала.
Ряд ученых выдвинули гипотезу о том, что активность эпимеразы является инсулин-зависимой, а ИР может присутствовать в различных тканях (мышцах, печени, жировой ткани), за исключением яичников[41–43]. В связи с этим было высказано предположение о повышении эпимеразной активности в яичниках пациенток с СПКЯ, приводящей к избыточному накоплению ДХИ и недостаточности МИ[44]. Данная гипотеза была подтверждена рядом исследований. Так, T.T.Y. Chiu и соавт. (2002) выявили, что содержание MИ в фолликулярной жидкости положительно коррелирует с хорошим качеством ооцитов и с концентрацией эстрадиола[45]. В другом исследовании добавление MИ к культуральной среде ооцитов мышей улучшало прогрессирование мейоза ооцитов (T.T.Y. Сhiu и соавт., 2003)[46].
В работе D. Heimark и соавт. (2014) показана более высокая активность эпимеразы в тека-клетках яичников у пациенток с СПКЯ по сравнению с таковой у здоровых женщин, что сопровождалось четырехкратным снижением соотношения МИ/ДХИ[44]. Это было подтверждено в исследовании B.K. Arya и соавт., где сообщалось, что в группе здоровых женщин соотношение МИ к ДХИ составляло 100 : 1, а в группе СПКЯ — 0,2 : 1[34]. Таким образом, можно сделать вывод, что при СПКЯ наблюдаются недостаточность МИ и избыток ДХИ. По всей видимости, это приводит к нарушению внутриклеточной передачи сигналов ФСГ и снижению качества ооцитов.
Во многих исследованиях продемонстрирована эффективность приема МИ при СПКЯ. Так, суточной прием 4 г МИ в сочетании с фолиевой кислотой (ФК) в течение 6 месяцев приводил к восстановлению овуляции у 72% и наступлению беременности у 40% больных с СПКЯ[47].
В исследовании Z. Kamenov и соавт. (2015) у женщин с ановуляторным фенотипом СПКЯ и ИР даже при трехмесячном приеме МИ отмечались восстановление овуляции (72%) и наступление беременности (37,9%). Более того, у пациенток с СПКЯ, помимо коррекции овуляторной дисфункции, также уменьшались ИМТ и индекс НОМА. Это подтверждает роль МИ в снижении ИР и улучшении функции яичников при СПКЯ[48].
В обзоре V. Unfer и соавт. проанализировано влияние MИ на метаболический и гормональный профиль пациенток с СПКЯ. Авторы оценивали данные 21 исследования, где протоколы приема МИ различались, а суточная доза препарата варьировала от 500 до 1500 мг[49].
Результаты анализа свидетельствуют о том, что у всех женщин с СПКЯ применение МИ сопровождалось нормализацией гормонального профиля: соотношений ЛГ/ФСГ и глюкозы/инсулина, уровней тестостерона, андростендиона и инсулина, индекса НОМА. Кроме того, выявлено снижение концентрации общего холестерина и повышение содержания ЛПВП. Отмечались также уменьшение ИМТ, регуляция менструального цикла, повышение частоты наступления беременности.
Эти данные подтвердила группа исследователей в 2018 году, по результатам их анализа, после 12 недель применения МИ и ФК в стандартной дозировке концентрация общего тестостерона снизилась в 2 раза, свободного тестостерона — в 4 раза, уровень прогестерона вырос в 6 раз.
Полученные данные подтвердили гипотезу о том, что снижение уровня инсулина, вызванное MИ, основано на повышении биодоступности вторичного мессенджера инсулина IPG. Следовательно, для нормализации функционирования эндокринной системы необходимо улучшение внутриклеточного обмена[50]. Механизм влияния МИ на снижение уровней андрогенов в приведенных исследованиях авторы объясняют тем, что сигнальные пути IPG вовлечены в инсулин-опосредованный биосинтез андрогенов тека-клетками, поэтому дефицит МИ и нарушенная конверсия МИ в ДХИ при СПКЯ способствуют гиперандрогении.
Большое внимание уделяется изучению не только эффективности МИ, но и его безопасности, особенно при беременности. Так, в исследовании F. Fraticelli и соавт. изучалось действие МИ и ДХИ на углеводный обмен и исходы беременности[51]. В него включили 80 беременных с гестационным СД с последующей рандомизацией на 4 группы: 4000 мг МИ + 400 мкг ФК, 500 мг ДХИ + 400 мкг ФК, 1100/27,6 мг МИ/ДХИ + 400 мкг ФК, группа контроля — только ФК. Результаты оценивали через 8 недель применения препаратов и по окончании беременности. Выраженное снижение индекса НОМА отмечено в группе МИ, что сопровождалось более низким весом новорожденных. В группах принимавших МИ и МИ + ДХИ потребовалась также меньшая доза инсулина во время беременности.
В ряде исследований продемонстрировано, что применение во время беременности МИ в дозировке 4 г в сутки не вызывает побочных эффектов и не обладает тератогенным действием[51, 52].
Таким образом, на основании многочисленных исследований высокую эффективность MИ при СПКЯ можно объяснить недостаточностью МИ, который является вторичным мессенджером внутриклеточного сигнала действия инсулина, ЛГ и ФСГ. При восполнении дефицита МИ повышается биодоступность вторичного мессенджера инсулина IPG, следовательно, улучшается внутриклеточный обмен, увеличиваются утилизация глюкозы, передача сигналов ЛГ и ФСГ[32, 37, 53, 54]. Это указывает на то, что для правильного функционирования яичников важно поддерживать физиологическое соотношение МИ/ДХИ (40 : 1–100 : 1)[32, 34].
РОЛЬ ИНОЗИТОЛА В ИСПОЛЬЗОВАНИИ ВСПОМОГАТЕЛЬНЫХ РЕПРОДУКТИВНЫХ ТЕХНОЛОГИЙ
Как уже указывалось, МИ и ДХИ принимают участие в качестве вторичных мессенджеров в различных клеточных процессах, таких как инсулиновый сигнальный каскад, метаболизм кальция, липидный обмен, рост и дифференцировка клеток, синтез белков цитоскелета. МИ играет важную роль в созревании и оплодотворении ооцитов, поскольку активирует рецептор инозитол 1,4,5-трифосфата (IP3R) и инициирует высвобождение внутриклеточного Са2+
в ответ на действие ЛГ и ФСГ[29, 37, 38]. Помимо этого, МИ в гранулезных и тека-клетках поддерживает стероидогенез путем модуляции структур цитоскелета[12, 37, 38].
После того, как обнаружилось, что инозитол является составляющей фолликулярной жидкости (ФЖ) и его содержание в ФЖ в 3–4 раза выше, чем в сыворотке крови, была выдвинута гипотеза о его влиянии на мейоз яйцеклеток[55]. T.T.Y. Chiu и соавт. сообщают, что при культивировании преовуляторных ооцитов мышей в среде с высоким содержанием МИ наблюдается рост скорости созревания ооцитов, оплодотворения и последующего деления, а после переноса эмбрионов — более быстрая имплантация[45]. Это исследование открыло новую страницу в понимании механизмов действия инозитола.
В дальнейшем последовал ряд исследований, доказывающих прямую корреляцию между уровнем МИ в ФЖ, качеством ооцитов и исходом беременности[34, 45, 47, 50, 52, 53]. Р.А. Regidor и соавт. провели исследование на большой выборке женщин с СПКЯ и бесплодием (n = 3602), которые были включены программу ЭКО. У женщин, принимавших 4 г МИ и ФК (400 мкг/сут) в течение 12 недель, снизилось количество незрелых ооцитов в стадии герминального везикула и ооцитов плохого качества. При этом прием МИ не влиял на общее число полученных яйцеклеток. Более того, в группе женщин, получавших МИ, количество дней стимуляции было меньше (9,7 дня в сравнении с 11,2). Это, вероятно, связано с более быстрой реакцией на стимуляцию ФСГ[50].
Полученные результаты можно объяснить тем, что в процессе созревания ооцитов производные МИ участвуют в формировании кальций-опoсредованных сигналов от рецепторов гонадoтропинов, которые активируют клетки в момент оплодотворения. Можно сделать вывод, что высокая концентрация МИ в фолликулярной жидкости коррелирует с качеством ооцитов и способствует полноценному фолликулогенезу.
В 2018 году МИ был включен в международные рекомендации по СПКЯ в качестве средства альтернативной терапии[56]. На российском фармацевтическом рынке МИ представлен под следующими торговыми названиями: Фертина (Финляндия), Миоферт, Иноферт (Италия). Это комплексы МИ (1000 мг) и ФК (100 мкг) выпускаются в форме порошка. МИ рекомендуется применять при СПКЯ, ИР, гиперандрогении, предиабете и СД 2 типа, а также в программах ЭКО по 4 г/сут в течение 3–6 месяцев.
ЗАКЛЮЧЕНИЕ
В настоящее время, несмотря на достаточно большое количество данных о патофизиологических механизмах формирования синдрома поликистозных яичников (СПКЯ), продолжается поиск методов терапии, отвечающих требованиям эффективности и безопасности. В качестве одного из альтернативных подходов к лечению СПКЯ рассматривается применение препаратов, содержащих мио-инозитол (МИ). МИ принимает участие во многих сигнальных путях, играет важную роль в регуляции репродуктивной системы и в клеточных механизмах фолликулогенеза.
Данными литературы подтверждается, что терапия больных с СПКЯ препаратами мио-инозитола приводит к коррекции эндокринно-метаболического профиля, регуляции менструального цикла и восстановлению овуляторных циклов более чем у 50% больных. Таким образом, применение препаратов МИ можно рассматривать как альтернативный патогенетически обоснованный вариант терапии метаболических нарушений и овуляторной дисфункции при СПКЯ.







