Проблема рака шейки матки (РШМ) на протяжении многих лет продолжает оставаться в центре внимания зарубежных и отечественных онкологов. Отмечается нарастание распространенности РШМ среди женщин моложе 30 лет, нередко имеющих уже запущенные формы. По прогнозам GLOBOCAN, к 2050 г. заболевaемость РШМ увеличится на 50%, достигнув более 1 000 000 новых случаев в год[1].
На сегодняшний день лучевая терапия и хирургический метод лечения местнораспространенных форм РШМ наиболее эффективны и считаются стандартными[2]. Однако, несмотря на доказанную эффективность, проведение лучевой терапии в предоперационном периоде не является оптимальным, особенно при значительных размерах опухоли. Установлено, что по мере увеличения первичного опухолевого очага уменьшается показатель эффективности лучевого лечения[3]. Использование повышенных доз облучения снижает частоту прогрессирования, но в то же время приводит к повреждению тканей малого таза и смежных органов, что обусловливает высокую частоту развития постлучевых изменений и лимитирует дальнейшее увеличение дозы.
Применение неоадъювантной химиотерапии в комбинированном и комплексном лечении больных РШМ активно изучается в зарубежных клиниках. Обзор литературы показал, что в большинстве схем химиотерапии используется комбинация с цисплатином. Проведение трех курсов с коротким интервалом и интенсификацией дозы цисплатина рекомендовано как приемлемое при оценке профиля токсичности. Установлено также, что платиносодержащие режимы неоадъювантной химиотерапии обеспечивают преимущество при хирургическом лечении и способствуют профилактике лимфогенного метастазирования[4]. Данные последнего Кокрановского метаанализа, посвященного сравнению индукционной химиотерапии с последующей операцией и хирургического лечения на первом этапе при местнораспространенных формах РШМ, продемонстрировали увеличение показателей общей выживаемости на 23% (p = 0,02), а безрецидивной выживаемости — на 25% (p = 0,008) в группе индукционной химиотерапии. Кроме того, отмечена значимая тенденция к снижению частоты рецидивов и метастазов в исследуемой группе[5].
На сегодняшний день в России опыт применения неоадъювантной химиотерапии у больных РШМ стадии IВ2–IIВ невелик. С 2016 г. в ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России инициировано исследование по изучению эффективности и токсичности неоадъювантной химиотерапии в дозоинтенсивном режиме с последующим хирургическим вмешательством у больных местнораспространенными формами РШМ. Конечными точками являются изучение конкурентных химиотерапевтических агентов в комбинации с цисплатином, проведение сравнительного анализа с аналогичной группой больных, получивших химиолучевое лечение по стандартной методике, оценка безрецидивной и общей выживаемости, статистическая обработка данных для подтверждения достоверности полученных результатов.
Задача настоящего этапа исследования — оценка непосредственных результатов химиотерапии: частоты клинических ответов, частоты хирургического вмешательства, степени патоморфологического регресса опухоли, профиля токсичности.
Цель исследования: оценка непосредственных результатов применения неоадъювантной химиотерапии доксорубицином и цисплатином у больных местнораспространенной формой РШМ IВ2–IIВ стадии.
МАТЕРИАЛЫ И МЕТОДЫ
Перед включением в исследование все первичные пациентки с морфологически подтвержденным диагнозом РШМ IB2–IIB стадии по классификации International Federation of Gynecology and Obstetrics (FIGO)/T1b22bN0M0 (TNM) подписывали информированное согласие. Протокол клинического испытания одобрен Этическим комитетом ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» Минздрава России. Основными критериями отбора больных в исследование стали возраст женщин не менее 18 лет; гистологически верифицированный РШМ; функциональный статус по Eastern Cooperative Oncology Group (ECOG) 0–1; отсутствие выраженных отклонений в гематологических и биохимических показателях.
С июня 2016 по октябрь 2017 г. в исследование были включены 70 первичных пациенток с морфологически подтвержденным диагнозом местнораспространенного РШМ IB2–IIB стадии (FIGO)/T1b22bN0M0 (TNM). Средний возраст больных составил 45 (27–64) лет. Общее состояние до начала терапии было расценено как «0» (ECOG — ВОЗ).
Морфологические типы опухоли были представлены в соотношении: плоскоклеточный рак — 66 (94,3%), аденокарцинома — 4 (5,7%) наблюдения. Степень дифференцировки плоскоклеточного рака: высокодифференцированный — 7 (10,0%), умереннодифференцированный — 44 (62,9%), низкодифференцированный — 19 (27,1%). Аденокарцинома во всех 4 случаях была умеренной дифференцировки.
При первичном стадировании (FIGO) больные распределились следующим образом: IB2 — 19 (27,1%), IIA — 9 (12,9%), IIB — 42 (60,0%).
Всем пациенткам провели 3 курса неоадъювантной полихимиотерапии по схеме АР в дозоинтенсивном режиме комбинацией цисплатина в дозе 75 мг/м2 и доксорубцина в дозе 35 мг/м2. Внутривенное введение препаратов выполнялось каждые 10–14 дней три раза.
На этапе отбора всем больным было проведено обследование, включающее стандартные клиниколабораторные исследования, рентгенографию органов грудной клетки в двух проекциях, КТ органов брюшной полости и забрюшинного пространства, цистоскопию и фиброколоноскопию. До начала и в процессе лечения осуществлялась видеофиксация опухоли шейки матки с использованием видеосистемы высокого разрешения VITOM (Karl Storz, Германия).
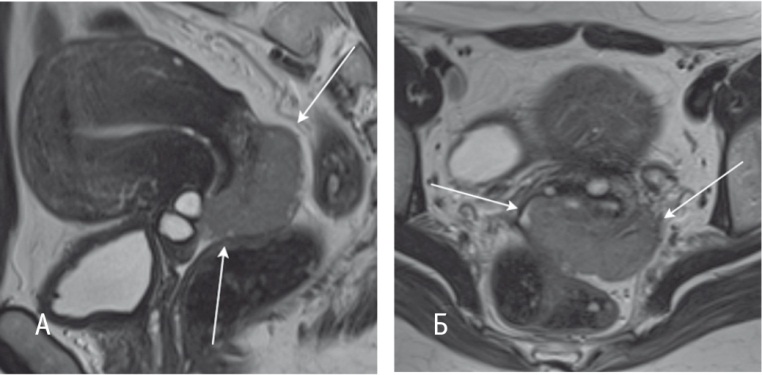
МРТ органов малого таза проводилась на этапе отбора и через 2 недели после окончания курса неоадъювантной химиотерапии, непосредственно перед хирургическим вмешательством. Исследования выполнялись на магнитнорезонансном томографе с индукцией магнитного поля 1,5 Тл MAGNETOM Aera (Siemens, Германия) с использованием поверхностной радиочастотной абдоминальной катушки (Body Coil). В специализированный протокол были включены следующие импульсные последовательности: Т2взвешенные изображения (Т2ВИ), полученные с помощью импульсных последовательностей (ИП) турбоспинэхо (turbospinecho); данная ИП позволяла дифференцировать опухолевую ткань и строму шейки матки. На сагиттальных (рис. 1А) и аксиальных срезах (рис. 1Б) оценивали размеры опухолевого узла, распространение процесса на тело матки, своды и стенки влагалища, а также взаимоотношение опухоли со стенками прямой кишки и мочевого пузыря.
Рис. 1. Т2-взвешенные изображения, полученные с помощью импульсных последовательностей турбо-спин-эхо: А — в сагиттальной плоскости (TR — 4860, TE — 87, FOV — 25 × 25 см, MTX — 320 × 256, ST — 4 мм), стрелками обозначена опухоль шейки матки; Б — в аксиальной плоскости (TR — 6790, TE — 87, FOV — 28 × 28 см, MTX — 320 × 256, ST — 4 мм), стрелками обозначена опухоль шейки матки. Здесь и далее в статье фото авторов
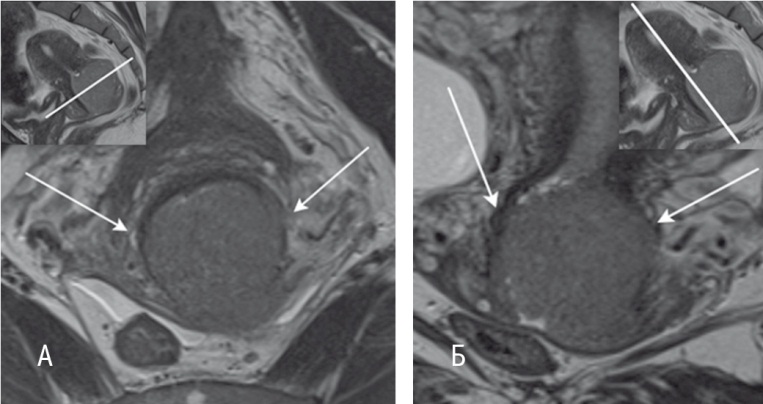
Для более детальной оценки параметральной инвазии получали Т2тонкосрезовые изображения с высоким разрешением (3 мм), ориентированные строго перпендикулярно (рис. 2А) и строго параллельно длинной оси шейки матки (рис. 2Б).
Рис. 2. Т2-взвешенные изображения, полученные с помощью импульсных последовательностей турбо-спин-эхо, с высоким разрешением: А — в аксиальной плоскости (TR — 5000, TE — 96, FOV — 20 × 20 см, MTX — 320 × 256, ST — 3 мм), стрелками обозначена опухоль шейки матки; Б — в корональной плоскости (TR — 5300, TE — 96, FOV — 20 × 20 см, MTX — 320 × 256, ST — 3 мм), стрелками обозначена опухоль шейки матки
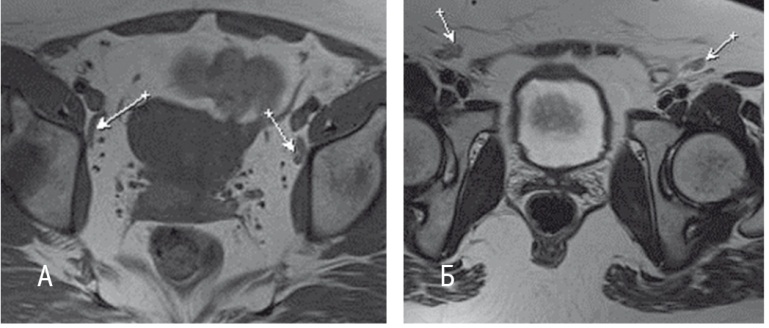
Состояние лимфатических узлов в зоне сканирования (от уровня бифуркации аорты до лонного сочленения с захватом паховой области) определяли преимущественно на аксиальных Т1ВИ (рис. 3А) и Т2ВИ (рис. 3Б).
Рис. 3. Изображения, полученные с помощью импульсных последовательностей турбо-спин-эхо (TSE): А — Т1-взвешенное изображение TSE в аксиальной плоскости (TR — 783, TE — 20, FOV — 28 × 28 см, MTX — 320 × 240, ST — 4 мм), стрелками обозначены наружные подвздошные лимфатические узлы неизмененной структуры; Б — Т2-взвешенное изображение TSE в аксиальной плоскости (TR — 6790, TE — 87, FOV — 28 × 28 см, MTX — 320 × 256, ST — 4 мм), стрелками обозначены паховые лимфатические узлы неизмененной структуры
Кроме того, для лучшей визуализации лимфатических узлов получали обзорные диффузионновзвешенные изображения (ДВИ) с значением bфакторов 50 и 800, карта ИКД (измеряемый коэффициент диффузии).
Для оценки изменения васкуляризации опухоли на фоне химиотерапии применялась методика динамического внутривенного контрастирования (доза — 0,2 мл/кг веса), с интервалом 20–30 с (сагиттальные Т1ВИ с жироподавлением) и отсроченных сканов Т1взвешенной последовательности.
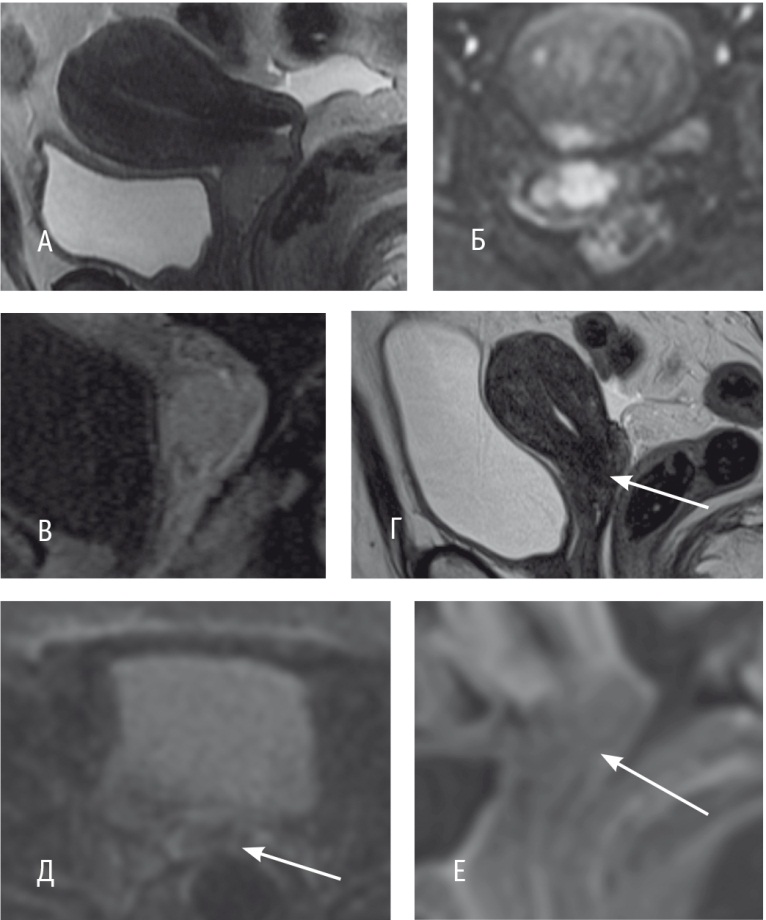
Магнитнорезонансными критериями полного регресса опухоли в результате лечения (рис. 4) являлись отсутствие участков повышенного магнитнорезонансного сигнала на Т2ВИ (рис. 4Г), полное исчезновение гиперинтенсивного сигнала на ДВИ (b = 800) (рис. 4Д), отсутствие участков более раннего накопления парамагнетика при динамическом контрастировании в области ранее выявляемого образования (рис. 4Е).
Рис. 4. Пациентка П., 49 лет, с магнитно-резонансными признаками полного ответа на неоадъювантную химиотерапию: А, Б, В — до начала лечения; Г, Д, Е — после окончания курса неоадъювантной химиотерапии, стрелками указана область ранее определяемой опухоли на Т2-взвешенном изображении, диффузионно-взвешенном изображении (b = 800) и постконтрастной серии
Для оценки лечебного патоморфоза после неоадъювантной химиотерапии проводилось сравнительное исследование первичного консультативного и биопсийного материала пациенток до лекарственного лечения с операционным материалом, полученным в результате хирургического вмешательства.
После удаления макропрепарат поступал патологу в абсолютно интактном виде для последующего макроскопического исследования, фиксации и вырезки. С целью адекватного стадирования и полноценной оценки резидуальной опухоли шейки матки определялись размеры, глубина инвазии и степень распространения процесса, состояние параметриев и хирургического края резекции. Перед фиксацией циркулярный край резекции параметриев и влагалища маркировались гистологической краской, после чего препарат вскрывался продольно по передней поверхности. Далее производилось макроскопическое описание органа, препарат раскладывался на планшете и заливался забуференным 10%ным раствором формалина для предварительной фиксации.
По истечении суток производилась вырезка препарата. Шейка матки, параметрии и манжета влагалища исследовались тотально. Для получения наиболее репрезентативных срезов шейку матки отделяли от тела на уровне нижнего маточного сегмента, затем со стороны эктоцервикса отсекалась часть стенки влагалища без макроскопических признаков поражения опухолью. Шейка матки вырезалась продольно с захватом окрашенного края параметрия и стенки влагалища, с направлением разреза от цервикального канала. Толщина среза не превышала 2 мм. Готовые фрагменты раскладывались по кассетам и после фиксации в течение суток отправлялись в проводку и окраску гистологических препаратов по классическому варианту.
При микроскопическом исследовании определялись гистологический тип опухоли, степень ее дифференцировки, оценивались глубина инвазии опухоли в строму шейки матки и распространение опухоли в параметрий и/или влагалище. Дополнительно рассчитывался процент некротизированных опухолевых клеток, определялось наличие лимфоваскулярной инвазии в сосудах всех исследованных слоев стенки шейки матки и параметриев.
Оценка патоморфологического ответа после неоадъювантной химиотерапии производилась на основании анализа цитологических характеристик, таких как дистрофия, апоптоз, некроз опухолевых клеток. Изменения стромального компонента были представлены фиброзом и склерозом стромы опухоли, формирующими опухолевое ложе, в котором могут присутствовать воспалительная инфильтрация, поля пенистых макрофагов, кровоизлияния различной степени давности с отложениями гемосидерина, скопления гемосидерофагов.
Для полноценной комплексной оценки патоморфологического ответа опухоли на химиотерапию использовались данные клиникоинструментальных методов исследования. Результаты исследования оформлялись в виде протоколов.
РЕЗУЛЬТАТЫ
Данные о профиле токсичности дозоинтенсивной неоадъювантной химиотерапии представлены в таблице 1, оценка проводилась согласно критериям Common Terminology Criteria for Adverse Events 4.03.
Таблица 1
Токсичность дозоинтенсивной неоадъювантной химиотерапии (n = 70)
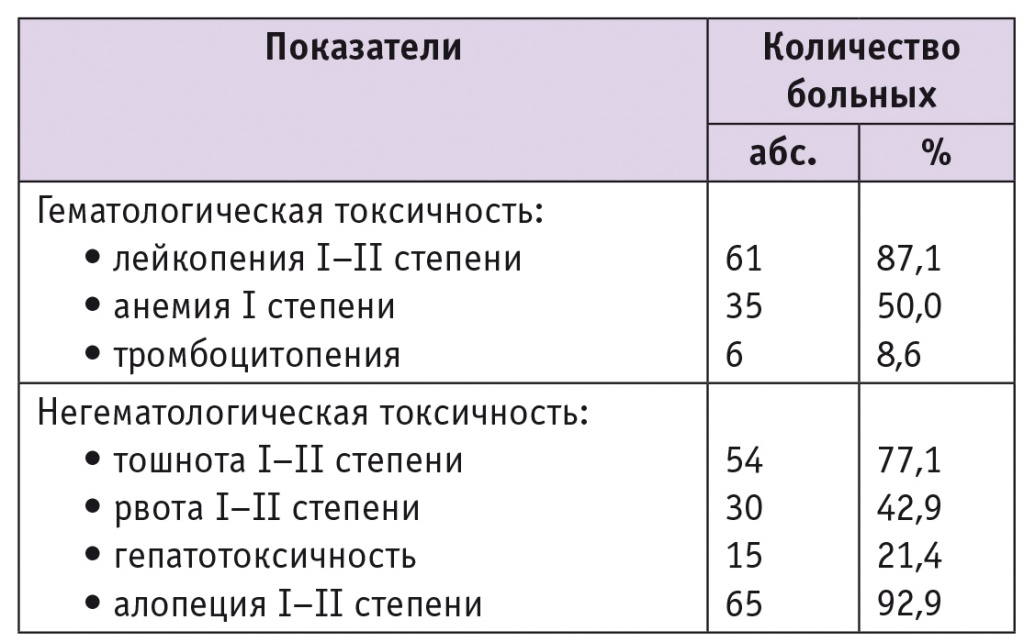
При дооперационной оценке эффективности дозоинтенсивной неоадъювантной химиотерапии по критериям RECIST 1.1. полный регресс опухоли был зафиксирован у 5 (7,1%), а частичный ответ — у 53 (75,7%) больных. Стабилизация процесса была отмечена в 6 (8,6%) случаях. Прогрессирование заболевания выявлено у 6 (8,6%) пациенток.
У 89,0% участниц, получивших неоадъювантную химиотерапию в дозоинтенсивном режиме, в сроки от 2 до 3 недель после завершения системного лечения было выполнено хирургическое вмешательство в объеме радикальной экстирпации матки, двусторонней аднексэктомии, тазовой лимфаденэктомии (Piver III).
Всем пациенткам со стабилизацией опухолевого процесса и двум с прогрессированием заболевания был проведен радикальный курс сочетанной химиолучевой терапии (цисплатин 40 мг/м2): дистанционная конформная лучевая терапия на аппарате ЛУЭ «CЛ755» РОД 2 Гр, до СОД 40 Гр на тт.А и 50 Гр на тт.В; внутриполостная лучевая терапия на брахитерапевтическом аппарате «Микроселектрон ВМД» РОД 7 Гр, до СОД 28 Гр на тт.А.
Остальным четырем больным из группы прогрессирования было выполнено хирургическое лечение.
При морфологическом исследовании операционного материала установлено, что хирургические вмешательства носили радикальный характер в подавляющем большинстве случаев — 61 (87,1%). В одном (1,4%) случае был обнаружен положительный край резекции бокового параметрия и влагалища.
В исследуемой группе патоморфологический ответ различной степени выраженности на проводимую неоадъювантную дозоуплотненную химиотерапию по схеме АР составил 82,9%. У 5 (7,1%) участниц полный клинический регресс подтверждался полным патоморфологическим ответом (ypCR). У 12 (17,1%) женщин морфологических признаков ответа опухоли на химиотерапевтическое лечение не было.
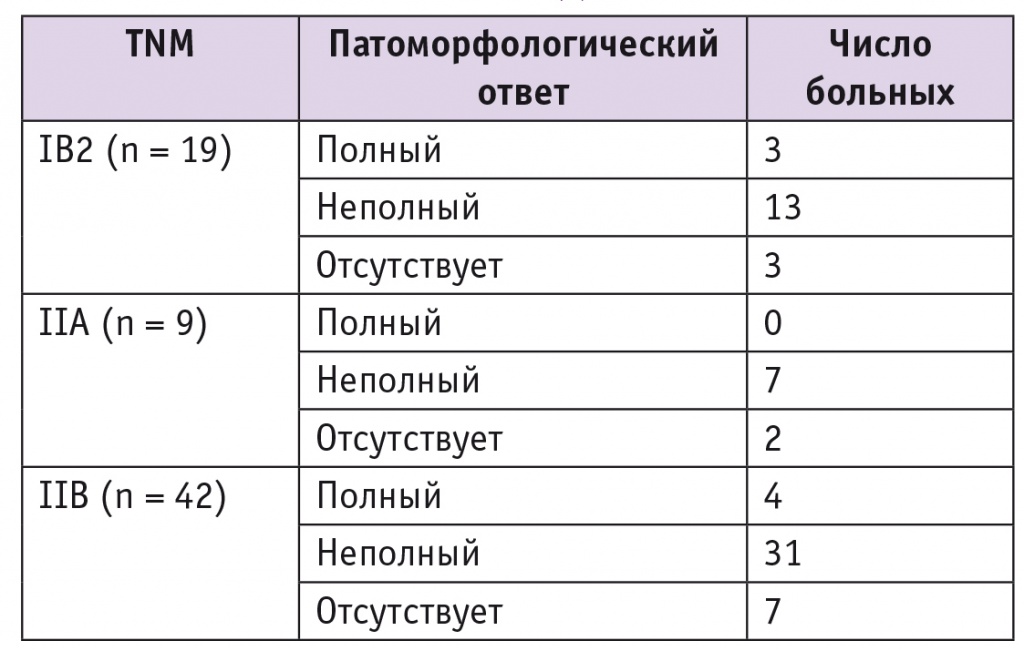
У всех пациенток с прогрессированием заболевания диагностирован низкодифференцированный плоскоклеточный рак. Патоморфологический ответ в зависимости от стадии заболевания представлен в таблице 2.
Таблица 2
Патоморфологический ответ на химиотерапевтическое лечение в зависимости от стадии заболевания
Всем больным после хирургического вмешательства была проведена дистанционная конформная лучевая терапия на аппарате ЛУЭ «CЛ755» РОД 2 Гр, до СОД 46–50 Гр на малый таз.
Больная, хирургическое вмешательство у которой оказалось нерадикальным, до сочетанной лучевой терапии получила 2 цикла полихимиотерапии по схеме ТС.
При продолжающемся наблюдении до января 2018 г. у 94,3% пролеченных больных подтверждена ремиссия заболевания. Продолжают химиотерапевтическое лечение 4 (5,7%) женщины с прогрессией опухоли с генерализацией процесса. При дооперационной оценке по шкале RECIST 1.1 у данных больных зафиксированы рост первичного очага и/или увеличение тазовых лимфоузлов. Всем пациенткам выполнено хирургическое лечение в объеме радикальной экстирпации матки, двусторонней аднексэктомии, тазовой лимфаденэктомии (Piver III). В послеоперационном материале — опухоль без признаков патоморфологического ответа на лечение.
Рецидив РШМ был диагностирован у одной (1,4%) пациентки с частичным регрессом заболевания спустя год после завершения лечения. На настоящий момент она получает химиотерапию.
ОБСУЖДЕНИЕ
В последние десятилетия стратегия использования неоадъювантной химиотерапии с последующим радикальным хирургическим вмешательством у больных местнораспространенным РШМ постепенно становится достойной альтернативой химиолучевому лечению. Во многих публикациях отмечена достаточно высокая эффективность нового варианта комбинированного лечения[6–10].
Анализ непосредственных результатов настоящего исследования показал, что при использовании неоадъювантной химиотерапии по схеме АР у больных РШМ IB2–IIB стадии клинический ответ на лечение составил 83,0%, патоморфологический ответ различной степени выраженности — 82,9%. Дозоинтенсивный режим химиотерапии характеризовался приемлемым профилем токсичности, его использование не привело к существенному росту частоты возникновения хирургических осложнений. Применение МРТ позволило адекватно клинически стадировать больных с учетом местного распространения первичной опухоли и вовлечения в процесс регионарных лимфоузлов.
ЗАКЛЮЧЕНИЕ
Полученные результаты дают основания рассматривать неоадъювантную химиотерапию у больных местнораспространенным раком шейки матки как эффективный метод, который может быть достойной альтернативой стандартного лечения. В настоящий момент невозможно сделать окончательные выводы о наиболее адекватном варианте индукционной лекарственной терапии. Подбор оптимальных препаратов, их комбинаций, режимов введения и дозировок требует продолжения накопления клинических данных. Проведение сравнительного анализа со стандартным методом лечения данной категории больных необходимо для подтверждения достоверности полученных результатов.







