Врожденная дисфункция коры надпочечников (ВДКН) относится к группе заболеваний, в основе которых лежат нарушения в процессе биосинтеза глюкокортикоидов и минералокортикоидов. Дефицит ферментов стероидогенеза приводит к снижению выработки кортизола. По механизму отрицательной обратной связи недостаток кортизола вызывает повышение уровня адренокортикотропного гормона, что оказывает стимулирующее действие на кору надпочечников, а в дальнейшем приводит к ее гипертрофии и затем — к гиперплазии коркового слоя коры надпочечников и накоплению предшественников стероидов проксимальнее возникшего ферментативного блока.
При всех формах ВДКН ферментативные дефекты могут быть частичными или полными, что видно по широкому спектру клинических проявлений. Клиническая картина может включать различные симптомы, такие как надпочечниковая недостаточность, генитальная неопределенность и гиперандрогения (гирсутизм, акне и т. д.). Кроме того, возможны нарушения менструального цикла, невынашивание беременности или бесплодие. Серьезность и клинические особенности ВДКН варьируют в зависимости от ферментативного дефекта и остаточной активности фермента[1].
В настоящее время описаны семь форм ВДКН:
- липоидная гиперплазия коры надпочечников (дефицит StAR-протерина);
- дефицит 20,22-десмолазы;
- дефицит 17α-гидроксилазы/17,20-лиазы;
- дефицит 3β-гидроксистероиддегидрогеназы;
- дефицит 21-гидроксилазы;
- дефицит 11β-гидроксилазы;
- дефицит оксидоредуктазы.
Более чем в 95% случаев причиной ВДКН является недостаточность фермента 21-гидроксилазы. На втором месте находится гипертоническая форма ВДКН, которая проявляется при дефиците 11β-гидроксилазы и встречается, по данным литературы, примерно у 1 из 100 000 новорожденных[2].
ВДКН включена в программу «Национальные приоритетные проекты» и введена в неонатальный скрининг с 2006 г.[3]. Ранее в клинических рекомендациях Российской ассоциации эндокринологов по диагностике и лечебно-профилактическим мероприятиям при ВДКН, опубликованных в 2016 г., было указано, что при положительных или сомнительных результатах определения уровня 17-гидроксипрогестерона как основного диагностического критерия при недостаточности 21-гидроксилазы необходимо проведение нагрузочного теста с тетракозактидом (Синактеном)[4]. Более того, для генетического консультирования далее предлагалось проводить генотипирование (2В)[4].
Так как в настоящее время в Российской Федерации отсутствуют зарегистрированные препараты тетракозактида, а отечественный аналог не создан, проведение пробы становится невозможным. Вместе с тем в планируемом проекте новых рекомендаций предполагается продолжить осуществление генотипирования для генетического консультирования при положительных или пограничных результатах определения уровня 17-гидроксипрогестерона и невозможности проведения пробы с тетракозактидом[5].
Генотипирование является завершающим этапом верификации признаков, характерных для ВДКН, выявленных на более ранних этапах скрининга новорожденных. Кроме того, оно используется для решения спорных вопросов, возникающих при диагностике стертой (неклассической) формы, которая становится одной из причин нарушения репродуктивного здоровья (бесплодия, невынашивания беременности и т. д.).
Разработка оптимального подхода к молекулярной диагностике ВДКН необходима для получения корректных результатов генетического тестирования и проведения адекватного лечения пациентов с данным заболеванием.
ГЕНЕТИЧЕСКИЕ НАРУШЕНИЯ ПРИ ДЕФИЦИТЕ 21-ГИДРОКСИЛАЗЫ
При дефиците 21-гидроксилазы, фермента цитохрома P450 (P450C21), участвующего в биосинтезе кортизола и альдостерона, 21-гидроксилирование нарушается в пучковой зоне коры надпочечников. Таким образом, 17-гидроксипрогестерон и прогестерон не преобразуются в 11-дезоксикортизол и 11-дезоксикортикостерон соответственно (рис. 1).
Рис. 1. Схема биосинтеза гормонов в коре надпочечников
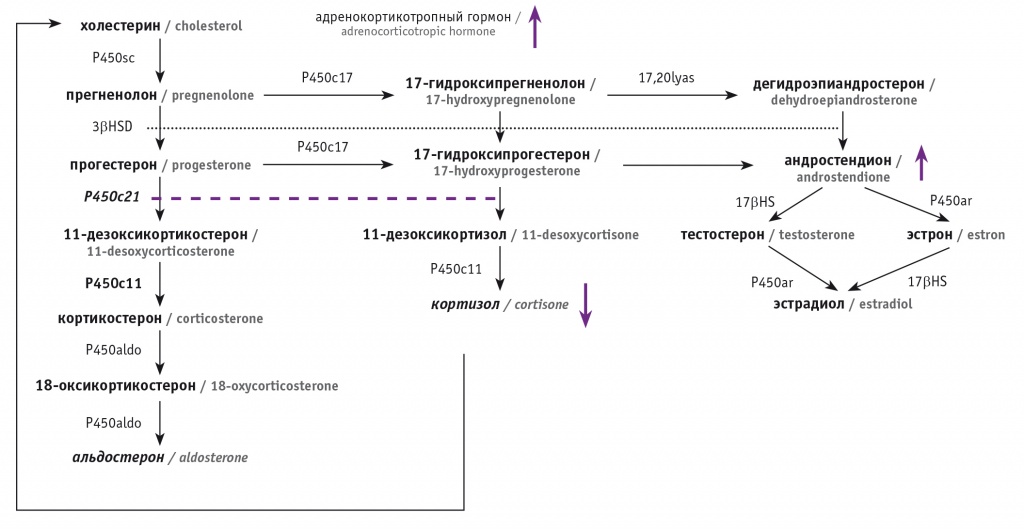
Вследствие снижения концентраций альдостерона и кортизола уровень адренокортикотропного гормона увеличивается, что приводит к перепроизводству и накоплению гормонов-предшественников кортизола (особенно 17-гидроксипрогестерона), которые конвертируются в андростерон и тестостерон[6, 7]. Клинические проявления заболевания широко варьируют в зависимости от степени избытка андрогенов, а также от степени снижения концентраций кортизола и альдостерона.
Принято выделять классическую форму заболевания с выраженной недостаточностью 21-гидроксилазы, которая проявляется внутриутробной вирилизацией, и неклассическую форму с умеренно выраженным ферментативным дефектом, проявляющуюся в постнатальном периоде. Классическую форму подразделяют на сольтеряющую (более 75% больных), при которой нарушен синтез альдостерона, и простую вирильную форму (приблизительно 25%)[8–10].
При сольтеряющей форме недостаточности 21-гидроксилазы у новорожденных могут возникать угрожающие жизни сольтеряющие кризы. Почки теряют способность реабсорбировать ионы натрия, что приводит к нарушению солевого обмена, гипонатриемии и гиперкалиемии. Избыточная продукция андрогенов у плодов женского пола уже на ранних стадиях внутриутробного развития (начиная с 7–8 недель) вызывает появление зачатков наружных половых органов по мужскому типу[11, 12]. Степень вирилизации зависит от выраженности ферментативного дефекта.
Простая вирильная форма характеризуется прогрессирующей вирилизацией и имеет практически те же клинические проявления, что и сольтеряющая, за исключением симптомов потери соли[13–15].
При сохранении активности фермента до 50% развивается неклассическая форма ВДКН. В отличие от классических форм она является более мягкой и не приводит к надпочечниковой недостаточности. Неклассическая форма ВДКН включает различные симптомы постнатального избытка андрогенов, такие как преждевременное пубархе, гирсутизм, акне, нарушение менструального цикла, невынашивание беременности, бесплодие и т. д.[16, 17].
Частота ВДКН варьирует в зависимости от популяции и составляет от 1 : 5000 до 1 : 67 000 новорожденных. Согласно данным, полученным при массовых обследованиях (почти 6,5 млн новорожденных по всему миру), средняя частота заболевания — 1 на 15 000 младенцев[18, 19]. В исследовании М.А. Каревой отмечено, что частота классических вариантов дефицита 21-гидроксилазы в России оказалась выше среднемирового показателя и составляет 1 случай на 10 000 новорожденных[20].
Неклассическая форма ВДКН встречается гораздо чаще[21]. Она выявляется у 0,1–0,2% населения в европейской популяции, в некоторых областях ее распространенность доходит до 10%[22], что значительно выше, чем ранее предполагалось в программах неонатального скрининга.
Нарушения в работе фермента 21-гидроксилазы возникают в результате наличия патогенных вариантов в гене CYP21А2, кодирующем данный фермент. Ген 21-гидроксилазы CYP21А2 картирован на коротком плече хромосомы 6 (6р21.3)[23].
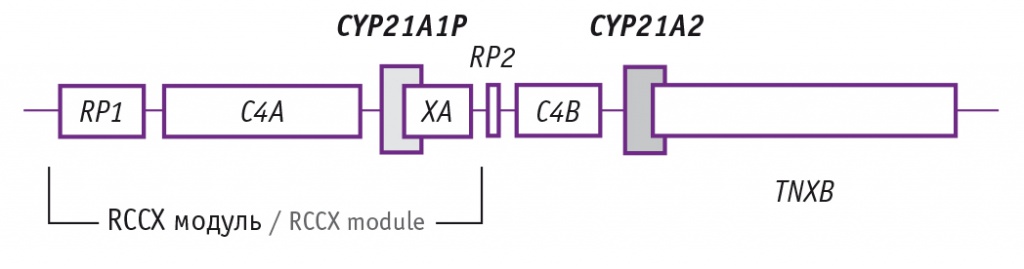
Функциональный ген CYP21A2 и его высокогомологичный псевдоген CYP21A1P расположены внутри главного комплекса гистосовместимости (МНС) в очень вариабельном локусе 6p21.33[24]. До клонирования гена CYP21A2 пренатальную диагностику ВДКН проводили с помощью HLA-типирования[25]. Как функциональный ген CYP21A2, так и псевдоген CYP21A1Р образуют генетическую единицу — модуль RCCX — с несколькими соседними генами, включая ген TNXB.
Описаны вариации числа копий для локуса RCCX, причем нормой считается наличие двух модулей (рис. 2)[26]. Большинство вариантов, нарушающих функцию 21-гидроксилазы, являются результатом рекомбинационных событий или генной конверсии между функциональным геном CYP21A2 и функционально неактивным псевдогеном CYP21A1P[27, 28].
Рис. 2. Схема RCCX модуля, включающего гены RP(1/2), C4(A/B), CYP21(A1P/A2) и TNX(A/B)
На сегодняшний день в мире описаны более 200 мутаций в гене CYP21A2. P. Concolino и A. Costella выделили 233 патогенных варианта, приводящих к заболеванию[29]. Однако существуют наиболее часто встречающиеся патогенные варианты, которые представляют около 75% всех аллелей при ВДКН (табл.). Кроме того, известно, что патогенные варианты в экзоне 6 гена CYP21A2: Ile237Asn, Val238Glu и Met240Lys — наследуются обычно кластером[30].
Таблица
Наиболее частые патогенные варианты в гене CYP21A2 [31]
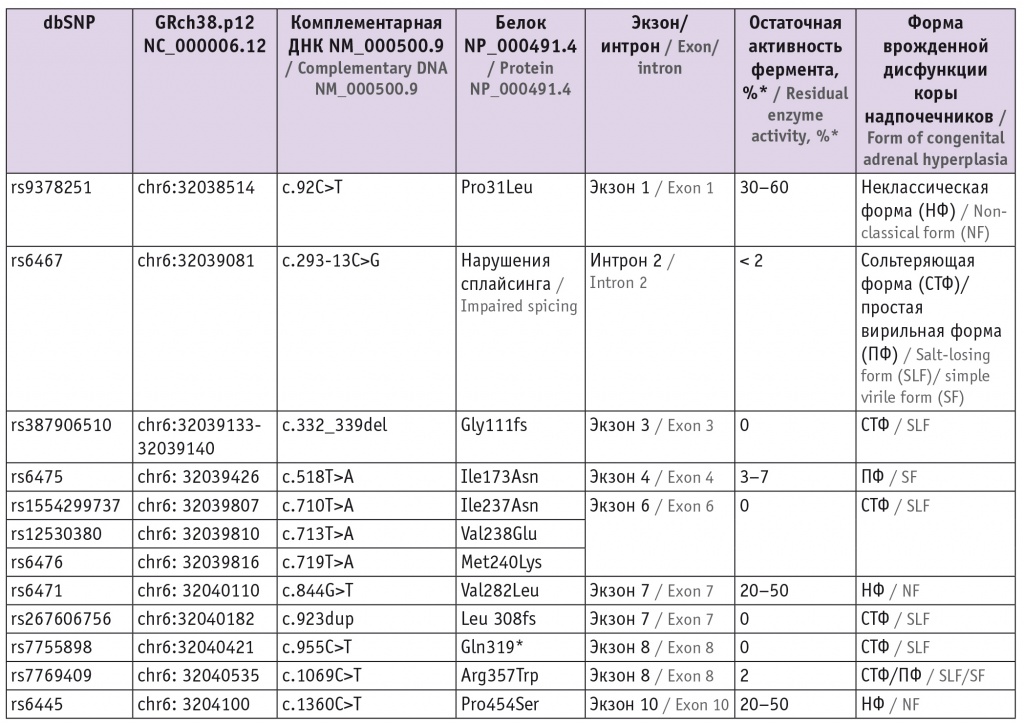
* По данным A. Rodríguez и соавт.[32].
Конверсии, включающие несколько экзонов, а также крупные делеции, захватывающие область протяженностью до 30 т. п. н. с точками разрыва между экзонами 2 и 8 генов CYP21A1P и CYP21A2, составляют около 20–30% патогенных вариантов при ВДКН[33]. И лишь небольшое количество вариантов гена CYP21A2, влияющих на функцию 21-гидроксилазы (~10%), представляют собой новые варианты, не являющиеся производными генной конверсии между геном и псевдогеном[9].
Возможны два подхода к проведению пренатального молекулярно-генетического исследования или выявлению гетерозиготного носительства у родственников пробанда при наличии недостаточности 21-гидроксилазы:
- прямой, основанный непосредственно на идентификации патогенного варианта[34];
- косвенный (непрямой) анализ наследования полиморфных генетических маркеров (например, HLA локуса), сцепленных с геном заболевания, у больных и здоровых членов семьи, в том числе с целью проведения пренатальной диагностики[25].
Главное преимущество прямого подхода в диагностике недостаточности 21-гидроксилазы — возможность судить о наличии или отсутствии соответствующей мутации по анализу ДНК одного индивидуума. Такой подход особенно важен для семей с высоким риском рождения ребенка с ВДКН, где уже погиб больной ребенок. Диагностика носительства мутации у членов такой семьи и, в особенности, пренатальная диагностика возможны только при наличии идентифицируемых мутаций у обоих родителей.
Поскольку более 70% «мутантных» аллелей несут один из 10 известных вариантов, описанных в международных базах данных, большинство случаев недостаточности 21-гидроксилазы при точно установленном по клиническим признакам диагнозе можно выявить путем скрининга таких мажорных вариантов. Для них разработаны специальные методы детекции, которые претерпели определенную эволюцию. Обычно проводят поэтапный поиск генетических вариантов, вовлеченных в развитие дефицита 21-гидроксилазы, с использованием различных молекулярно-генетических методов, что позволяет быстро идентифицировать наиболее распространенные варианты, вызывающие ВДКН, и потом, при необходимости, исследовать более редкие мутации.
Существуют различные методы генетической диагностики ВДКН. К ранним относят метод аллель-специфической гибридизации (allele-specific oligonucleotide hybridization), метод анализа конформационного полимофизма ДНК, SSCP (single-strand conformation polymorphism) и гетеродуплексный анализ[35]. Затем стали применять технологии, основанные на ПЦР-ПДРФ анализе. Их особенностью является то, что при исследовании осуществляют 2-этапную амплификацию необходимого фрагмента гена CYP21A2. Полученный продукт ПЦР первого этапа, нужный для наработки последовательности гена, а не псевдогена, используют в качестве матрицы на втором этапе, добавляя в данную реакцию специальные модифицированные олигопраймеры с целью создания специфичных сайтов рестрикции на каждую мутацию[36].
К технологиям, которые стали применять позднее, можно отнести метод мини-секвенирования Multiplex SNaPShot PCR с флуоресцентными дидезоксинуклеотидами для генотипирования наиболее распространенных патогенных вариантов при ВДКН[37]. В отдельных зарубежных центрах для диагностики ВДКН используют относительно простой стрип-тест (StripAssay)[38], позволяющий идентифицировать наиболее распространенные варианты. Процедура включает три этапа: 1) выделение ДНК; 2) ПЦР-амплификацию с использованием биотинилированных праймеров; 3) гибридизацию продуктов амплификации с тест-полоской, содержащей аллель-специфичные олигонуклеотидные зонды, иммобилизованные в виде массива параллельных линий. Связанные биотинилированные последовательности обнаруживают при помощи стрептавидина-щелочной фосфатазы и субстратов различного цвета.
В случае если этими методами не выявлен ни один патогенный вариант или найден только один аллель с патогенным вариантом, для точной постановки диагноза проводят полное определение нуклеотидной последовательности (секвенирование) гена CYP21A2[39]. Секвенирование по Сэнгеру выполняется для нахождения клинически значимых однонуклеотидных замен, небольших делеций и вставок на протяжении всей последовательности гена. Один или несколько фрагментов, покрывающих все 10 экзонов и экзон-фланкирующие регионы интронов, специфически амплифицируются с помощью селективных праймеров для ПЦР, дифференцирующих функциональный ген CYP21A2 от псевдогена CYP21A1P. Далее проводят второй этап ПЦР с целью наработки фрагмента с последующим секвенированием по Сэнгеру.
В последние годы для изучения структуры генов активно применяется метод секвенирования нового поколения (Next Generation Sequencing, NGS). Технологии массового параллельного секвенирования быстро развиваются, и данный метод представляет собой многообещающий инструмент для разработки новых подходов к молекулярной диагностике заболеваний. Он уже используется отдельными лабораториями при недостаточности 21-гидроксилазы. Но ввиду ограниченного опыта пока невозможно давать рекомендации по обязательному его применению.
В заключениях по диагностике методом NGS рекомендовано включать больше информации по биоинформатическим параметрам и способам оценки выявленных вариантов[31].
Так как в гене CYP21A2 могут присутствовать не только единичные миссенс-варианты, но и множественные патогенные варианты в цис-положении (как результат генных конверсий), а также делеции и дупликации различной протяженности[40], применяют метод мультиплексной лигазной реакции (multiplex ligation dependent probe amplification) с последующим разделением фрагментов на капиллярном анализаторе[41]. Для определения количества копий гена в отдельных его областях проводят анализ на основе ПЦР в реальном времени (CAH RealFast™ CNV Assay). С этой же целью и для выявления «химерных» генов, возникших после слияния гена и псевдогена, можно использовать методику, описанную в работе А.П. Баранник и соавт., основанную на выделении специфических генных вариантов с последующим проведением ферментативного гидролиза и анализа длин выявленных фрагментов[42].
Известно, что последовательность гена CYP21A2 может включать по всей своей протяженности отдельные участки последовательности псевдогена CYP21A1P (результат генной конверсии), несущие патогенные варианты, поэтому генетическую диагностику надо проводить в полном объеме, возможном для конкретной лаборатории, не останавливаясь на двух выявленных вариантах. Требуется также произвести анализ идентифицированных вариантов у родителей пробанда с целью верификации диагноза.
Тяжесть клинического проявления недостаточности 21-гидроксилазы практически всегда коррелирует с типом патогенных вариантов, присутствующих в гене CYP21A2[43], поэтому точное и максимально полное определение патогенных вариантов, вовлеченных в развитие заболевания, играет важнейшую роль при медико-генетическом консультировании пациентов с ВДКН как для назначения соответствующей терапии, так и с целью планирования беременности в семье, имеющей ребенка с ВДКН, а также определения гетерозиготного носительства у ближайших родственников пробанда.
Интерпретация полученных результатов и адекватное медико-генетическое консультирование больного и членов его/ее семьи требуют глубоких знаний генетических основ данной патологии[44, 45].
В соответствии с руководством Общества эндокринологов по клинической практике, при рождении ребенка с ВДКН следует проводить медико-генетическое консультирование родителей[46]. Чтобы обеспечить правильное медико-генетическое консультирование, необходимо учитывать следующее:
- только анализ гена CYP21A2 позволяет выявить и подтвердить носительство у родителей, имеющих ребенка с ВДКН, а также исключить возникновение мутации de novo;
- генотипирование дает возможность оценить характер патогенных вариантов для уточнения клинической формы заболевания;
- информация о патогенных вариантах помогает понять, необходимо ли пренатальное исследование в семье гетерозиготных носителей, и определить тактику ведения беременности у пациенток с ВДКН для исключения осложнений и уменьшения риска развития вирилизации у плодов женского пола;
- генотипирование CYP21A2 можно использовать для выявления носительства у партнеров пациентов с ВДКН или партнеров гетерозиготных носителей патогенных вариантов в гене CYP21A2 с целью уточнения риска рождения детей с ВДКН в данных семьях;
- информация о конкретных патогенных аллельных вариантах гена CYP21A2 и полиморфных генетических маркерах (например, HLA локуса), сцепленных с геном заболевания, позволяет обнаружить носительство патогенных аллельных вариантов у клинически бессимптомных родственников из группы риска; это облегчает пренатальное или предимплантационное генетическое тестирование в программе ЭКО при последующей беременности в условиях ограниченного времени диагностики и делает ее более надежной;
- следует рассмотреть возможность диагностики патогенных вариантов в гене 21-гидроксилазы у пациентов (и доноров) перед ЭКО в программах ВРТ[47, 48].
ЗАКЛЮЧЕНИЕ
Если при диагностике недостаточности 21-гидроксилазы использовать методы, которые охватывают только мажорные точечные замены, вызывающие заболевание, но не способствуют обнаружению крупных делеций/дупликаций, ограничения этих методов должны быть указаны в соответствующих генетических заключениях, поскольку в подобных случаях теряется возможность выявить определенный процент нарушений, включающих крупные перестройки гена CYP21A2.
Идентификация одного патогенного варианта в исследуемом гене, вызывающего заболевание, не исключает наличия других, не охваченных используемым методом анализа. Этот факт также следует упомянуть в генетических заключениях и учитывать при медико-генетическом консультировании[31]. Тем не менее все упомянутые методы имеют ограничения, и ни один из них не может идентифицировать 100% возможных вариантов из-за сложности локуса CYP21A2.
Наилучшей стратегией для генетической диагностики недостаточности 21-гидроксилазы является 2-этапный анализ гена CYP21A2. Исследование должно включать не только анализ последовательности гена и выявление точечных замен, небольших делеций и дупликаций (например, секвенирование по Сэнгеру или Next Generation Sequencing, NGS), но и обнаружение протяженных делеций и дупликаций (multiplex ligation dependent probe amplification, ПЦР в реальном времени). Такой комплексный подход поможет найти большинство типов потенциальных изменений. И, конечно, создание таргетных панелей для анализа методом NGS, включающих кодирующие области других генов (CYP17A1, HSD3B, HSD3B2, POR), задействованных в процессах стероидогенеза, позволит максимально охватить все возможные патогенные варианты, приводящие к врожденной дисфункции коры надпочечников.
Поступила: 02.04.2021
Принята к публикации: 28.04.2021







