Артериальные и венозные осложнения при использовании гормональных препаратов (ГП) имеют разные механизмы развития и клиническую значимость. Если с частотой артериальных осложнений ассоциированы метаболические эффекты препаратов, то частота венозных осложнений зависит от их влияния на гемостаз. При этом в обоих случаях принципиальное значение имеют сопутствующие факторы риска у пациентки, выявление которых позволяет существенно снизить распространенность побочных эффектов ГП.
Артериальные осложнения чаще встречаются в постменопаузальном возрасте, тогда как частота венозных осложнений высока как у пользовательниц контрацептивов, так и у получающих менопаузальную гормональную терапию (МГТ). К сожалению, в арсенале врачей нет ГП, который бы снижал все риски кардиоваскулярных заболеваний. Так, при применении ГП последних поколений продемонстрировано уменьшение риска артериальных заболеваний, но оно сопровождается более высоким риском венозной тромбоэмболии (ВТЭ).
Все комбинированные ГП увеличивают риск ВТЭ [1], который является основным побочным эффектом гормональной терапии (ГТ) [2]. Баланс между преимуществами и рисками контрацептивных стероидов, как правило, положительный, особенно по сравнению с рисками беременности. Следует отметить, что ВТЭ, связанная с их применением, редко встречается у молодых женщин, тем не менее тяжелые клинические последствия требуют особого внимания к данной проблеме.
Среди женщин репродуктивного возраста 4–5 из 10 000 страдают от ВТЭ каждый год, тогда как женщины, использующие КОК, — в 2 раза чаще (8–9 из 10 000). Эпидемиологические исследования демонстрируют либо отсутствие различий по риску ВТЭ между разными КОК (проспективные исследования с активным наблюдением), либо увеличение риска при использовании препаратов с новыми гестагенами (обсервационные исследования или исследования в базе данных) [3]. Расхождение может быть объяснено разными схемами исследований и тем фактом, что в некоторых обсервационных исследованиях факторы риска ВТЭ, такие как избыточный вес, семейный анамнез тромбоза и курение, не были скорректированы. У пациенток старшей возрастной группы (после 50 лет) частота ВТЭ выше — около 1 случая на 1000 женщин — и увеличивается с возрастом [4]. МГТ сопровождается повышением риска ВТЭ в 2–3 раза, особенно в течение первого года лечения.
Ответственность за рост риска ВТЭ на фоне применения ГП первоначально приписывали исключительно эстрогенному компоненту. Это вынудило производителей существенно снизить содержание этинилэстрадиола (ЭЭ) — с 50 мкг до 35–20 мкг, что практически сразу привело к снижению числа случаев тромбоэмболии. Ситуация осложнилась после появления прогестинов третьего поколения (гестодена, дезогестрела и норгестимата, которые считаются «метаболически нейтральными», однако повышают риск развития ВТЭ по сравнению с левоноргестрелом) [5]. В этих условиях был продолжен поиск комбинаций с минимальным риском венозных осложнений и введены новые прогестины (диеногест и дроспиренон), а также препараты натуральных эстрогенов — микронизированный эстрадиол (E2) и эстриол (Е3), эстрадиола валерат (E2V) и эстетрол (E4).
Но проблема повышенного риска ВТЭ у пользовательниц ГП сохраняется, и систематический обзор и крупный метаанализ, опубликованные в 2013 году [6], позволили сделать вывод, что «относительный риск венозного тромбоза у КОК с 30–35 мкг ЭЭ и гестоденом, дезогестрелом, ципротероном или дроспиреноном был сходным и примерно на 50–80% выше, чем у КОК с левоноргестрелом». Выявлена дозовая зависимость эффекта у препаратов, содержащих комбинацию ЭЭ и гестодена, дезогестрела или левоноргестрела, — более высокие дозы связаны с более высоким риском тромботических осложнений.
Есть момент, о котором стоит упомянуть и который уже 30 лет назад подчеркивал Джон Боннар [7]: «Свертывание крови и тромбоз — это не идентичные процессы, но они... тесно связаны между собой. Сосудистый тромбоз можно рассматривать как гемостаз с участием тромбоцитов и свертывания крови, происходящих в неправильном месте, и с участием интактного кровеносного сосуда. Когда вводятся новые типы КОК или эстроген-содержащих лекарств, важно исследовать их влияние на физиологические процессы, связанные с гемостазом».
На практике значительная часть исследований в этой области носит эпидемиологический характер, поэтому они сосредоточены на анализе риска ВТЭ, а не на его причинах (изменения в гемостатическом каскаде). В нашем обзоре мы рассмотрим механизмы развития эффектов половых стероидов на гемостаз с акцентом на свойствах отдельных гестагенов.
ФАКТОРЫ РИСКА ВЕНОЗНЫХ И АРТЕРИАЛЬНЫХ ОСЛОЖНЕНИЙ
Риск ВТЭ по Вирхову (триада) — замедление тока крови, изменение функционирования венозного эндотелия и усиление свертывания крови. Периферический тромбоз глубоких вен и тромбоэмболия легочной артерии являются основными проявлениями ВТЭ [8]. Артериальные события включают инфаркт миокарда, ишемический инсульт, геморрагический инсульт и периферические артериальные события. Они не зависят от застоя крови и только вторично — от повышенной коагуляции; в основном они зависят от факторов риска развития атеросклероза (дислипидемии, СД, гипертензии, ожирения и курения). Значимость диабета и измененного метаболизма липопротеинов ниже, а коагуляции — выше [9] для риска ишемического инсульта, чем для такового инфаркта миокарда. Риск геморрагического инсульта зависит от тяжести гипертензии и в меньшей степени — от чрезмерного употребления алкоголя, абдоминального ожирения и курения.
СИСТЕМА ГЕМОСТАЗА
Существует три механизма защиты от кровопотери: спазм сосудов, образование тромбоцитарного сгустка и коагуляция. А три противодействующих фактора защиты от избыточного тромбообразования — ингибитор тканевого фактора (TFPI), антикоагулянтная система белка С и антитромбин III.
При повреждении ткани из клеток и тромбоцитов выделяются биологически активные соединения (тканевой фактор — TF), которые в сочетании с болевым рефлексом вызывают спазм ангиомиоцитов, и это сдерживает кровопотерю от нескольких минут до нескольких часов, в течение которых начинают работать другие механизмы гемостаза.
Тромбоциты связываются с поврежденной стенкой сосуда через рецепторы GP-Ib/Ix/V и GP-VI и активируют протромбиназу (комплекс Ха/Va), в результате образуется тромбин. Тромбоциты содержат АДФ, АТФ, Са2+, серотонин, ферменты синтеза тромбоксана А2, простагландинов, фибрин-стабилизирующий фактор (ХIII), лизосомы, немного митохондрий, мембранные цистерны для хранения кальция, цитоскелет для высвобождения гранул и гликоген. Внутри тромбоцитов также находится тромбоцитарный фактор роста (PDGF), который необходим для пролиферации эндотелиальных клеток, ангиомиоцитов и фибробластов, т. е. для восстановления поврежденных кровеносных сосудов.
Формирование тромбоцитарного сгустка включает адгезию, активацию и агрегацию тромбоцитов. Адгезия тромбоцитов на оголенные участки соединительной ткани поврежденного сосуда запускает активацию тромбоцитов, которая начинается и многократно усиливается высвобождением содержимого пузырьков из тромбоцитов наружу. АДФ, тромбин и тромбоксан А2, оказавшись за пределами клетки, связываются со своими рецепторами (P2Y12, PAR1 и TPa-R) на поверхности собственного и соседних тромбоцитов, в которых в ответ на это повышается уровень свободного Са2+, активируется цитоскелет клетки, а он, в свою очередь, обеспечивает выход рецепторов для фибриногена (GPIIb/IIIa) на поверхность клетки и высвобождение тромбоцитарных пузырьков из соседних тромбоцитов.
Собственно активация тромбоцита — это и есть выход рецепторов для фибриногена из цитозоля на поверхность плазматической мембраны клетки, данные рецепторы необходимы для связи отдельных тромбоцитов между собой через фибриновые мостики. В результате агрегации тромбоцитов (накопления и связывания клеток между собой) формируется тромбоцитарный сгусток, который может полностью остановить кровопотерю, если отверстие в кровеносном сосуде не слишком большое. Серотонин и тромбоксан А2 действуют как вазоконстрикторы, вызывая и поддерживая сокращение гладких мышц сосудов.
Агрегация тромбоцитов и коагуляция представляют собой два взаимозависимых процесса с общими регуляторными (тромбин) и функциональными (фибрин) молекулами.
Коагуляция крови — это каскад ферментативных реакций, которые завершаются образованием нерастворимых фибриновых нитей. К факторам свертывания относят ионы кальция (Ca2+), несколько неактивных ферментов, которые синтезируются гепатоцитами и высвобождаются в кровоток, а также различные молекулы, связанные с тромбоцитами или выделяемые поврежденными тканями.
Свертывание включает три этапа: двумя путями (внешним и внутренним) образуется протромбиназа (Ха/Va), затем она превращает протромбин в тромбин, тромбин превращает растворимый фибриноген в нерастворимый фибрин. Следует подчеркнуть, что разделение коагуляции на два отдельных пути является чрезмерным упрощением, поскольку существует много точек взаимодействия, и ни один из путей не может полностью объяснить гемостаз.
Внешний путь — быстрый и короткий (несколько секунд) — запускается TF или тромбопластином, который попадает в кровоток извне сосуда (поэтому он внешний). TF — это сложная смесь липопротеинов и фосфолипидов, выделяемых с поверхности поврежденных клеток и тромбоцитов. TF в присутствии Са2+ активирует протромбиназу, завершая внешний путь.
Внутренний путь более сложный и медленный (несколько минут), его инициаторы находятся в кровеносном русле либо в прямом контакте с кровью. Травма эндотелиальных клеток вызывает повреждение тромбоцитов, которые выделяют фосфолипиды. Контакт с коллагеновыми волокнами активирует фактор свертывания крови XII, а он начинает последовательность реакций с итогом в виде активации фактора X, завершая внутренний путь.
Общий путь — протромбиназа и Са2+ катализируют превращение протромбина в тромбин. На этой стадии тромбин расщепляет фибриноген (четыре небольших пептида — растворимые фибринопептиды) на фибриновые мономеры, которые самопроизвольно собираются в волокнистые нити фибрина, что приводит к формированию высокоорганизованной и прочной сети, способной захватывать эритроциты, лейкоциты и тромбоциты в местах повреждения сосудов, тем самым образуя стабильный сгусток, стабилизированный и уплотненный еще одним ферментом, фактором XIII. Фибринопептид А и мономер фибрина используют в качестве маркеров синтеза фибрина in vivo. Тромбин активирует и такие факторы, как XIII (фибрин-стабилизирующий фактор) и протеин C. При этом образуется комплекс протеина С с протеином S, что сопровождается антикоагулянтным эффектом.
Образованный сгусток закупоривает разрыв кровеносного сосуда и за счет ретракции сближает края поврежденного сосуда. Во время ретракции часть сыворотки вытекает между нитями фибрина, но форменные элементы крови застревают в сгустке. Эффективность ретракции зависит от количества тромбоцитов в сгустке, которые поставляют фактор XIII. Далее фибробласты образуют соединительную ткань в области повреждения, и новые эндотелиальные клетки восстанавливают выстилку сосуда.
В процессе образовании сгустка закладывается основа его лизиса — плазминоген входит в состав сгустка. Активаторами плазминогена являются тромбин, активированный фактор XII и тканевой активатор плазминогена (t-PA), который синтезируется и хранится в лизосомах эндотелиальных клеток большинства тканей. Активированный плазминоген (плазмин) расщепляет нерастворимый фибрин на мелкие растворимые пептиды, полезные в качестве маркеров фибринолиза in vivo (особенно D-димер). Плазмин инактивирует также протромбин, факторы V и XII.
Три тормозных фактора защиты от избыточного тромбообразования — TFPI, антикоагулянтная система белка С и антитромбин III (эндогенные антикоагулянты) — задерживают, подавляют или предотвращают свертывание крови. TFPI — эндотелиальный фактор, который противодействует активации внешнего пути. Антитромбин III блокирует действие нескольких факторов, включая XII, X и II (протромбин), следовательно, снижает активность общего пути. Гепарин вырабатывается тучными клетками и базофилами, связывается с антитромбином и повышает его эффективность в блокировании тромбина. Другой натуральный антикоагулянт, активированный протеин С, блокирует два основных фактора свертывания — V и VIII, не контролируемых антитромбином, тем самым снижая активность общего и внутреннего путей свертывания. Кроме того, протеин С потенцирует эффект активаторов плазминогена.
Несмотря на эффективные антикоагулянтные и фибринолитические механизмы, в сердечно-сосудистой системе иногда формируются тромбы. Тромб — аномально образующийся в сосуде кровяной сгусток, который смещается и закупоривает просвет сосуда, или уносится кровотоком (эмбол). Такие сгустки могут быть инициированы поврежденной поверхностью эндотелиоцитов в результате атеросклероза, травмы или инфекции. Другой причиной образования внутрисосудистых сгустков является замедление кровотока (стаз), когда создаются условия локального накопления факторов коагуляции в высоких концентрациях — обычная причина тромбоза в венах.
СТЕРОИДНЫЕ ГОРМОНЫ И ГЕМОСТАЗ
Отдельные данные экспериментальных и клинических исследований указывают на то, что половые стероиды способны уменьшать кровоток за счет расширения вен. Так, ГТ [10] увеличивает емкость вен. Длительное применение ГП может влиять на функциональную активность эндотелия путем воздействия на липидный и углеводный метаболизм [11].
Аномально высокие уровни некоторых факторов свертывания и дефекты в системе антикоагулянтов способствуют риску тромбообразования. Гормоны вызывают значительные изменения уровней в плазме белков коагуляционного, антикоагуляционного и фибринолитического путей. По-видимому, существуют также этнические различия: сравнительное исследование четырех препаратов КОК показало, что изменения в профиле коагуляции заметно различаются в Сальвадоре (Бразилия), Дублине, Сантьяго-де-Чили и Сингапуре [12]. Следует упомянуть и исследование [13], показавшее, что при разных дозах ЭЭ наблюдаются бóльшие изменения гемостатических параметров у курящих, чем у некурящих.
ДЕЙСТВИЕ ЭСТРОГЕНОВ НА ПАРАМЕТРЫ КОАГУЛЯЦИИ
Е2, самый активный эндогенный эстроген, реализует свою активность через собственные ядерные и мембранные рецепторы. При этом изменяется транскрипция эстроген-зависимых генов — увеличивается или снижается синтез белков-мишеней стероида. К таким мишеням относятся и белки свертывающей системы крови. Если повышение коагуляционного потенциала у пациенток при беременности предохраняет их от чрезмерной кровопотери в родах, то колебания концентраций гормонов в значительно более узком интервале в течение полового цикла успешно сглаживаются резервными возможностями гомеостаза. Очевидно, что отлично сбалансированная система гемостаза, являющаяся залогом выживаемости организма, успешно справляется с эндокринным штормом.
Следует отметить, что роль компонентов ГП зависит от цели применения. Если это контрацептив, то контрацептивной активностью в паре обладает гестаген, а эстроген выполняет вспомогательную функцию — контроль менструального цикла. Если препарат предназначен для МГТ, основная нагрузка ложится на эстроген, а прогестин необходим только при наличии матки для профилактики гиперплазии эндометрия. В качестве основного эстрогенного компонента в КОК используют ЭЭ — эстроген с медленным метаболизмом, а в средствах МГТ — либо сам Е2, либо Е1 (эстрон, его эфиры).
Эстрогенный компонент ГП действует по геномному и негеномному механизмам, так же, как эндогенные стероидные гормоны. В геномном механизме эстроген связывается со своими ядерными рецепторами (ER) — ERα и ERβ [14]. Плотность ERβ в гепатоцитах (основном месте синтеза коагуляционных белков) ниже, чем ERα. Гормон-рецепторный комплекс проходит ряд согласованных этапов, которые включают фосфорилирование, гомодимеризацию и конформационные изменения, после чего транслоцируется в ядро, где мобилизует регуляторные кофакторы для формирования большой транскрипционной машины и транскрипции зависимых генов.
Зависимые гены — те, в промоторной/регуляторной области которых имеется эстроген-чувствительный элемент (ERE). Далее с мРНК транслируется белок, в нашем случае синтезированные белки могут быть вовлечены в коагуляцию, антикоагуляцию или фибринолиз. Функциональные EREs имеются у генов ряда факторов свертывания [15]. Зависимыми от эстрогенов оказались факторы свертывания крови II, V, VII, IX, X, XI и XII; белок S, белок Z и гепарин-кофактор II. Эстрогены влияют на синтез и других протеинов — в том числе SHBG, кортикостероид-связывающего глобулина, транскортина и ангиотензиногена, а также нескольких маркеров воспаления.
ЭЭ повышает в плазме уровни прокоагулянтных факторов — VIIa и фибриногена, снижает активность всех трех механизмов антикоагуляции. Усиление коагуляции не зависит от пути введения препарата, но напрямую зависит от дозы ЭЭ. Однако это приводит лишь к незначительным изменениям баланса в свертывающей системе крови [3]. Прием внутрь ГП, содержащих конъюгированный лошадиный эстроген, комбинированных или чисто эстрогенных, сопряжен с более высоким риском ВТЭ, чем локальное применение препаратов, содержащих Е2. Более высокие дозы эстрогена также ассоциированы с более высоким риском ВТЭ [16]. Замена ЭЭ на Е2 или его эфир может уменьшать, но не отменяет стимуляцию коагуляции [17]. Эстетрол (E4) — эстроген плода, полученный из E3, исследуется в комбинации с мощными антигонадотропными прогестинами [18]. Об объективных эффективности и безопасности применения такой комбинации в популяции говорить пока рано.
ДЕЙСТВИЕ АНДРОГЕНОВ НА ПАРАМЕТРЫ КОАГУЛЯЦИИ
Существуют доказательства того, что тестостерон (Те) оказывает благотворное влияние на сердечно-сосудистую систему: он действует как сосудорасширяющее средство, тормозит развитие атеромы и положительно влияет на сердечную мышцу [19]. Кроме того, Те в физиологических концентрациях может потенцировать антикоагулянтную активность за счет стимуляции экспрессии TFPI и тканевого активатора плазминогена (TPAP), а также ингибирования PAI-1 (активатора ингибитора типа 1 плазминогена), секретируемого эндотелием. Однако в клинике уровни половых гормонов у мужчин не связаны с риском ВТЭ [20]. У женщин уровень эндогенного андрогена значительно ниже, чем у мужчин, а защита сердечно-сосудистой системы обеспечивается эстрогенами. Тем не менее и у женщин пери- и постменопаузального возраста концентрации эндогенного Tе не связаны с риском ВТЭ [21]. Экзогенный Те также не влиял на параметры коагуляции у женщин.
ВЛИЯНИЕ ГЕСТАГЕНОВ НА ПАРАМЕТРЫ КОАГУЛЯЦИИ
Первые прогестины, синтезированные в 1960-х годах, были структурно связаны с Те (левоноргестрел — самый андрогенный из прогестинов) [22]. Чтобы улучшить профиль безопасности гормональной терапии, в 1970-х годах были синтезированы прогестины с менее андрогенными свойствами, такие как дезогестрел, гестоден и норгестимат, и их комбинацию с ЭЭ в более низких дозах назвали КОК III поколения. Позже разработаны прогестины, полученные из 19-норпрогестерона или из спиронолактона. Производные 19-норпрогестерона проявляют более высокую специфичность к рецепторам прогестерона (RP) и мало влияют на другие стероидные рецепторы, не вызывают андрогенные побочные эффекты [22].
Прогестины действуют через собственные мембранные и ядерные PR (A и B). Интересно, что в печени человека значительно больше рецепторов андрогенов, чем эстрогенов и прогестерона [23]. При этом в печени андрогены имеют тенденцию противодействовать эффектам эстрогенов на синтезы белков.
М.А. Blanco-Molina и соавт. [24] обнаружили, что прогестины в монорежиме (ципротерон, ацетат мегестрола, левоноргестрел, ацетат норэтистерона) не оказывают неблагоприятное влияние на коагуляцию в целом (не действуют на уровни фибриногена, факторов II, V, VII, VIII и IX, антитромбина III, на время свертывания, время частичной активации протромбина, агрегацию тромбоцитов, концентрации плазминогена, α2-микроглобулина, α1-антитрипсина или фибринолитическую активность). Более того, дезогестрел и левоноргестрел снижают уровни фактора VII, 1 + 2 фрагментов протромбина с возможным уменьшением прокоагулянтной активности! В то же время при использовании гестагенов в высоких дозах (например, в онкологии) наблюдается активация системы гемостаза.
Более 20 лет назад на основании эпидемиологических данных выдвинута гипотеза о влиянии прогестина на гемостатические параметры, которые, очевидно, зависят от типа и дозы стероида, сопутствующего эффекта эстрогена, пути введения и продолжительности использования [2]. Позже появились публикации, где гестагены рассматриваются уже как независимые факторы риска развития ВТЭ наряду с эстрогенами и комбинированными препаратами [25].
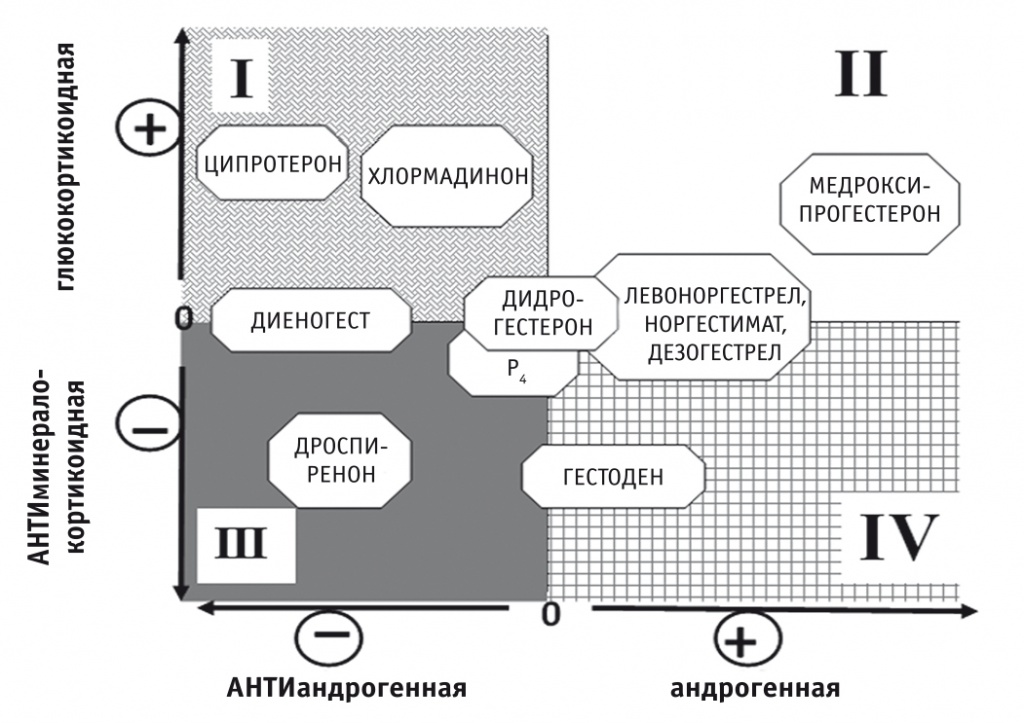
Противоречивые данные о влиянии гестагенов на гемостаз переключили внимание исследователей на тот факт, что сама группа гестагенов крайне разнообразна. Особенность функционирования PR, являющихся по сути лиганд-активируемыми транскрипционными факторами, регулирующими транскрипцию зависимых генов, заключается в том, что гестаген кроме собственного рецептора может связываться и влиять на работу «родственных» рецепторов — андрогенного, глюкокортикоидного и минералокортикоидного, оказывая агонистическое или антагонистическое действие [26]. Перечисленные свойства могут отражаться на эффектах прогестина на коагуляцию. Химическая модификация стероидной молекулы позволила получить гестагены со смешанной активностью — андрогенной/антиандрогенной, глюкокортикоидной/антиминералокортикоидной (рис. 1) [27].
Рис. 1. Дополнительная активность синтетических гестагенов [27].
Примечание: в I квадранте находятся гестагены с дополнительной глюкокортикоидной и антиандрогенной активностями, во II — с глюкокортикоидной и андрогенной, в III — с антиандрогенной и антиминералокортикоидной, в IV — с андрогенной и антиминералокортикоидной
Система контроля свертываемости крови имеет много уровней защиты, и любое значимое фармакологическое вмешательство в систему вызывает сдвиг активности контрлатеральных механизмов (усиливается тромбоз — в ответ активируется тромболизис). ГП потенцируют снижение уровней природных антикоагулянтов (активированного протеина С, антитромбина) и увеличение содержания прокоагулянтов (тромбина). На такую фармакологическую агрессию свертывающая система крови отвечает стимуляцией фибринолиза (снижением концентрации фибриногена и PAI-1) [28]. Различия в составе, пути введения, дозе и продолжительности ГТ могут влиять на риск ВТЭ [4].
Насколько серьезно применение препарата воздействует на гемостаз пациентки, можно судить только по результатам клинических (эпидемиологических) исследований. Однако результаты таких исследований оказываются часто недостоверными по причине объективных вмешательств как со стороны пациенток (собственные факторы риска — возраст, вес, метаболический профиль, физическая активность, комплаентность, наследуемые формы коагуло- и тромбопатий и др.), так и со стороны препаратов (тип, доза, путь введения).
Анализ влияния эффектов разных гестагенов на гемостаз позволил выявить некоторые закономерности. В частности, гестагены III–IV поколения (III — гестоден, дезогестрел, норгестимат, IV (новые) — дросперинон) оказались более тромбогенными по сравнению с препаратами ранних поколений (левоноргестрел) [29]. В то же время сам прогестерон и его производное дидрогестерон, как выяснилось, наиболее безопасны в отношении тромботического риска [30]. Очевидные различия эффектов гестагенных компонентов ГП на гемостаз могут объясняться дополнительными активностями стероидов — влиянием на андрогенные, минералокортикоидные и глюкокортикоидные рецепторы.
Прогестины с глюкокортикоидной активностью. Активация гестагеном глюкокортикоидных рецепторов повышает уровень тромбина [31]. Клиническое значение глюкокортикоидный эффект имеет при довольно высоких дозах гестагена, и только у медроксипрогестерона ацетата обнаружена значимая глюкокортикоидная активность [32].
Прогестины с андрогенной активностью. Андрогенные прогестины дозозависимо тормозят эстроген-индуцированное снижение концентраций TFPI, активированного белка C и рост уровня фактора VIIa (рис. 2). При этом они не влияют на эстроген-индуцированное увеличение концентрации фибриногена и уменьшение уровня антитромбина III [33]. Следовательно, андрогенные прогестины в большей степени, чем другие прогестины, нивелируют индуцированную эстрогеном активацию системы свертывания, при этом состояние коагуляционной готовности остается повышенным.
Рис. 2. Схема влияния эстрогенного и гестагенного компонентов комбинированного гормонального препарата на факторы свертывания крови.
Примечание. Сплошные стрелки: фиолетовые — активация экспрессии факторов, красные — антикоагулянтные эндогенные механизмы. Пунктирные стрелки: блокада гестагеном отрицательных эффектов эстрогена на гемостаз
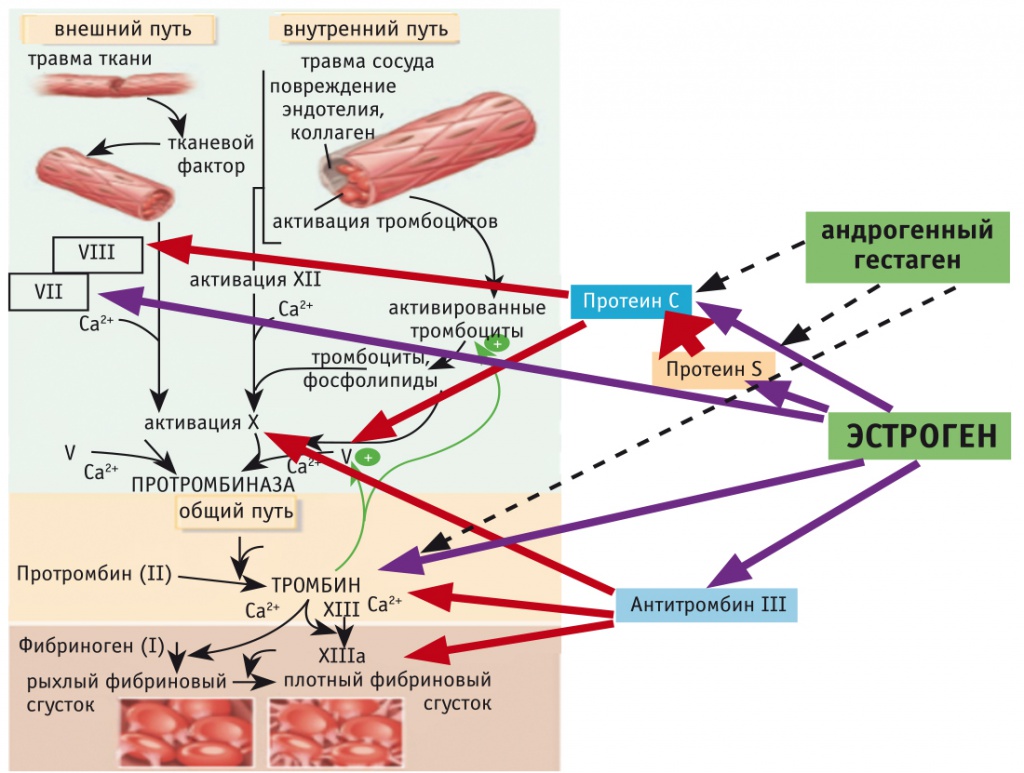
Наиболее мощными андрогенными прогестинами являются норэтистерон и левоноргестрел. Гестоден немного слабее, чем левоноргестрел. Активная форма дезогестрела 3-кето-дезогестрел слабее, чем левоноргестрел или гестоден.
Увеличение уровня SHBG в крови является маркерным эффектом эстрогена в печени и связано с большей резистентностью активированного протеина С и риском ВТЭ [1]. Соответственно, комбинация ЭЭ с норгестиматом менее андрогенна, чем комбинация с левоноргестрелом, и ее использование может быть связано с высоким риском ВТЭ. Однако мнение экспертов, что время свертывания и резистентность АП-C являются прогностическими для ВТЭ, не является общепринятым [34].
Антиандрогенные прогестины, такие как хлормадинона ацетат, номегестрола ацетат, ципротерон, диеногест и дроспиренон [3], не предупреждают ЭЭ-индуцированную гиперкоагуляцию. Антиандрогенные свойства дроспиренона и диеногеста потенциально полезны женщинам с гиперандрогенемией. Антиандрогенные прогестины в комбинации с Е2 оказывают минимальное влияние на липидный профиль и углеводный обмен, что теоретически может снизить риск развития артериальных осложнений [35].
Прогестины с антиминералокортикоидной активностью. Активация ренин-ангиотензин-альдостероновой системы (РААС) усиливает свертывание крови. Помимо самого прогестерона, норэтистерон, гестоден и дроспиренон обладают антиминералокортикоидными свойствами. Дроспиренон имеет больший аффинитет к минералокортикоидному рецептору, чем сам альдостерон, и проявляет ощутимый антиминералокортикоидный эффект in vivо. Следовательно, он может противодействовать стимуляции коагуляции, вызванной активацией РААС. Дроспиренон в отсутствие эстрогена уменьшает активность коагуляции — снижает уровни фактора VII и D-димера [36]. Однако в комбинации с эстрогеном он повышает риск ВТЭ [37]. В перекрестном исследовании у здоровых женщин репродуктивного возраста применение внутрь дроспиренона/20 мкг ЭЭ в течение 6 месяцев вызвало значимое изменение протромбинового и частично активированного тромбопластинового времени, уровней фибриногена, белка S и D-димеров в сторону гиперкоагуляции [29].
Дроспиренон влияет еще на один важный компонент свертывания крови — агрегацию эритроцитов. Анализ воздействия двух доз КОК — 3 мг дроспиренона/20 мкг ЭЭ и 3 мкг дроспиренона/30 мкг ЭЭ — на вязкость/упругость сгустков цельной крови, а также на биофизические и биохимические характеристики эритроцитов показал, что по данным тромбоэластографии изученные ГП дозозависимо стимулируют коагуляцию. Световая микроскопия и сканирующая электронная микроскопия выявили изменения формы эритроцитов, вызванные повреждением мембраны. SEM-анализ обнаружил спонтанную активацию фибрина и тромбоцитов у пациенток, принимающих КОК, а также активацию взаимодействия между эритроцитами и тромбоцитами и/или фибрином. Общий анализ уровня тромбоза показал рост активации тромбоцитов и низкий уровень тромболизиса в обеих группах КОК по сравнению с контрольной группой. Следовательно, комбинация дроспиренона и ЭЭ влияет на биофизические и биохимические свойства эритроцитов, вызывая переход гемостаза в протромботическое состояние. Хотя выявленные эффекты в основном являются субклиническими, долгосрочные эффекты и риски, связанные с использованием этих гормонов, должны тщательно рассматриваться для каждой женщины [38].
В 2009 году были опубликованы первые данные о более высоком риске развития ВТЭ на фоне применения препаратов КОК и МГТ с дроспиреноном по сравнению с таковым при использовании левоноргестрел-содержащих препаратов. По взвешенным оценкам, у примерно 10 000 молодых европейских женщин ежегодно диагностируют ВТЭ из-за применения ГП высокого риска (с гестагенами III или IV поколения) вместо безопасных препаратов КОК II поколения. В Дании удалось перевести пациенток на более безопасную контрацепцию, и в настоящее время наблюдается значительное снижение уровня заболеваемости у небеременных женщин репродуктивного возраста [37]. Аналогичное снижение частоты легочной эмболии отмечено во Франции при переходе пациенток на КОК с низким риском тромбофилии.
Сбалансированные гестагены без значимой дополнительной активности. К этим препаратам относят сам прогестерон (микронизированную лекарственную форму) и дидрогестерон, которые оказались наиболее безопасными в отношении тромботического риска. В 2016 году в Великобритании опубликованы данные о том, что использование эстрадиола/дидрогестерона (месяцы — годы) у пациенток менопаузального возраста не повышает риск инфаркта миокарда, ишемического инсульта и ВТЭ по сравнению с другими типами МГТ [30]. Последние публикации, анализирующие безопасность ГП, свидетельствуют о том, что не увеличивает риск тромботических осложнений комбинация эстрадиола с дидрогестероном [16].
Недавнее проспективное исследование [39] стандартной и сверхнизкодозовой МГТ — 1 мг Е2/5 мг дидрогестерона (Фемостон конти) и 0,5 мг Е2/2,5 мг дидрогестерона (Фемостон мини) — не выявило ни у одной из женщин ВТЭ или серьезные осложнения в течение 12 месяцев. Однако найдена дозовая зависимость влияния на фибринолиз. На фоне стандартной ГТ снижен потенциал фибринолиза (концентрации антитромбина, PAI-1 и антител к PAI-1), тогда как при использовании ультранизкодозированной МГТ у пациенток не наблюдается снижение концентрации антитромбина.
В данном исследовании не обнаружено влияние МГТ на уровень фибриногена (его рост — независимый фактор риска ВТЭ), однако в ранних работах отмечено как снижение [40], так и повышение его концентрации [41] на фоне МГТ.
Комбинации эстрогена с дидрогестероном влияют на кардиоваскулярные события не только прямым, но и опосредованным путем — через изменение работы генов провоспалительных цитокинов. Стандартная (2/10), низко- (1/10) и ультранизкодозированная (0,5/2,5) МГТ с дидрогестероном снижает уровни провоспалительных цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, ФНО-α и ИФН-γ в бронхоальвеолярной лаважной жидкости и сыворотке крови пациенток [42].
Применение Е2/дидрогестерона от нескольких месяцев до нескольких лет не связано с повышением рисков сердечно-сосудистых событий [43]. Ни циклическая, ни непрерывная схема приема Е2/дидрогестерона не были сопряжены со статистически значимым повышением риска ВТЭ. Более того, при применении МГТ с дидрогестероном у пациенток 65–79 лет и/или с избыточной массой тела отмечен наименьший шанс риска развития ВТЭ в сравнении с таковым при приеме других гестагенов.
Важным вопросом при обсуждении негативного действия ГП на гемостаз является обратимость эффекта после прекращения приема. Проспективное рандомизированное исследование использования КОК с 30 мкг ЭЭ и дезогестрелом или гестоденом в течение 6 месяцев показало, что плазменные концентрации фактора X и фибриногена увеличились, а уровень антитромбина III снизился. Через 2–6 недель после прекращения приема препарата наблюдали рикошетное увеличение концентрации антитромбина III и снижение таковой фибриногена в плазме. Далее в течение 8 недель концентрация фактора X постепенно возвратилась к начальным значениям [44]. Следовательно, необходимо прекратить ГТ как минимум за 4 недели до хирургической операции.
Нахождение баланса между риском ВТЭ и артериальных событий должно быть частью индивидуальной стратегии назначения гормонального средства. В некоторых случаях, например у женщин с тромбофилией, такой выбор прост [8], но в других случаях он менее очевиден. Тучные и пожилые женщины подвержены повышенному риску как ВТЭ, так и артериальных заболеваний [45]. Так как влияние на метаболизм липидов (атеросклероз) является длительным, а действие на риск на ВТЭ — быстрым, выбор может быть сделан на основе риска ВТЭ на момент назначения и вероятной продолжительности (краткосрочной или долгосрочной) использования ГП. Необходимы дополнительные исследования с разными когортами пациенток.
Слишком мало исследований посвящено лекарственным средствам с Е2. Эффект Е2-содержащих ГП на ВТЭ, по-видимому, аналогичен эффекту ЭЭ/левоноргестрела. Тем не менее неизвестно, оказывают ли они в долгосрочной перспективе влияние на артериальное давление и другие параметры. Какими бы ни были результаты, предположение, что только одно лекарственное средство окажется самым безопасным для всех женщин, представляется слишком упрощенным.
Следует надеяться, что в дальнейшем будет получена более исчерпывающая информация о безопасности новых комбинаций в отношении венозных и артериальных событий.
ЗАКЛЮЧЕНИЕ
Гормональные препараты (ГП) широко используются в качестве безопасного и эффективного средства регулирования рождаемости и для коррекции перименопаузальных расстройств. Медицинские критерии приемлемости ВОЗ и Centers for Disease Control and Prevention помогают врачу надлежащим образом выбрать лучшую гормональную композицию для каждой женщины в соответствии с ее возрастом и дополнительными факторами риска [46].
В целом ГП потенцируют тромбофилию у пациенток, влияя на коагуляцию и фибринолиз. При этом наблюдается снижение уровней природных антикоагулянтов и увеличение уровней прокоагулянтов. Различия в составе, пути введения, дозе и продолжительности гормональной терапии (ГТ) могут влиять на риск венозной тромбоэмболии (ВТЭ) [4]. Один из способов повышения ее безопасности — выбор пути введения лекарственного средства, позволяющий миновать портальную систему и избежать пресистемного метаболизма и избыточного влияния препаратов на функцию печени [47]. Вполне логично, что пероральное, но не трансдермальное введение ГП повышает уровни прокоагулянтных факторов в плазме крови, так как только при приеме препаратов внутрь стероиды попадают в печень — основное место синтеза прокоагулянтных белков. Кроме того, эффект стероидов на коагуляцию и фибринолиз зависит от дозы.
Прием эстрогена в высокой дозе является фактором риска развития ВТЭ. Хотя большинство прогестинов в форме монотерапии не вызывают изменения уровней факторов свертывания, роль прогестина в ГП связана с его способностью препятствовать или модулировать нежелательные воздействия эстрогена на коагуляцию и фибринолиз. Андрогенные прогестины потенциально противодействуют влиянию этинилэстрадиола на коагуляцию, тогда как гестагены с антиандрогенной или антиминералокортикоидной активностью могут усугубить отрицательное влияние эстрогена на частоту венозных осложнений. При этом действие гестагенов на артериальные осложнения носит противоположный характер.
Поэтому безопасность комбинированных ГП можно повысить использованием комбинаций эстрогенов с прогестинами, более близкими к прогестерону (дидрогестерон) с минимальными дополнительными эффектами. Теоретически этот вариант может обеспечить более благоприятный метаболический профиль с меньшей стимуляцией синтеза прокоагулянтов в печени.
Кроме того, в отличие от стандартной менопаузальной ГТ, сверхнизкодозовая ГТ (Е2 и дидрогестерон, 12 месяцев) положительно влияет на гемостаз за счет усиления фибринолиза. Таким образом, сбалансированные гестагены — прогестерон и дидрогестерон — оказались наиболее безопасными в отношении тромботического риска.







