ВВЕДЕНИЕ
Рак яичников (РЯ) является вторым по частоте гинекологическим злокачественным новообразованием и занимает пятое место среди причин смерти в Европе. Более чем в 60% случаев заболевание диагностируется на III–IV стадии, когда в процесс вовлекаются органы брюшной полости, малого таза или ретроперитонеальные лимфоузлы, что обусловливает летальность на первом году с момента установления диагноза, равную 33%, и общую 5-летнюю выживаемость не выше 35–40%[1].
В большинстве случаев злокачественного течения эпителиальных опухолей яичников, на которые приходится до 90% всех опухолей яичников, диссеминация происходит путем эксфолиации опухолевых клеток с поверхности пораженной яичниковой ткани с током внутрибрюшинной жидкости и поражением париетальной и висцеральной брюшины[2, 3].
В связи с преобладанием интраперитонеального пути распространения над гематогенным и лимфогенным в многочисленных теоретических исследованиях внутрибрюшинное введение лекарств рассматривалось как стратегия лечения РЯ. В исследованиях подчеркивались такие фармакологические преимущества интраперитонеальной доставки химиопрепаратов перед внутривенной, как улучшенный доступ к опухолевым клеткам, более длительный период полувыведения, повышенная интенсивность дозы, медленный клиренс в брюшной полости и достижение достаточного уровня системного воздействия[4, 5]. Однако, несмотря на то что интраперитонеальное введение повысило процент выживаемости пациенток, оно не получило широкого распространения в качестве стандарта лечения по причине вероятной токсичности, сложной логистики и высокой стоимости[6].
Гипертермическая интраперитонеальная химиотерапия (hyperthermic intraperitoneal chemoperfusion, HIPEC) — это метод интраоперационной интраперитонеальной доставки лекарственных агентов, который может устранить некоторые проблемы, связанные со стандартной интраперитонеальной терапией. Тем не менее вопросы эффективности, безопасности HIPEC, обоснованности стоимости и критерии отбора пациенток со злокачественными эпителиальными опухолями яичников остаются спорными[7].
HIPEC заметно отличается от послеоперационной интраперитонеальной химиотерапии тем, что это однократное введение цитостатических препаратов во время циторедуктивной операции. Такой подход был изучен при лечении пациентов с другими злокачественными новообразованиями, включая псевдомиксому брюшины, мезотелиому, а также злокачественные опухоли червеобразного отростка, желудка, ободочной и прямой кишки[8, 9].
HIPEC обладает следующими преимуществами:
- послеоперационные спайки не мешают проникновению лекарственного препарата;
- во время операции внутрибрюшная химиотерапия проводится в соответствии со строго стандартизированными правилами, и хирург может оптимально распределять химиопрепарат и осуществлять контроль времени выполнения манипуляции;
- гипертермия увеличивает цитотоксический эффект многих химиотерапевтических агентов.
Точные цитотоксические механизмы, связанные с супранормальными температурами, в настоящий момент не изучены до конца. В первоначальных исследованиях показано, что температуры в диапазоне 42–45°C в течение 10–60 минут вызывают летальное повреждение опухолевых клеток. Токсичные эффекты включают изменения в клеточной мембране и ядре, денатурацию белка. Кроме того, гипертермия повышает чувствительность к химиотерапевтическим агентам, в частности к цисплатину, как в чувствительных, так и в устойчивых к платине клеточных линиях.
Поскольку количество недавно опубликованных рандомизированных исследований, посвященных HIPEC и РЯ, критично мало, в настоящее время окончательно определить какие-либо преимущества в отношении выживания, связанные с этим подходом, нельзя. Систематический обзор демонстрирует неоднородность критериев включения, режимов приема лекарств, методик процедуры и методов сообщения о выживаемости[10].
Так, в 2015 году опрос 34 различных французских коллективов выявил отсутствие единообразия в методике HIPEC, несмотря на то что многие участники являлись работниками экспертных учреждений и сами обучали членов других команд. Различались подходы к выполнению гипертермической химиоперфузии (открытые или закрытые), используемое оборудование, защитные механизмы и процесс обучения[11].
Стандарт первичного лечения распространенного РЯ — первичная циторедуктивная операция, затем последующая адъювантная химиотерапия на основе платины или неоадъювантная химиотерапия с последующим интервальным циторедуктивным хирургическим вмешательством. Хотя большинство пациенток с помощью этой схемы лечения достигают первоначальной клинической ремиссии, существует необходимость в ее усовершенствовании, поскольку у подавляющего числа больных впоследствии развивается рецидив заболевания.
Выбор II линии лечения зависит от времени возникновения рецидива после окончания I линии химиотерапии, от режима I линии, общего состояния больной (с учетом тяжести сопутствующих заболеваний). Интервал времени, исчисляемый с момента окончания I линии химиотерапии до регистрации рецидива заболевания (бесплатиновый интервал, интервал без лечения), при условии регулярного обследования в период ремиссии предопределяет чувствительность к производным платины.
Однако терапия рецидивов РЯ остается одним из наиболее спорных разделов онкогинекологии. Тактические вопросы: кого, как и когда лечить — пока не решены.
В ряде исследований изучалась роль HIPEC в лечении пациенток с рецидивом РЯ. Основные параметры сравнения — результаты лечения трех групп больных: получавших HIPEC во время вторичной циторедуктивной операции, подвергшихся циторедукции с последующей химиотерапией и проходящих только системную химиотерапию без хирургического вмешательства.
В исследовании 2012 года, выполненном А. Fagotti и соавт., проведен сравнительный анализ лечения чувствительных к платине больных с рецидивирующим РЯ, которым производили циторедуктивную операцию и HIPEC на основе оксалиплатина, и пациенток с сопоставимыми клиническими и патологическими характеристиками, которые в тот же период подверглись только хирургическому вмешательству и системной химиотерапии[12].
Авторы отмечают, что у женщин, перенесших HIPEC, не было задержки с началом адъювантной химиотерапии, у 35% пациенток наблюдалась приемлемая токсичность, связанная с HIPEC. Кроме того, в течение 2 лет у всех участниц контрольной группы произошел повторный рецидив, тогда как в группе лечения HIPEC повторный рецидив развился лишь у двух третей пациенток. В экспериментальной группе зафиксированы более длительные беспрогрессивные периоды, и у 53% этих женщин после рецидива наблюдалась более длительная клиническая ремиссия, чем в контрольной группе.
В аналогичном исследовании 2013 года, проведенном во Франции, сравнивались пациентки с первым платино-чувствительным рецидивом, которым произвели HIPEC и циторедукцию, с больными, которые не получали HIPEC, но перенесли циторедуктивную операцию. Все женщины получали системную химиотерапию до вторичного циторедуктивного вмешательства +/– HIPEC.
Было зафиксировано значимое улучшение выживаемости: 75%-ная 4-летняя выживаемость в экспериментальной группе по сравнению с 19%-ной в контрольной. Авторы пришли к выводу, что HIPEC эффективнее при более ранних рецидивах, причем наибольшую пользу она принесла пациенткам, безрецидивный интервал у которых составил менее 2 лет[13].
J. Spiliotis и соавт. опубликовали первое рандомизированное исследование, освещавшее лечение рецидивов РЯ с применением HIPEC[14]. Они рандомизировали 120 женщин с рецидивирующим заболеванием, перенесших циторедуктивные операции с или без HIPEC. Авторы исследовали как чувствительные к платине (цисплатину и паклитакселу) рецидивы, так и платинорезистентные (резистентные к схеме доксорубицин/паклитаксел) формы. Всех пациенток оперировали врачи одной хирургической бригады. Общая выживаемость в группе HIPEC была значительно длиннее, чем в контрольной (26,7 против 13,4 месяца). Как и ожидалось, самая высокая общая выживаемость наблюдалась у участниц исследования после полной циторедукции и HIPEC.
В настоящее время в мире проводится 10 рандомизированных исследований II и III фазы, оценивающих как первичный, так и рецидивирующий РЯ. Эти исследования, безусловно, предоставят более полную информацию о перспективах HIPEC в лечении РЯ.
Цель данного исследования: анализ собственных результатов лечения больных рецидивирующим РЯ с использованием HIPEC.
МАТЕРИАЛЫ И МЕТОДЫ
В ходе проведенного исследования проанализированы результаты лечения двух групп больных, получавших его на базе онкогинекологического отделения ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России.
Группа I (экспериментальная) — 92 пациентки с первым рецидивом РЯ, которые в период с августа 2006 года по октябрь 2013 года получали комбинированное лечение, включавшее повторную HIPEC с последующими циклами химиотерапии. У всех участниц после повторных вмешательств проведена HIPEC с цисплатином в дозе 100 мг/м2.
Группа II (контрольная) — 80 больных с выявленным первым рецидивом РЯ, которые после циторедуктивных вмешательств подверглись системной химиотерапии.
Подробная характеристика пациенток представлена в таблице 1.
Таблица 1
Характеристика пациенток с рецидивами рака яичников
Для установления степени распространения процесса проведены стандартные клинико-диагностические мероприятия: эхографическое обследование, спиральная КТ органов грудной и брюшной полости, ядерно-магнитная томография малого таза, эндоскопическое обследование желудка и толстой кишки.
Ведение больных в послеоперационном периоде вне зависимости от объема хирургического лечения осуществлялось в соответствии с принятым в клинике ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России единым протоколом.
С целью оценки влияния проводимого лечения на качество жизни больные заполняли русскоязычные версии опросников Европейской организации по исследованию и лечению рака (European Organization for Research and Treatment Cancer, EORTC): общего опросника EQ-5D и специального опросника EORTC QLQ-C30. Каждая из анкет была разделена на функциональную и симптоматическую шкалы, показатели измерялись в баллах. При оценке функционального статуса большее количество баллов соответствовало лучшему качеству жизни, в симптоматической шкале — наоборот. В первый раз анкеты пациентки заполняли за сутки до операции, далее на 3-и, 7-е и 30-е сутки после нее. Все данные, полученные при заполнении опросников, проанализированы в соответствии с рекомендациями для обработки данных EORTC Group.
Циторедукция обеспечивалась выполнением повторного хирургического вмешательства с использованием продольного срединного разреза (до мечевидного отростка), дающего возможность полного обзора брюшной полости и широкий доступ к ней. Во время повторных чревосечений после ревизии операция производилась в том объеме, какой технически оказывался возможным с учетом необходимости выполнения максимально полного циторедуктивного вмешательства.
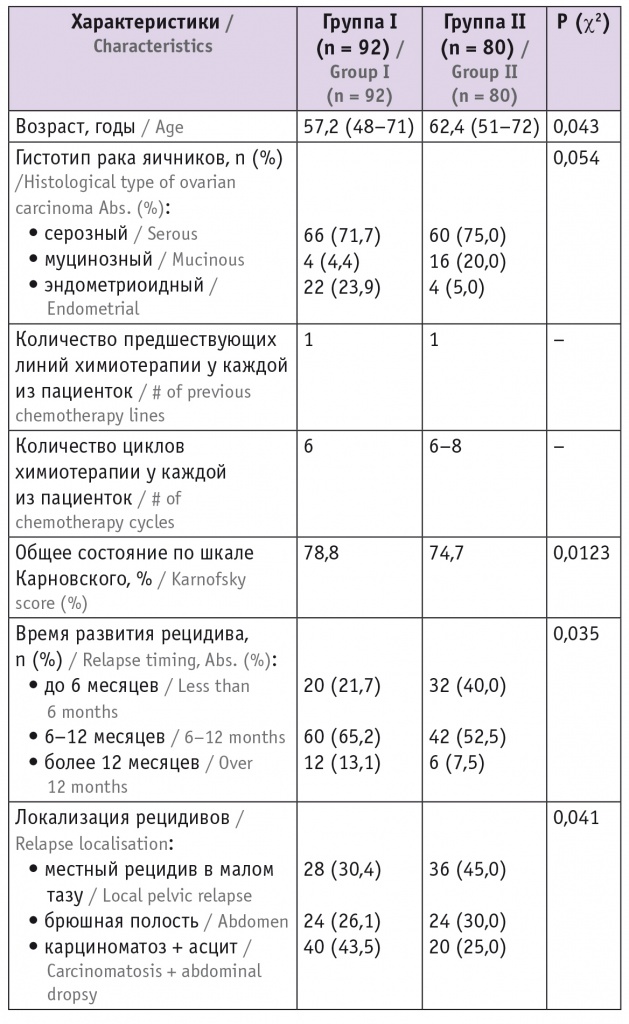
Завершающим этапом являлась установка дренажей (ирригаторов), представляющих собой одноканальные поливинилхлоридные трубки длинной 60 см и диаметром 16 мм с пятью отверстиями диаметром 0,5 см для притока и оттока цитостатика. Два ирригатора устанавливали в зоне малого таза, два — в брюшной полости по боковым флангам, их направляли навстречу друг другу для усиления непосредственного воздействия химиопрепарата на зону наиболее вероятного возникновения рецидива заболевания, а также для обеспечения движения перфузата и равномерного распределения его в брюшной полости и малом тазу (рис. 1, 2).
Рис. 1. Схема установки дренажей
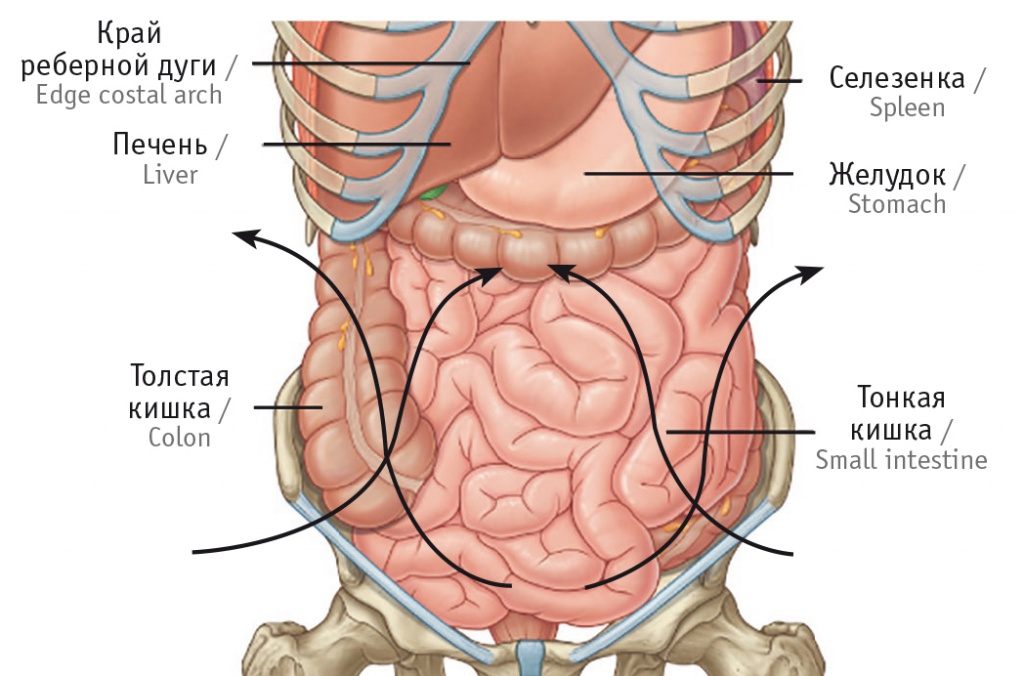
Рис. 2. Вид лапаротомной раны с установленными дренажами. Здесь и далее фотографии авторов
Перфузия производилась по закрытой методике посредством роликового перфузионного насоса с объемной скоростью 600–1200 мл/мин по сформированному временному контуру 4000 мл 0,9%-ного изотонического раствора хлорида натрия с высокой концентрацией цитостатиков: цисплатина (100 мг/м2) или доксорубицина (25 мг/м2) — в условиях гипертермии (42–43 °С). Поддержание нужного температурного режима осуществлялось при помощи термостата (термобаня серии LOIP LB-200) (рис. 3, 4).
Рис. 3. Термобаня серии LOIP LB-200

Рис. 4. Перфузионный насос

Последующая системная химиотерапия в группах сравнения назначалась в зависимости от времени развития рецидива: в случае платиночувствительных рецидивов проводилась платиносодержащая химиотерапия (карбоплатин (AUC 5–6) и паклитаксел (175 мг/м2) с интервалом в 21 день), при платинорезистентных рецидивах заболевания в качестве I линии терапии использовались следующие препараты: гемцитабин 1000 мг/м2 (введение в 1-й и 8-й дни) с интервалом в 21 день; топотекан 1,5 мг/м2 (введение с 1-го по 5-й день) с интервалом в 21 день.
Статистическая значимость различий между показателями в сравниваемых группах оценивалась по критериям χ2 и Стьюдента. Изучали отдаленные результаты лечения: время до прогрессирования и общую продолжительность жизни, которую вычисляли от начала лечения по методу Каплана — Мейера с момента постановки диагноза.
РЕЗУЛЬТАТЫ
Средняя продолжительность оперативных вмешательств составила 376,8 ± 6,4 минуты. При этом минимальное время операции — 210 минут, максимальное — 610 минут.
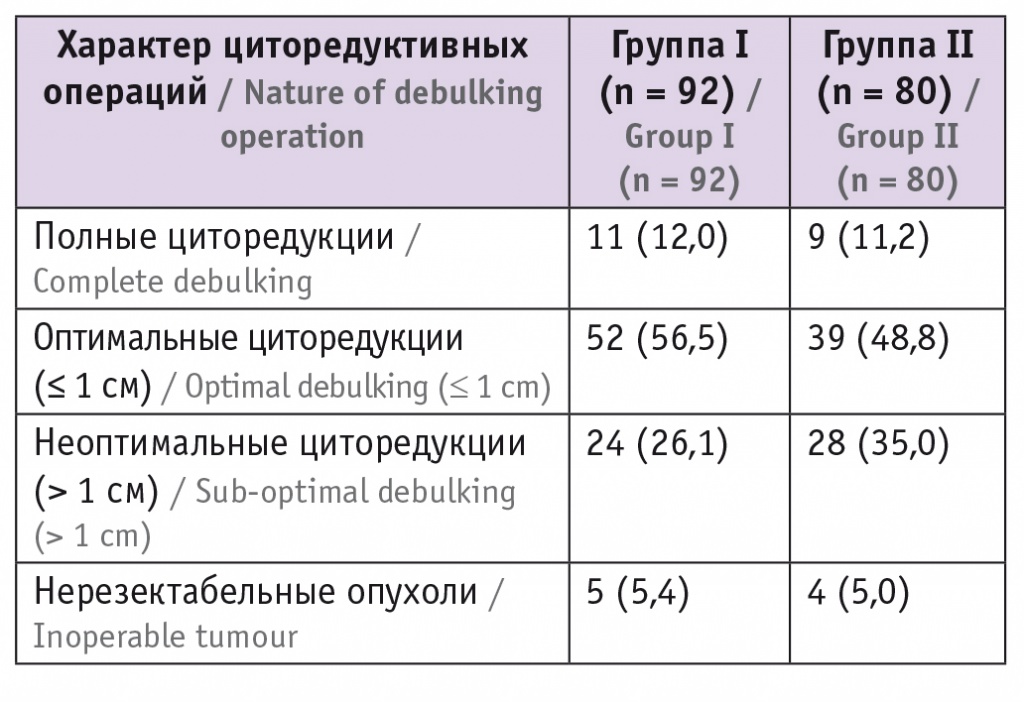
Средний объем интраоперационной кровопотери (один из косвенных показателей травматичности операции) в группе HIPEC составил 820,5 ± 80 мл, минимальный — 550 мл, максимальный — 1500 мл, что было сопоставимо с показателями контрольной группы. Проведенные вмешательства носили расширенный и агрессивный характер, включали удаление рецидивных узлов, резекцию различных отделов толстой кишки у 50 (29,1%) пациенток с формированием толстокишечных анастомозов, а у 12 (7,0%) — с формированием колостом, экстирпацию культи шейки матки, краевую резекцию мочевого пузыря и селективную парааортальную лимфаденэктомию (табл. 2).
Таблица 2
Объем хирургических вмешательств при рецидивах рака яичников, n (%)
Интраоперационных осложнений, повлекших за собой тяжелые расстройства функций организма, не было. Единственным осложнением, с которым мы столкнулись у некоторых больных в ходе выполнения интраперитонеальной химиоперфузии, стало повышение внутрибрюшного давления вследствие нарушения оттока перфузионного раствора по отводящему зонду, что легко купировалось сменой положения больной, изменением объемной скорости перфузии или сменой направления потока в отводящих и приводящих дренажах.
Следует отметить, что интраоперационно не умерла ни одна больная.
Проявления нефротоксичности (табл. 3), характерные при применении цисплатина, в виде повышения уровня креатинина и мочевины на 2–7-е сутки выявлены у 34,8% больных в экспериментальной группе, они носили транзиторный характер со снижением показателей на фоне инфузионной терапии с форсированием диуреза.
Таблица 3
Послеоперационные осложнения, n (%)
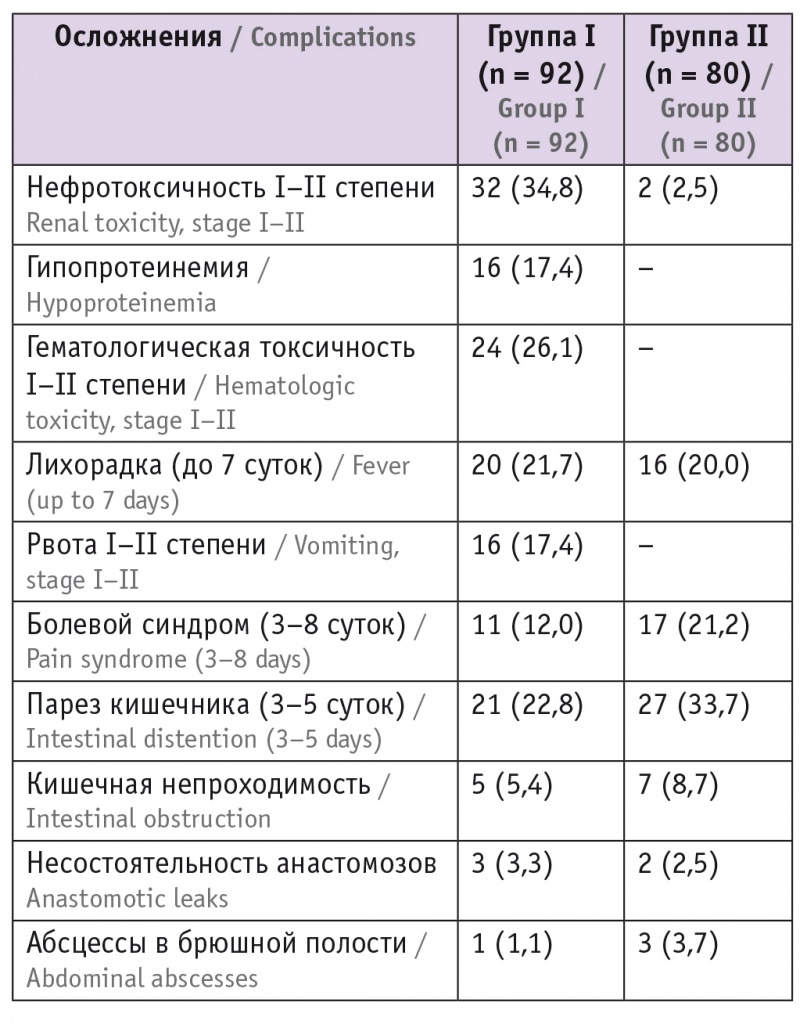
Ни в одном случае не потребовалось применение средств, стимулирующих гемопоэз факторов, так как показатели крови самостоятельно возвращались в границы нормы через 12–16 суток.
Рвота, как самостоятельная, так и сопровождавшая парез кишечника, связанная с эметогенным действием цисплатина, зафиксирована у 16 (17,4%) пациенток основной группы, тогда как в контрольной группе это осложнение отсутствовало. Следует отметить, что токсичность не превышала II степень, но у 4 больных рвота сохранялась более 5 суток, была тягостной и значительно ухудшала самочувствие в раннем послеоперационном периоде.
Специфической чертой раннего послеоперационного периода у больных c эметогенной реакцией на цисплатин являлся длительный (более 2–3 суток) парез кишечника, что нехарактерно для пациенток после обычных циторедуктивных операций. Дополнительные факторы, влияющие на темп восстановления функции кишечника: объем резекции полых органов и обширная лимфодиссекция забрюшинного пространства.
В большинстве случаев явления пареза были разрешены консервативной терапией. Кишечная непроходимость зафиксирована у 5 (5,4%) пациенток в экспериментальной группе и у 7 (8,7%) в контрольной, что стало причиной повторных хирургических вмешательств.
Анализ интервалов времени между операцией и началом системной химиотерапии не выявил значимого различия в группах сравнения и составил от 28 до 43 дней.
В начале наблюдения (3-и и 7-е сутки) показатели качества жизни (по опроснику EORTC QLQ-C30) снизились до среднего значения 77,34 ± 0,67 балла. Отмечались увеличение общей слабости, ограничение в выполнении повседневных дел и значительных физических нагрузок, выраженность болевого синдрома. К 30-м суткам эти показатели качества жизни возвращались к исходным значениям. В то же время зафиксировано нарастание показателей тревоги/депрессии по общему опроснику EQ-5D именно к 30-м суткам наблюдения, что может быть связано с серьезными переживаниями пациенток по поводу своей дальнейшей судьбы.
Поскольку в обеих группах начальные этапы лечения совпадали, мы посчитали целесообразным сравнивать не первичный эффект лечения, а его отсроченные результаты.
Среднее время до прогрессирования процесса непосредственно зависело от объема циторедукции. После неоптимальной циторедукции в экспериментальной группе оно составило 1,4 месяца (n = 29), в контрольной группе — 2,1 месяца (n = 48) (р = 0,67); после оптимальной — 22,1 месяца (n = 63) и 4,3 месяца (n = 32) соответственно (р < 0,05). Наилучший результат наблюдался у 16 пациенток, которые после оптимальной циторедукции с интраперитонеальной гипертермической химиоперфузией и платиносодержащей химиотерапии находятся в клинической ремиссии более 32 месяцев.
Кроме того, следует отметить купирование изнуряющего асцита у 34 больных после выполнения гипертермической химиоперфузии.
Анализ общей пятилетней выживаемости (рис. 5) показал, что в экспериментальной группе при оптимальной циторедукции она достигала 20,5%, в то время как в контрольной группе не превышала 4,3% (p < 0,05).
Рис. 5. Пятилетняя выживаемость больных после циторедуктивной операции
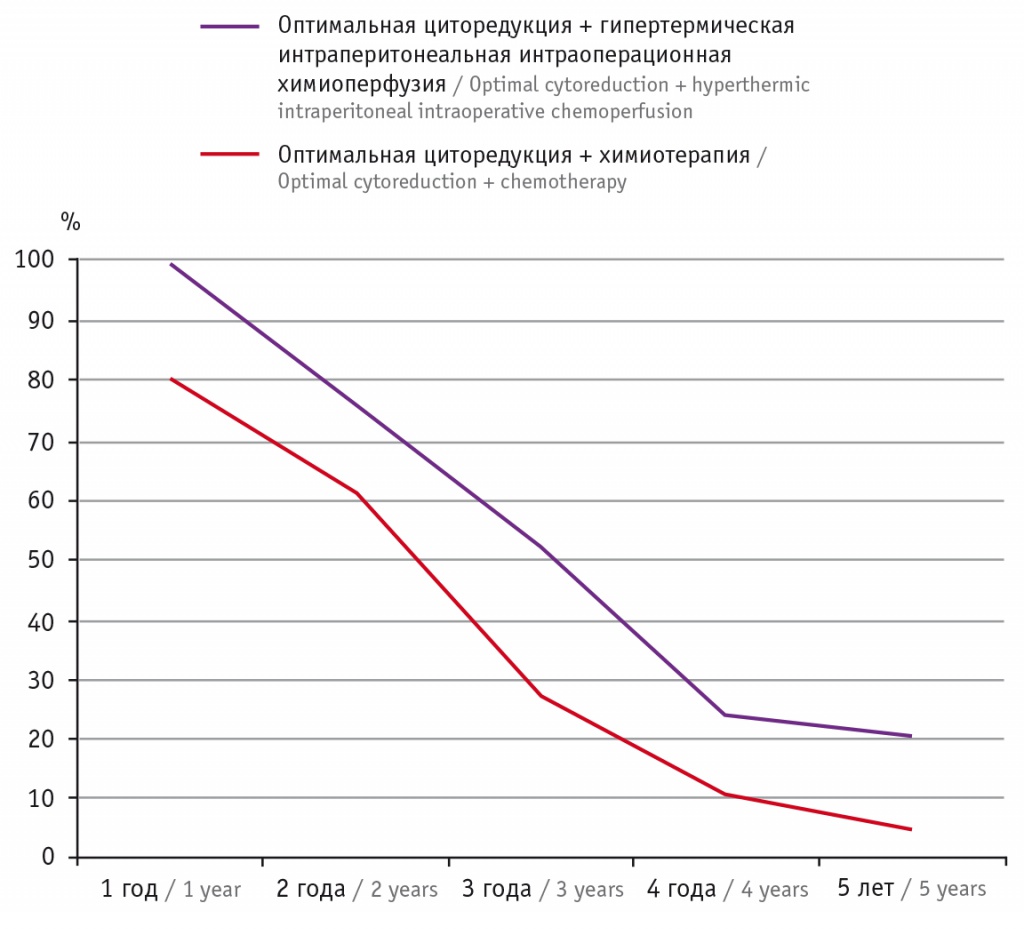
После неоптимальной циторедукции результаты оставались одинаково неудовлетворительными.
ОБСУЖДЕНИЕ
Несмотря на огромные успехи в лечении РЯ, наблюдается высокая частота рецидивирования этого заболевания. Значит, существует настоятельная необходимость совершенствовать методы его лечения. В статье представлены результаты комбинированного лечения больных с первым рецидивом РЯ, в которое была включена HIPEC.
Обращает на себя внимание, что в целом методика является вполне воспроизводимой и технически выполнимой.
Проведение гипертермической химиоперфузии безопасно для пациенток: различия в частоте послеоперационных осложнений, нежелательных явлений, а также в связанных с состоянием здоровья показателях качества жизни между группами были незначительны.
Анализ полученных нами результатов позволяет сказать, что HIPEC увеличивает беспрогрессивную и общую выживаемость больных с рецидивирующим РЯ, но только при выполнении оптимальных циторедуктивных вмешательств.
ЗАКЛЮЧЕНИЕ
Вероятно, гипертермическая интраперитонеальная химиоперфузия при хирургической циторедукции со временем станет применяться в качестве обычной терапии первичного и/или рецидивирующего рака яичников. Несмотря на то что данный подход к лечению этих злокачественных новообразований исследован не до конца, есть основания считать его рациональным, пока не будут получены данные рандомизированных контролируемых исследований.
Поступила: 20.12.2019
Принята к публикации: 23.12.2019







