Врачи анестезиологи-реаниматологи чаще других специалистов сталкиваются с проблемами антикоагулянтной терапии. Прежде всего это обусловлено чрезвычайно широким спектром ситуаций, требующих применения антикоагулянтов (АК). В него входят профилактика венозных тромбоэмболических осложнений (ВТЭО) у хирургических больных после плановых и экстренных оперативных вмешательств; применение АК при ОКС, после операций на органах сердечно-сосудистой системы и для предотвращения тромбирования стентов различной локализации; поддержание достаточного уровня антикоагуляции при использовании экстракорпоральных методов детоксикации и заместительной почечной терапии; лечение синдрома диссеминированного внутрисосудистого свертывания крови и т. д. [3, 4].
В последнее время приобрела актуальность проблема приема пациентами АК по поводу сопутствующей патологии (например, фибрилляции предсердий (ФП) или имплантации искусственного клапана сердца) до поступления в стационар. Врачам приходится проводить лечение с учетом изменений в системе гемостаза, возникающих под влиянием антикоагулянтной терапии. Поэтому анестезиолог-реаниматолог должен хорошо разбираться в современных АК и знать особенности схем их назначения. Кроме того, постоянно возникает необходимость замены препаратов в протоколах антикоагулянтной терапии в связи с изменением клинической ситуации.
До недавнего времени анестезиологам-реаниматологам приходилось в основном назначать парентерально прямые АК — нефракционированный гепарин (НФГ), низкомолекулярные гепарины (НМГ) и фондапаринукс натрия. Небольшое число пациентов принимали непрямые АК — антагонисты витамина К (АВК), которые перед операцией заменяли на НФГ или НМГ. Однако сегодня арсенал клиницистов значительно расширился, так как появились АК для перорального приема: прямой ингибитор тромбина дабигатрана этексилат (Прадакса), а также прямые ингибиторы активированного фактора Х ривароксабан (Ксарелто) и апиксабан (Эликвис). Для обозначения этих препаратов в литературе используется устоявшийся термин «новые оральные антикоагулянты» (НОАК) [1, 4].
В Российской Федерации зарегистрированы следующие показания для назначения этих лекарственных средств: профилактика инсульта и системной тромбоэмболии у пациентов с неклапанной ФП; профилактика венозной тромбоэмболии (ВТЭ) после планового эндопротезирования тазобедренного или коленного сустава; лечение тромбоза глубоких вен (ТГВ), ТЭЛА и профилактика их рецидивов. Для ривароксабана дополнительно регламентировано использование в целях предупреждения смерти вследствие сердечно-сосудистых причин и инфаркта миокарда у пациентов после ОКС, протекавшего с повышением уровня кардиоспецифических ферментов.
Основные публикации посвящены сравнению эффективности и безопасности НОАК и варфарина — лекарственного средства из группы АВК [5, 6, 20, 24]. Чем же не устраивает клиницистов варфарин, почему ведутся поиски новых подходов к профилактике и лечению тромбоэмболических осложнений?
В литературе подробно изложены основные недостатки варфарина: медленное начало действия; узкое «терапевтическое окно»; индивидуальная вариабельность ответа на лечение; необходимость в регулярном мониторинге уровня антикоагуляции (контроле МНО) и в коррекции дозы. Значения МНО должны находиться в терапевтическом диапазоне не менее 60% времени, в противном случае возрастает риск тромбоэмболических осложнений и кровотечений [11]. Установлено, что при сочетанном приеме варфарина с рядом лекарственных средств (антибиотиками, статинами, антисекреторными препаратами и др.) его действие может снижаться или потенцироваться.
НОАК демонстрируют следующие преимущества: быстрое развитие антикоагуляционного эффекта с минимальной вариабельностью при приеме внутрь; широкое «терапевтическое окно»; отсутствие потребности в регулярном мониторинге уровня антикоагуляции; низкий риск взаимодействия с другими лекарственными средствами и пищей; снижение концентрации препаратов наступает вскоре после их отмены. Как отмечено ранее, дабигатрана этексилат относится к прямым ингибиторам тромбина, а ривароксабан и апиксабан уменьшают образование тромбина путем блокирования фактора Ха. Безусловно, между препаратами НОАК существуют определенные различия, основные фармакокинетические свойства НОАК суммированы в таблице 1. Чаще всего НОАК назначаются пациентам с ФП для профилактики инсультов и системных тромбоэмболий.
Таблица 1
Фармакокинетические свойства новых оральных антикоагулянтов*
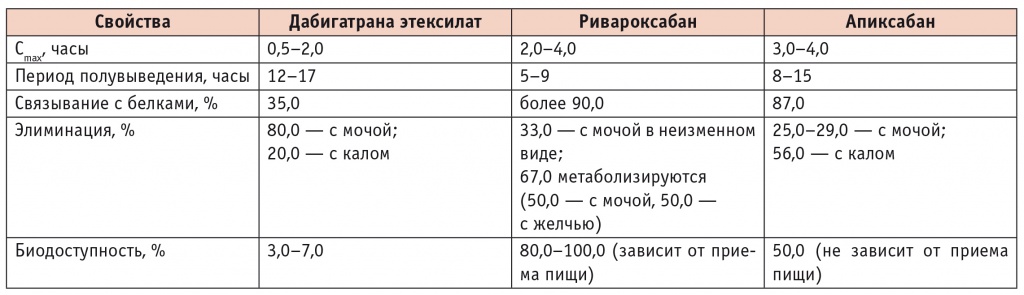
* Более подробную информацию см. в инструкциях по медицинскому применению лекарственных препаратов Ксарелто, Прадакса, Эликвис.
В общей популяции населения Российской Федерации количество пациентов, получающих НОАК с целью профилактики тромботических осложнений, постоянно увеличивается [2]. Соответственно в хирургические клиники все чаще госпитализируются пациенты, принимающие новые АК в связи с терапевтической патологией.
На сегодняшний день в хирургических стационарах чаще всего НОАК используют для профилактики ВТЭ после протезирования крупных суставов. Обычно АК назначают через 4-24 часа после операции, длительность курса зависит от наличия факторов риска и составляет от 10 до 14 дней у пациентов, перенесших эндопротезирование коленного сустава, от 32 до 38 дней — после операций на тазобедренном суставе.
Настоящей революцией стало использование НОАК для лечения ВТЭО, к которым относятся ТГВ, подкожный тромбофлебит и ТЭЛА. При применении дабигатрана этексилата требуется предшествующее парентеральное введение АК в течение 5 дней, что связано с особенностями его фармакокинетики. Терапия же ривароксабаном и апиксабаном начинается сразу после установления диагноза.
Вместе с тем появление рекомендаций по лечению ТГВ и ТЭЛА посредством НОАК было настороженно встречено анестезиологами-реаниматологами и хирургами. В первую очередь это обусловливалось формой выпуска НОАК: большинство специалистов были консервативно настроены в отношении возможности лечения острых состояний таблетированными лекарственными средствами; при этом аргументы о скорости всасывания в ЖКТ, биодоступности и эффективности не оказывали должного воздействия. Лечение ТГВ и ТЭЛА традиционно начинается с парентерального введения гепарина. Одной из причин этого является устоявшаяся практика снабжения отделений реанимации лекарственными средствами: во многих лечебных учреждениях считают, что таблетки в хирургической реанимации не нужны. Однако данные заблуждения преодолеваются.
Максимальный эффект НОАК отмечается примерно через 2 часа после приема внутрь первой дозы, поэтому стало возможно начинать лечение ТГВ и ТЭЛА с таблетированных лекарственных форм, отказавшись от первоначального парентерального введения АК.
Публикации, доказывающие эффективность НОАК для лечения ТГВ и ТЭЛА, призваны изменить отношение анестезиологов-реаниматологов к этой проблеме. Среди НОАК особо выделяется апиксабан, для которого изучен короткий (7 дней) курс лечения острого периода и особая доза для каждого периода ведения пациента. Наиболее демонстративны два исследования — AMPLIFY и AMPLIFY-EXT [6, 7]. В исследовании AMPLIFY у 5395 пациентов с ВТЭО (ТГВ и ТЭЛА) изучали эффективность и безопасность апиксабана. Двойным слепым методом всех пациентов рандомизировали в две группы. Больным первой группы назначали апиксабан per os по 10 мг 2 раза в день в течение 7 дней, далее — по 5 мг 2 раза в день в течение 6 месяцев. Пациентам второй группы вводили эноксапарин подкожно по 1 мг/кг 2 раза в день в течение по крайней мере 5 дней до достижения МНО более 2,0 и далее варфарин per os в течение 6 месяцев (целевое МНО — 2,0-3,0). Первичная конечная точка — развитие повторных ВТЭО (ТГВ или нефатальной ТЭЛА), смерть, связанная с ВТЭО, — регистрировалась в первой группе у 59 из 2609 пациентов (2,3%), а во второй — у 71 из 2635 больных (2,7%) (ОР = 0,84; 95%-й ДИ: 0,60-1,18; p > 0,001 для гипотезы о неменьшей эффективности апиксабана). Большие кровотечения наблюдались у 0,6% пациентов при приеме апиксабана и у 1,8% больных, получавших стандартную терапию (ОР = 0,31; 95%-й ДИ: 0,17-0,55; p > 0,001 для гипотезы о большей безопасности апиксабана). Авторы делают вывод, что лечение ВТЭО посредством монотерапии апиксабаном не менее эффективно, чем комбинированное лечение с применением НМГ и варфарина; при этом при изолированном применении апиксабана статистически значимо реже регистрируются большие и клинически значимые небольшие кровотечения [6].
Авторы исследования AMPLIFY дополнительно провели субанализ рисков рецидива ВТЭО и возникновения кровотечений в первые три месяца от начала терапии — на 7-й, 21-й и 90-й день лечения. Применение апиксабана не отличалось по эффективности от комбинированного использования эноксапарина и варфарина на всех этапах исследования, однако монотерапия апиксабаном имела явные преимущества в отношении риска возникновения кровотечений с самого начала лечения [27].
Было установлено также, что в группе апиксабана исследования AMPLIFY статистически значимо реже встречались случаи реадмиссии, а длительность госпитализации была меньше [24]. Обнадеживающие результаты были получены в подгруппе онкологических больных вышеприведенного исследования — как с диагностированными злокачественными заболеваниями в момент исследования (169 пациентов из 5395), так и с указаниями на онкологическую патологию в анамнезе (365 пациентов из 5395). В обоих случаях число повторных ВТЭО и кровотечений при использовании апиксабана было статистически значимо ниже [8].
В исследовании AMPLIFY-EXT изучались эффективность и безопасность различных доз апиксабана в сравнении с плацебо у пациентов, завершивших 12-месячный курс лечения по поводу ВТЭО. Из 2482 обследованных больных 836 участвовали в исследовании AMPLIFY. Пациентов рандомизировали в группы апиксабана, где препарат назначали 2 раза в день в дозах 2,5 мг и 5 мг, и плацебо; длительность наблюдения составила 12 месяцев. У больных, получавших апиксабан, показатель эффективности (повторные ВТЭО или смерть от ВТЭО) составил 1,7%, при этом не было различий в зависимости от дозы, а при назначении плацебо — 8,8% (p < 0,001 для гипотезы о большей эффективности апиксабана). Результаты терапии апиксабаном не зависели от возраста, пола, ИМТ и состояния функции почек. Большие кровотечения при назначении 2,5 мг апиксабана диагностировали у 0,2% пациентов, при приеме 5 мг — у 0,1%, а в группе плацебо — у 0,5% больных. Число клинически значимых небольших кровотечений по группам также не различалось. Эти результаты позволили авторам сделать вывод, что назначение как 2,5 мг, так и 5 мг апиксабана эффективно предотвращает рецидив ВТЭО без увеличения риска геморрагических осложнений [7]. Важным, на наш взгляд, является и то, что в группах апиксабана в процессе исследования реже возникала потребность в госпитализации пациентов в стационар, чем при приеме плацебо [25].
В повседневной практике врачи сталкиваются с нерафинированными ситуациями, при которых у них возникает целый ряд вопросов по применению НОАК (например, связанных с лабораторным контролем, изменением схем антикоагулянтной терапии, передозировкой, периоперационным ведением больных). Попытаемся акцентировать внимание на проблемах повседневного использования НОАК.
Возможности лабораторной оценки новых оральных антикоагулянтов. У пациентов, принимающих НОАК согласно инструкции, не требуется проведения рутинного лабораторного контроля. При назначении дабигатрана этексилата установлена прямая корреляция между его концентрацией в плазме и выраженностью антикоагуляционного эффекта. Действие его основано на прямом ингибировании тромбина, поэтому возможен контроль по величине тромбинового времени [28]. При приеме ривароксабана и апиксабана отмечено индивидуальное увеличение хронометрических коагулологических тестов, таких как время свертывания, протромбиновое время и активированное частичное тромбопластиновое время. Однако из-за вариабельности реактивов воспроизводимость тестов в различных лабораториях низка, поэтому они не рекомендованы для оценки терапевтического эффекта препаратов [12]. Антикоагуляционное действие ривароксабана и апиксабана при необходимости можно оценить с помощью определения анти-Xa-активности, которая имеет прямую линейную зависимость от концентрации препарата в плазме [13, 16, 29]. Лабораторное определение анти-Xa-активности (методом хромогенного анализа ингибирования фактора Ха) может потребоваться у пациентов с предполагаемыми инвазивными процедурами, в том числе хирургическими операциями, и при подозрении на передозировку.
Назначение новых оральных антикоагулянтов при изменении схем антикоагулянтной терапии. При необходимости замены одного АК на другой, к примеру при невозможности принимать лекарственные средства per os, переход с НОАК на НМГ и обратно трудностей обычно не вызывает благодаря схожести их фармакокинетических характеристик.
При переходе с варфарина на НОАК последние назначают при снижении МНО до 2,0, что обычно наблюдается через 72 часа после отмены АВК. Обратная замена НОАК на варфарин ассоциируется с увеличением риска тромботических осложнений, поэтому не менее 48 часов применяют оба препарата, ставя целью превышение МНО уровня 2,0. Осуществляя смену этих АК, необходимо помнить, что прием НОАК в ряде случаев приводит к увеличению МНО, поэтому перед очередным приемом АК анализы обычно повторяют.
Тактика ведения больных при возникновении кровотечений во время приема новых оральных антикоагулянтов. Назначение НОАК иногда осложняется возникновением кровотечений, не всегда связанных с их действием. Тактика ведения таких пациентов ориентирована на остановку кровотечения и выяснение причинно-следственной взаимосвязи с назначением препаратов. Учитывая сроки полувыведения НОАК, стоит ожидать восстановления свертывающей способности крови в течение суток. При возникновении кровотечения необходимо выяснить, сколько длится терапия НОАК, когда был прием последней дозы, назначались ли другие препараты, влияющие на гемостаз. Обязательно учитываются факторы, оказывающие влияние на концентрацию препарата в крови (прием лекарственных средств, служащих субстратом Р-гликопротеина, ингибиторов CYP3A4), наличие заболеваний почек и печени. Скорость элиминации дабигатрана этексилата зависит от функции почек, поэтому при возникновении кровотечения на фоне его приема целесообразно проводить стимуляцию диуреза. Добиться ускорения элиминации дабигатрана этексилата можно также с помощью гемодиализа, однако опыт его применения ограничен [30].
При незначительных кровотечениях достаточно использовать местный гемостаз (механическое прижатие) и перенести прием следующей дозы НОАК. В случаях возникновения массивного кровотечения проводят общепринятые в случае кровопотери мероприятия, и прием НОАК прекращается. Восполнение объема циркулирующей крови, а при необходимости и коррекция анемии проводятся по общим принципам лечения кровопотери. При кровотечениях из слизистых оболочек положительный эффект может быть достигнут назначением транексамовой кислоты — 15 мг/кг внутривенно болюсно, далее по 1 мг/кг/ч до купирования кровотечения. Введение препаратов протромбинового комплекса (в РФ имеется Протромплекс 600) изучалось на добровольцах [14]. Однако нет доказательств их влияния на исход кровотечения. Аналогичная ситуация наблюдается и при применении при жизнеугрожающих кровотечениях рекомбинантного фактора VIIa (НовоСэвен). Авторы подчеркивают, что при его использовании повышается риск развития тромбоза [21].
Периоперационное ведение больных, принимающих новые оральные антикоагулянты. При анализе популяции больных, принимающих НОАК, установлено, что у 25% пациентов в течение года возникает потребность в проведении инвазивных процедур или оперативных вмешательств [9]. Вместе с тем многие врачи не осведомлены в достаточной мере о риске возникновения кровотечений при приеме НОАК и тактике ведения больных при появлении осложнений [15].
У пациентов без выраженных нарушений метаболизма период полувыведения НОАК составляет 10-17 часов. При подготовке к плановым операциям или инвазивным процедурам необходимо взвешивать риск кровотечений, связанных с вмешательством, и риск тромбоза, связанный с прекращением антикоагулянтной терапии, индивидуально у каждого пациента.
Различные медицинские сообщества предлагают схожие рекомендации по ведению больных, получающих НОАК, в периоперационном периоде [10, 18, 19]. В случаях, когда хирургическая операция не сопровождается клинически значимым риском развития кровотечения и/или имеется возможность механической остановки кровотечения, например при выполнении большинства стоматологических вмешательств, отмена НОАК не требуется (табл. 2). Целесообразно проводить операцию через 12-24 ч после приема препаратов, т. е. в момент минимальной концентрации НОАК в крови. Антикоагулянтная терапия возобновляется через 6 часов после окончания операции.
Таблица 2
Классификация плановых хирургических вмешательств в зависимости от риска развития кровотечения [18]

* Вмешательство проводится в момент наименьшей концентрации новых оральных антикоагулянтов в крови, т. е. через 12 или 24 часа после последнего приема.
Перед выполнением операции с низким риском развития кровотечения рекомендуется прекратить прием НОАК за 24 часа до планового оперативного вмешательства (табл. 2, 3). У больных с нарушением функции почек может потребоваться более ранняя отмена препаратов (табл. 3). Если предстоит операция с высоким риском кровотечения, то время между отменой НОАК и операцией необходимо увеличивать (табл. 2, 3). При сочетанном назначении НОАК с антиагрегантами время подготовки к хирургическому вмешательству увеличивается на 12 часов.
Таблица 3
Возможные сроки отмены новых оральных антикоагулянтов до начала хирургического вмешательства у больных с низким и высоким риском кровотечений [18]
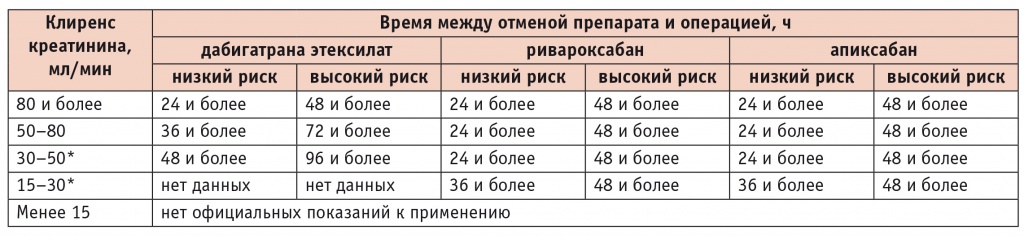
* Часть больных с таким клиренсом креатинина может получать антикоагулянты в более низких дозировках: дабигатрана этексилат ― 110 мг 2 раза в сутки; ривароксабан ― 15 мг 1 раз в сутки; апиксабан ― 2,5 мг 2 раза в сутки.
При полном гемостазе во время операции прием НОАК возобновляют в течение 6-8 часов. Однако если у хирургов нет уверенности в эффективном гемостазе, прием НОАК осуществляется через 24-48 часов. В целом при возобновлении антикоагулянтной терапии в течение первых 48 часов после операции необходимо соблюдать осторожность.
При высоком риске послеоперационных тромботических осложнений и риске кровотечения НОАК применяют в сниженной дозе. Если после операции пероральный прием препаратов невозможен, то на этот период назначают подкожное введение НМГ («мост-терапию»). Аналогичный подход оправдан у больных, получающих варфарин, когда прием антикоагулянта прекращают за 5 дней до операции. После возобновления лечения варфарином снова требуется около 5 дней для достижения целевых уровней МНО. Профилактика тромботических осложнений в этот период обычно достигается с помощью «мост-терапии» на основе НМГ.
При необходимости выполнения хирургических вмешательств по срочным и экстренным показаниям НОАК отменяют. Операцию по возможности откладывают на 12-24 часа. В работе G. Penod и соавт. предпринята попытка установить взаимосвязь между концентрацией НОАК в крови и риском кровотечения. Авторы считают, что при содержании НОАК в крови ниже 30 нг/мл риск кровотечения минимален и возможно проведение оперативного вмешательства. При уровне НОАК 30-200 мг/мл высока вероятность кровотечения и требуется отложить операцию на 12 часов с последующим повторным анализом содержания АК, а при концентрации 200-400 нг/мл — на 24 часа. Концентрация дабигатрана этексилата, превышающая 400 нг/мл, является показанием для проведения гемодиализа [26]. Несмотря на противоречивость данных, в случаях жизнеугрожающих кровотечений во время операции рекомендуют переливание препаратов протромбинового комплекса в дозе 25-50 Ед/кг [15].
Опыт использования НОАК при нейроаксиальной анестезии и люмбальной пункции ограничен, поэтому при выполнении этих вмешательств необходимо соблюдать особую осторожность. Из-за риска развития осложнений требуется полное восстановление свертывающей способности крови после прекращения действия АК. Мнения исследователей очень противоречивы. В рекомендациях Европейского общества аритмологов имеется положение о нежелательности проведения нейроаксиальных блокад на фоне приема НОАК [18]. В других работах допускается использование регионарных методов анестезии у пациентов, принимающих НОАК. Так, K. Waurick и соавт. рекомендуют отменять дабигатрана этексилат за 56-85 часов, ривароксабан — за 44-65 часов, а апиксабан — за 40-75 часов до выполнения эпидуральной анестезии. Эпидуральный катетер должен быть удален по меньшей мере за 5-7 часов до возобновления применения НОАК. При высоком риске развития тромботических осложнений возможно проведение «мост-терапии» НМГ [31]. После нетравматичной спинальной пункции назначение НОАК возможно через 4-8 часов после окончания операции. Если же выполнение спинномозговой анестезии сопровождалось техническими трудностями, то назначение НОАК нужно отложить на 24 часа [22].
Перед врачом и пациентом всегда стоит вопрос о наиболее эффективном и безопасном препарате. Прямых исследований по сравнению эффективности и безопасности в группе НОАК между препаратами не проводилось. Предпринимаются попытки сравнить эффективность различных НОАК и частоту побочных эффектов на основании разных источников. В связи с этим представляются интересными данные, полученные N. Kang и D. M. Sobieraj [20]. Был проведен литературный поиск рандомизированных исследований, в которых изучалась терапия ВТЭО препаратами из группы НОАК: дабигатрана этексилатом, ривароксабаном, апиксабаном. Изучение качества отобранных исследований проводилось на основании Кохрановского метода оценки риска ошибки. Авторы провели скорректированный непрямой сравнительный метаанализ оценки эффективности и безопасности применения НОАК. Вид НОАК значимо не влиял на риск смертельного исхода, частоту повторных ТГВ и ТЭЛА. Назначение дабигатрана этексилата сопровождалось увеличением риска возникновения большого кровотечения по сравнению с апиксабаном (ОР = 2,69, 95%-й ДИ: 1,19-6,07 и ОР = 2,74, 95%-й ДИ: 1,4-5,39 соответственно). В результате были сделаны выводы об одинаковой эффективности различных НОАК у больных с ВТЭО и большей безопасности апиксабана.
Главным недостатком НОАК при сопоставлении с варфарином является их высокая стоимость. На первый взгляд, действительно цена месячного курса терапии варфарином значительно ниже, чем НОАК. Однако при детальном рассмотрении установлена экономическая эффективность лечения НОАК пациентов с ФП за счет снижения числа госпитализаций, возникновения осложнений и затрат на лабораторный контроль МНО [17]. При этом высказывается точка зрения о преимуществах апиксабана по соотношению «эффективность/цена» [23].
Анестезиологам-реаниматологам все чаще приходится сталкиваться с лекарственными средства из группы НОАК. В стационары поступает все больше пациентов, принимающих НОАК в плановом порядке по поводу сопутствующей патологии. Профилактика ВТЭО у больных после операций на крупных суставах чаще всего осуществляется НОАК. Кроме того, установлена эффективность и безопасность НОАК для лечения и профилактики ТГВ и ТЭЛА. При этом доказанными являются возможность монотерапии и меньшее число геморрагических осложнений. Применение НОАК позволяет намного упростить лечение ТГВ и ТЭЛА за счет отказа от парентерального введения АК и использования фиксированной дозы препарата без рутинного лабораторного контроля. Меньшее число геморрагических осложнений при длительном приеме препаратов позволяет добиться экономического эффекта вследствие уменьшения частоты госпитализации. Публикации, посвященные НОАК, свидетельствуют о большей безопасности апиксабана в отношении риска кровотечений, также имеются данные о его преимуществах по соотношению «эффективность/цена». В рамках одной публикации невозможно дать рекомендации на все случаи жизни. Выбор конкретного препарата для профилактики и лечения ВТЭО у хирургических больных, безусловно, осуществляет клиницист, ориентируясь на индивидуальные особенности пациента, сопутствующую патологию, экстренность оперативного вмешательства, тяжесть течения послеоперационного периода, возможности медикаментозного обеспечения. Активное обсуждение оптимального использования АК на страницах журналов, конференциях, мастер-классах позволит донести до врачей всех специальностей основные достижения противотромботической терапии. Кроме того, важна выработка преемственности в назначении АК различными специалистами. Единые подходы терапевтов, кардиологов, хирургов, анестезиологов-реаниматологов к проведению антикоагулянтной терапии позволят безопасно «преодолеть» оперативные вмешательства и пребывание в отделениях реанимации при возникновении жизнеугрожающих хирургических заболеваний.







