Считается, что причина таких противоречивых результатов исследований при МС заключается в том, что основной критерий МС — абдоминальное ожирение, определенное по окружности талии, — далеко не всегда отражает наличие висцерального ожирения, а иногда указывает только на подкожное ожирение в зоне измерения. При этом могут отсутствовать провоспалительная и проатерогенная нейрогормональная активность висцеральной жировой ткани (ВЖТ) и связанные с ней сердечнососудистые риски.
Важным направлением в современной кардиологии является поиск факторов риска (ФР), связывающих ожирение, МС и коронарный атеросклероз, с целью своевременного выявления групп высокого риска и назначения профилактических мер.
Современные рекомендации по лечению пациентов с ИБС в качестве препаратов второго ряда рассматривают метаболические цитопротекторы, защищающие клетки миокарда от гибели в период ишемии [6, 7]. Большое число проведенных исследований и метаанализов показывает, что миокардиальный цитопротектор триметазидин оказывает выраженное антиангинальное действие и улучшает качество жизни больных со стенокардией напряжения [8–10]. В настоящее время нет данных по эффективности применения новой формы триметазидина — Предуктала ОД 80 мг — у пациентов со стабильной стенокардией напряжения на фоне МС.
Цель исследования: изучить ФР коронарного атеросклероза у мужчин с МС и оценить эффективность новой формы триметазидина у пациентов со стабильной стенокардией напряжения на фоне МС.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 170 мужчин, поступивших в Алтайский краевой кардиологический диспансер в 2017 г. с неуточненным болевым синдромом в грудной клетке с целью верификации диагноза стенокардии. В исследование включали только больных с ранее диагностированной гипертонической болезнью I–II стадии, абдоминальным ожирением и хотя бы еще одним из других дополнительных критериев МС (Всероссийское научное общество кардиологов, 2009). Всем пациентам проводилась велоэргометрия (ВЭМ) и при положительном тесте — коронароангиография (КАГ), а при отрицательном — мультиспиральная КТ КА (МСКТ КА).
Таким образом, в исследование были включены 82 мужчины с МС в возрасте 39–73 лет (в среднем — 56,42 ± 7,3 года). Группу 1 (n = 40) составили пациенты с МС, клиническими признаками стенокардии напряжения II–III функционального класса (ФК) и коронарным атеросклерозом по данным КАГ, группу 2 (n = 42) — больные с МС, не имеющие клинических проявлений стенокардии напряжения и признаков коронарного атеросклероза по данным МСКТ КА.
Поскольку на фоне назначенной антиангинальной терапии у пациентов группы 1 сохранялись приступы стенокардии, было принято решение провести дополнительный анализ и оценить антиангинальную эффективность триметазидина (препарат Предуктал ОД 80 мг), в связи с чем пациенты группы 1 методом случайной выборки были разделены на две подгруппы: подгруппа ОД+ (n = 20) — получавшие данный препарат утром, подгруппа ОД– (n = 20) — пациенты, его не принимавшие. Эффективность препарата оценивали через 3 месяца лечения по клиническим данным и результатам нагрузочных тестов.
ВЭМ проводили всем пациентам при отсутствии противопоказаний при включении в исследование и в группе 1 через 3 месяца наблюдения на фоне лечения. Критериями прекращения пробы были развитие типичного приступа стенокардии, горизонтальное или косонисходящее смещение сегмента ST больше 1 мм от изолинии, инверсия зубца T, жизнеугрожающие нарушения ритма сердца, снижение АД во время нагрузки на 20 мм рт. ст. или повышение АД, превышающее исходное на 50%, появление слабости, головокружения, одышки, невозможность продолжения пробы в связи с усталостью пациента или при достижении субмаксимальной ЧСС. Критериями стенокардии считали только сочетание нарастающих ангинозных болей с типичной депрессией сегмента ST, описанной выше.
Селективная КАГ c определением протяженности и диаметра пораженных сосудов проводилась на ангиографическом аппарате INNOVA 3100 (США). Делали пункцию бедренной или лучевой артерии под местной анестезией по методу Сельдингера с установкой интродьюсера 6–7 Fr. На одну съемку вводили от пяти до восьми миллилитров контрастного вещества.
При МСКТ КА визуализировали коронарные сосуды с определением индекса коронарного кальция на мультиспиральном рентгеновском компьютерном томографе Aquilion64 (Toshiba, Япония) с обработкой данных на рабочей станции VITREA.
Всем пациентам была проведена оценка основных метаболических ФР: уровней глюкозы крови, общего холестерина (ОХС), триглицеридов (ТГ), ХС ЛПВП, ХС ЛПНП. У всех больных оценивали также дополнительные метаболические ФР. Содержание аполипопротеина А1 (АпоА1), аполипопротеина В (АпоВ) и липопротеина а (ЛПа) определяли с использованием метода, основанного на измерении иммунопреципитации, усиленной полиэтиленгликолем, при 340 нм на аналитической биохимической платформе Modular SWA (Roсhе, США). Уровень инсулина в сыворотке измеряли методом твердофазного иммунноферментного анализа с использованием наборов фирмы DRG (США). Для оценки степени резистентности к инсулину использовалась малая модель гомеостаза (Homeostasis Model Assessment) с определением индекса HOMAIR, который вычисляли по формуле:
[инсулин натощак (мкМЕ/мл) × глюкоза крови натощак (ммоль/л)]/22,5.
Концентрации цитокинов ФНО α, ИЛ6 в сыворотке крови измеряли методом количественного твердофазного иммуноферментного анализа с использованием тестсистем ЗАО «ВекторБест» (Новосибирск), высокочувствительного СРБ (вчСРБ) — методом иммунопреципитации с латексным усилением с помощью наборов Thermo Fisher Scientific (Финляндия) на автоматическом биохимическом анализаторе. Уровень апелина в плазме крови определяли с применением иммуноферментного анализа реагентами Bender Med System (Австрия) на иммунохимическом автоматическом анализаторе IMMULITE 2000 (Siemens).
Методы статистического анализа. Процедуры статистического анализа выполнялись с помощью статистического пакета Statistica 10. Проверка нормальности распределения количественных признаков в отдельных группах сравнения проводилась с использованием критерия Шапиро — Уилка. Для всех количественных признаков в сравниваемых группах производилась оценка средних арифметических и среднеквадратических (стандартных) ошибок среднего, а также коэффициента вариации, медианы, определение 25го и 75го процентилей. Дескриптивные статистики в тексте представлены как M ± SD, где М — среднее, а SD — стандартное отклонение.
Для сравнения двух независимых групп использовался метод Манна — Уитни, для сравнения центральных параметров двух зависимых групп (до и после лечения) — метод Вилкоксона. Критическое значение уровня статистической значимости при проверке нулевых гипотез принималось равным 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Факторы риска коронарного атеросклероза у пациентов с метаболическим синдромом
Прежде всего были сопоставлены исходные клинические характеристики пациентов групп 1 и 2 (табл. 1).
Таблица 1
Клиническая характеристика пациентов в группах исследования
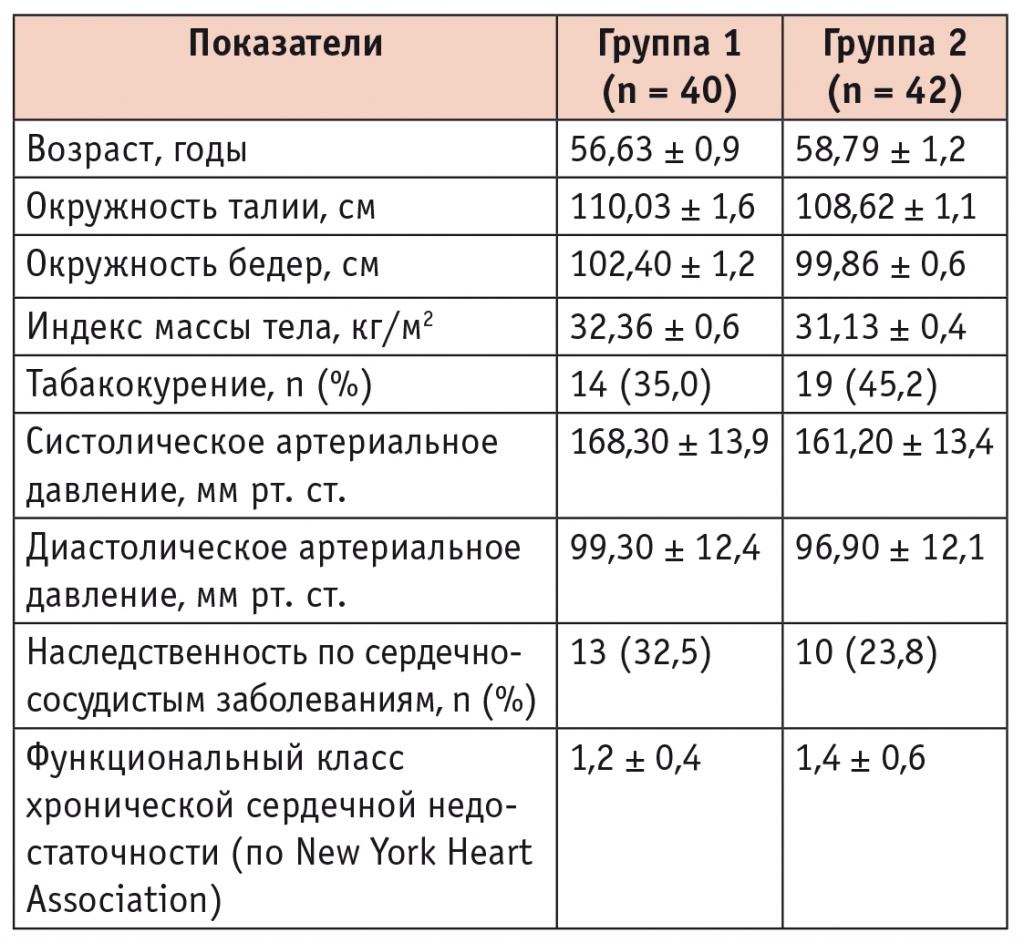
Группы значимо не отличались по возрасту, курению, отягощенной наследственности, параметрам ожирения и исходным цифрам АД.
Несмотря на то что мужчины обеих групп имели МС и не отличались по основным клиническим характеристикам, в группе 1 у пациентов был верифицирован коронарный атеросклероз, подтвержденный результатами КАГ, а в группе 2 нет. В связи с этим нами был проведен анализ основных и дополнительных метаболических ФР в группах сравнения (табл. 2).
Таблица 2
Сравнительная характеристика липидного спектра крови в группах исследования
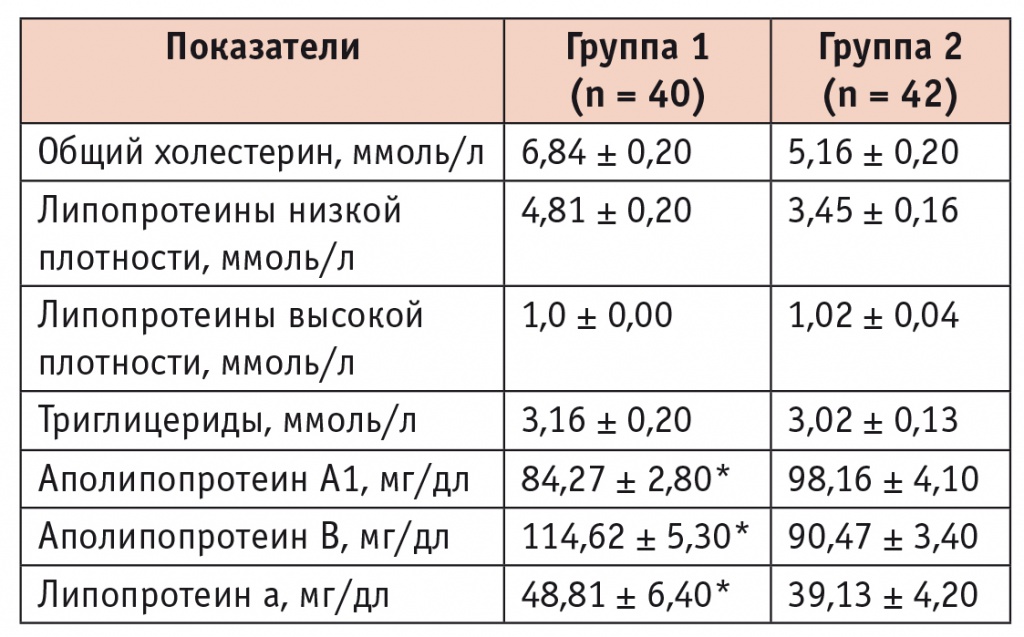
* P < 0,05.
Группы сравнения не отличались по основным показателям липидного спектра крови: ОХС, ХС ЛПНП, ТГ, ХС ЛПВП. Но в группе 1 были выявлены более высокие концентрации АпоВ, ЛПа и более низкий уровень АпоА1 (для всех показателей p < 0,05). Как показано ранее, ЛПа участвует в процессе сосудистого воспаления, индуцируя экспрессию молекул адгезии на эндотелий сосудов, хемотаксис моноцитов и пролиферацию гладкомышечных клеток, тем самым потенцируя развитие и прогрессирование атеросклероза [11]. Кроме того, обнаружено, что ЛПа стимулирует продукцию провоспалительных цитокинов сосудистым эндотелием [12].
При сравнении показателей углеводного обмена (табл. 3) было выявлено, что в группе 1 более высокие уровень инсулина и индекс HOMAIR. Известно, что одним из важнейших патогенетических механизмов, связывающим ожирение и метаболические нарушения с коронарным атеросклерозом, является инсулинорезистентность. У пациентов с гиперинсулинемией отмечается высокая постпрандиальная дислипидемия, которая играет важную роль в формировании атеросклероза. Так, в одном из исследований у бессимптомных пациентов инсулинорезистентность ассоциировалась с коронарным атеросклерозом независимо от других ФР [13]. Кроме того, ранее было обнаружено, что показатели инсулинорезистентности связаны с эпикардиальным ожирением и коронарным атеросклерозом [14].
Таблица 3
Показатели углеводного обмена в группах исследования
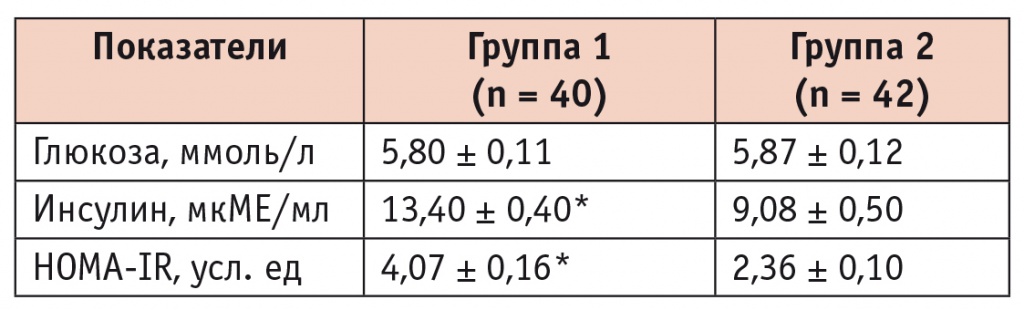
* P < 0,001.
Далее в группах сравнения был проведен анализ содержания провоспалительных цитокинов (ИЛ6 и ФНОα) и вчСРБ.
В нашем исследовании в группе 1 определялись более высокие показатели ФНОα и ИЛ6, чем в группе 2 (5,5 ± 0,36 пг/мл против 3,41 ± 0,2 пг/м и 6,35 ± 0,31 пг/л против 3,45 ± 0,02 пг/л соответственно, для обоих случаев р < 0,05).
ФНОα, секретируемый ВЖТ, в том числе периваскулярной, ингибирует фермент NOсинтетазу, снижает концентрацию оксида азота в сосудистой стенке и способствует прогрессированию атеросклероза. Несколько исследований показали увеличение концентрации ФНОα у пациентов с ожирением и СД 2 типа [15, 16]. В одном из исследований полиморфизм гена ФНОα был связан с увеличением риска ИБС [17].
ИЛ6 — многофункциональный цитокин, продуцируется многими клетками в организме, включая адипоциты ВЖТ, которые синтезируют до 35% циркулирующего в плазме ИЛ6 [18]. Ожирение ассоциируется с увеличением уровня ИЛ6 в организме, тогда как снижение веса приводит к уменьшению его концентрации.
Известно, что ИЛ6 совместно с другими цитокинами является медиатором атеротромбоза, синтеза металлопротеиназ, окисления липидов [19]. В одном из исследований у пациентов с МС ИЛ6 был предиктором наличия эндотелиальной дисфункции и повышения жесткости артериальной стенки [20]. В другом исследовании провоспалительные цитокины были связаны с прогрессированием коронарного атеросклероза и развитием сердечнососудистых осложнений [21].
В группе 1 был выше уровень вчСРБ: 8,78 ± 0,43 мг/л против 6,44 ± 0,4 мг/л в группе 2 (р < 0,05).
СРБ — один из основных маркеров хронического воспаления и непосредственно участвует в прогрессировании атеросклероза КА [22]. Выявлено, что ВЖТ стимулирует синтез СРБ [23]. Ранее была найдена связь СРБ с атеросклеротическим поражением как коронарных, так и других периферических артерий [24]. Доказано, что СРБ и окисленные ХС ЛПНП непосредственно связаны с воспалительным повреждением артерий при ИБС [25].
В последнее время все больше научных работ подтверждают, что одним из основных механизмов, ведущих к развитию атеросклероза у пациентов с ожирением и МС, является специфическая гормональная активность ВЖТ, адипоциты которой продуцируют десятки биологически активных веществ, принимающих участие в процессах формирования эндотелиальной дисфункции, тромбообразования и в атерогенезе. Один из таких адипокинов — апелин, представляющий собой пептид, идентифицированный как лиганд для ангиотензинподобных рецепторов 1, который в основном секретируется эндотелиальными клетками и адипоцитами жировой ткани. Данные о роли апелина в риске развития ИБС и сердечнососудистых осложнений в литературе противоречивы, нет сведений о связи апелина и коронарного атеросклероза у пациентов с МС.
Нами проведен анализ уровня апелина у пациентов с МС и ИБС (группа 1) и пациентов без с МС и ИБС (группа 2). В группе 1 содержание апелина было статистически значимо ниже и составило 0,17 ± 0,15 пг/л, а в группе 2 — 0,46 ± 0,15 пг/л (р < 0,001).
Из результатов экспериментальных работ следует, что лечение больных с ожирением апелином приводит к снижению концентрации инсулина в крови, улучшению усвоения глюкозы и активации липолиза. В ряде исследований продемонстрировано, что при ожирении и СД 2 типа плазменный уровень апелина, а также экспрессия гена апелина в жировой ткани увеличиваются [26, 27]. Несмотря на это, в работе [28] авторы после обследования 290 мужчин обнаружили, что ожирение не было связано с увеличением концентрации апелина.
В исследовании [29] уровень апелина в плазме у пациентов с атеросклерозом КА был значительно ниже, чем у пациентов без коронароного атеросклероза. Данные результаты были подтверждены и другими исследованиями, проводимыми среди больных со стабильной стенокардией, у которых содержание апелина в плазме крови отрицательно коррелировало со степенью поражения коронарного русла атеросклерозом. В нашем исследовании у пациентов со стенокардией и коронарным атеросклерозом на фоне МС уровень апелина был значимо ниже, чем у пациентов без коронарного атеросклероза, причем при наличии в обеих группах признаков МС.
Таким образом, в нашем исследовании наличие коронарного атеросклероза у пациентов с МС было связано с инсулинорезистентностью, высокими концентрациями АроВ, ЛПа, провоспалительных цитокинов, вчСРБ и низкими уровнями АпоА1 и апелина.
Оценка эффективности антиангинальной терапии триметазидином у пациентов со стенокардией напряжения II–III функционального класса на фоне метаболического синдрома
Механизм антиангинального действия триметазидина обусловлен прямым влиянием на выработку во время эпизодов ишемии митохондриями кардиомиоцитов АТФ — универсального источника энергии для всех биохимических процессов [8, 30]. Сохранение клетками способности синтезировать АТФ в условиях ишемии предотвращает возникновение «энергетического кризиса» и обеспечивает осуществление активного переноса молекул через мембраны, поддерживает трансмембранный электрический потенциал и сократительную способность миокарда, снижает вероятность наступления некроза и апоптоза кардиомиоцитов. Важно, что ни один из механизмов, на которые влияет триметазидин, не пересекается с механизмами действия антиангинальных препаратов первого выбора.
В нашем исследовании был проведен анализ эффективности антиангинальной терапии у пациентов группы 1 со стабильной стенокардией напряжения II–III ФК на фоне МС. С этой целью методом случайной выборки из участников группы 1 были сформированы две подгруппы: ОД+ и ОД–. Исходная клиническая характеристика подгрупп представлена в таблице 4.
Таблица 4
Клиническая характеристика подгрупп сравнения
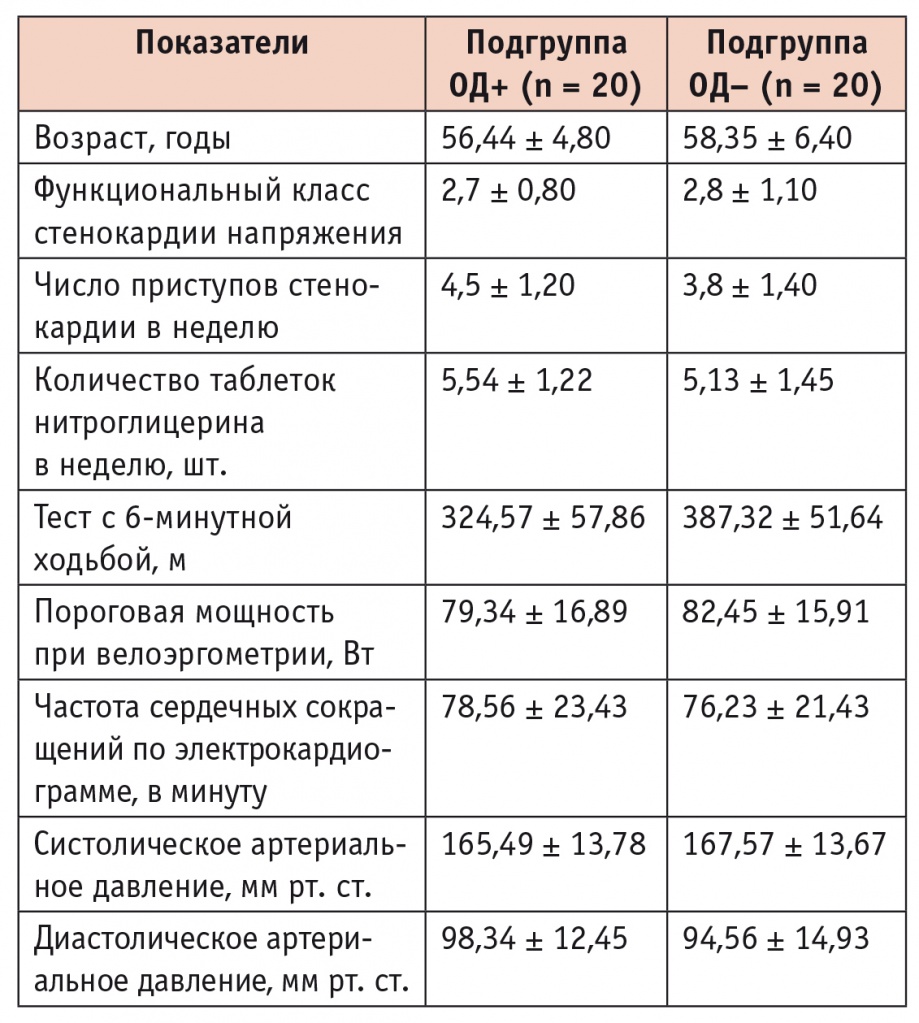
По основным исходным параметрам подгруппы сравнения значимо не отличались.
Все пациенты получали стандартную терапию, согласно существующим рекомендациям (табл. 5), значимых отличий не было.
Таблица 5
Медикаментозная терапия в подгруппах сравнения, n (%)
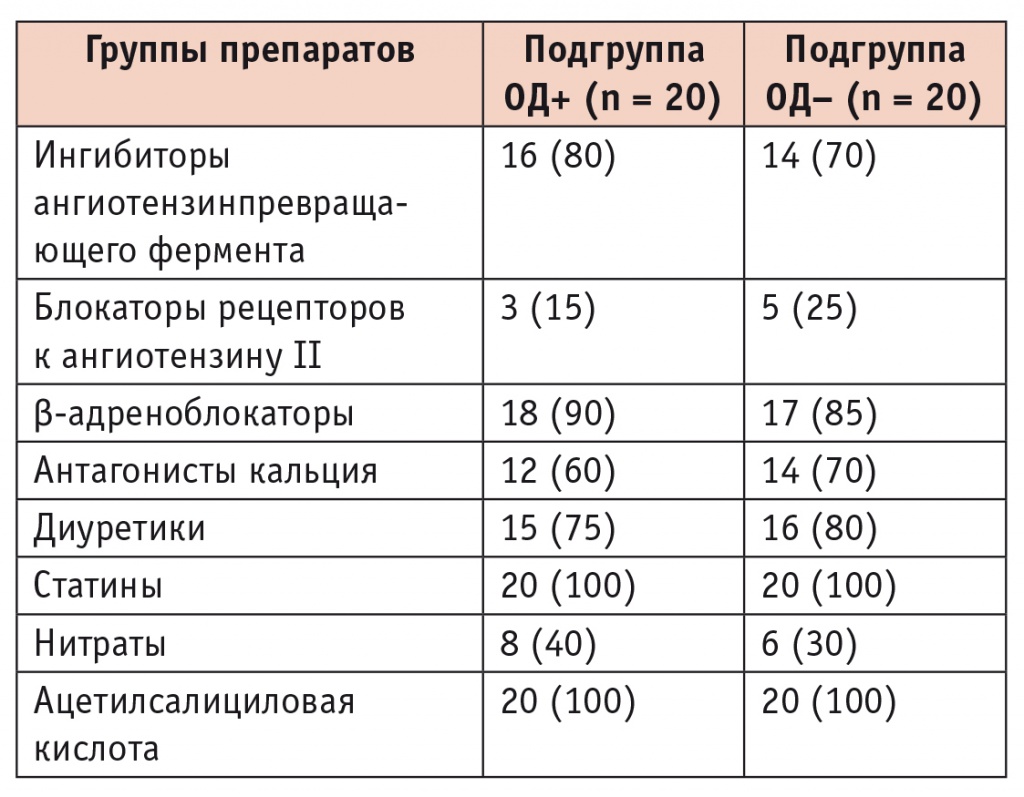
Всем участникам подгруппы ОД+ помимо стандартной терапии был назначен триметазидин в дозе 80 мг утром.
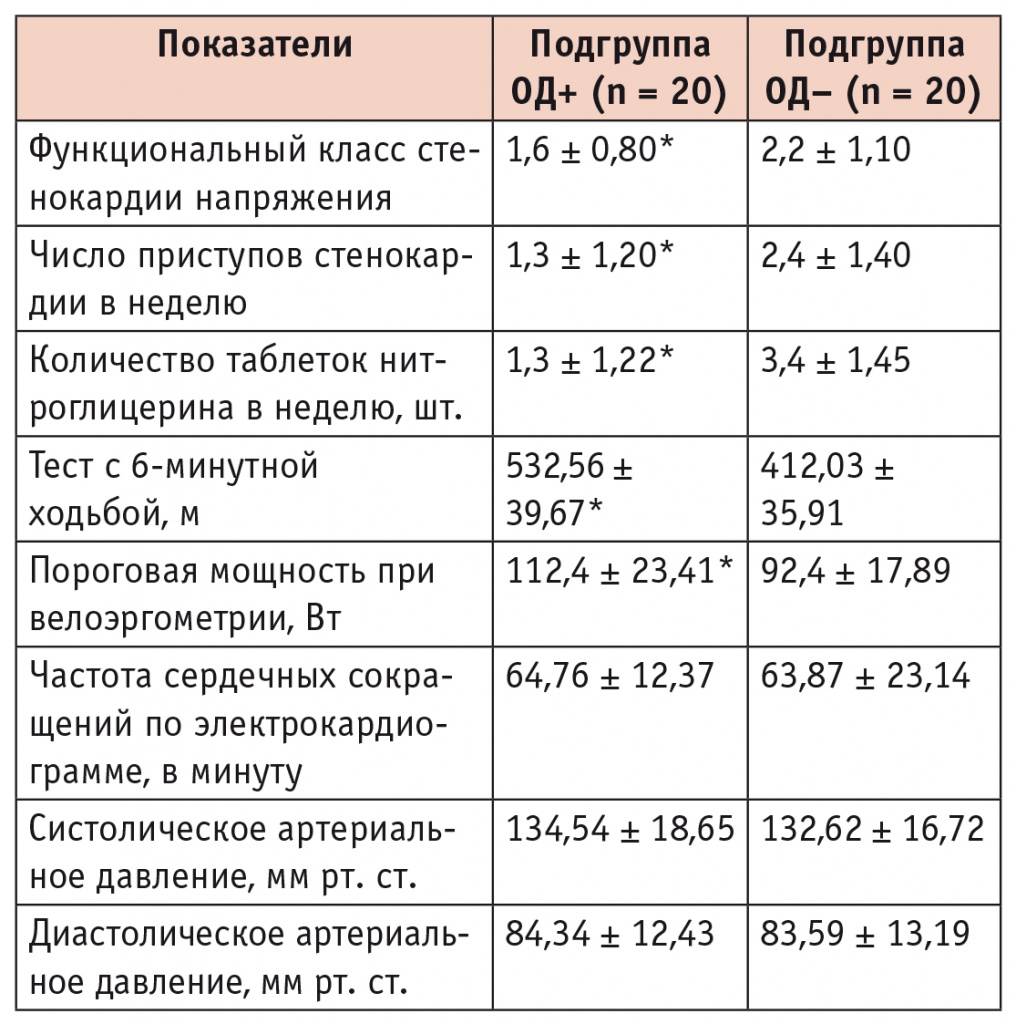
Через 3 месяца пациенты были приглашены для оценки основных клинических параметров и показателей ВЭМ в динамике. Клиническая характеристика подгрупп сравнения через 3 месяца лечения представлена в таблице 6.
Таблица 6
Клиническая характеристика подгрупп сравнения через 3 месяца лечения
* P < 0,05.
Частота приступов стенокардии и потребность в приеме короткодействующих нитратов в подгруппе ОД+ стали значимо ниже, чем в группе ОД–. При этом в подгруппе ОД+ уменьшился ФК стенокардии напряжения. В данной подгруппе также отмечались более высокая толерантность к физической нагрузке при проведении ВЭМ и большее количество пройденных метров в тесте с 6минутной ходьбой.
Таким образом, терапия триметазидином в течение 3 месяцев у пациентов со стенокардией напряжения II–III ФК на фоне МС приводила к более значимому улучшению всех основных клинических показателей эффективности лечения.
Заключение
Важной целью диагностики метаболического синдрома (МС) в клинической практике является выявление пациентов высокого сердечнососудистого риска. В нашем исследовании у пациентов с МС коронарный атеросклероз ассоциировался с наличием инсулинорезистентности, дисапопротеинемией, высокой провоспалительной активностью плазмы и низким уровнем апелина, что, возможно, связано с более высокой нейрогуморальной активностью висцеральной жировой ткани в данной группе.
Применение препарата триметазидина у пациентов со стабильной стенокардией напряжения II–III функционального класса на фоне МС оказалось эффективным.







