ВВЕДЕНИЕ
Синдром мышечной гипотонии (СМГ) у детей грудного и раннего возраста имеет различный генез и представляет трудности для нозологической диагностики. СМГ входит в структуру более 100 различных заболеваний, его основные клинические маркеры неспецифичны, а течение и исход вариабельны. Начиная с 1900 г. в серии статей выдающийся немецкий невролог Герман Оппенгейм описал состояния, наблюдавшиеся у детей раннего возраста, основным симптомом которых являлась мышечная гипотония[1].
С тех пор описано множество заболеваний, дебютирующих снижением мышечного тонуса, что дало основание J.G. Greenfield и соавт. в 1958 г. предложить термин «вялый ребенок» (floppy baby)[2]. В 1969 г. V. Dubowitz предложил систему классификации мышечной гипотонии по клиническим критериям с разделением на две группы:
- первая группа с преобладанием паралича с мышечной гипотонией, включающая различные патологии на сегментарном уровне (от спинальной амиотрофии Верднига — Гоффмана до прогрессирующих мышечных дистрофий);
- вторая группа с преобладанием гипотонии с мышечной слабостью; патологии, обусловленные различными заболеваниями ЦНС (в первую очередь атонически-астатическая форма ДЦП), соединительной ткани и метаболическими нарушениями[3].
Сложность диагностики СМГ связана с наличием различных топически обусловленных вариантов развития. Известно, что СМГ может быть вызван поражением разного уровня моторной интеграции: на мышечном, синаптическом, невральном, на уровне передних рогов спинного мозга, а также поражением белого вещества головного мозга и центрального мотонейрона. Нарушение функции на каждом из этих участков нервно-мышечного пути может проявляться при ряде заболеваний, из которых наиболее значимыми являются семь групп:
- врожденные мышечные дистрофии;
- врожденная миотоническая дистрофия 1-го типа;
- врожденные конгенитальные структурные миопатии;
- врожденные миастенические синдромы;
- наследственные демиелинизирующие моторно-сенсорные полинейропатии (группа наследственных моторно-сенсорных нейропатий с дебютом в раннем детском возрасте: полинейропатия Шарко — Мари — Тута 3-го типа, или синдром Дежерин — Сотта; полинейропатия Шарко — Мари — Тута 4-го типа, или болезнь Рефсума);
- спинальные мышечные атрофии (СМА) 1–2-го типов;
- врожденные наследственные и приобретенные заболевания головного мозга: врожденные пороки развития — синдром Жубера, лиссэнцефалия, голопрозэнцефалия, хромосомные болезни; наследственные болезни обмена — нарушение метаболизма сложных молекул, нарушение промежуточного метаболизма и наиболее часто встречающаяся гипоксически-ишемическая энцефалопатия с СМГ.
Арсенал параклинических возможностей диагностики СМГ различного генеза включает методы генетических, биохимических, гистологических, а также инструментальных исследований, таких как нейровизуализация и электронейромиография (ЭНМГ). Однако при топически ориентированной диагностике СМГ именно метод ЭНМГ является наиболее точным и удобным для применения. Кроме достаточной доступности, оперативности, преимущества миографического метода — его прямая направленность на выявление локализации поражения (мышца, синапс, нерв, передние рога спинного мозга, двигательные центральные проводники), а также возможность оценки функциональной активности пораженной структуры в состоянии покоя и при активации.
Несмотря на это, эффективность ЭНМГ в диагностике структурных миопатий имеет неоднозначную оценку[4, 5], что снижает доверие к миографии при дифференциальной диагностике СМГ миогенного и центрального генеза. По данным авторов[4, 5], чувствительность ЭНМГ в диагностике структурных миопатий у детей до 2 лет составляет 14%, увеличиваясь до 75% у детей в возрасте от 2 до 9 лет. Однако в опубликованных материалах не складывается полная картина верификации этих выводов, что требует дальнейшего научного поиска особенностей ЭНМГ-исследований у пациентов со структурными миопатиями.
Кроме того, по данным отечественных и зарубежных руководств, включая руководства по педиатрической ЭНМГ, не разработан регламент детального проведения игольчатой электромиографии (ЭМГ), что предполагает различные качество и информативность получаемых разными авторами ЭМГ-данных. Помимо сложности ЭНМГ-исследования структурных миопатий, в дифференциальной диагностике СМГ миопатического и центрального генеза также существенны недостаточность сведений в доступной литературе, возможности использования позитивной ЭНМГ-диагностики состояния центральных двигательных проводников.
Вместе с тем наши предшествующие публикации показали, что ряд ЭНМГ-показателей, таких как Н-рефлекс, F-волна, миотатический рефлекс, используемые в оценке поражения пирамидных путей у детей со спастической диплегией и гемипарезами, могут использоваться и в позитивной диагностике скрытых центральных поражений нервной системы с развитием СМГ[6, 7].
Однако даже наличие достаточного количества значимых ЭНМГ-показателей на основе ряда ЭНМГ-методик не может быть залогом успеха в дифференциальной диагностике СМГ, если отсутствует оптимальный путь направленного и последовательного их использования по конкретному алгоритму[8]. В доступной литературе представлены различные алгоритмы клинико-лабораторной диагностики заболеваний с СМГ[9, 10], которые включают критерии, основанные на клинических методах диагностики матери и ребенка, генетических, биохимических, гистологических, МРТ, ЭНМГ-методах. Но и в отечественной, и в иностранной литературе специфические клинико-ЭНМГ алгоритмы диагностики СМГ отсутствуют.
Цель исследования: разработать алгоритм клинико-ЭНМГ топической диагностики СМГ у детей раннего возраста на основе рутинной ЭМГ, стандартизации метода игольчатой ЭМГ и ЭМГ-характеристик состояния супрасегментарных структур ЦНС.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 123 ребенка в возрасте от 1 месяца до 3 лет (64 мальчика, 59 девочек) с 2010 по 2017 г. с диагнозом СМГ, задержки моторного развития. Пациенты обследовались в рамках лечебно-диагностического процесса в медицинском центре «Нейромед», г. Махачкалы (главный врач — Гейбатова Л.Г.), медицинском центре «Аверс» г. Санкт-Петербурга (директор — Сорокин М.В.).
В исследование включали детей в возрасте до 3 лет с клиническим СМГ, имевших задержку моторного развития на 3–6 месяцев, со снижением или отсутствием сухожильных рефлексов. Критерии исключения: возраст старше 3 лет, наличие в анамнезе перинатальных и постнатальных травм периферической нервной системы, заболеваний и травм головного мозга.
По данным разработанного алгоритмизированного ЭНМГ-исследования у больных СМГ с установленной локализацией первично-мышечного поражения и СМГ центрального генеза через 2,5–4 года проводилась проспективная верификация диагноза на основе динамики клинической картины заболевания, ЭНМГ-данных повторного обследования, генетической, биохимической и МРТ-диагностики.
Клиническая диагностика СМГ основывалась на изменении позы ребенка с ротацией бедер кнаружи в положении лежа на спине, запрокидывании головы назад при тракции за руки, на наличии симптома «вялых» надплечий при удержании за подмышки; изменении рефлекторной сферы (снижение или отсутствие сухожильных рефлексов); на низком мышечном тонусе (снижение сопротивления при пассивном движении конечностей, дряблость мышц), снижении силы.
Лабораторные исследования включали биохимический анализ крови (креатинфосфокиназа, АЛТ, АСТ). ЭНМГ проводили на двух- и четырехканальном электромиографах фирмы «Нейрософт» и пятиканальном электромиографе «Нейромиан» фирмы «Медиком МТД», согласно рекомендациям [11].
Методом измерения скорости проведения импульса (СПИ) по моторным и сенсорным волокнам периферических нервов верхних и нижних конечностей исследовали срединные локтевые и малоберцовые нервы, М-ответ musculus biceps brachii и m. rectus femoris; нервно-мышечную проводимость для m. abductor digiti minimi с оценкой наличия феноменов декремента и инкремента; F-волну на стимуляцию nervus tibialis с расчетом процента мономорфности F-волн (MМ-Ftib), т. е. отношения числа F-волн идентичной формы к числу всех зарегистрированных F-волн.
Методом поверхностной ЭМГ регистрировали амплитуду произвольной активности m. rectus femoris, m. extensor digitorum brevis с расчетом отношений их амплитуд. Поверхностными электродами также регистрировали реакцию мышцы на пассивное растяжение со скоростью 60 угловых градусов в 1 секунду — миотатический рефлекс с m. gastrocnemius — с визуальной оценкой и расчетом среднего значения амплитуды 5 залпов активности[6].
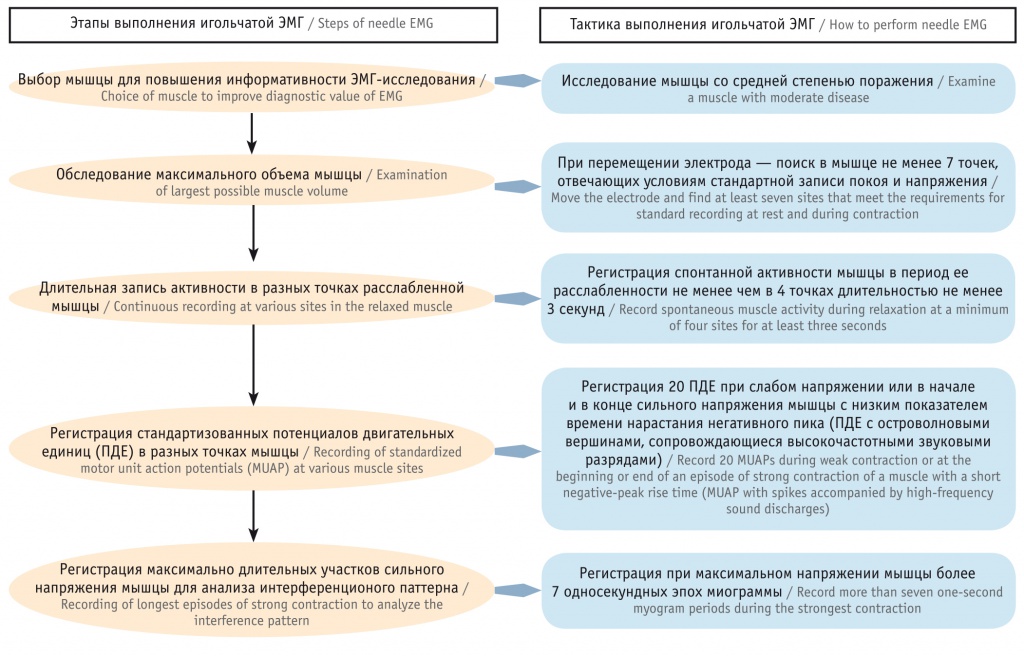
Методом игольчатой ЭМГ исследовали m. biceps brachii, m. vastus lateralis, m. tibialis anterior с регистрацией интерференционного паттерна, спонтанной активности (потенциалов фибрилляций, положительных острых волн, миотонических разрядов, потенциалов фасцикуляций и др.), потенциалов двигательных единиц (ПДЕ) с расчетом процента мелкоразмерных полифазных («миопатических») ПДЕ. Пороговым критерием наличия миопатических изменений мышц у пациента являлся уровень наличия мелкоразмерных полифазных ПДЕ более 15% более чем в двух мышцах, включая верхние и нижние конечности.
РЕЗУЛЬТАТЫ
По данным ЭНМГ-исследования, все пациенты разделились на семь групп, характеристика которых по возрасту и верификации диагнозов представлена в таблице.
Таблица
Структура нервно-мышечного поражения у пациентов с синдромом мышечной гипотонии (СМГ), по данным электронейромиографии
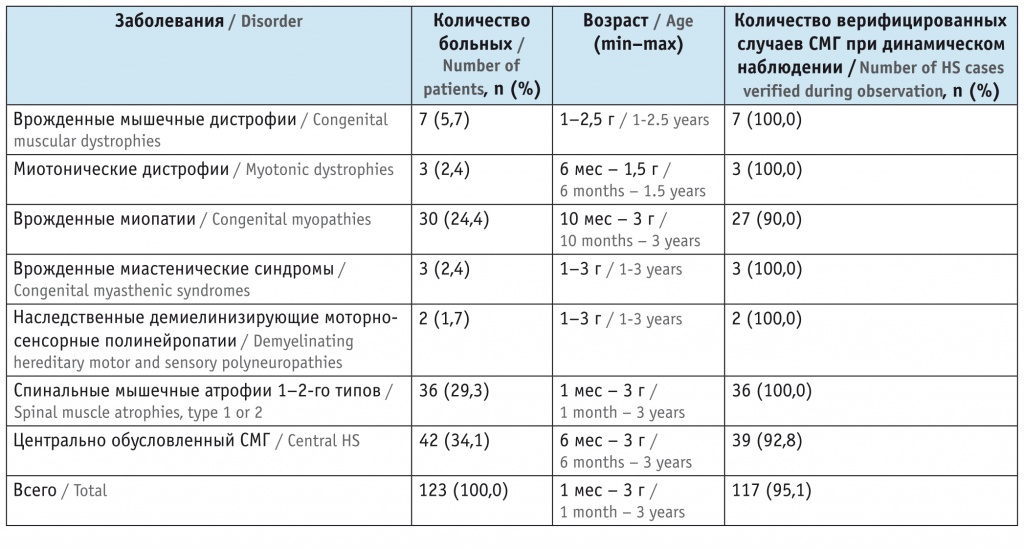
Верификация типа нервно-мышечного поражения показала, что использование разработанной методологии помогает добиться высокой точности ЭНМГ-диагностики СМГ — 95,1% (90–100%). Усовершенствованная ЭНМГ-диагностика СМГ позволила сформировать и предложить для использования разветвляющийся алгоритм с пошаговой детализацией (рис. 1).
Рис. 1. Общий клинико-электронейромиографический алгоритм топической диагностики синдрома мышечной гипотонии у детей.
Примечание: ПДЕ — потенциалы двигательных единиц, СМА — спинальная мышечная атрофия, СПИ — скорость проведения импульса, ШМТ — полинейропатия Шарко — Мари — Тута, ЭМГ — электромиография, ЭНМГ — электронейромиография, BB — m. biceps brachii, EDB — m. extensor digitorum brevis, RF — m. rectus femoris
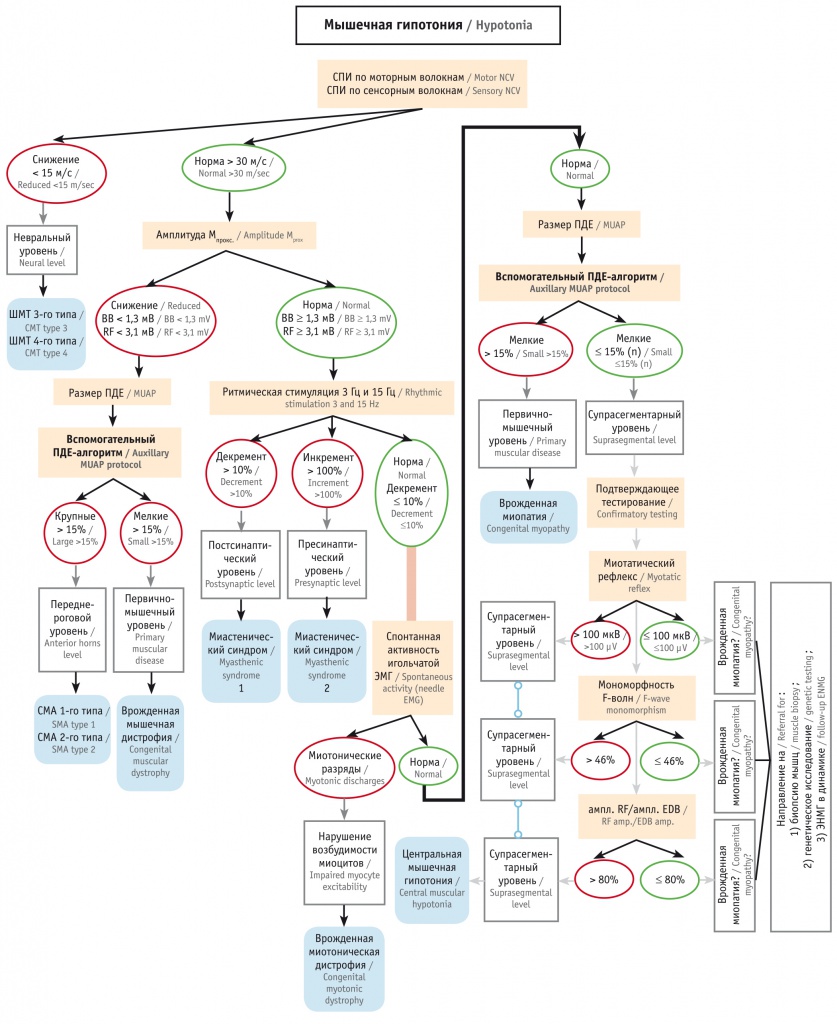
Необходимость такого алгоритма обусловлена ограниченным временем обследования детей раннего возраста, большой вариативностью выбора рутинных ЭНМГ-методик, широким спектром заболеваний детей с СМГ, при которых ЭНМГ-показатели имеют разную информативную значимость. Дополнительно для проведения тщательного ЭМГ-обследования игольчатым электродом детей с диагностически наиболее сложной структурной миопатией разработан и предложен линейный алгоритм вспомогательного типа, которым дополняется на определенном этапе общий алгоритм клинико-ЭНМГ диагностики (рис. 2).
Рис. 2. Вспомогательный алгоритм проведения игольчатой электромиографии (ЭМГ)
Основной алгоритм клинико-ЭНМГ диагностики построен на основе этапных блоков, состоящих из опорного критерия (вариант ЭНМГ-методики) и диагностического показателя (значения нормативного показателя), на основе которого происходит разделение обследуемых на две или три вариантные группы (норма/патология, крупные/мелкие и др.) в ходе применения указанного вида ЭНМГ-методики. На основе последующих аналогично повторяющихся шагов диагностической детализации окончательно формируются группы по уровням локализации поражения, которые согласуются с соответствующими нозологическими формами.
ЭНМГ-исследование начинают с оценки невральной проводимости по критерию «СПИ по сенсорным волокнам», СПИ по моторным волокнам». Достаточно исследовать СПИ по моторным и сенсорным волокнам по малоберцовым нервам с разных сторон. Снижение СПИ до 5–15 м/с будет свидетельствовать о невральном уровне поражения и, соответственно, о наличии наследственной полинейропатии (болезни Шарко — Мари — Тута 3-го, 4-го типов). Для всех других предполагаемых видов патологии этот показатель будет в пределах нормативных значений с учетом возрастных процессов миелинизации.
Следующий блок имеет опорный критерий «амплитуда проксимального моторного ответа» на одной верхней и одной нижней конечностях. Наиболее проксимальными мышцами, доступными для стимуляции, являются m. biceps brachii и m. rectus femoris. Минимальная амплитуда в норме — более 1,3 мВ для m. biceps brachii и более 3,1 мВ для rectus femoris[12]. Сниженные значения М-ответов будут патогномоничны для прогрессирующего процесса — СМА или миодистрофии с утратой значимого объема мышечной ткани.
Для их дифференциации в следующем блоке диагностики используется опорный критерий «размер ПДЕ». Крупные полифазные ПДЕ характерны для переднерогового процесса и обусловлены СМА, мелкие — для первично-мышечного поражения и обусловлены врожденной мышечной дистрофией.
Использование на этом этапе дополнительно вспомогательного алгоритма игольчатой ЭМГ позволяет повысить надежность выявления первично-мышечного поражения при наличии более 15% мелких полифазных ПДЕ.
Пациентам с нормальными значениями амплитуды проксимального моторного ответа проводится диагностика с опорным критерием «ритмическая стимуляция» для выявления врожденных миастенических синдромов. Получение феномена декремента будет характеризовать постсинаптический механизм нарушения нервно-мышечной проводимости, а феномен инкремента — пресинаптический механизм нарушения нервно-мышечной проводимости, что согласуется с двумя вариантами врожденных миастенических синдромов.
У пациентов с отсутствием феноменов декремента и инкремента проводится диагностика с опорным критерием наличия спонтанной активности по игольчатой ЭМГ. Регистрация миотонических разрядов будет показывать нарушенную возбудимость миоцитов, характерную для врожденной миотонической дистрофии.
При отсутствии спонтанной активности используется опорный критерий «размер ПДЕ». Наличие более 15% мелких ПДЕ без спонтанной активности характерно для непрогрессирующего первично-мышечного поражения, обусловленного врожденной миопатией. Надежность диагностики обеспечивает использование на этом этапе вспомогательного алгоритма проведения игольчатой ЭМГ. Нормальные значения ПДЕ при наличии мышечной гипотонии будут характерны для супрасегментарной локализации поражения и обусловлены центральной мышечной гипотонией.
Так как на этом этапе алгоритмизированной диагностики группа центрально обусловленной мышечной гипотонии сформирована на основе только негативной диагностики (исключения других видов патологии) дополнительно для повышения надежности проводится подтверждающее позитивное тестирование с использованием трех опорных критериев: миотатического рефлекса, формы F-волны и амплитуды активности проксимальной мышцы rectus femoris.
Повышение значения миотатического рефлекса (выше 100 мкВ), наличие мономорфности F-волны по показателю повторяемости (> 46%) и высокого относительного показателя амплитуды произвольного напряжения m. rectus femoris (ампл. rectus femoris/ампл. extensor digitorum brevis) (> 80%) являются позитивными маркерами супрасегментраной локализации поражения и, соответственно, центральной мышечной гипотонии[6, 7].
Нормальные или сниженные значения этих показателей будут ставить под сомнение наличие центральной мышечной гипотонии. В таких случаях требуется выполнение в первую очередь дополнительной, более углубленной диагностики на наличие врожденной миопатии: биопсии мышц, генетического тестирования и повторного ЭНМГ исследования в динамике с оценкой ПДЕ большего числа мышц.
Проведение игольчатой ЭМГ у детей раннего возраста является достаточно трудной процедурой и в ряде случаев вынужденно сокращается по объему и времени. Основные ограничения полного обследования — отсутствие согласованных скооперированных действий врача и больного, противодействие ребенка обследованию, трудности в поддержании расслабленного и дозированного слабого напряжения мышцы, создание пациентом эмоционально напряженной атмосферы для его родителей и врача.
Однако, несмотря на это, полноценное заключение о наличии или отсутствии структурной миопатии по результатам игольчатой ЭМГ возможно при накоплении достаточного количества ПДЕ с низким (менее 500 мкс) показателем времени нарастания негативного пика, что, несомненно, может быть достигнуто при соблюдении регламентированной последовательности действий. Эту задачу решает предлагаемый алгоритм игольчатой ЭМГ для детей раннего возраста, сформированный на эмпирической основе (см. рис. 2).
Алгоритм является линейным и состоит из пяти блоков-этапов (см. детализацию на рисунке 2). Выполнение всех этапов алгоритма записи игольчатой ЭМГ позволяет в дальнейшем в режиме off-line провести качественную обработку ЭМГ-данных и с высокой степенью вероятности говорить о наличии или отсутствии первично-мышечного уровня поражения.
Новизна полученных данных заключается в представлении клинико-ЭНМГ алгоритма, позволяющего проводить первичную топически обусловленную диагностическую дифференциацию СМГ на основе ЭНМГ-обследования, а в дальнейшем использовать другие методы диагностики для определения этиологической и нозологической принадлежности заболевания.
ОБСУЖДЕНИЕ
Созданный алгоритм клинико-ЭНМГ диагностики СМГ у детей в течение последних 4 лет использования показал свою высокую эффективность в диагностической практической работе. Он дает возможность на основе небольшого числа данных проводить полную топически обусловленную дифференциальную диагностику с выделением первично-мышечного уровня, поражения нервно-мышечного синапса, неврального, переднерогового и супрасегментарного уровней.
Предложенные в ходе настоящего исследования этапы клинико-ЭНМГ диагностики с включением в алгоритм новых ЭНМГ-показателей для характеристики супрасегментарных нарушений — миотатического рефлекса, F-волны, произвольной мышечной активности — позволили сократить время диагностики и повысить ее надежность. Разработанный дополнительный линейный алгоритм проведения игольчатой ЭМГ у детей позволяет улучшить качество диагностики первично-мышечной патологии и особенно структурных миопатий, что повышает надежность дифференциальной диагностики СМГ миогенного и центрального генеза.
Нами также выработаны диагностические критерии адекватной ЭНМГ-методики, которые можно использовать для каждого патологического уровня поражения нервно-мышечной системы и оценивать по рекомендуемым показателям варианты дихотомического и трихотомического деления на топически обусловленные виды патологии. Новым элементом алгоритма является использование диагностических показателей, подтверждающих поражение не только периферического, но и супрасегментарного звена, отражающих развитие СМГ.
Значимость проведения дифференциальной диагностики СМГ и наиболее часто встречающихся структурных миопатий и перинатальной гипоксически-ишемической энцефалопатии очень высока, и предложенный нами алгоритм проведения игольчатой ЭМГ позволил увеличить надежность их дифференциации до 90–100%, что значительно превышает показатели ряда исследований[4, 5] и согласуется с данными P. Hafner и соавт.[13].
ЗАКЛЮЧЕНИЕ
Полученные результаты и катамнестическое исследование пациентов свидетельствуют о высокой эффективности дифференциальной электронейромиографической диагностики синдрома мышечной гипотонии на основе использования предложенных алгоритмов и показателей состояния супрасегментарных структур.
Поступила: 20.02.2020
Принята к публикации: 10.07.2020







