Нарушение высших мозговых функций представляет собой одно из наиболее распространенных церебральных расстройств, которое очень часто встречается в практике как неврологов, так и других специалистов. Очевидно, что в первую очередь когнитивным расстройствам подвержены лица пожилого и старческого возраста, однако патология со стороны высших мозговых функций может выявляться в любой возрастной группе. Крупные международные эпидемиологические исследования свидетельствуют, что не менее 5% лиц старше 60 лет слабоумны [25, 34]. Еще у 11–20% пожилых лиц выявляются когнитивные нарушения, выходящие за пределы возрастной нормы, но не достигающие выраженности деменции [23, 25]. Неисследованной остается распространенность так называемых субъективных когнитивных нарушений, когда есть жалобы на повышенную забывчивость или снижение умственной работоспособности, но пока еще нет объективного подтверждения интеллектуального снижения с помощью когнитивных тестов.
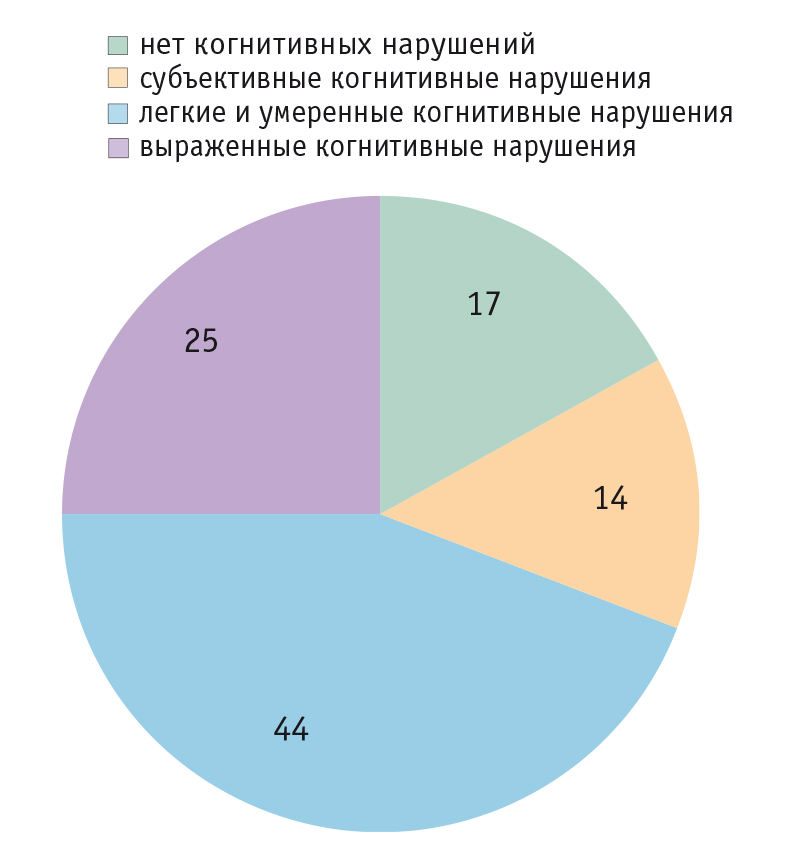
Среди лиц, активно обращающихся за врачебной помощью, представленность когнитивных нарушений существенно выше, чем в популяции в целом. В 2004–2005 гг. в России проводилось масштабное исследование распространенности когнитивных расстройств в амбулаторной неврологической практике («ПРОМЕТЕЙ»). В программе участвовали 132 врача-невролога и более 3 тысяч пациентов из 33 городов 30 регионов Российской Федерации. У каждого пациента старше 65 лет, который впервые приходил на амбулаторный прием к неврологу, независимо от причины обращения проводилось короткое когнитивное тестирование (краткая шкала оценки психического статуса, тест рисования часов). Анализировались также жалобы когнитивного характера (забывчивость, трудности концентрации и др.). В результате когнитивные нарушения были выявлены в 69% случаев, причем у 25% обследованных они достигали значительной выраженности. Помимо этого 14% пожилых пациентов предъявляли жалобы когнитивного характера, хотя формально имели нормальные результаты тестов (рис.) [7].
Рис. Распространенность когнитивных нарушений среди пожилых пациентов на приеме у невролога, % [7]
Учитывая высокую распространенность когнитивных нарушений, у неврологов и других специалистов должна присутствовать особая настороженность в отношении этого вида церебральных расстройств. Такая настороженность особенно актуальна при работе с пациентами пожилого возраста, а также при наличии других значимых факторов риска (табл. 1). Раннее выявление когнитивных нарушений (на стадии умеренных, легких или субъективных расстройств) делает возможным более раннее врачебное вмешательство. Хотя на сегодняшний день не существует общепринятого протокола лечения когнитивных нарушений, не достигающих выраженности деменции, применение на ранних стадиях комплексного подхода, включающего фармакотерапию и немедикаментозные методы, может способствовать уменьшению выраженности имеющихся расстройств и профилактике слабоумия.
Таблица 1
Факторы риска развития когнитивных расстройств в пожилом возрасте
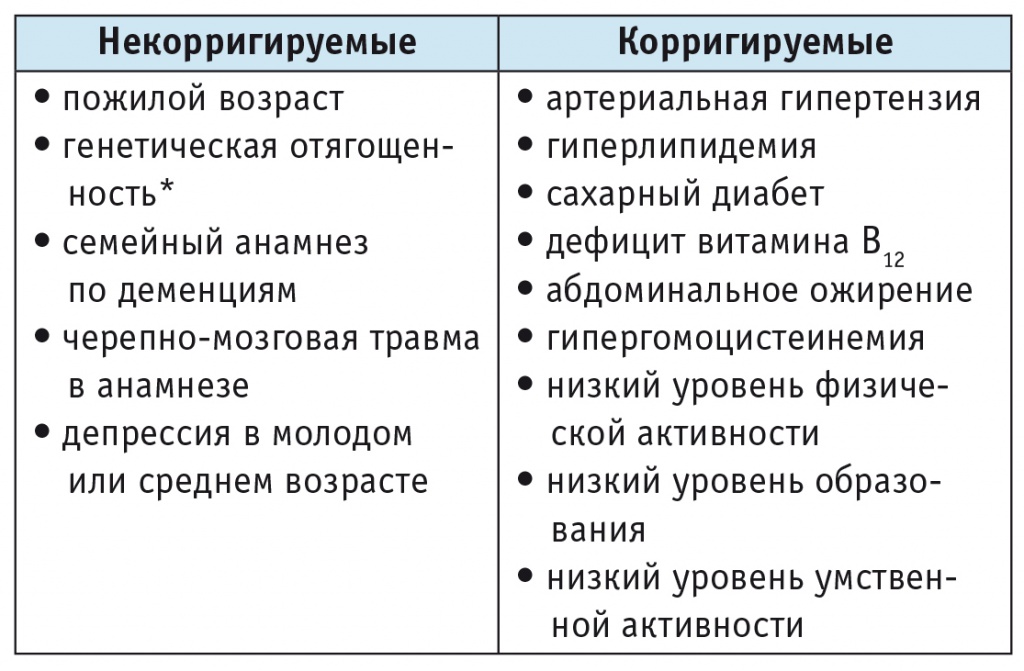
* Ген, кодирующий белок — предшественник амилоида, пресенилин 1, пресенилин 2, АПОЕ4.
Факторы риска когнитивных нарушений. Для оптимизации ранней диагностики, первичной и вторичной профилактики когнитивных нарушений большое значение имеет знание факторов риска их развития. Как видно из таблицы 1, важное место среди изменяемых факторов риска недостаточности высших мозговых функций занимают сосудистые заболевания и сахарный диабет. При этом в настоящее время доказана статистически значимая связь артериальной гипертензии, гиперлипидемии, абдоминального ожирения и сахарного диабета не только с сосудистыми когнитивными нарушениями, но и с риском развития болезни Альцгеймера (БА) [28, 29].
Увеличение риска развития БА на фоне артериальной гипертензии, гиперлипидемии и сахарного диабета объясняется следующим образом. Как известно, БА представляет собой медленно развивающийся дегенеративный процесс. Долгие годы, несмотря на морфологические изменения в головном мозге, пациент остается клинически здоровым, и лишь на последних стадиях патологического процесса развиваются умеренные когнитивные нарушения, а затем и деменция. Однако, как свидетельствует Nun Study, наличие хотя бы одного-двух лакунарных инфарктов в области базальных ганглиев может значительно ускорить клиническую манифестацию латентного дегенеративного процесса [38]. Причиной лакунарных инфарктов является поражение сосудов небольшого калибра (микроангиопатия), а в качестве основных причин микроангиопатии фигурируют артериальная гипертензия и сахарный диабет.
В ряде крупных эпидемиологических исследований показана связь между сахарным диабетом и деменцией как сосудистого, так и дегенеративного характера. Наиболее известное из них — проспективное Роттердамское исследование, которое продолжалось 6 лет. В течение этого срока наблюдались 6370 пациентов в возрасте 55–99 лет с сахарным диабетом. Результаты свидетельствовали, что больные сахарным диабетом 2 типа имеют в 1,9 раза больший риск развития деменции, чем их сверстники, не страдающие диабетом. При использовании в качестве терапии инсулина риск был больше в 4,3 раза [32]. Вероятно, это обусловливалось в первую очередь более тяжелым течением диабета, требовавшим инсулинотерапии. По нашим данным, сахарный диабет 2 типа в большинстве случаев сопровождается когнитивными нарушениями. При этом наличие или отсутствие сопутствующих сосудистых заболеваний (артериальной гипертензии, церебрального атеросклероза) влияет на риск развития когнитивных нарушений в небольшой степени. Так, у пациентов с сочетанием сахарного диабета 2 типа и сосудистых факторов риска когнитивные расстройства присутствовали в 85% случаев, а при изолированном сахарном диабете — в 72% [15].
Не вызывает сомнений, что к факторам риска развития когнитивных расстройств относятся абдоминальное ожирение и гиперлипидемия. По данным скандинавских эпидемиологов, наличие каждого из указанных факторов у лиц среднего и пожилого возраста увеличивает риск развития деменции в 1,5–2 раза [28, 39]. Объяснением может быть повышение вероятности инфарктов мозга, развитие хронической церебральной ишемии, формирование инсулинорезистентности при абдоминальном ожирении. Известна роль холестерина в формировании сенильных бляшек при БА. Однако следует подчеркнуть, что нет прямой корреляции между содержанием холестерина в крови и в паренхиме головного мозга [35].
Согласно результатам многочисленных крупных независимых эпидемиологических исследований, увеличение систолического АД в среднем возрасте статистически значимо повышает риск развития когнитивных нарушений после 60 лет [37]. По данным Н. Н. Яхно и соавт., артериальная гипертензия в подавляющем большинстве случаев сопровождается когнитивным снижением, выраженность которого соответствует ее тяжести [21].
При наличии у пациента нескольких сосудистых заболеваний риск появления когнитивных расстройств увеличивается. Согласно данным Фрамингемского исследования, риск развития деменции наибольший у больных с сочетанием сахарного диабета и артериальной гипертензии, средний при изолированном сахарном диабете и наименьший при изолированной артериальной гипертензии [27]. Скандинавские эпидемиологи разработали специальную шкалу для оценки риска развития деменции в ближайшие 20 лет, которая представлена в таблице 2 [29].
Таблица 2
Шкала сосудистого и возрастного риска деменции (Cardiovascular Risk Factors, Aging and Dementia — CAIDE) [29]
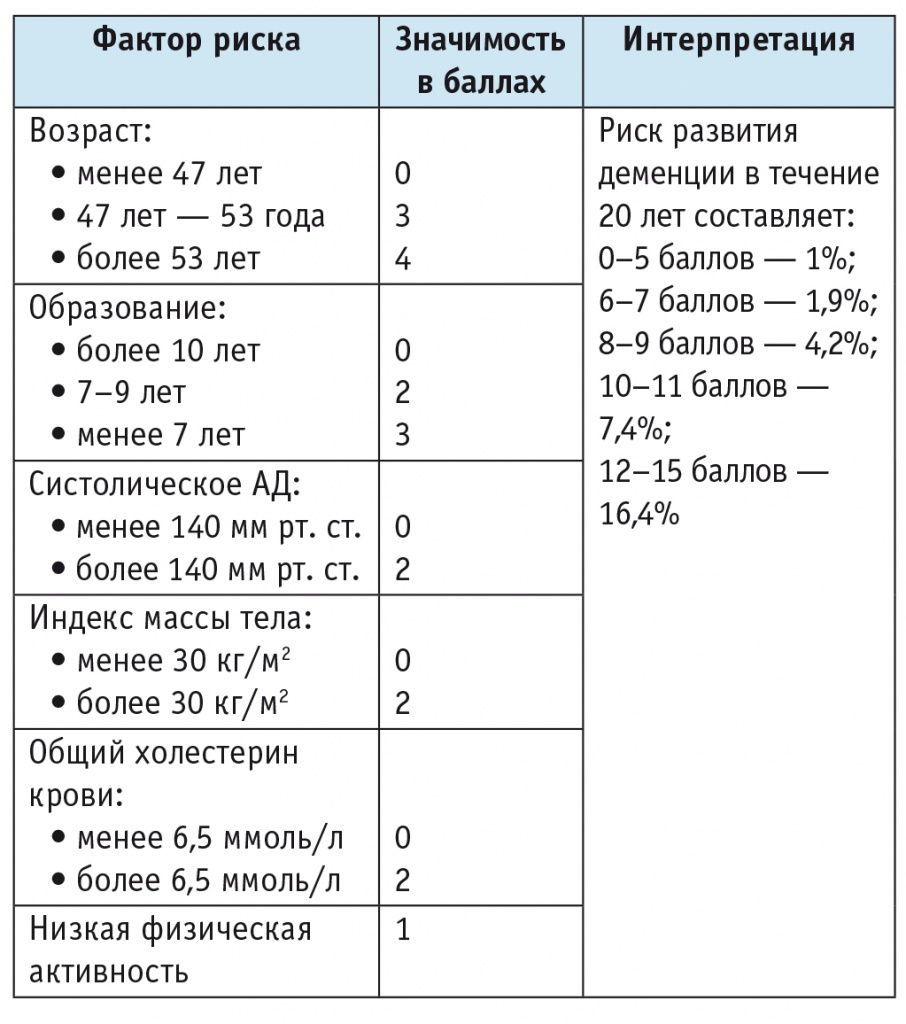
Примечание. АД — артериальное давление.
Метаболический синдром (МС) представляет собой сочетание абдоминального ожирения с другими сосудистыми и/или дисметаболическими расстройствами (табл. 3). Это одно из наиболее часто встречаемых патологических состояний в общеклинической практике: по эпидемиологическим данным, его признаки отмечаются приблизительно у 40% лиц старше 50 лет [10]. МС является сильным фактором риска весьма серьезных осложнений, включая инфаркты миокарда и церебральные инсульты. Поэтому важными задачами врачей различных специальностей являются своевременная диагностика МС и корректное ведение пациентов с данным синдромом [10].
Таблица 3
Диагностические критерии метаболического синдрома
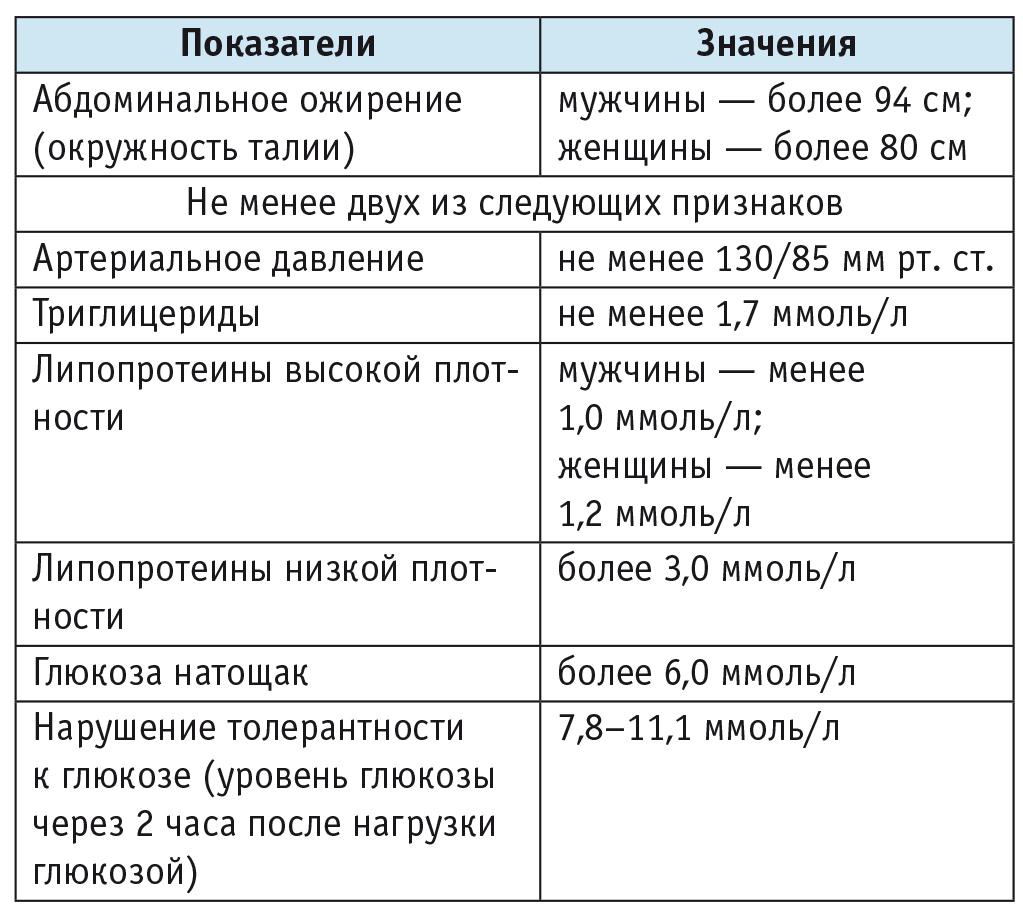
В настоящее время большинство экспертов считают, что в основе МС лежит снижение чувствительности периферических тканей, в первую очередь жировой, мышечной и печеночной, к инсулину (феномен инсулинорезистентности). Вероятно, имеется генетическая предрасположенность к развитию данного феномена, однако для ее реализации необходимо накопление избыточной массы жировой ткани. Как известно, жировая ткань относится к гормонально-активным: в липоцитах происходит синтез эстрогенов, провоспалительных тканевых медиаторов, фактора некроза опухолей. Указанные соединения способствуют развитию системной воспалительной реакции, а также блокируют периферические рецепторы к инсулину, усиливая генетически детерминированную инсулинорезистентность. Для ее преодоления поджелудочная железа увеличивает синтез инсулина — развивается компенсаторная гиперинсулинемия. Вначале наличие гиперинсулинемии позволяет преодолеть имеющуюся инсулинорезистентность, поэтому показатели тощаковой гликемии могут оставаться в пределах нормы. Однако впоследствии при неблагоприятном течении патологического процесса может развиться сахарный диабет 2 типа [1, 5, 10, 17].
Характерная для МС гиперинсулинемия приводит к увеличению синтеза в печени липопротеинов низкой и очень низкой плотности, а следовательно, к развитию гиперлипидемии и системного атеросклероза. Гиперлипидемия и системная воспалительная реакция вызывают эндотелиальную дисфункцию с преобладанием вазоконстрикторных реакций и значительным обеднением капиллярного русла. Этот эффект существенно усиливается при декомпенсации углеводного обмена за счет активации полиолового пути окисления глюкозы, накопления конечных продуктов гликолиза, активации синтеза свободных радикалов [1, 5, 10, 17].
Предполагается, что эндотелиальная дисфункция играет ключевую роль в развитии церебральных осложнений, так как вазоконстрикция и обеднение капиллярного русла вызывают хроническую ишемию головного мозга и затрудняют доставку как кислорода, так и глюкозы. С возрастом потребность нейронов гиппокампа в глюкозе увеличивается, что в сочетании с недостаточным поступлением может приводить к усилению возрастных нарушений памяти.
Наряду с эндотелиальной дисфункцией патогенетическое значение в развитии церебральных осложнений МС имеет нарушение дренирования предшественников амилоидного белка на фоне системной воспалительной реакции и нарушения липидного обмена [22]. Это способствует увеличению темпов развития характерного для БА церебрального амилоидоза у генетически предрасположенных лиц. Таким образом, поражение головного мозга при МС реализуется как по типу хронической недостаточности мозгового кровообращения, так и за счет ускорения темпов нейродегенеративного процесса. Неблагоприятное влияние на когнитивные функции у пациентов с МС оказывают также весьма частые МС-ассоциированные состояния, такие как депрессия и синдром обструктивного апное сна.
Популяционные исследования показывают, что распространенность деменции при МС в 5 раз превышает аналогичный показатель у сверстников без МС. В 5 раз увеличивается и вероятность формирования выраженного лейкоареоза, что может говорить о преимущественно сосудистой этиологии когнитивных нарушений. При этом риск развития выраженных когнитивных нарушений при сочетании МС с высокими показателями системной воспалительной реакции увеличивается в 9,5 раза. Эти данные еще раз свидетельствуют о патогенетической роли эндотелиальной дисфункции, которая в существенной степени вызывается системными воспалительными изменениями. Продемонстрировано также, что МС увеличивает риск инфаркта мозга — как симптомного, так и «немого» — в 2–4 раза [10, 24].
Наличие МС не только повышает риск возникновения когнитивных нарушений, но и способствует более быстрому их прогрессированию. У пациентов с синдромом умеренных когнитивных нарушений риск развития деменции при наличии МС вдвое выше, чем в отсутствие данного расстройства [10].
Дифференциальный диагноз когнитивных нарушений при метаболическом синдроме. Как отмечено выше, когнитивные нарушения при МС могут иметь сосудистую и нейродегенеративную природу. Уточнение этиологии когнитивных расстройств у пациентов с МС имеет существенное значение для ведения пациентов и прогноза.
Дифференциальный диагноз сосудистых и нейродегенеративных когнитивных нарушений базируется на анализе структуры когнитивного дефекта в целом и качественных особенностей мнестических расстройств в частности.
Сосудистые когнитивные нарушения, связанные с патологией сосудов небольшого калибра (а результатом эндотелиальной дисфункции при МС, как видно из изложенного выше, является дисфункция микроциркуляторного русла), относятся к так называемому подкорковому типу когнитивных расстройств. Для него типичны замедленность познавательной деятельности (брадифрения), снижение концентрации внимания, нарушение управляющих функций головного мозга (планирования и контроля), а также умеренная зрительно-пространственная дисгнозия и конструктивная диспраксия. Память нарушена по типу недостаточности воспроизведения. Нарушения речи (дисфазия) нехарактерны [13].
В отличие от сосудистых когнитивных нарушений, нейродегенеративный процесс характеризуется в первую очередь выраженными и прогрессирующими нарушениями памяти, связанными с первичной недостаточностью запоминания новой информации [30]. Для дифференциального диагноза между нарушениями воспроизведения и запоминания используют следующий прием. Пациенту предъявляют слова для запоминания и просят рассортировать их по семантическим категориям (например, диван — это мебель, куртка — одежда). В дальнейшем при исследовании воспроизведения название категории используют в качестве подсказок. Считается, что такие подсказки помогают преодолеть дефицит воспроизведения, поэтому, если, несмотря на подсказку, пациент затрудняется вспомнить слово, констатируют первичную невозможность усвоения новой информации, которая указывает на наличие нейродегенеративного процесса. Этот прием позволяет определить природу когнитивного расстройства уже на достаточно ранних его стадиях.
Нарушения зрительно-пространственного гнозиса и праксиса характерны как для сосудистых, так и для нейродегенеративных когнитивных нарушений. Однако при сосудистой этиологии они, как правило, носят менее выраженный характер. В частности, пациенты с сосудистыми когнитивными нарушениями крайне редко испытывают затруднения при ориентировке на местности, в то время как при БА трудности пространственной ориентировки — закономерный и почти облигатный симптом, особенно на продвинутых стадиях заболеваниях [13, 30].
Наличие прогрессирующей афазии, не связанной с перенесенными инсультами, — также весьма специфичный признак нейродегенеративного процесса, который практически полностью исключает возможность «чистого» сосудистого когнитивного дефицита. Первым симптомом формирующейся афазии обычно является недостаточность номинативной функции речи: пациенты испытывают затруднения при назывании тех или иных предметов. В последующем речь пациентов обедняется существительными, вместо них употребляются местоимения. У больного может частично страдать понимание обращенной к нему речи. В результате формируется синдром акустико-мнестической (или, по международной номенклатуре, транскортикальной сенсорной) афазии [30].
В отличие от сосудистых когнитивных нарушений, для нейродегенеративного процесса на начальных стадиях нехарактерны снижение концентрации внимания и темпа познавательной деятельности (брадифрения), а также нарушения управляющих функций (планирования и контроля) [30].
При этом следует учитывать достаточно широкую распространенность сочетанной патологии, когда сосудистое поражение головного мозга и нейродегенеративный процесс наблюдаются одновременно. О таком сочетании будет говорить наличие замедленности когнитивных процессов (брадифрении) и прогрессирующих нарушений памяти по типу недостаточности запоминания [12].
Проведенные к настоящему времени исследования клинических особенностей когнитивных нарушений у пациентов с МС свидетельствуют о преобладании «подкоркового типа» расстройств с доминированием нарушений воспроизведения и управляющих функций. Это говорит о том, что ведущим механизмом поражения головного мозга при МС является все же недостаточность мозгового кровообращения [10].
Лечение когнитивных нарушений при метаболическом синдроме. Очевидно, что объектом лечебных мероприятий у пациентов с МС и когнитивными нарушениями в первую очередь должно быть основное заболевание.
Важной целью лечения пациентов с МС является нормализация окружности талии и массы тела. С этой целью они должны изменить пищевое поведение. Необходимо объяснить пациенту, что речь идет не о временном переходе на ту или иную «диету», а именно о стратегическом изменении пищевого поведения навсегда. При МС следует полностью исключить или значительно меньше употреблять легкоусвояемые углеводы (сахар, сладости и т. п.). Рекомендуется также сократить употребление мяса и животных жиров. Мясные блюда можно употреблять не чаще одного раза в день и шести дней в неделю, при этом мясо должно быть очищено от кожи и жира. Напротив, следует увеличить в рационе долю изделий из твердых сортов пшеницы, овощей и фруктов, творога и кисломолочных продуктов, нежирных сортов рыбы и морепродуктов.
Одновременно дается рекомендация увеличить физическую активность. Это не только способствует увеличению расходов калорий, полученных с пищей, но и повышает уровень ЛПВП, обладающих антиатерогенным эффектом.
В исследовании FINGER (Finnish Geriatric Intervention Study to Prevent Cognitive Impairment and Disability — Финляндское гериатрическое интервенционное исследование профилактики когнитивных нарушений и инвалидизации) анализировалось влияние изменения образа жизни на темпы прогрессирования когнитивных расстройств у пожилых лиц без деменции. При этом 1260 пожилых пациентов были случайным образом разделены на две группы. В первой (631 участник) активно осуществлялась оптимизация питания, применялись физические упражнения и когнитивное стимулирование; вторая, без изменения образа жизни (629 участников), была группой сравнения. Пациенты наблюдались на протяжении 24 месяцев. По данным исследования, пациенты первой группы достоверно превосходили группу сравнения по показателям темпа познавательной деятельности и управляющих функций (планирование и контроль), что говорило о достоверном уменьшении темпов прогрессирования сосудистых когнитивных нарушений [31].
В качестве медикаментозной терапии МС используют препараты, повышающие чувствительность периферических тканей к инсулину: метформин или пиоглитазон. По показаниям назначаются также статины и антигипертензивные препараты. Данные о том, как указанные лекарственные средства воздействуют на когнитивные функции, пока недостаточны и противоречивы. Однако большинство экспертов сходятся во мнении, что на фоне своевременной и адекватной антигипертензивной терапии риск развития когнитивных нарушений и деменции уменьшается [26, 33].
Для коррекции имеющихся когнитивных нарушений в повседневной клинической практике активно используются нейрометаболические препараты с нейропротективной активностью, такие как холина альфосцерат (Церетон) и этилметилгидроксипиридина сукцинат — ЭМГПС (Нейрокс).
Холина альфосцерат представляет собой высокоэффективное нейрометаболическое и нейропротективное лекарственное средство, активирующее церебральную ацетилхолинергическую систему. Он проникает через гематоэнцефалический барьер и метаболизируется с образованием двух основных действующих веществ — холина и глицерофосфата. Холин, будучи предшественником ацетилхолина, активирует синтез данного нейромедиатора, что оказывает прямое положительное воздействие на когнитивные функции. Известно, что активация церебральной ацетилхолинергической системы необходима для обеспечения устойчивости внимания и эффективного запоминания новой информации. Второй образующийся метаболит — глицерофосфат — является предшественником фосфатидилхолина, входящего в состав фосфолипидов нейрональных мембран. Поэтому он способствует нейропротекции и активации церебральных репаративых процессов при различных повреждениях головного мозга [18].
Клинические исследования свидетельствуют об эффективности холина альфосцерата (Церетона) при хронической недостаточности мозгового кровообращения, в восстановительном периоде ишемического инсульта, а также при БА с деменцией легкой или умеренной выраженности. Так, в работе Е. Г. Менделевич и соавт. (2009) показано, что на фоне его применения происходит регресс когнитивных и эмоционально-аффективных расстройств при хронической недостаточности мозгового кровообращения и у пациентов с последствиями черепно-мозговой травмы. Применение холина альфосцерата (Церетона) способствовало статистически значимому улучшению когнитивных функций по краткой шкале психического статуса и одновременно регрессу астенических и депрессивных расстройств по шкале «самочувствие — активность — настроение» [11]. Сходные данные получены в работе А. В. Соловьевой и соавт. (2009), которые также использовали холина альфосцерат (Церетон) у пациентов с хронической цереброваскулярной патологией. На фоне указанной терапии отмечались повышение концентрации внимания и умственной работоспособности по результатам повторной пробы Шульте и регресс эмоционально-поведенческих расстройств. Кроме того, был зафиксирован статистически значимый регресс выраженности головной боли, головокружения и других субъективных неврологических симптомов [14].
По общепринятому мнению, оценить клиническую значимость изменений когнитивного статуса по тем или иным психометрическом методикам можно с помощью так называемых шкал общего клинического впечатления, где фиксируется динамика клинического статуса в целом. Такой подход был использован в исследовании Т. Н. Батышевой и соавт. (2009), в котором холина альфосцерат (Церетон) применялся у пациентов с синдромом умеренных когнитивных нарушений сосудистой природы. В цитируемом исследовании лечащие врачи в большинстве случаев сообщили о значительном клиническом улучшении, прежде всего за счет уменьшения выраженности когнитивных и других нервно-психических нарушений. При этом пациенты указывали на значительное улучшение самочувствия. Многие из них отмечали появление «ясности мысли» на фоне терапии. Одновременно было зафиксировано объективное улучшение когнитивных функций по краткой шкале оценки психического статуса [3].
И. Д. Стулин и соавт. (2009) исследовали динамику клинических и электрофизиологических показателей на фоне терапии холина альфосцератом (Церетоном) у пациентов с хронической ишемией головного мозга. Препарат вводился в дозе 1000 мг/сут внутривенно капельно в течение 5 дней, затем внутримышечно в течение 10 дней. Были отмечены улучшение самочувствия, нормализация ночного сна, снижение уровня тревожности, уменьшение выраженности очаговой неврологической симптоматики, улучшение показателей памяти. При повторном проведении ЭЭГ наблюдалась положительная динамика биоэлектрической активности головного мозга: представленность медленных волн уменьшалась, а альфа-ритма — увеличивалась [16].
В ряде работ показано благоприятное влияние холина альфосцерата (Церетона) в отношении когнитивных и других неврологических расстройств у пациентов, перенесших ОНМК. При этом положительный эффект отмечался как при ишемическом, так и при геморрагическом инсульте [4, 8, 9, 20].
Имеются клинические данные об эффективности применения холина альфосцерата у пациентов с БА. P. L. Scapicchio и соавт. (2013) использовали его в рамках двойного слепого плацебо-контролируемого исследования при деменции легкой или умеренной степени, связанной с БА. У 261 пациента применяли активный препарат холина альфосцерата (400 мг 3 раза в день) или плацебо в течение 180 дней. В основной группе было получено статистически значимое улучшение когнитивных функций, наблюдались нормализация поведения, положительная динамика клинического статуса в целом. За то же время в группе плацебо было зафиксировано ухудшение состояния или отсутствие изменений. Тот факт, что когнитивные расстройства при МС могут быть не только сосудистой, но и нейродегенеративной природы, обусловливает большое клиническое значение приведенных данных [36].
Благоприятное патогенетическое и симптоматическое воздействие при когнитивных нарушениях на фоне МС оказывает ЭМГПС. Данное лекарственное средство обладает антиоксидантным эффектом. Учитывая роль оксидантного стресса в развитии эндотелиальной дисфункции при гипергликемии, гиперлипидемии и гипертензии, оно, несомненно, показано при указанных состояниях для осуществления вазо- и нейропротекции. Антиоксидантный эффект ЭМГПС убедительно продемонстрирован в целом ряде экспериментальных и клинических работ. В частности, показано, что на фоне использования ЭМГПС (Нейрокса) уменьшается активность малондиальдегида, который обычно рассматривается в качестве одного из ведущих показателей оксидантного стресса [2]. С другой стороны, его применение сопровождалось увеличением активности фермента супероксиддисмутазы, физиологическая роль которого — дезактивация свободных радикалов [2]. В эксперименте также продемонстрировано, что ЭМГПС (Нейрокс) увеличивает выживаемость нейронов и проявляет мембранопротективный эффект при моделировании оксидантного стресса введением глютамата — основной возбуждающей аминокислоты ЦНС [2]. Следует отметить, что перекисное окисление липидов является одним из основных механизмов повреждения клеточных мембран не только при сосудистом, но и при нейродегенеративном патологическом процессе [2].
В клинических исследованиях доказана фармакологическая и терапевтическая эквивалентность Нейрокса оригинальному ЭМГПС. Так, С. Н. Дума и Ю. И. Рагино (2011) применяли Нейрокс и оригинальный ЭМГПС у пациентов с хронической недостаточностью мозгового кровообращения. На фоне терапии был достигнут достоверный и клинически значимый регресс эмоционально-аффективных, психовегетативных, астенических и когнитивных симптомов хронической цереброваскулярной патологии. Одновременно отмечалась положительная динамика системных показателей оксидантного стресса в сыворотке крови. При этом эффективность Нейрокса и оригинального ЭМГПС оказалась сопоставимой [6].
Имеется опыт совместного применения холина альфосцерата (Церетона) и ЭМГПС (Нейрокса) у пациентов в восстановительном периоде ишемического инсульта [19]. Исходя из механизмов действия, очевидно, что указанные средства имеют различные терапевтические мишени, поэтому взаимно дополняют друг друга. Они не образуют между собой какого-либо лекарственного взаимодействия. С патогенетических позиций совместное применение холина альфосцерата (Церетона) и ЭМГПС (Нейрокса) у пациентов с хронической недостаточностью мозгового кровообращения на фоне МС также целесообразно и обоснованно.
ЗАКЛЮЧЕНИЕ
Сочетание немедикаментозного и медикаментозного воздействия на основное заболевание и его причины с воздействием на патогенетические механизмы церебральных осложнений позволяет значительно уменьшить выраженность когнитивных и других нервно-психических расстройств у пациентов с метаболическим синдромом.







