Целлекс — нейропептидный препарат, который является как первичным, так и вторичным нейропротектором. Первичное нейропротективное действие Целлекса основано на регуляции нейромедиаторных процессов, что реализуется в торможении возбуждающих аминокислот — аспартата и глутамата. Вторичная нейропротекция связана с прерыванием отсроченных механизмов смерти клеток (отдаленных последствий ишемии) [7–10, 12, 20, 23]. Важнейшим моментом в патогенетической терапии ишемического повреждения мозга при ЧМТ в этом случае выступает элемент тканевой иммунорегуляции, связанной с торможением иммуногенной цитотоксичности макрофагов и активацией аутофагии (убиквитин-шаперонового каскада клиренса поврежденных молекул) [14, 18, 19, 26–31].
Цель статьи — оценка эффективности и безопасности применения нейропептидного препарата Целлекс у пациента с ЧМТ в остром и восстановительном периодах.
КЛИНИЧЕСКИЙ ПРИМЕР
Пациент К., 68 лет. Поступил в травматологическое отделение КГБУЗ «Уссурийская городская больница» 30.10.2014 с диагнозом: «Открытая проникающая черепно-мозговая травма. Ушиб головного мозга тяжелой степени. Очаги размозжения левой лобной и теменной долей, повреждение мозолистого тела. Субарахноидально-вентрикулярное кровоизлияние. Пневмоцефалия». 01.11.2014 переведен бригадой службы медицины катастроф в нейрохирургическое отделение (НХО) ГАУЗ «Владивостокская клиническая больница № 2».
Из анамнеза: в молодости перенес ЧМТ, после которой сохранялся трепанационный дефект левой лобной кости. Ориентировочно 25.10.2014 с целью суицида нанес себе ножевое ранение через костный дефект. 30.10.2014 был обнаружен родственниками дома без сознания и госпитализирован. Состояние при поступлении тяжелое, стабильное, контакту недоступен. Проведены первичная хирургическая обработка раны, КТ.
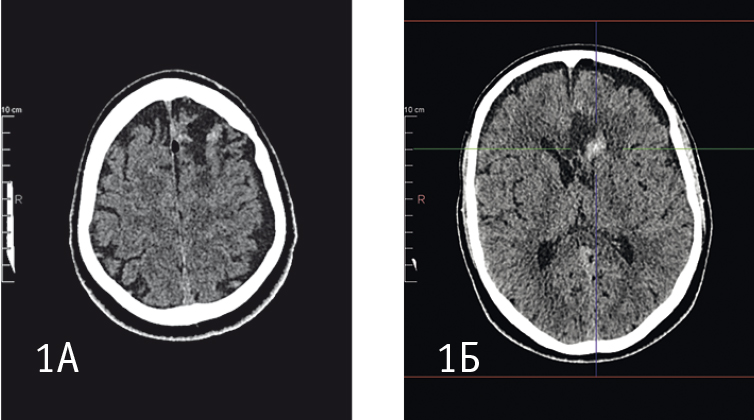
На КТ от 30.10.2014 виден раневой канал длиной 8 см, шириной до 1 см. Субарахноидально-вентрикулярное кровоизлияние, очаги ушиба головного мозга 1–2-го вида в лобных и левой теменной долях, колене мозолистого тела. Субдуральные ликворные гидромы правой лобной, левой лобной и теменной долей. Пневмоцефалия. Дефект левой лобной кости. Застарелые рубцовые изменения левой лобно-теменной области (рис. 1А, Б). При рентгенографии органов грудной полости патологии не выявлено. Терапевтом диагностирована гипертоническая болезнь II степени, риск 3.
Рис. 1. Спиральная компьютерная томограмма пациента К. (октябрь 2014 г.). Фото авторов.
Примечание. На томограмме 1А видны очаги ушиба в обеих лобных и левой теменной долях. На томограмме 1Б — кровь в желудочках мозга
Лечение включало перевязки, повторные люмбальные пункции. Регресс раневой ликвореи был достигнут 06.11.2014, ликвор санировался 17.11.2014. Пациент получал антибактериальные, антиоксидантные и сосудистые препараты.
В связи с неэффективностью нейрометаболической терапии по решению локального этического комитета лечебного учреждения и при подписании информированного согласия на 3-и сутки стационарного лечения К. был назначен курс Целлекса: по 1 мл подкожно ежедневно в течение 10 дней.
На 2-е сутки от начала терапии нейропептидами отмечалась четкая реакция активации: пациент пришел в сознание, появился аппетит, диурез адекватный, самостоятельный.
Через 7 дней после госпитализации в НХО было проведено нейропсихологическое обследование пациента с применением методик «Отсчитывание», «Десять слов», «Повторение цифр в прямом и обратном порядке», «Счетные операции», «Пиктограммы», «Толкование пословиц и метафор», «Воспроизведение рассказа», «Четвертый лишний», «Сравнение предметов», а также краткой шкалы оценки психического статуса (Mini-Mental State Examination — MMSE). Сумма баллов по MMSE соответствовала деменции легкой степени — 21 балл из 30. У пациента диагностировалось грубое нарушение когнитивных процессов в рамках органического патопсихологического симптомокомплекса (ригидный вариант, до уровня деменции).
В неврологическом статусе на момент выписки: сознание ясное, некритичен, несколько неадекватен, во времени и пространстве ориентирован. Менингеальные знаки регрессировали полностью, нистагма и анизокории нет, движения глазных яблок в полном объеме. Черепно-мозговые нервы без особенностей. Рефлексы с рук и ног живые, равные, мышечный тонус нормальный, координаторные пробы выполняет удовлетворительно. Речь правильная, скудная.
В течение последующего наблюдения пациенту были проведены четыре курса лечения препаратом Целлекс (по 1 мл подкожно ежедневно, № 10): первый — в стационаре, второй — через 1 месяц и далее дважды с интервалом в 6 месяцев. Кроме того, К. получал рисперидон и наблюдался у психиатра до ноября 2015 г.
Состояние пациента оценивалось по данным неврологического осмотра, ЭЭГ, MMSE, шкале госпитальной тревоги и депрессии, шкале тревоги Шихана, шкале депрессии Гамильтона, шкале А. М. Вейна для оценки вегетативных изменений, а также по результатам КТ и МРТ [1].
Через 6 месяцев от момента госпитализации в НХО оценка психического статуса по шкале MMSE составила 29 баллов; пациент был адекватен, ориентирован во времени и пространстве, охотно вступал в контакт, развернуто отвечал на вопросы. Суицидальных мыслей не высказывал и критично относился к своему прошлому поступку. Легко справлялся со сложными задачами.
Нами отмечена стойкая положительная динамика. С момента выписки из стационара до настоящего времени в неврологическом статусе без особенностей. На ЭЭГ, которая проводилась 1 раз в 3 месяца, отмечены увеличение альфа-ритма на 40% от первоначального уровня при правильном зональном распределении и уменьшение регионального замедления над лобными областями и левой теменной областью до 34%. Эпилептиформной активности не зарегистрировано.
В настоящее время К. предъявляет жалобы на нарушение сна, потливость, покраснение лица, перебои в работе сердца, утомляемость, желудочно-кишечные расстройства в виде вздутия, что отражает вегетативную дисфункцию. Результат тестирования по шкале А. М. Вейна для оценки вегетативных изменений снизился с 51 балла при выписке из стационара до 16 баллов — это соответствует вегетативным нарушениям легкой степени выраженности.
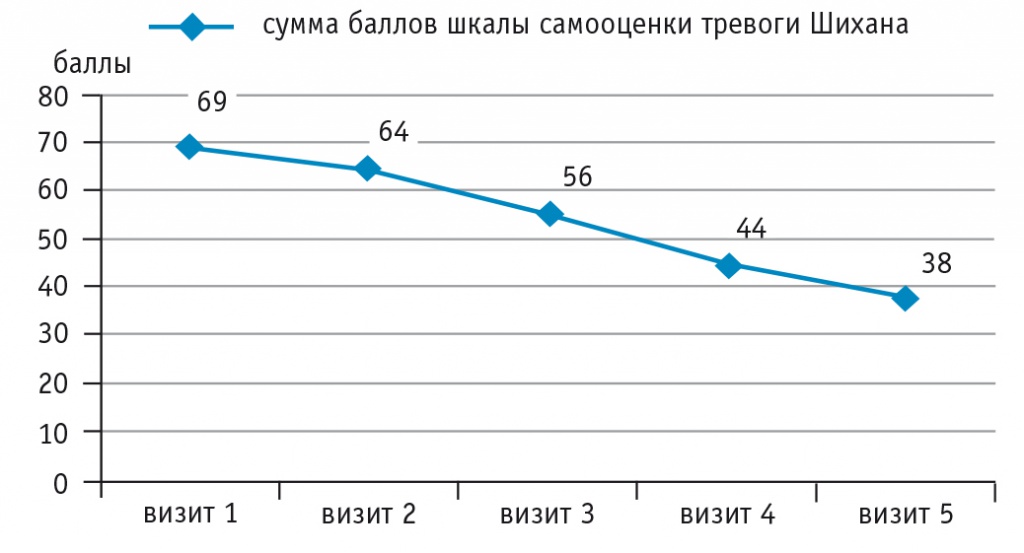
Редукция депрессивных проявлений по шкале депрессии Гамильтона отмечалась по всем основным пунктам, включая чувство вины, сниженный фон настроения, суицидальные намерения, работоспособность, заторможенность (рис. 2). Оценка тревоги по шкале Шихана также показала положительную динамику в отношении как психических, так и соматических феноменов (рис. 3).
Рис. 2. Динамика выраженности депрессивных проявлений по шкале депрессии Гамильтона, баллы.
Примечание. На рисунках 2, 3 кратность посещений составляет 1 раз в 6 недель
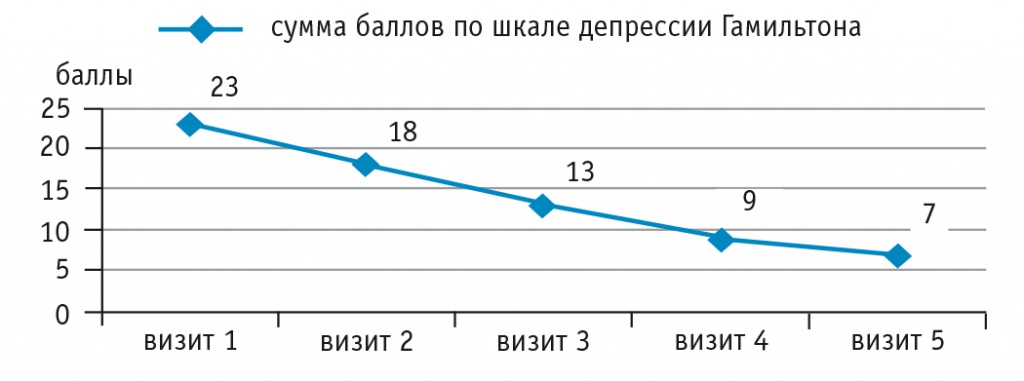
Рис. 3. Динамика оценки тревоги по шкале Шихана, баллы
В настоящий момент пациент трудоспособен, адекватен и правильно ориентирован во времени и пространстве. Суицидальных намерений не высказывает. Следует отметить хорошую переносимость Целлекса: в процессе терапии нами не отмечено значимых побочных эффектов.
ЗАКЛЮЧЕНИЕ
Не вызывает сомнения, что применение нейропептидного препарата Целлекс у пациентов с черепно-мозговой травмой в остром и восстановительном периодах позволяет получить положительный эффект, который характеризуется восстановлением как двигательных функций, так и составляющих высшей нервной деятельности, а именно мышления, памяти, мотивации, а также способности к стратегическому и тактическому решению сложных задач.







