В практике каждого педиатра встречаются больные с таким состоянием, как лихорадка неясного генеза. За последние несколько десятилетий список дифференциальных диагнозов этого состояния значительно расширился. Помимо инфекционных, аутоиммунных, паранеопластических причин лихорадки, нужно помнить об относительно новой группе заболеваний — аутовоспалительных синдромах (АВС).
ABC — достаточно разнородная группа редких, генетически обусловленных состояний, характеризующихся периодическими эпизодами системного воспаления и проявляющихся лихорадкой и полиморфной клинической картиной, нередко имитирующей ревматические и другие заболевания в отсутствие аутоиммунных или инфекционных причин[3, 20]. По классификации Европейского общества по изучению иммунодефицита, аутовоспалительные заболевания отнесены к первичным иммунодефицитным состояниям, а именно к группе дефектов врожденного звена иммунитета.
Термин «аутовоспалительные синдромы» появился в 1999 г. благодаря американскому исследователю Дону Кастнеру[20]. С тех пор перечень аутовоспалительных заболеваний постоянно пополняется за счет вновь открываемых синдромов. На сегодняшний день описано более 25 различных АВС[1, 3, 24], а также создана их классификация (табл. 1).
Таблица 1
Классификация синдромов острого лизиса опухоли[31]
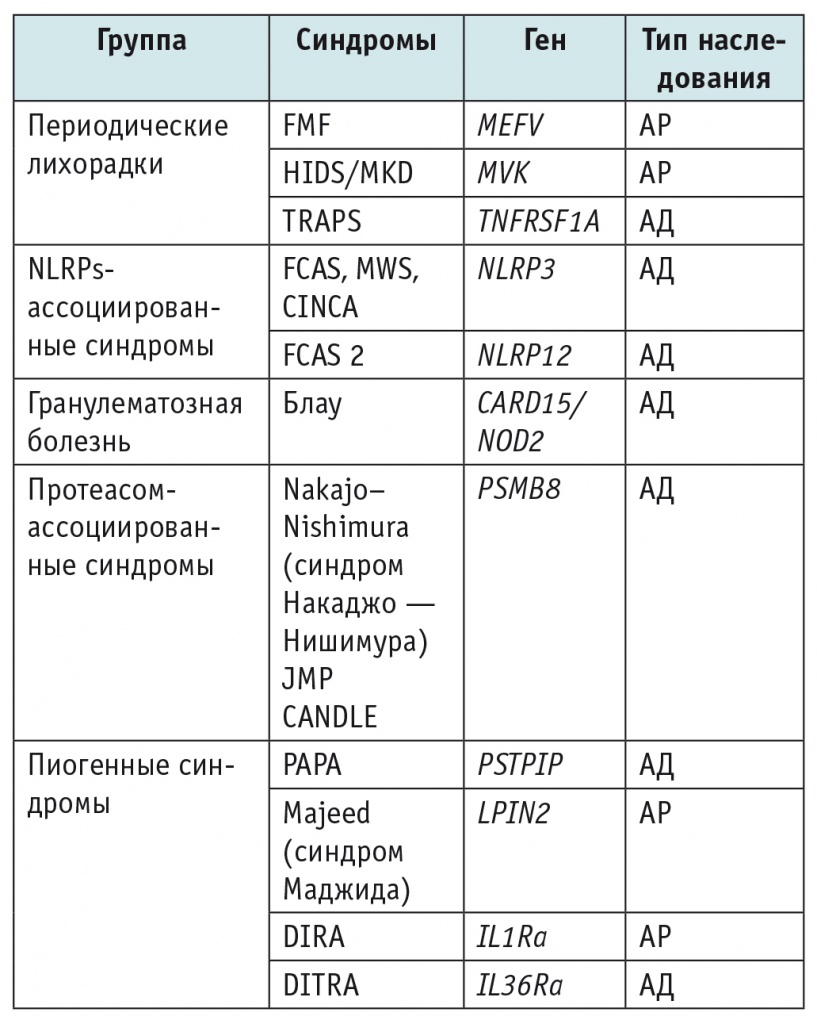
Примечание. АД — аутосомно-доминантный, АР — аутосомно-рецессивный; CANDLE — Chronic Atypical Neutrophilic Dermatosis with Lipodystrophy and Elevated Temperature (хронический атипичный нейтрофильный дерматоз с липодистрофией и лихорадкой); CINCA — Chronic Infantile Neurological, Cutaneous and Articular Syndrome (хронический младенческий неврологический кожно-артикулярный синдром); DIRA — Deficiency of the Interleukin-1 Receptor Antagonist (дефицит антагониста рецептора интерлейкина 1); DITRA — Deficiency of the Interleukin-36 Receptor Antagonist (дефицит антагониста рецептора интерлейкина 36); FCAS — Familial Cold Autoinflammatory Syndrome (семейный холодовой аутовоспалительный синдром); FMF — Familial Mediterranean Fever (семейная средиземноморская лихорадка); HIDS/MKD — Hyperimmunoglobulinemia D Syndrome/Mevalonate Kinase Deficiency (гипер-IgD-синдром/синдром дефицита мевалонаткиназы); JMP — Joint Contractures, Muscular Atrophy, Microcytic Anemia and Panniculitis-Induced Lipodystrophy (синдром, связанный с контрактурой суставов, мышечной дистрофией и панникулитами); MWS — Muckle–Wells Syndrome (синдром Макла — Уэллса); PAPA — Pyogenic Sterile Arthritis, Pyoderma Gangrenosum and Acne (пиогенный стерильный артрит в сочетании с гангренозной пиодермией, выраженными акне и фурункулезом); TRAPS — Tumor Necrosis Factor Receptor 1 Associated Periodic Syndrome (периодический синдром, ассоциированный с рецептором фактора некроза опухоли 1-го типа).
Значительный прогресс в изучении АВС был достигнут в конце XX века, когда благодаря стремительному развитию молекулярной биологии и молекулярной медицины удалось установить генетическую природу ряда моногенных аутовоспалительных заболеваний и тем самым приблизиться к пониманию их патогенеза. Тем не менее у остальных аутовоспалительных заболеваний генетические основы пока не выявлены. Кроме того, возникла концепция полигенных АВС, когда один или несколько генетических дефектов предрасполагают к их развитию, однако не являются истинно причинно-значимыми. К этим заболеваниям относят системный ювенильный идиопатический артрит, болезнь Бехчета, синдром Маршалла (периодическая лихорадка, афтозный стоматит, фарингит и аденит — Periodic Fever with Aphthous Stomatitis, Pharyngitis and Adenitis, PFAPA), подагру и т. д.
Как возник термин «аутовоспалительные»? Воспаление является наиболее филогенетически древним механизмом иммунной защиты. Оно ограничивает распространение патогена из очага первичной инфекции, привлекает в этот очаг иммунокомпетентные клетки, а также, в случае массивной инфекции, активизирует системные механизмы для борьбы с нею, в том числе и высокоспециализированные механизмы приобретенного иммунитета. Однако длительное, избыточное воспаление само по себе может стать серьезным повреждающим фактором, приводящим к деструкции тканей, истощению белково-синтетической функции, отложению амилоида и вторичному поражению внутренних органов. Поэтому в процессе филогенеза иммунной системы выработались сложные механизмы, регулирующие не только включение воспалительных реакций, но и их своевременное выключение. В основе АВС лежат генетические дефекты различных звеньев сложного механизма воспаления, которые приводят к нарушению его регуляции и к течению воспаления без инфекционной причины или на протяжении долгого времени после ее устранения[1]. В частности, такие дефекты ведут к нарушению взаимодействия белков, отвечающих за нормальную работу инфламмасом, например NLRP3-инфламмасомы.
Инфламмасомы представляют собой цитоплазматические белковые комплексы, распознающие типичные молекулярные маркеры патогенов и эндогенные молекулы опасности и обеспечивающие запуск и прекращение механизмов воспаления[37], в первую очередь продукцию активного ИЛ-1[17]. Симптомы многих аутовоспалительных заболеваний схожи между собой и с симптомами более частых приобретенных воспалительных синдромов (например, ревматоидного артрита) именно потому, что различные первичные дефекты имеют единое последствие — избыток продукции провоспалительных цитокинов, основным из которых является ИЛ-1. Это также объясняет тот факт, что селективные ингибиторы цитокинов воспаления (ФНО, ИЛ-1, ИЛ-6) эффективны при различных моногенных и полигенных АВС.
Своевременная диагностика АВС представляет сложную проблему, что связано, во-первых, с редкостью этих заболеваний и недостаточными знаниями о них среди различных специалистов и, во-вторых, с разнообразием их клинической картины[3, 5, 8]. Как было сказано выше, общими для этой группы заболеваний являются лихорадка (рецидивирующая с различными интервалами), воспалительная лабораторная активность во время эпизодов обострения, а нередко и в промежутках между ними, кожные сыпи и поражения слизистых оболочек, поражения суставов (от артралгий до тяжелых артритов с выраженной дефигурацией), лимфопролиферация. У наиболее часто встречающихся АВС нередко отмечают идентичную клиническую картину, поэтому во многих случаях окончательная верификация диагноза возможна только после проведения молекулярно-генетического исследования. Однако есть и характерные отличительные особенности отдельных синдромов.
СИНДРОМ МАРШАЛЛА (PERIODIC FEVER WITH APHTHOUS STOMATITIS, PHARYNGITIS AND ADENITIS, PFAPA)
Периодический синдром с афтозным стоматитом, фарингитом и лимфаденитом, или синдром Маршалла, часто встречается в практике педиатров, инфекционистов и отоларингологов и на сегодняшний день относится к полигенным АВС[16, 36, 48]. В 1987 г. G. S. Marshall и соавт. впервые описали у 12 детей хронический синдром, который характеризовался эпизодами высокой лихорадки продолжительностью 4–8 дней, повторявшимися каждые 2–9 недель, в сочетании с афтозным стоматитом, фарингитом и шейным лимфаденитом; отмечалось, что у мальчиков этот синдром встречается чаще[35]. В 1989 г. были определены диагностические критерии синдрома, модифицированные спустя 10 лет[31, 36](табл. 2).
Таблица 2
Диагностические критерии синдрома Маршалла (Periodic Fever with Aphthous Stomatitis, Pharyngitis and Adenitis)
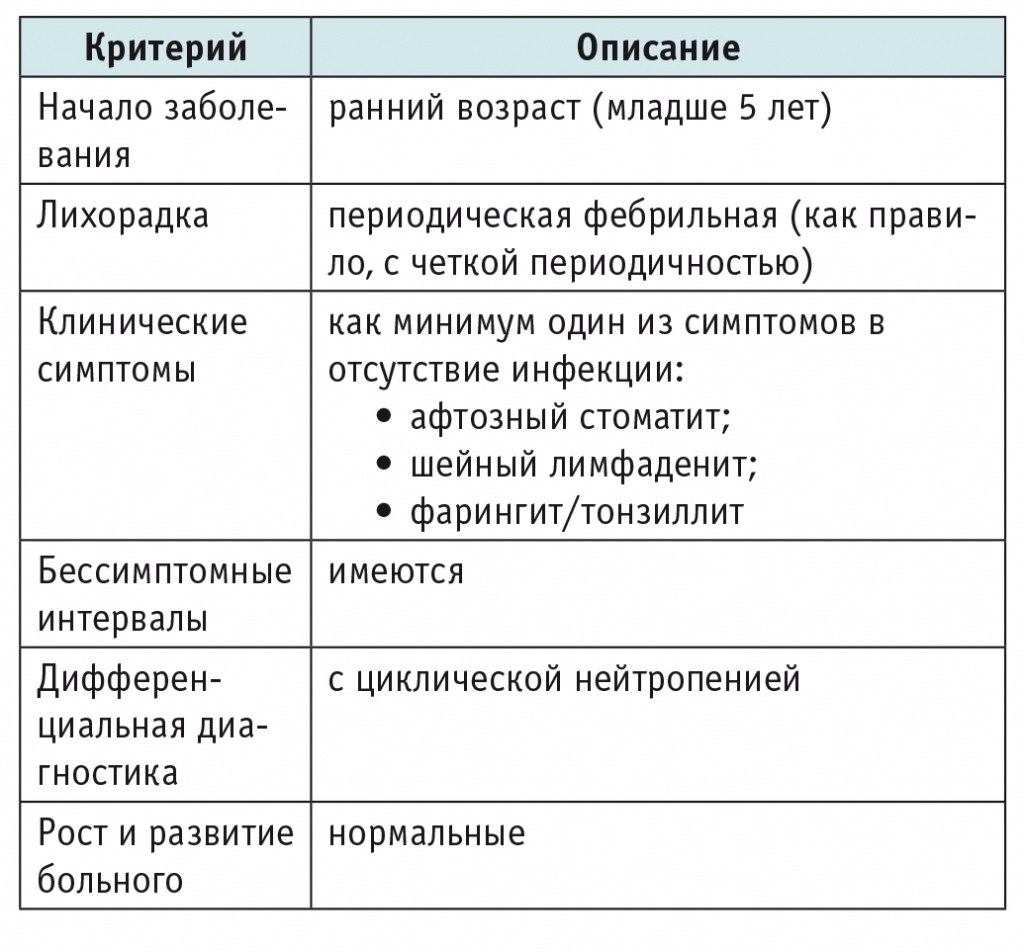
Как правило, это заболевание дебютирует в раннем детском возрасте, что отражено в критериях синдрома (см. табл. 2), однако его развитие описано и у взрослых, наиболее поздний дебют зафиксирован в возрасте 37 лет[1, 43].
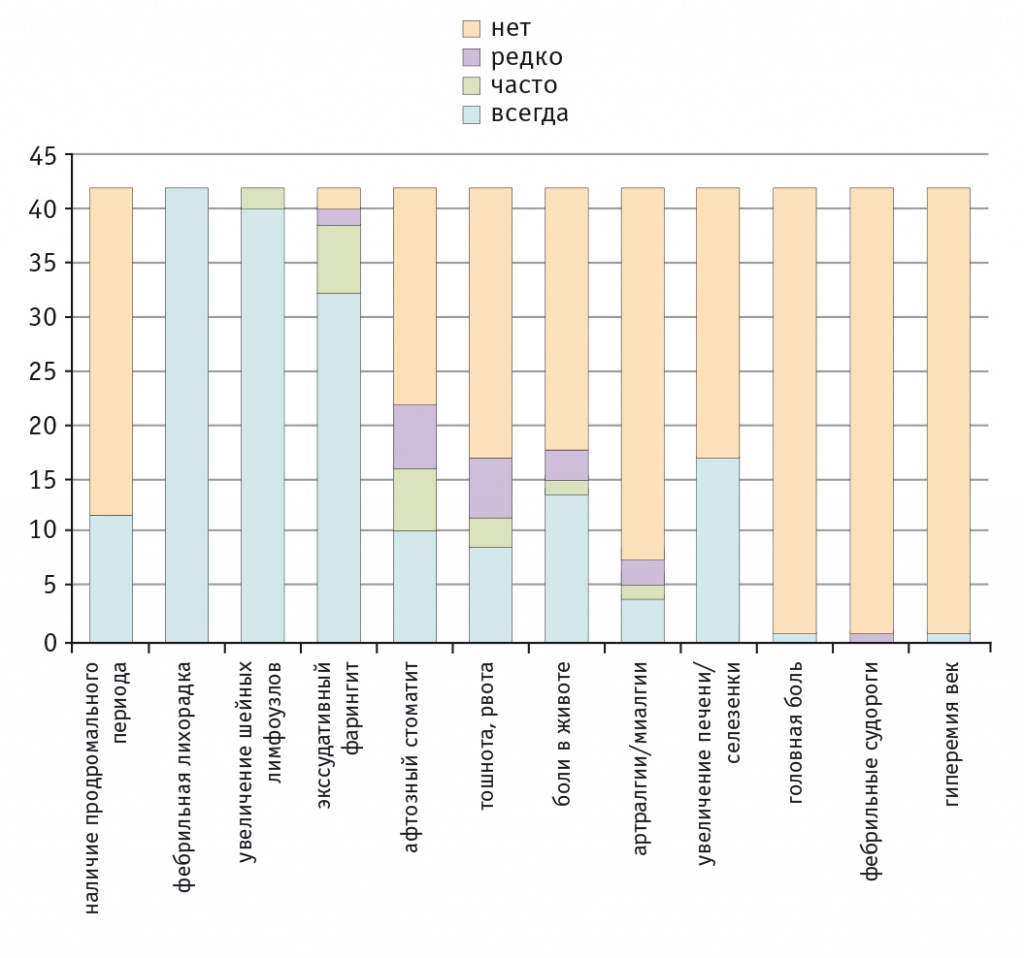
В начале очередной атаки больные отмечают недомогание, повышенную утомляемость, раздражительность. Нередко наблюдаются боли в животе, которые обычно имеют среднюю интенсивность и не требуют консультации хирурга. Фарингит, как правило, сопровождается одно- или двухсторонними наложениями на миндалинах, напоминающими ангину (рис. 1). Афты проявляются не у всех больных, обычно это мелкие (до 5 мм), несгруппированные, возможно, множественные поражения слизистой полости рта, которые возникают в первый день приступа и саморазрешаются в течение 5–10 дней. У некоторых больных афтозный стоматит может проявляться и в межприступный период[1, 36]. Часто выявляют лейкоцитоз с нейтрофильным сдвигом, повышение СОЭ[1]. Кроме того, по нашим данным, у больных с PFAPA встречаются более редкие симптомы (рис. 2).
Рис. 1. Фарингит с наложениями на миндалинах у больного с синдромом Маршалла (собственные данные)
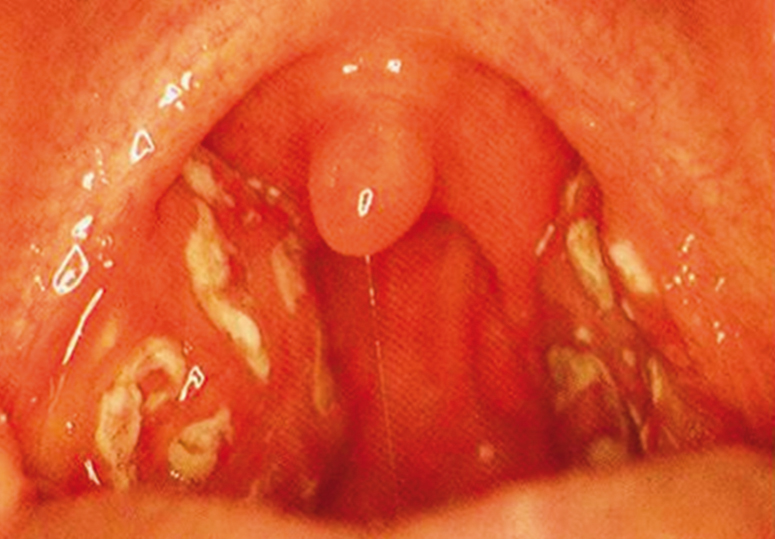
Рис. 2. Клиническая характеристика приступа синдрома Маршалла (собственные данные, 42 пациента), n
Интересно, что для детей с синдромом Маршалла характерно редкое возникновение обычных респираторных вирусных инфекций в периоды атак заболевания[36].
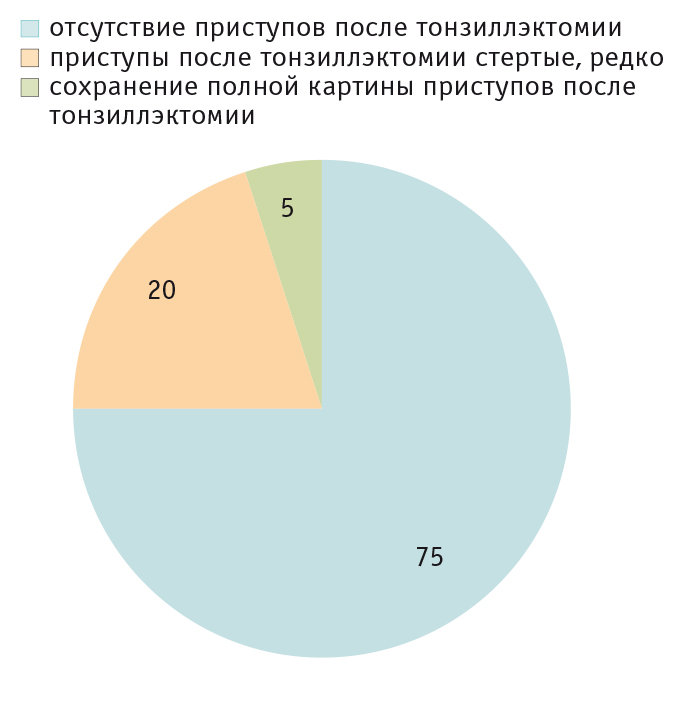
Терапия синдрома складывается из воздействия на два звена развития заболевания и включает в себя: 1) купирование лихорадочного приступа и сопутствующей симптоматики; 2) предупреждение новых атак заболевания. При купировании приступа НПВП и антибиотики неэффективны, а разовое применение глюкокортикоидов (ГК) в дозе 1–2 мг/кг (по преднизолону) в момент атаки прерывает приступ. Этот факт используют для подтверждения диагноза (тест с преднизолоном). В редких случаях требуется повторное применение ГК на следующий день. В межприступный период пациенты с синдромом Маршалла здоровы, однако приступы продолжают рецидивировать. Стероиды нередко меняют длительность межприступного периода (как увеличивают, так и укорачивают его). Кардинальным способом лечения является хирургическое вмешательство (тонзиллэктомия или аденотонзиллэктомия), которое в 90–95% случаев приводит к выздоровлению ребенка[23] (рис. 3). Данное заболевание носит доброкачественный характер, не приводит к системным осложнениям и купируется самопроизвольно по мере роста ребенка.
Рис. 3. Эффективность тонзиллэктомии в группе больных с синдромом Маршалла (собственные данные, 20 пациентов, время наблюдения от 1 года до 7 лет), %
КРИОПИРИНАССОЦИИРОВАННЫЙ ПЕРИОДИЧЕСКИЙ СИНДРОМ (CRYOPYRIN-ASSOCIATED PERIODIC SYNDROME, СAPS)
Возникает вследствие мутаций в гене CIAS1, кодирующем белок криопирин/NLRP3/PYPAF1 — основной компонент NLRP3-инфламмасомы. Дефект наследуется аутосомно-доминантно.
Клинически (и исторически) выделяют несколько нозологических форм в составе CAPS: семейный холодовой АВС (Familial Cold Autoinflammatory Syndrome, FCAS)/семейную холодовую крапивницу (Familial Cold Urticaria, FCU), синдром Макла — Уэллса (Muckle–Wells Syndrome, MWS) и младенческое мультисистемное воспалительное заболевание (Neonatal/Infantile Onset Multisystem Inflammatory Disease, NOMID/IOMID)/хронический младенческий неврологический кожно-артикулярный синдром (Chronic Infantile Neurological, Cutaneous, and Articular Syndrome, CINCA), которые, по сути, представляют собой разную комбинацию и степень выраженности симптомов CAPS. Представляет интерес тот факт, что одни и те же мутации могут вызывать различные клинические синдромы из этой группы[7, 9]. Кроме того, у 30–50% больных с типичной клинической картиной CAPS и хорошим ответом на терапию ИЛ-1-ингибитором не удается выявить мутации в гене CIAS1 методами традиционного секвенирования. У многих таких больных обнаруживают соматические, мозаичные мутации этого гена[45].
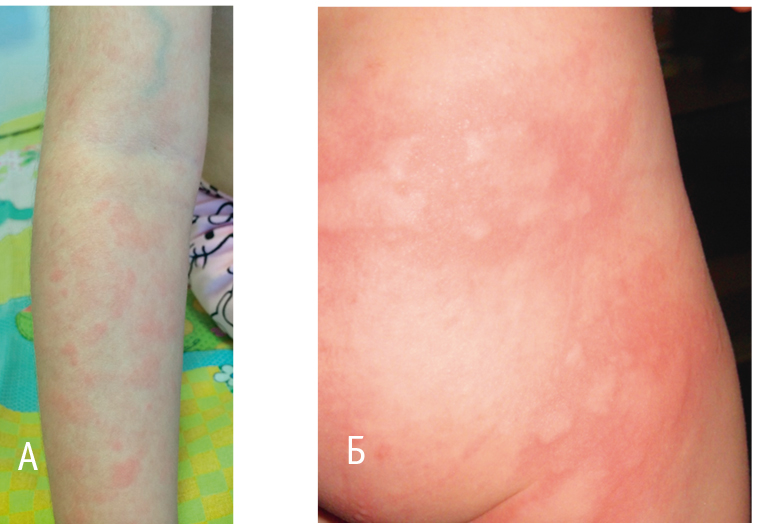
FCAS/FCU — наиболее легкий вариант CAPS, со значительным снижением качества жизни, однако без поражения внутренних органов. Характеризуется приступами лихорадки, сопровождающимися недомоганием, ознобом, артралгией, миалгией, появлением макулопапулезной или уртикарной сыпи, могут сочетаться с явлениями конъюнктивита и периартикулярным воспалением (рис. 4). Кожные высыпания могут сопровождаться зудом и болевым синдромом, наблюдаются приблизительно через 1,5 часа после стимула, сохраняются в течение 5–24 часов и купируются самостоятельно. Провоцирующими факторами являются холод, повышенная влажность, резкое понижение температуры окружающей среды. Приступы сопровождаются лейкоцитозом, увеличением СОЭ, повышением концентраций белков острой фазы (СРБ, сывороточного амилоида А). При биопсии элементов сыпи выявляется массивная нейтрофильная инфильтрация.
Рис. 4. Сыпь, характерная для криопиринассоциированых синдромов (собственные данные)
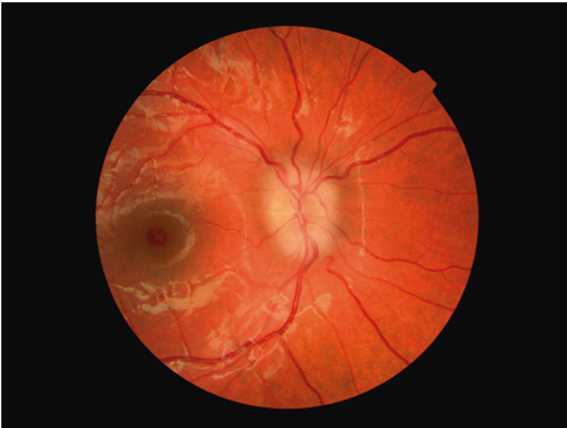
Клиническая картина MWS характеризуется регулярными (нередко ежедневными) эпизодами лихорадки, выраженным нарушением самочувствия, артралгиями, сыпью (см. рис. 4), конъюнктивитом, реже микрогематурией. Отмечают прогрессирующую лимфаденопатию, гепатоспленомегалию, боли в животе. Помимо нарушения качества жизни, задержки роста, прогноз определяется выраженностью поражения глаз, нарушения слуха и в некоторых случаях — развитием амилоидоза органов. Снижение слуха и в последующем полная глухота являются следствием кохлеарного воспаления и у больных с MWS могут проявляться (без лечения) как в первые годы, так и на 2–3-м десятилетии жизни. Хроническое поражение глаз включает увеит, инфильтраты и рубцы радужки, помутнение роговицы, отек зрительного нерва (рис. 5), что со временем приводит к его атрофии. В совокупности все эти изменения ведут к прогрессивному снижению зрения.
Рис. 5. Поражение глаз при синдроме Макла — Уэллса: отек диска зрительного нерва, спазм артерий, макулодистрофия (собственные данные)
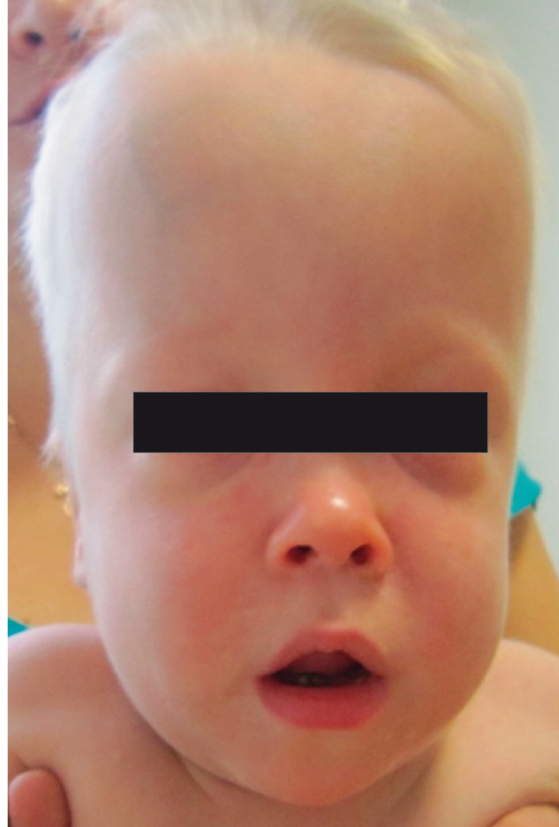
NOMID/CINCA — наиболее тяжелая форма CAPS. Характеризуется уртикарными высыпаниями, прогрессирующим поражением глаз, а также типичными деформирующими поражениями суставов и поражением нервной системы. Макулопапулезные, уртикарные высыпания часто присутствуют уже при рождении. Поражения суставов различны по степени: от транзиторного отека, не оставляющего никаких последствий в период между кризами, до избыточного роста хряща, при биопсии которого описывают дезорганизацию хрящевой ткани в отсутствие клеток воспаления, приводящую к массивной деформации суставов и выраженной инвалидизации (рис. 6). Следствием поражения хряща является характерный лицевой дисморфизм: выдающиеся лобные бугры и седловидная переносица (рис. 7). Поражение ЦНС проявляется в виде асептического менингита, повышенного внутричерепного давления, что со временем приводит к развитию гидроцефалии, церебральной атрофии, головных болей, судорожных синдромов, задержки психического развития различной степени. Результаты люмбальной пункции (повышенное содержание белка, нейтрофилов, иногда эозинофилов) свидетельствуют о течении хронического неинфекционного менингита. Лабораторно выявляют: анемию, лейкоцитоз, нейтрофилез, тромбоцитоз, увеличение СОЭ, повышение концентраций белков острой фазы. Характерно раннее развитие амилоидоза внутренних органов, в первую очередь почек, с развитием прогрессирующей полиорганной недостаточности[3, 27].
Рис. 6. Изменения суставов больного младенческим периодическим мультисистемным воспалительным заболеванием (собственные данные)
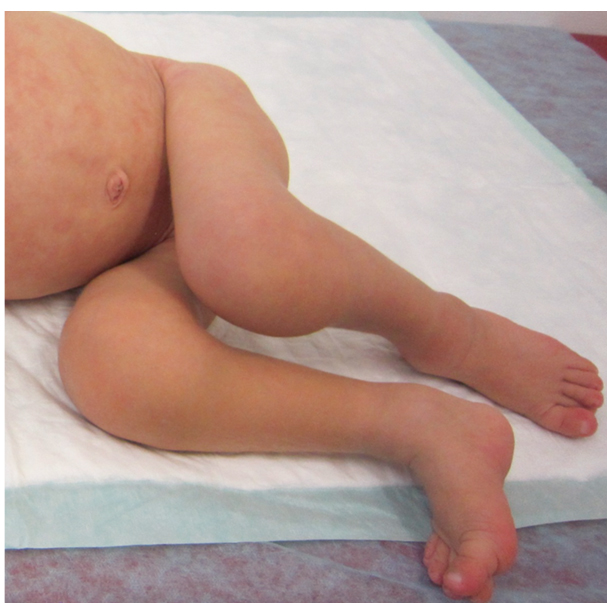
Рис. 7. Характерный лицевой дисморфизм больного младенческим периодическим мультисистемным воспалительным заболеванием (собственные данные)
Терапия семейной холодовой крапивницы сводится к предупреждению воздействия холода и назначению НПВП во время атак. Единственным методом лечения для пациентов, страдающих синдромами MWS и NOMID/CINCA, является назначение ингибитора ИЛ-1[3, 27].
ПЕРИОДИЧЕСКИЙ СИНДРОМ, АССОЦИИРОВАННЫЙ С РЕЦЕПТОРОМ ФАКТОРА НЕКРОЗА ОПУХОЛИ 1-ГО ТИПА (TUMOR NECROSIS FACTOR RECEPTOR 1 ASSOCIATED PERIODIC SYNDROME, TRAPS)
TRAPS представляет собой синдром с аутосомно-доминантным типом наследования. Ген TNFRSF1A, мутация в котором отвечает за данную патологию, локализован на коротком плече 12-й хромосомы (12р13). Этот ген кодирует TNF-рецептор 1-го типа[22, 38]. Патогенез заболевания до конца не ясен, однако недавно проведенные исследования показали, что мутантный рецептор накапливается внутри клеток и это приводит к увеличению синтеза провоспалительных цитокинов вследствие активации синтеза активных радикалов кислорода и/или непосредственной активации инфламмасомы[14, 46].
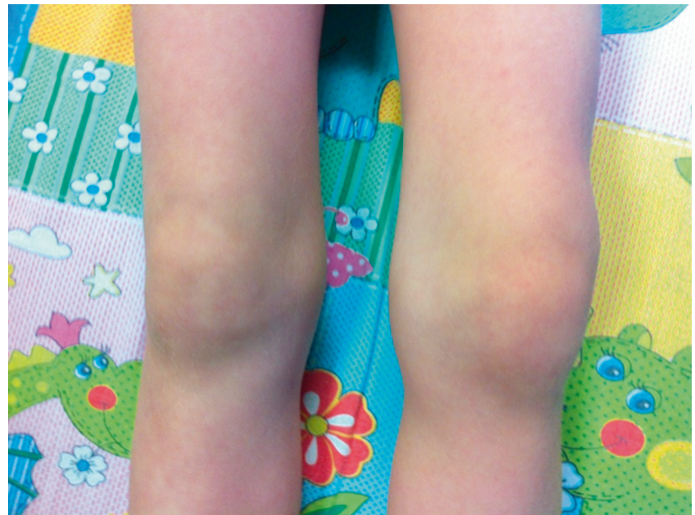
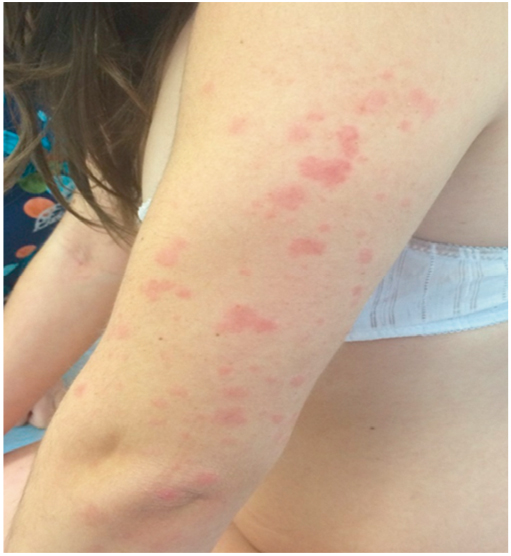
TRAPS характеризуется приступами лихорадки, болями в животе и локальными миалгиями. Описаны также эпизодическая эритематозная сыпь, лимфаденопатия, конъюнктивит, односторонний периорбитальный отек (рис. 8), синдром отечной мошонки, артралгия/артрит (рис. 9) [4]. Продолжительность атак вариабельна (от одного дня до нескольких месяцев) и в среднем составляет 2–3 недели. Инфекции, стресс, повышенное физическое и эмоциональное напряжение часто являются провоцирующими факторами. У 10–25% пациентов течение заболевания приводит к развитию АА-амилоидоза с формированием полиорганной недостаточности[4, 22].
Рис. 8. Периорбитальный отек у больной с периодическим синдромом, ассоциированным с рецептором фактора некроза опухоли 1-го типа (собственные данные)
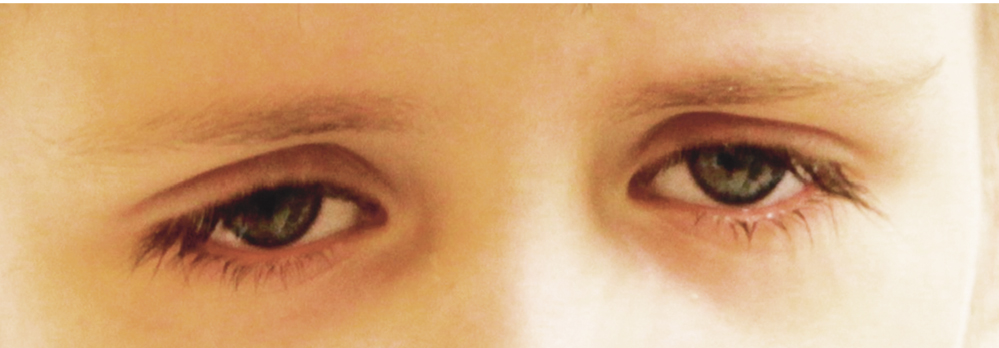
Рис. 9. Поражение суставов у больной с периодическим синдромом, ассоциированным с рецептором фактора некроза опухоли 1-го типа (собственные данные)
Терапия TRAPS до недавнего времени заключалась в применении ГК в момент приступа, однако это не обеспечивает полной эффективности и при длительном сроке закономерно сопровождается развитием нежелательных явлений. Несмотря на наличие мутации в гене, кодирующем TNF-рецептор, применение блокаторов TNF оказалось результативным не во всех случаях, отмечено, что их эффект является непродолжительным и зачастую неполным[13]. В настоящее время среди направлений терапии TRAPS, по мнению ряда экспертов и по нашему опыту, наиболее перспективно применение блокаторов ИЛ-1[4, 12, 15].
ГИПЕР-IGD-СИНДРОМ (HYPERIMMUNOGLOBULINEMIA D SYNDROME, HIDS)
Ответственным за развитие HIDS является ген MVK, локализованный на длинном плече 12-й хромосомы (12q24), который кодирует синтез мевалонаткиназы[18]. Это аутосомно-рецессивно наследуемое заболевание. Следствием генетического дефекта является увеличение концентрации мевалоновой кислоты в моче на фоне приступа. Каким образом дефицит мевалонаткиназы вызывает развитие данной клинической патологии и повышение уровня IgD, до сих пор неизвестно.
Продолжительность приступов при данном заболевании составляет 3–7 дней, эпизоды обострения повторяются каждые 4–6 недель. Часто возникновению приступов предшествуют провоцирующие факторы: стресс, операция, травма, вакцинация. Приступы начинаются внезапно, с подъема температуры. Боли в животе, диарея, рвота, артралгия встречаются в 70–80% случаев. Часть пациентов подвергалась повторным лапаротомиям в связи с выраженностью болевого синдрома, при этом у них отмечали лишь признаки мезентериального лимфаденита. Во время атаки заболевания выявляют генерализованную лимфаденопатию (рис. 10) и у половины больных — спленомегалию, в 80% случаев обнаруживают пятнистую или пятнисто-папулезную сыпь локального характера (рис. 11), почти у 70% больных имеются проявления артрита, обычно симметричного, с поражением крупных суставов. При этом отмечено, что кожные и суставные симптомы разрешаются медленно[2].
Рис. 10. Лимфаденопатия у пациентки с гипер-IgD-синдромом (собственные данные)
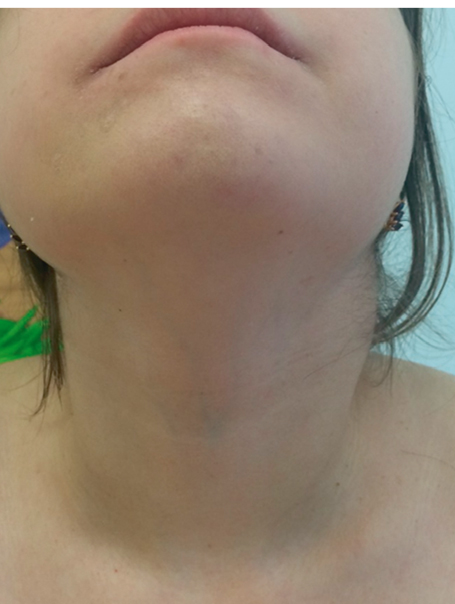
Рис. 11. Сыпь у пациентки с гипер-IgD-синдромом (собственные данные)
Лабораторно определяют повышение уровня сывороточного IgD более чем на 100 МЕ/мл (откуда и происходит название синдрома), однако это необязательный симптом заболевания, особенно у детей младшего возраста[34]. Во время приступа также отмечают ускорение СОЭ, лейкоцитоз, повышение концентрации СРБ.
Лечение синдрома остается не до конца решенной проблемой. Использование колхицина и иммуносупрессантов не увенчалось успехом. Обнадеживающей представляется терапия селективными ингибиторами цитокинов, в первую очередь ингибитором ИЛ-1, а также ингибиторами ФНО[11, 47]. Для последней группы препаратов, однако, характерно «ускользание» эффекта со временем. Таким образом, полный контроль над симптомами у этих пациентов проблематичен.
СЕМЕЙНАЯ СРЕДИЗЕМНОМОРСКАЯ ЛИХОРАДКА (FAMILIAL MEDITERRANEAN FEVER, FMF)
FMF — один из наиболее исследованных синдромов, с которого началась эра изучения аутовоспалительных заболеваний. Как следует из названия, болезни наиболее подвержены представители национальностей, распространенных в зоне средиземноморского бассейна (евреи-сефарды, турки, армяне, северные африканцы и арабы). Ген, дефект которого обусловливает FMF, локализован на коротком плече 16-й хромосомы (16p13.3) и обозначается как МEFV [1, 21]. Ген и его мутации впервые были описаны в 1997 г. Для этого заболевания характерен аутосомно-рецессивный тип наследования.
Характерны короткие эпизоды лихорадки (24–48 часов) в сочетании с выраженным серозитом, который проявляется в виде болей в животе и грудной клетке. В момент приступа возможны также рвота, артрит/артралгия, рожеподобные высыпания на коже. Обычно за год случается несколько эпизодов[6].
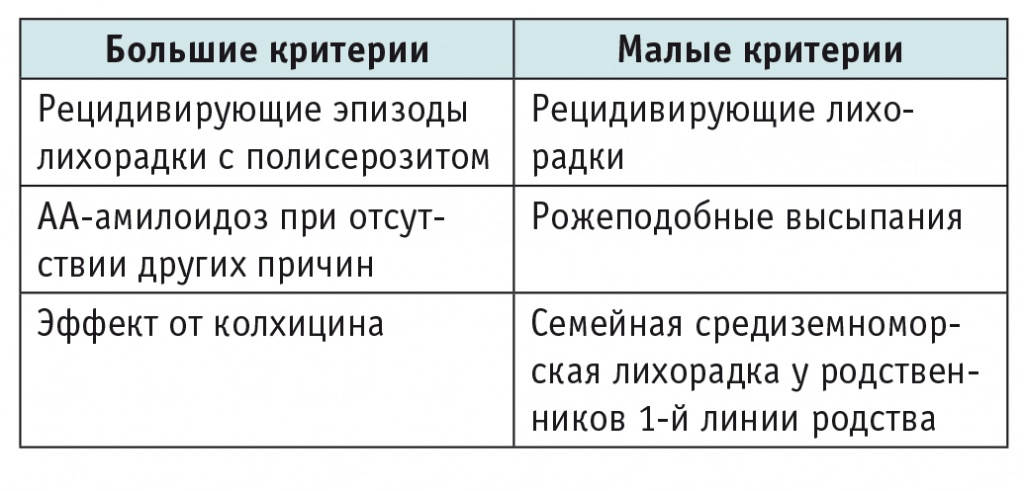
Для диагностики наиболее часто используют критерии Тель ха-Шомер (табл. 3)[10]. Для установления определенного диагноза необходимо наличие у пациента двух больших критериев или одного большого критерия и двух малых; вероятный диагноз устанавливают, если у пациента отмечены один большой и один малый критерии.
Таблица 3
Критерии клиники Тель ха-Шомер (Тель-Авив)[10]
Для постановки окончательного диагноза крайне важно молекулярно-генетическое исследование гена MEFV. Известно, что в типичных случаях FMF больные имеют гомозиготные мутации MEFV, однако описывают все больше случаев типичной клиники FMF и гетерозиготного носительства мутации MEFV [42]. Нельзя исключить, что у таких больных есть другие, в том числе соматические, генетические дефекты.
Колхицин является препаратом первой линии в лечении FMF[28], но некоторые пациенты с неполный ответом на терапию отмечают сохраняющиеся эпизоды лихорадки и/или имеют субклиническое повышение концентраций белков острой фазы. У части этих больных в будущем развивается амилоидоз. С развитием средств биологической терапии в лечении FMF у резистентных к колхицину пациентов с успехом стали использоваться блокаторы ИЛ-1[39, 41].
ХРОНИЧЕСКИЙ РЕЦИДИВИРУЮЩИЙ МУЛЬТИФОКАЛЬНЫЙ ОСТЕОМИЕЛИТ (CHRONIC RECURRENT MULTIFOCAL OSTEOMYELITIS, CRMO), ИЛИ ХРОНИЧЕСКИЙ НЕБАКТЕРИАЛЬНЫЙ ОСТЕОМИЕЛИТ (CHRONIC NONBACTERIAL OSTEOMYELITIS, CNO)
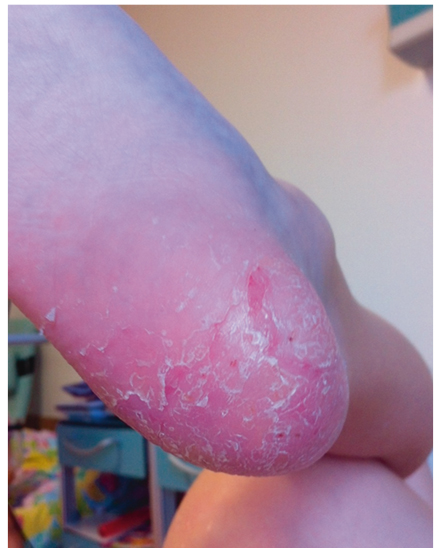
Синдром впервые был описан в 1972 г. A. Giedion и соавт.[25]. Он характеризуется рецидивирующими неинфекционными очагами костной деструкции и является заболеванием преимущественно детского возраста: средний возраст начала составляет 10 лет (2–17 лет). В патологический процесс могут быть вовлечены все кости скелета, но чаще очаги локализуются в метафизах длинных костей и ключице[30, 44] (рис. 12). Часть пациентов, страдающих CRMO, имеют сопутствующие аутовоспалительные заболевания: псориаз, воспалительные заболевания кишечника, — что дополнительно подчеркивает его аутовоспалительную природу (рис. 13)[33].
Рис. 12. Магнитно-резонансные томограммы поражения костей больного хроническим рецидивирующим мультифокальным остеомиелитом (собственные данные)
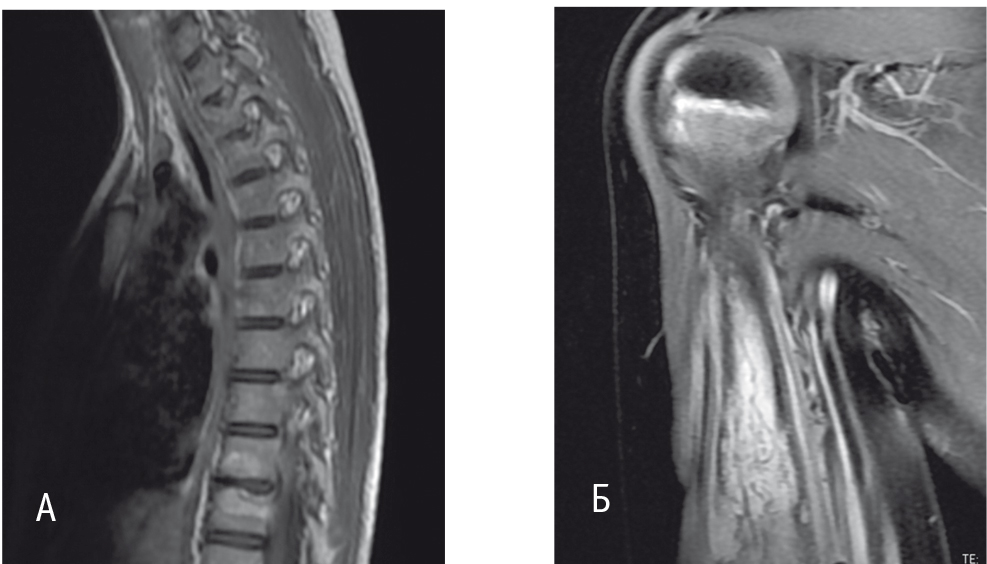
Рис. 13. Псориаз у больного хроническим рецидивирующим мультифокальным остеомиелитом (собственные данные)
Этиология заболевания неизвестна, однако есть ряд аутовоспалительных заболеваний с поражением костей и дополнительной симптоматикой, которые имеют выявленную генетическую основу: Pyogenic Sterile Arthritis, Pyoderma Gangrenosum and Acne (пиогенный стерильный артрит в сочетании с гангренозной пиодермией, выраженными акне и фурункулезом); Deficiency of the Interleukin-1 Receptor Antagonist (дефицит антагониста рецептора интерлейкина 1); Majeed. Патогенез поражения костей у этих больных не установлен, но существует версия, связанная с недостаточностью выработки ИЛ-10, нарушением цитокинового баланса, гиперпродукцией ФНО, ИЛ-6 и в последующем — с развитием воспалительного процесса в кости[29, 32].
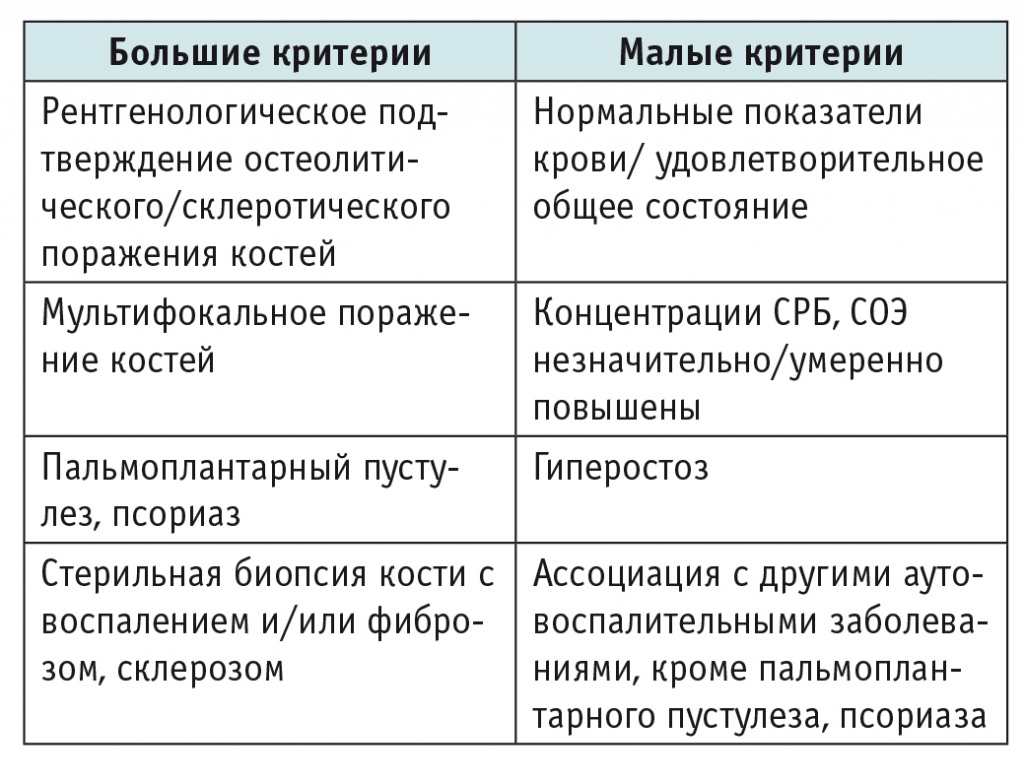
Клиническая картина представлена болью в области поражения, местным повышением температуры, отеком, иногда общим повышением температуры тела. Лабораторные показатели при CRMO неспецифичны. У части больных наблюдают повышение концентраций острофазовых белков крови (СОЭ, СРБ), может быть обнаружен лейкоцитоз с нейтрофилезом, однако есть и больные с нормальными показателями крови[30]. Диагностические критерии CRMO представлены в таблице 4[40]. Постановка диагноза CRMO правомочна при наличии двух больших критериев или одного большого критерия и трех малых.
Таблица 4
Диагностические критерии мультифокального остеомиелита[40]
Патоморфологическая картина CRMO характеризуется изменениями, укладывающимися в картину неспецифического воспаления. Они проявляются образованием в межкостных пространствах фокусов из полиморфноядерных лейкоцитов по типу микроабсцессов, по периферии которых определяются лимфоидная инфильтрация и рассеянные гигантские многоядерные клетки типа инородных тел. Отмечают также явления перестройки, резко выраженного полнокровия и лакунарного рассасывания, сильнее проявляющегося вблизи очагов воспаления. В очагах с резко выраженными явлениями воспаления определяют склероз мелких сосудов системы питающей артерии, местами с возникновением тромбоза и явления, описываемого в литературе как «луковичный» склероз[40].
Рентгенологическую картину костных повреждений практически невозможно отличить от бактериального остеомиелита, что весьма усложняет дифференциальную диагностику. Поэтому обязательным этапом диагностического поиска является исключение бактериального остеомиелита, неопластических процессов (лимфомы, саркомы Юинга, лейкоза, гистиоцитоза, метастазирования и т. д.). В связи с этим проводят биопсию очага поражения для морфологического и микробиологического исследований.
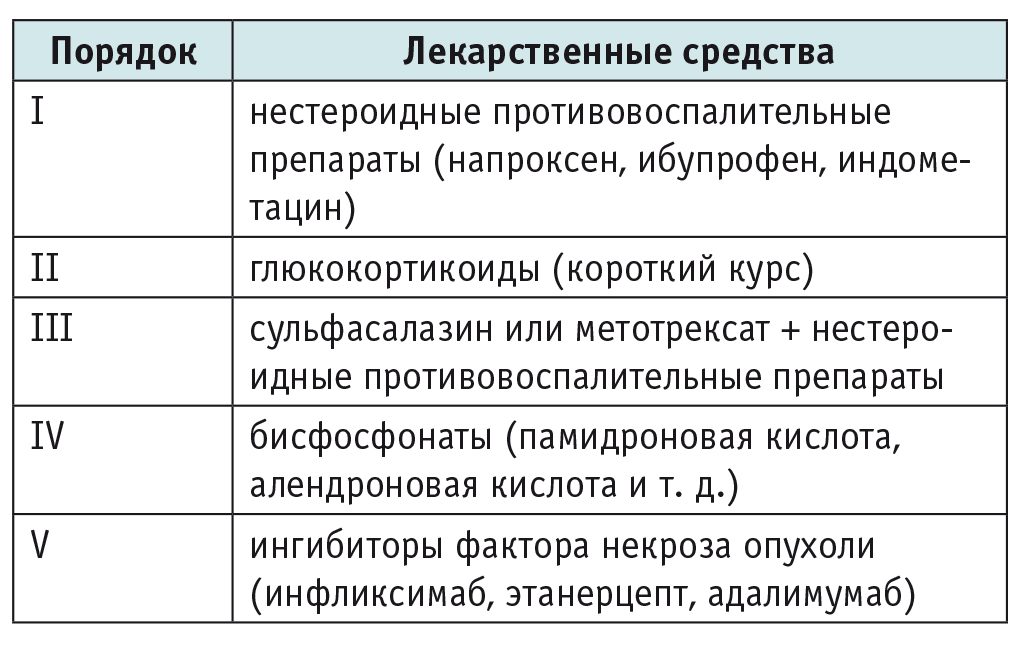
Лечение CRMO эмпирическое и включает в себя использование НПВП, ГК, сульфасалазина, метотрексата, ингибиторов ФНО и бисфосфонатов. Однако существует множество разногласий по вопросу о необходимости применения препаратов II–III порядка (табл. 5)[26].
Таблица 5
Препараты, используемые в лечении больных хроническим рецидивирующим мультифокальным остеомиелитом[26]
Прогноз при CRMO в целом удовлетворительный. Возможны прогрессирующий склероз в очагах поражения, чрезмерный гиперостоз, преждевременное закрытие зон роста длинных костей, прогрессирующий кифоз при поражении позвонков, в то же время есть данные о восстановлении костной структуры в очагах[19].
ЗАКЛЮЧЕНИЕ
В диагностике аутовоспалительных синдромов (АВС) важную роль отводят генетическому анализу. Выявление мутаций причинных генов необходимо для верификации варианта АВС, которые нередко фенотипически очень схожи между собой. Кроме того, важно, что выявление причинного генетического дефекта часто определяет тактику ведения больного и прогноз заболевания. Наконец, выявление причинной мутации позволяет провести консультирование всех членов семьи и при необходимости осуществить пренатальную или преимплантационную диагностику, благодаря чему можно предотвратить рождение других больных детей в семье или осуществить раннюю диагностику и своевременную терапию заболевания.
В настоящее время для лечения АВС используют спектр препаратов, модулирующих те или иные звенья воспаления. Однако по-прежнему существует проблема резистентности к имеющейся в арсенале терапии. Это говорит о необходимости разработки новых биологических препаратов, позволяющих контролировать воспаление. Кроме того, патогенетическая терапия АВС является пожизненной, дорогостоящей и иногда сопровождается нежелательными реакциями, что ухудшает качество жизни больных. В таких случаях логично изучение эффективности методов терапии с применением клеточных технологий (трансплантации гемопоэтических стволовых клеток и генной терапии).
Больные с АВС нуждаются в мультидисциплинарном подходе с участием различных специалистов. Наиболее существенным аспектом диагностики представляется осведомленность врачей первичного звена о наличии таких редких заболеваний, как АВС, поскольку раннее распознание этих состояний является ключом к успешному лечению.







