Ожирение стало тяжелой проблемой общественного здравоохранения во многих странах мира. В настоящее время распространенность избыточной массы тела и ожирения среди взрослого населения в странах Европы превышает 40% [4]. Вызывает тревогу высокая распространенность ожирения среди детей и подростков. По данным мультицентрового исследования, проведенного В. А. Тутельяном и соавт., распространенность избыточной массы тела и ожирения в различных регионах России оказалась сходной: в Астрахани — 18,8% и 4,7%; в Екатеринбурге — 20,7% и 5,3%; в Красноярске — 22,0% и 6,7%; в Санкт-Петербурге — 18,7% и 5,9%; в Самаре — 19,4% и 6,0% соответственно [9].
Ожирение давно признано в качестве независимого фактора риска развития сердечно-сосудистых заболеваний и сахарного диабета. Новые исследования показывают, что оно является также фактором риска формирования хронических заболеваний почек [2, 13, 18]. Потенциальные механизмы, посредством которых ожирение влияет на почечную ткань, включают инсулинорезистентность и гиперлипидемию, изменение гемодинамики, активацию ренин-ангиотензин-альдостероновой системы (РААС), воспаление и окислительный стресс [21].
При обследовании больных с подозрением на почечную патологию наряду с клинико-анамнестическими данными и лабораторными тестами важную роль играют визуальные диагностические методы (рентгеновские, ультразвуковые, магнитно-резонансные, радионуклидные) [5, 22]. Рентгенография является первым визуализирующим методом. Хотя она широко использовалась во второй половине прошлого века, следует учитывать, что дети имеют высокие темпы пролиферации клеток, особенно во время физиологических скачков роста, и, следовательно, являются более радиочувствительными. Появление йодсодержащих контрастных средств, позволяющих визуализировать структуру органа, дало возможность расширить перечень показаний для проведения рентгенографии и обусловило появление в числе диагностических методов таких исследований, как экскреторная урография, цистография, ангиография. Однако ангиография имеет очень ограниченное применение в педиатрической практике в связи со сложностью и потенциальной опасностью ее проведения.
КТ сопряжена с высокой дозой облучения [23]. Для проведения МРТ требуется дорогостоящее оборудование и необходимо проведение седации детей дошкольного и младшего школьного возраста. Радиоизотопные методы используются для уточнения функционального состояния почек. УЗИ в связи с его повсеместным распространением, экономической доступностью и неинвазивностью используется в качестве метода визуализации первой линии [17]. Появление новых ультразвуковых технологий значительно расширило возможности применения ультразвука, в том числе в уронефрологии. Помимо определения морфологических параметров (размеров почек, толщины паренхимы, эхогенности), посредством УЗИ можно оценить и функциональные параметры (в частности, провести качественную и количественную оценку кровотока) [7].
Количественно оценить жесткость почечной ткани возможно с помощью нового метода ультразвуковой диагностики — эластографии сдвиговой волны [3]. Принцип действия метода основан на генерации в тканях сдвиговой волны и последующей оценке скорости ее распространения [8]. Метод эластографии сдвиговой волны на сегодняшний день используется в диагностике заболеваний печени, молочной железы, щитовидной железы [1, 3]. Данных по его применению для диагностики заболеваний почек в литературе мало.
Цель исследования: оценить возможности использования эластографии сдвиговой волны почек в качестве метода ранней неинвазивной диагностики почечных нарушений у детей, страдающих ожирением и метаболическим синдромом.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 79 пациентов, страдающих ожирением, в возрасте от 11 до 17 лет, находившихся на стационарном лечении в педиатрическом отделении № 1 ОГБУЗ «Детская клиническая больница» г. Смоленска (заведующая отделением — к. м. н., доцент кафедры госпитальной педиатрии, врач высшей категории Т. А. Плескачевская) в 2015-2016 гг. Исследование выполнено в соответствии с Хельсинкской декларацией1 и одобрено этическим комитетом Смоленского государственного медицинского университета.
У всех обследованных детей оценивали клинико-анамнестические и антропометрические данные: вес (кг), рост (см), окружность талии (см), индекс массы тела (ИМТ, кг/м2). В работе была использована классификация ожирения на основе перцентильных таблиц ИМТ в сопоставлении его с полом и возрастом пациента.
Метаболический синдром устанавливался согласно рекомендациям Международной федерации диабета (International Diabetes Federation) 2007 г. [10]. Детей 11-16 лет включали в группу метаболического синдрома при наличии абдоминального ожирения в сочетании с двумя из следующих дополнительных критериев: артериальная гипертензия (АГ); уровень триглицеридов более 1,7 ммоль/л; содержание ЛПВП менее 1,03 ммоль/л; уровень глюкозы плазмы крови натощак более 5,6 ммоль/л. Метаболический синдром у детей старше 16 лет определяли согласно критериям для взрослых [10]. АГ диагностировали в случае повышения средних уровней систолического и/или диастолического артериального давления (АД) для данного возраста, пола, роста по результатам суточного мониторирования АД.
Общеклиническое обследование включало общие анализы крови и мочи; проводился биохимический анализ крови с определением параметров липидного и углеводного обмена, протромботического статуса.
Пациенты были разделены на две группы: первую составили дети с метаболическим синдромом (n = 26), вторую — дети с ожирением (n = 53). В контрольную группу вошли дети 2-й группы здоровья с нормальной массой тела, не имевшие патологии мочевыделительной системы (n = 16).
УЗИ почек проводилось при помощи цифровой ультразвуковой портативной системы АНГИОДИН-Соно/П-Ультра (НПФ «БИОСС», Россия) электронным конвексным датчиком с диапазоном частот 3-6 МГц в положении больного лежа на животе. УЗИ включало сканирование в В-режиме с оценкой размеров, расположения и контуров почек, исследование в режиме энергетического допплера и эластографию паренхиматозного слоя почек в шести точках в продольном и поперечном направлениях с оценкой жесткости почечной паренхимы в килопаскалях. Выбор точек был обусловлен анатомическим строением почки (рис. 1).
Рис. 1. Точки эластометрии паренхимы почек
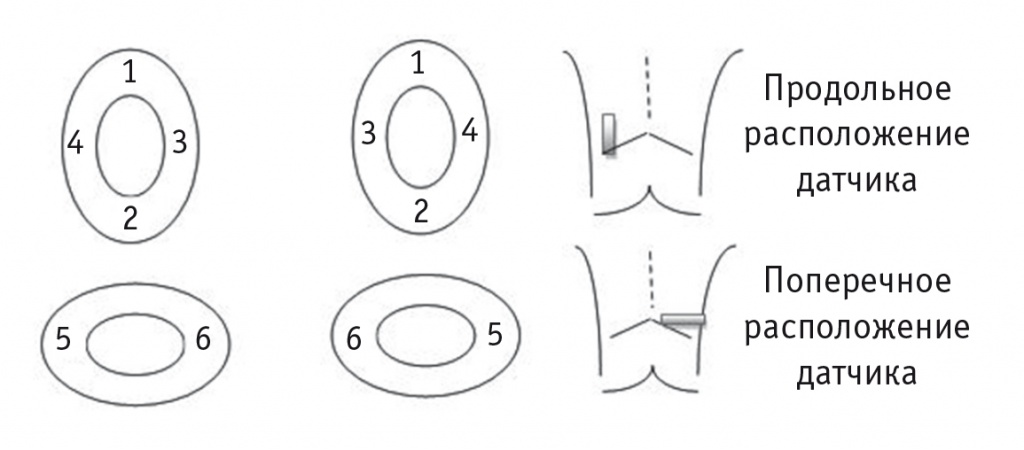
При исследовании в серошкальном режиме при хорошей визуализации всех отделов почек включали режим эластометрии сдвиговой волны. Измерение проводится при задержке дыхания. На экране на фоне серошкального изображения в виде цветовой эластограммы кодируется эластичность исследуемого отдела почечной паренхимы: жесткая ткань, характеризующаяся высокими показателями в килопаскалях, картируется в красной цветовой гамме; ткань с низкими показателями в килопаскалях — в голубой цветовой гамме. На экране при этом отображается показатель упругости (кПа). Средний показатель в килопаскалях регистрируется, когда отклонение от средней величины не превышает 30%.
Статистическую обработку проводили с помощью пакетов прикладных программ Microsoft Excel 2000 и Statistica 7. Данные представляли в виде медианы (Ме) и стандартного отклонения (SD), 25-го и 75-го процентилей. Для сравнения полученных показателей использовали критерии Манна — Уитни, Колмогорова — Смирнова. Статистическую значимость различий констатировали при p < 0,05.
РЕЗУЛЬТАТЫ
При оценке антропометрических показателей была выявлена тенденция (p > 0,05) к более высоким показателям массы тела у детей с метаболическим синдромом (94,57 ± 13,72 кг), чем у детей с ожирением (87,15 ± 12,68 кг). Аналогичная тенденция отмечена при сравнении ИМТ, который в первой группе составил 34,94 ± 3,78 кг/м2, а во второй — 31,23 ± 2,80 кг/м2.
При оценке углеводного обмена в группе детей с метаболическим синдромом в трех случаях выявлялись показатели сахара крови, соответствовавшие нарушенной гликемии натощак. В целом различий по уровню гликемии у детей групп сравнения получено не было: средний показатель гликемии натощак в первой группе составил 5,60 ± 0,84 ммоль/л, во второй — 5,37 ± 0,31 ммоль/л.
Анализ показателей липидного спектра выявил статистически значимое повышение уровня триглицеридов у детей с метаболическим синдромом по сравнению с детьми с ожирением: 2,10 ± 0,04 ммоль/л в первой группе против 1,05 ± 0,02 ммоль/л во второй (p < 0,05). Показатели общего холестерина, коэффициента атерогенности статистически значимых различий не имели. Содержание холестерина ЛПВП в первой группе составило 0,86 ± 0,15 ммоль/л против 1,49 ± 0,27 ммоль/л во второй (p < 0,05).
По результатам суточного мониторирования АД у 16 детей первой группы регистрировалась АГ: лабильная (n = 9; 56,25%) и стабильная (n = 7; 43,75%). АГ у всех детей с метаболическим синдромом была 1-й степени, высокого риска. Во второй группе АГ не регистрировалась.
При проведении эластографии были выявлены статистически значимые различия по показателю эластичности почечной паренхимы между детьми с метаболическим синдромом и с ожирением, между детьми с метаболическим синдромом и участниками контрольной группы, а также между детьми с ожирением и участниками контрольной группы (табл.).
Таблица
Показатели эластичности почечной паренхимы у обследованных детей, кПа
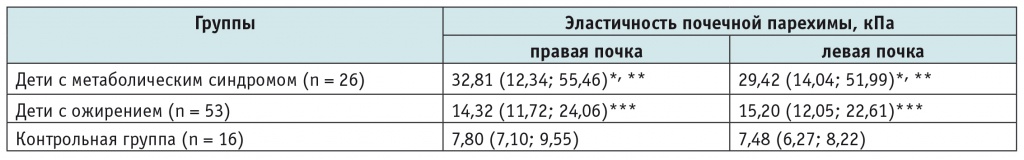
* Различия между детьми с метаболическим синдромом и детьми контрольной группы статистически значимы: р < 0,05.
** Различия между детьми с метаболическим синдромом и детьми с ожирением статистически значимы: р < 0,05.
*** Различия между детьми с ожирением и детьми контрольной группы статистически значимы: р < 0,05.
Примечание. Данные представлены как медиана (25-й процентиль; 75-й процентиль).
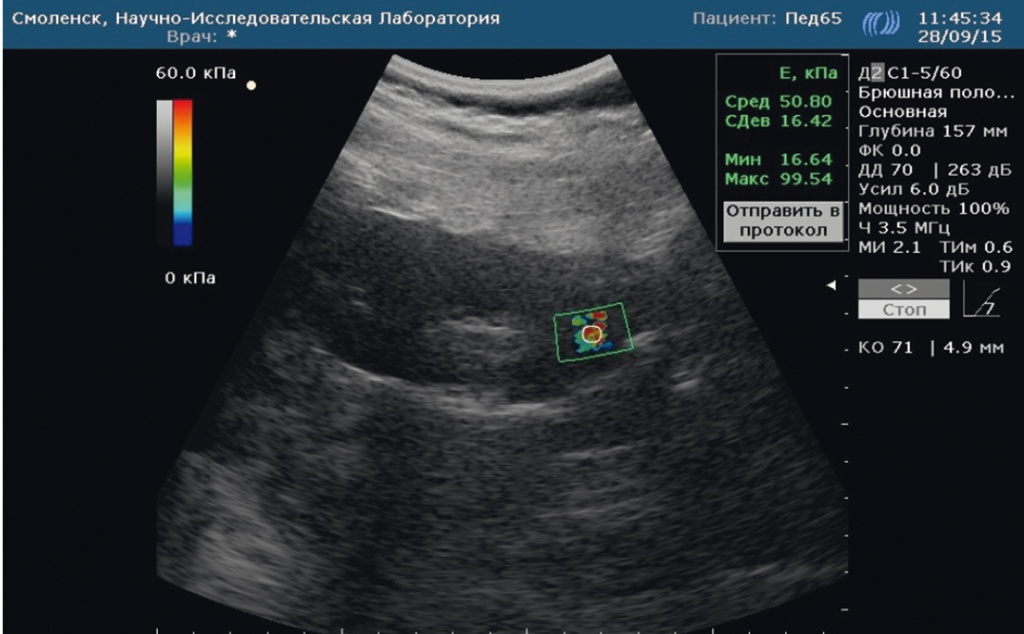
На рисунках 2 и 3 представлены для сравнения эхограммы почки у ребенка контрольной группы (см. рис. 2) и ребенка с метаболическим синдромом (см. рис. 3).
Рис. 2. Эластограмма паренхимы почки ребенка контрольной группы: низкий показатель жесткости паренхимы. Фото авторов
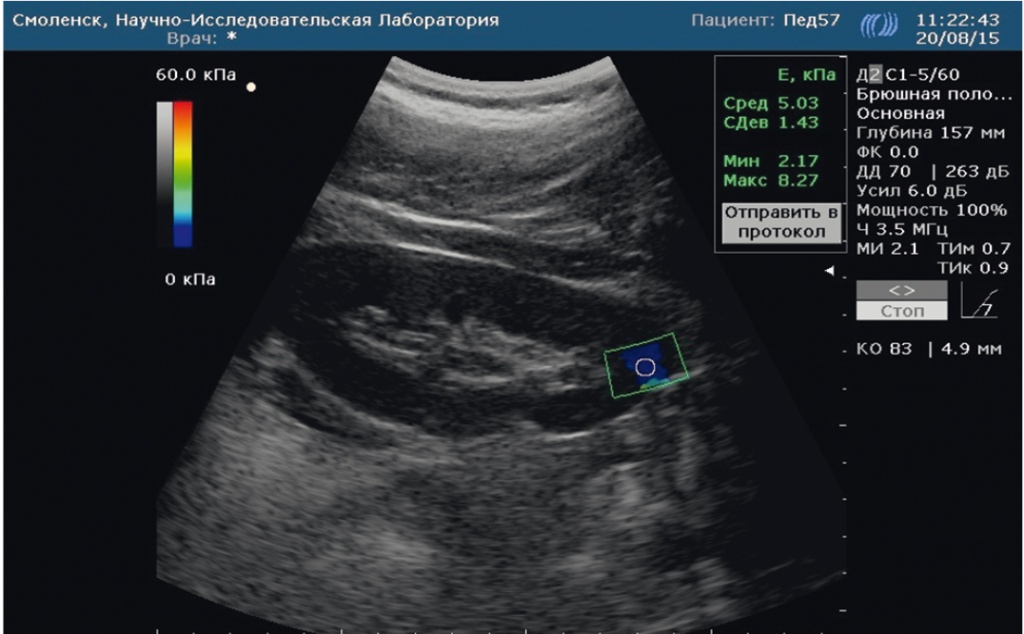
Рис. 3. Эластограмма паренхимы почки ребенка с метаболическим синдромом: высокий показатель жесткости паренхимы. Фото авторов
ОБСУЖДЕНИЕ И ВЫВОДЫ
Жировая ткань представлена в разных количествах во всех тканях организма. Ее распределение зависит от пола, возраста, характера питания, генетических особенностей, физической активности [6]. Около 80-90% жировой ткани распределено подкожно в области живота, ягодичных и бедренных областях. Висцеральная жировая ткань составляет приблизительно 10-20% и располагается в области сердца, суставов, печени, почек, сальниках. Именно висцеральное ожирение является фактором риска развития сердечно-сосудистых заболеваний и метаболических нарушений.
Жировая ткань почек представлена околопочечной жировой клетчаткой и жиром почечного синуса. Жир почечного синуса представляет собой периваскулярную жировую ткань вокруг крупных ветвей почечной артерии и вены, лимфатических сосудов, чашечек почки, мочеточников. Накопление жира вокруг почек играет роль в нарушении функции почек и повышении АД [15, 16]. В исследованиях на животных, страдающих ожирением, показано, что увеличение содержания жира в почечном синусе смещает и сдавливает почечные лимфатические сосуды и вены, а также мочеточники [12, 19]. Сдавление этих структур приводит к увеличению почечного гидростатического давления и активирует РААС. Активация РААС способствует развитию АГ, инсулинорезистентности, атеросклероза. В другом исследовании накопление липидов в области почечной паренхимы за счет развития липотоксичности приводило к воспалению, окислительному стрессу и почечному фиброзу [20]. Эти исследования подтверждают ассоциацию накопления липидов в почках с сопутствующими структурными и функциональными изменениями в них [11, 14].
Таким образом, выявленные нами изменения показателей эластичности почечной паренхимы у детей с ожирением могут свидетельствовать о нарастании стеатоза почечного синуса, что ведет к повышению жесткости почки путем давления изнутри на паренхиму с уменьшением объема паренхимы, ограниченной почечной капсулой.
ЗАКЛЮЧЕНИЕ
С учетом полученных данных эластография сдвиговой волны является информативным неинвазивным методом оценки состояния почек у детей с ожирением и метаболическим синдромом и диагностическим инструментом для оценки риска развития артериальной гипертензии при избыточной массе тела и ожирении. Повышение жесткости паренхиматозного слоя почек, с нашей точки зрения, является более ранним маркером развития артериальной гипертензии, чем нарушение ангиоархитектоники.








