Бронхообструктивный синдром (БОС) является одним из наиболее распространенных симптомокомплексов в практике врача-педиатра. Первые симптомы — одышка и свистящее дыхание (wheezing в англоязычной литературе) — часто появляются у детей уже в раннем возрасте, т. е. до 3 лет [1-3]. По различным данным, от 30% до 50% детей раннего возраста хотя бы однажды переносят БОС, при этом у 30% из них первый эпизод обструкции нижних дыхательных путей регистрируется уже на первом году жизни [3, 4, 6].
Проблемы широкой распространенности БОС у детей, а также гетерогенности его развития, течения и исхода в течение многих лет сохраняют свою актуальность и изучаются учеными и практикующими врачами [4, 11, 14, 19]. Немало сложностей возникает при дифференциальной диагностике данного состояния. Сам по себе БОС имеет характерную клиническую картину, поэтому трудностей с его диагностикой обычно не бывает [13]. Однако, сталкиваясь с БОС у детей грудного возраста на практике, врач, как правило, ставит диагноз «обструктивный бронхит» или «бронхиолит» [7, 12]. При этом БОС может быть следствием аллергического воспаления трахеобронхиального дерева, обтурационной непроходимости или гемодинамических нарушений, а также ремоделирования дыхательных путей (бронхолегочная дисплазия, дистония бронхиального дерева, врожденные пороки развития верхних дыхательных путей). Сложность диагностики заключается еще и в том, что в большинстве случаев симптомы этих заболеваний впервые проявляются на фоне респираторной инфекции [15, 16].
Исход БОС у ребенка раннего возраста предсказать трудно [6]. У большинства детей (до 60%) после 6 лет эпизоды обструкции перестают регистрироваться (транзиторный wheezing, возникающий на фоне ОРВИ или связанный с курением матери), тогда как приблизительно у 40% детей наблюдаются повторяющиеся эпизоды БОС в более старшем возрасте (стойкий wheezing, обусловленный атопией или семейной наследственностью по бронхиальной астме — БА) [17]. Хотя в большинстве случаев симптомы бронхиальной обструкции имеют благоприятный исход, в раннем возрасте они могут быть очень серьезными и приводить к госпитализации. Свистящие хрипы в дошкольном возрасте как предиктор развития в дальнейшем БА являются проблемой во всем мире [8-10, 18]. Установление диагноза БА в раннем возрасте по-прежнему вызывает трудности.
Широкое распространение БОС у детей определяет важность своевременного выявления значимых дифференциально-диагностических признаков, а также установления зависимости между факторами риска и особенностями течения бронхиальной обструкции у детей грудного возраста.
Цель исследования: выделить наиболее значимые предикторы для различных вариантов БОС у детей грудного возраста на основе изучения анамнестических данных, особенностей клинической картины и факторов риска для оптимизации дифференциальной диагностики и уточнения прогноза заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 343 ребенка с БОС в возрасте от 1 месяца до 1 года (средний возраст детей составил 5,7 ± 0,4 месяца). Набор пациентов производился на базе Красноярской межрайонной клинической больницы № 20 им. И. С. Берзона (главный врач — к. м. н. В. А. Фокин).
Критерии включения в исследование: дети грудного возраста, поступившие в стационар в течение года с диагнозами: острый бронхит неуточненный (J20.9 согласно МКБ-10) и острый бронхиолит неуточненный (J21.9).
Критерии исключения: новорожденные; возраст старше 1 года; дети из социально неблагополучных семей и домов ребенка; верифицированные диагнозы: муковисцидоз, инородное тело в дыхательных путях, стенозирующий ларинготрахеит, врожденный стридор, врожденные пороки развития бронхолегочной системы, сердца и сосудов, а также атипичная инфекция (Chlamydia spp, Mycoplasma spp). Для выявления атипичных возбудителей при затяжном течении БОС у детей проводился иммуноферментный анализ.
С учетом анамнестических данных (контакт с больными ОРВИ; личный и семейный анамнез; особенности раннего неонатального периода — недоношенность, проведение ИВЛ, длительность респираторной поддержки и т. д.) пациентов распределили на три группы: в первую группу (n = 247) вошли дети с БОС неаллергического генеза; во вторую (n = 77) — дети с БОС аллергического генеза; в третью (n = 19) — дети с БОС на фоне бронхолегочной дисплазии (табл. 1).
Таблица 1
Распределение обследованных детей по полу и возрасту
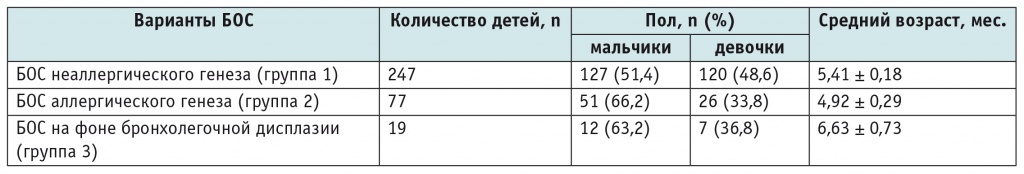
Примечание. БОС — бронхообструктивный синдром.
У всех детей проводили анализ анамнестических данных и особенностей клинической картины, а также оценку факторов риска. С помощью логистического регрессионного анализа были выделены наиболее значимые критерии (предикторы) среди клинико-анамнестических данных и построены модели клинико-патогенетических вариантов БОС. Статистический анализ выполняли с использованием программного обеспечения SPSS (Statistical Package for the Social Sciences Inc., США) в версии 20.0 для Windows.
Математически модель логистической регрессии, выражающая зависимость логарифма шанса (логита) от линейной комбинации факторных переменных, была представлена формулой:
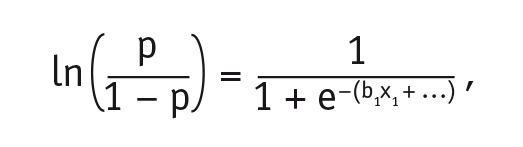
где р — вероятность прогнозируемого события;
е — математическая константа 2,72;
b1 — коэффициент при предикторной переменной х1;
х1 — переменная, показывающая изменение логарифмических шансов, вызванное единичным изменением независимых переменных.
Факт наличия признака представляли в виде бинарной (дихотомической) переменной, где 0 — отсутствие признака, 1 — его наличие. Построение логистических регрессионных моделей осуществлялось методом пошагового исключения прогностических факторов с определением минимального набора предикторов по оценке R-квадрата Нейджелкерка (значение R2 показывает долю влияния всех предикторов модели на дисперсию зависимой переменной), с расчетом чувствительности и специфичности полученных моделей. При низкой значимости, или достоверности, включенных переменных (предикторов) часть критериев, входивших в анализ, автоматически отбрасывалась программой. Значимость модели проверялась при помощи критерия χ2. При p < 0,05 нулевая гипотеза отвергалась.
В качестве основных характеристик описательной статистики применялись процентные доли и их стандартные ошибки (m). Значимость различий качественных признаков оценивали с помощью непараметрического критерия χ2 Пирсона. При малых размерах выборки использовали точный критерий Фишера. Различия считали статистически значимыми при р < 0,05. Оценку риска производили из расчета ОШ в таблицах сопряженности 2 × 2 с определением 95%-ного ДИ.
Проведено нерандомизированное исследование серии случаев. На первом этапе выполняли анализ клинико-анамнестических данных и факторов риска БОС в сравниваемых группах. На втором этапе путем логистического регрессионного анализа выявляли дифференциально-диагностические предикторы различных вариантов БОС у детей грудного возраста.
Дизайн исследования согласован этическим комитетом Красноярского государственного медицинского университета им. проф. В. Ф. Войно-Ясенецкого Минздрава России (протокол № 28/2010 от 10.12.2010). Обязательным условием было наличие информированного согласия родителей на участие в исследовании и обработку персональных данных.
РЕЗУЛЬТАТЫ
Первый этап исследования включал в себя сравнительную характеристику БОС у детей грудного возраста по началу развития и длительности течения, анализ частоты встречаемости клинико-анамнестических параметров и особенностей терапии БОС, а также оценку факторов риска в трех сравниваемых группах.
Анализ частоты встречаемости бронхиальной обструкции разной длительности показал, что продолжительность БОС от 3 до 5 дней статистически значимо чаще отмечалась у детей с БОС неаллергического генеза (38,9%), чем в группах «БОС аллергического генеза» и «БОС на фоне бронхолегочной дисплазии» (26,0% и 10,5% соответственно; при сравнении с обеими группами р < 0,05). При этом затяжное течение БОС (более 7 дней) в первой группе регистрировалось у 19,4% детей, что было статистически значимо реже, чем во второй и третьей группах (36,4% и 52,6% соответственно; при сравнении с обеими группами р < 0,01) (табл. 2).
Таблица 2
Длительность бронхообструктивного синдрома у детей грудного возраста
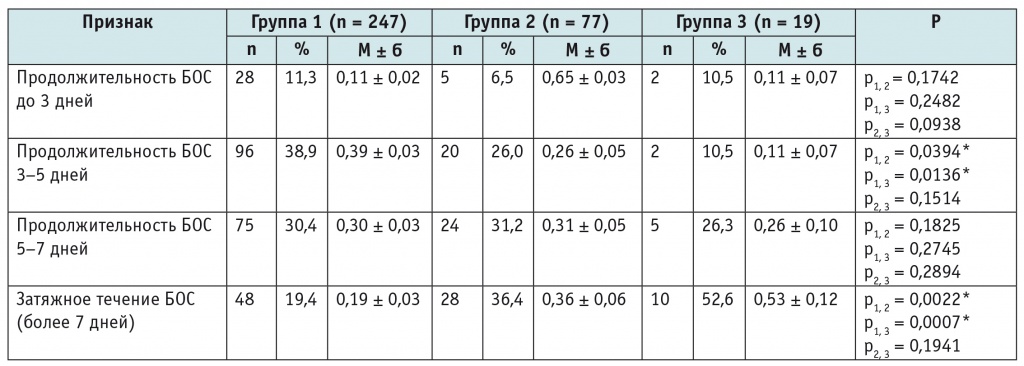
* Различия между группами статистически значимы (критерии χ2 и Фишера).
Примечание. БОС — бронхообструктивный синдром.
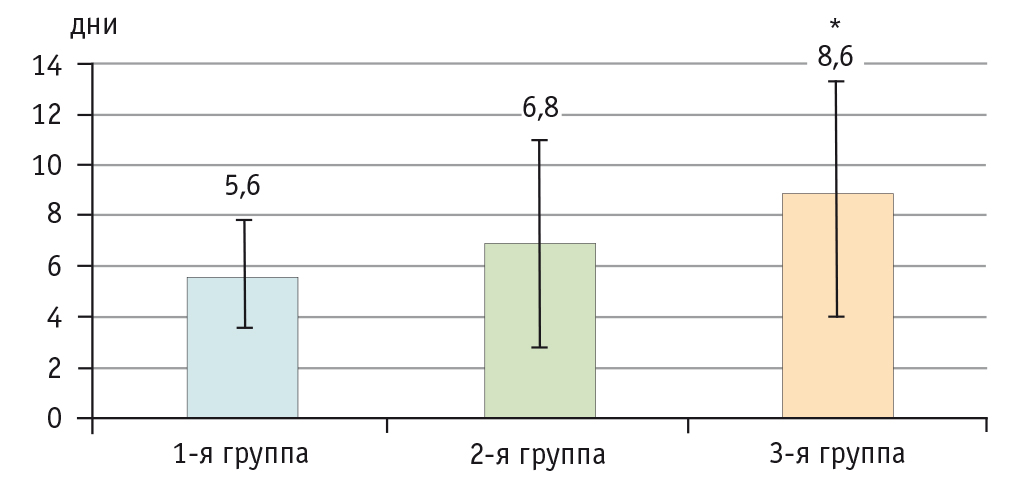
При оценке длительности бронхиальной обструкции, несмотря на однотипность клинических симптомов, отмечено более длительное течение БОС на фоне бронхолегочной дисплазии (8,63 ± 3,9 дня, при сравнении с двумя другими группами р < 0,05) (рис. 1).
Рис. 1. Продолжительность бронхиальной обструкции у детей грудного возраста, дни.
* Различия с первой и со второй группой статистически значимы: р < 0,05 (критерий χ2)
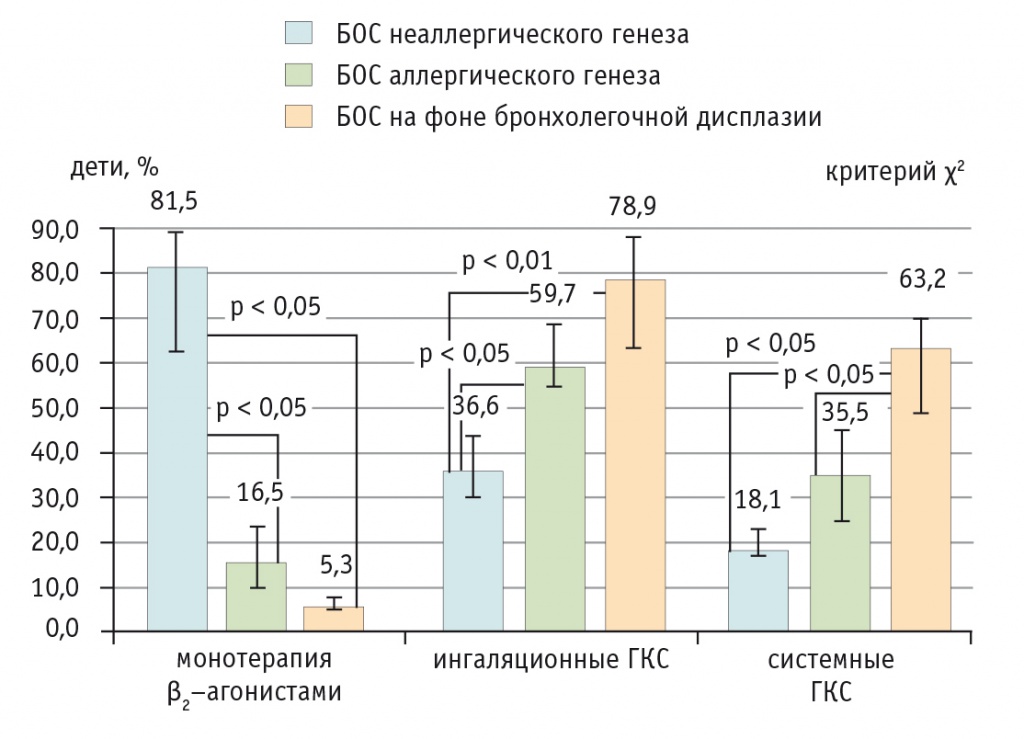
При анализе лекарственных препаратов, применявшихся для лечения БОС, выявлено, что монотерапия β2-агонистами статистически значимо чаще назначалась детям с БОС неаллергического генеза (при сравнении с другими группами р < 0,05). Ингаляционные кортикостероиды чаще, чем в первой группе (36,6%), применялись при БОС аллергического генеза (59,7%; р < 0,05) и на фоне бронхолегочной дисплазии (78,9%; р < 0,01). Терапия системными ГКС статистически значимо чаще применялась при БОС на фоне бронхолегочной дисплазии (при сравнении с остальными группами р < 0,05) (рис. 2).
Рис. 2. Терапия для купирования бронхиальной обструкции при различных вариантах бронхообструктивного синдрома, %.
Примечание. БОС — бронхообструктивный синдром; ГКС — глюкокортикостероиды
Среди факторов риска для детей из группы БОС аллергического генеза статистически значимыми оказались:
-
крапивница и отек Квинке в анамнезе — отмечены у 9,1% детей (ОШ = 8,333; 95%-ный ДИ: 2,207-31,467);
-
аллергические заболевания у родственников — отмечены у 6,5% детей (ОШ = 5,952; 95%-ный ДИ: 1,455-24,353);
-
БА у родственников II линии родства (бабушки и дедушки) — встречалась у 11,7% детей (ОШ = 4,018; 95%-ный ДИ: 1,604-10,064), что было в 4 раза чаще, чем в группе БОС неаллергического генеза (р < 0,05) (рис. 3).
Рис. 3. Ранжирование факторов риска по показателю отношения шансов при различных вариантах бронхообструктивного синдрома.
* Р < 0,05.
Примечание. БА — бронхиальная астма; БОС — бронхообструктивный синдром
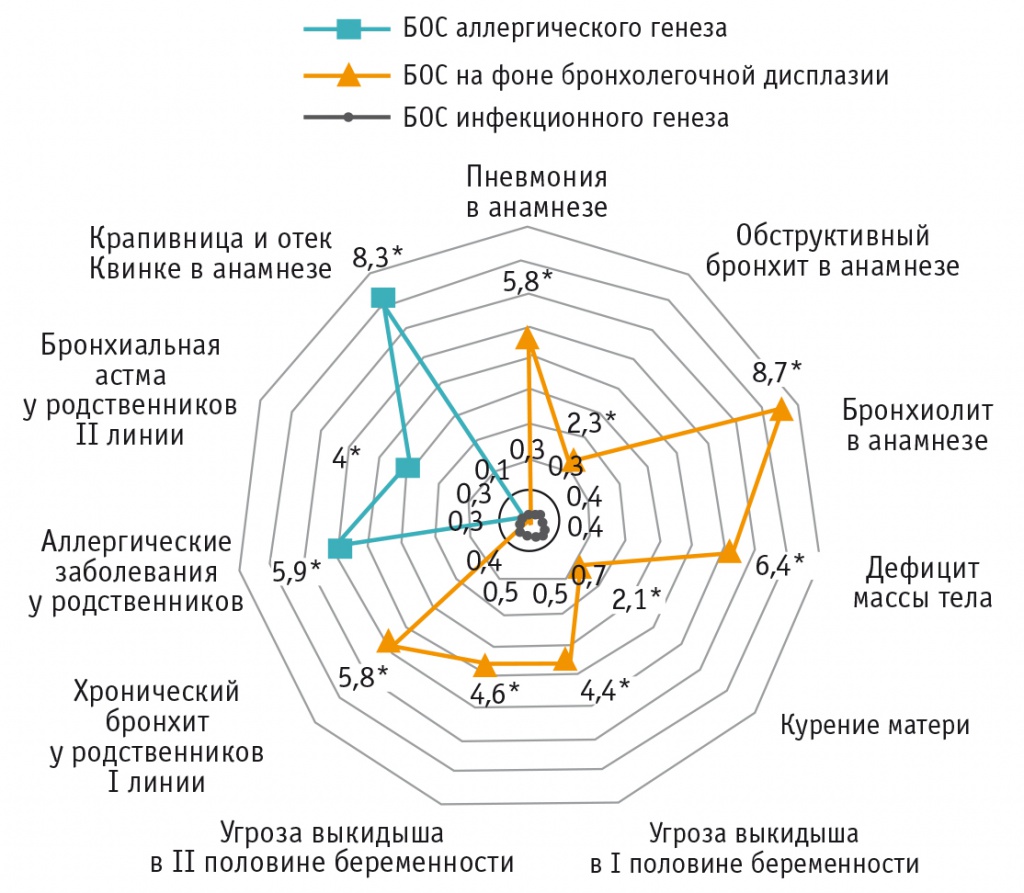
Для БОС на фоне бронхолегочной дисплазии статистически значимыми факторами риска явились:
-
пневмония в анамнезе — выявлена у 10,5% детей (ОШ = 5,842; 95%-ный ДИ: 1,262-27,036);
-
обструктивный бронхит в анамнезе — обнаружен у 31,6% детей (ОШ = 2,337; 95%-ный ДИ: 1,143-4,779);
-
бронхиолит в анамнезе — встречался у 10,5% детей (ОШ = 8,763; 95%-ный ДИ: 1,711-44,870), что было в 8 раз чаще, чем в группе БОС неаллергического генеза (р < 0,05);
-
дефицит массы тела — обнаружен у 63,2% детей (ОШ = 6,373; 95%-ный ДИ: 3,975-10,218), что в 6 раз превосходило показатель в группе БОС неаллергического генеза (р < 0,01);
-
курение матери — отмечалось у 31,6% детей (ОШ = 2,062; 95%-ный ДИ: 1,015-4,187);
-
угрозы выкидыша в I и II половинах беременности — встречались у 47,4% детей (ОШ = 4,382; 95%-ный ДИ: 2,489-7,713) и 31,6% детей (ОШ = 4,572; 95%-ный ДИ: 2,116-9,879) соответственно;
-
хронический бронхит у родственников I линии родства (родители, братья и сестры) — отмечен в 10,5% случаев (ОШ = 5,842; 95%-ный ДИ: 1,262-27,036) (см. рис. 3).
На втором этапе исследования с целью выделения наиболее значимых критериев (предикторов) различных вариантов БОС у детей грудного возраста был применен логистический регрессионный анализ.
Среди включенных в исследование детей (n = 343) в качестве возможных предикторов оценивались категориальные (прогностические) переменные — данные клинической картины и анамнеза. Предикторы, включенные в уравнения, прошли проверку на коллинеарность и автокорреляцию. При построении логистических регрессионных моделей применяли пошаговое исключение предикторов с учетом достоверности, что позволяло выбрать достоверно значимую модель с оптимальной специфичностью и чувствительностью отобранных переменных на определенном шаге. Критерии шагового отбора: переменная включалась в модель, если вероятность критической статистики критерия укладывалась в заданный порог классификации наблюдений. Интерпретация параметров логистической регрессии производилась на основе величины экспоненциальной функции — exp(b): если коэффициент b положительный, то exp(b) > 1 и шансы возрастают; если коэффициент b отрицательный, то шансы снижаются. Проверка всех трех моделей на статистическую значимость показала значимость объединенных тестов для коэффициентов каждой модели на определенном шаге при р < 0,05.
В логистический регрессионный анализ с целью прогнозирования вероятности развития БОС неаллергического генеза были включены 247 (72,0%) детей; БОС аллергического генеза — 77 (22,5%); БОС на фоне бронхолегочной дисплазии — 19 (5,5%). Как показано в таблице 3, для модели «БОС неаллергического генеза» выявлены предикторы на девятом шаге: наличие гипертермии; длительность БОС 3-5 дней; купирование БОС бронхолитиками; БА у родственников II линии; хронический бронхит у родственников II линии. Для модели «БОС аллергического генеза» определены предикторы на шестом шаге: атопический дерматит в анамнезе; крапивница, отек Квинке в анамнезе; БА у родственников I линии; БА у родственников II линии. Для модели «БОС на фоне бронхолегочной дисплазии» выявлены предикторы на третьем шаге: ИВЛ с первых часов в период новорожденности; необходимость в системных ГКС.
Таблица 3
Клинико-анамнестические предикторы различных вариантов бронхообструктивного синдрома (итоговая логистическая регрессионная модель)
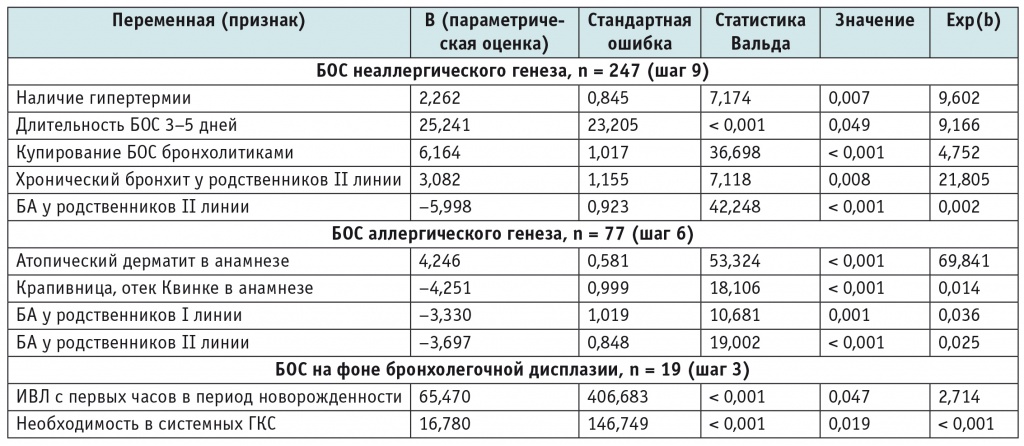
Примечание. БА — бронхиальная астма; БОС — бронхообструктивный синдром; ГКС — глюкокортикостероиды; ИВЛ — искусственная вентиляция легких.
Статистическое описание трех моделей БОС представлено в таблице 4. Чувствительность модели БОС неаллергического генеза составила 78,0%, специфичность — 51,3%. Предсказывающая способность данной модели оказалась не слишком высокой (66,3%), что можно объяснить неспецифичностью предикторов. Это подтверждается и коэффициентом детерминации R2 Нейджелкерка: на девятом шаге построения модели R2 был равен 0,196, следовательно, доля влияния анализируемых предикторов для данной модели в совокупности равнялась 19,6%. Чувствительность модели БОС аллергического генеза составила 98,0%, специфичность — 53,8%. Общий процент корректных предсказаний на шестом шаге был равен 82,0, а доля влияния анализируемых предикторов в совокупности — 26% по скорректированному коэффициенту детерминации. Чувствительность модели развития БОС на фоне бронхолегочной дисплазии составила 99,1%, специфичность — 93,8%. Предсказывающая способность данной модели оказалась высокой (99,7%), поскольку указанные предикторы весьма специфичны, доля их влияния в совокупности на третьем шаге достигла 64% по коэффициенту детерминации.
Таблица 4
Статистическое описание моделей [5]
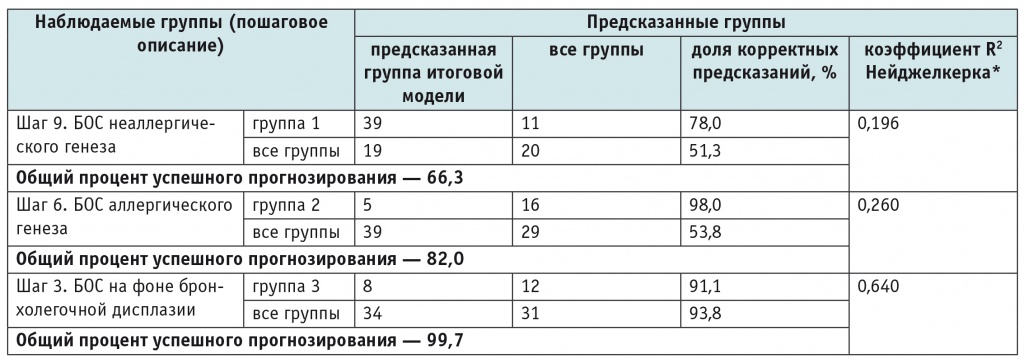
* Коэффициент R2 Нейджелкерка отражает долю влияния анализируемых предикторов на дисперсию модели.
ОБСУЖДЕНИЕ
Клинико-анамнестический анализ позволил доказать неоднородность БОС у детей грудного возраста и возможность выделения различных его вариантов. При дифференциальной диагностике заболеваний врач выделяет набор параметров: жалобы при поступлении в стационар, анамнестические сведения о болезни и жизни ребенка, данные объективного осмотра и результаты инструментальных исследований, а также лечение, которое пациент получал на амбулаторном этапе и в стационаре. Поскольку выбор врачом признаков субъективен, а клиническая картина БОС однотипна, то необходимо выделение наиболее значимых критериев (предикторов) различных вариантов БОС у детей грудного возраста путем статистического анализа.
При ведении детей грудного возраста с БОС следует учитывать выявленные факторы риска: наличие в анамнезе у ребенка острых аллергических реакций (крапивница и отек Квинке), отягощенный семейный аллергологический анамнез (аллергические заболевания у родственников, БА у родственников II линии родства), являющиеся характерными для БОС аллергического генеза. Выявление детей с признаками атопии и отягощенным аллергологическим анамнезом необходимо для раннего прогнозирования развития рецидивирующего БОС и формирования групп риска по развитию БА.
Выполнено выделение статистических групп БОС с фенотипическим подходом. Использование точных математических методик позволило определить среди клинико-анамнестических данных и факторов риска значимые предикторы, характерные для различных клинико-патогенетических вариантов БОС у детей грудного возраста, и оптимизировать дифференциально-диагностический подход.
ЗАКЛЮЧЕНИЕ
Выделение значимых параметров среди клинико-анамнестических данных путем логистического регрессионного анализа может применяться у детей для дифференциальной диагностики бронхообструктивного синдрома (БОС). Это позволит применять дифференцированный подход при лечении, диспансеризации и определении прогноза у детей, перенесших БОС в грудном возрасте.









