ВВЕДЕНИЕ
Сурфактант представляет собой легочное поверхностно-активное вещество, которое является смесью липидов и белков, покрывающей дистальные воздушные пространства и уменьшающей поверхностное натяжение в конце выдоха. Сурфактант синтезируется в альвеолоцитах II типа. Основной липид сурфактанта, который помогает снизить поверхностное натяжение, — динасыщенный фосфатидилхолин. Два небольших гидрофобных белка, называемых сурфактантными белками (SP) B и C, необходимы для того, чтобы липиды сурфактанта переходили тонкий слой жидкости, покрывающей дистальную альвеолу, и распространялись на границе раздела «воздух — жидкость» с образованием монослоя.
Сурфактант также содержит два более крупных гидрофильных родственных белка, SP-A и SP-D, которые играют важную роль во врожденном иммунитете и местной иммунной регуляции. Белок ABCA3 принадлежит к семейству трансмембранных АТФ-связывающих кассетных транспортных белков (ABC-белков). ABCA3 присутствует преимущественно в альвеолоцитах II типа на мембране ламеллярных телец[1].
На протяжении последних десятилетий растет интерес к изучению связанных с дисфункцией сурфактанта генетически детерминированных интерстициальных заболеваний легких (ИЗЛ) у детей и взрослых, проявляющихся симптомокомплексом диффузного паренхиматозного поражения легких, хронической дыхательной недостаточности. Генетические дисфункции системы сурфактанта представляют собой группу редких ИЗЛ в результате мутаций генов SFTPB, SFTPC, ABCA3, кодирующих соответствующие белки (SP-B, SP-C, ABCA3), и гена NKX2-1, кодирующего фактор транскрипции щитовидной железы 1 (TTF-1).
В результате патогенных изменений нуклеотидной последовательности генов SFTPB, SFTPC, ABCA3 развивается дефицит SP-B, SP-C, белка ABCA3 соответственно; в результате патогенных вариантов в гене NKX2-1 возникает синдром «мозг — легкие — щитовидная железа» (СМЛЩЖ) с поражением одноименных органов[2]. В таблице 1 приведены краткие сведения о данных заболеваниях.
Таблица 1
Дифференциальная диагностика генетических заболеваний, вызывающих дисфункцию системы сурфактанта[3–12]
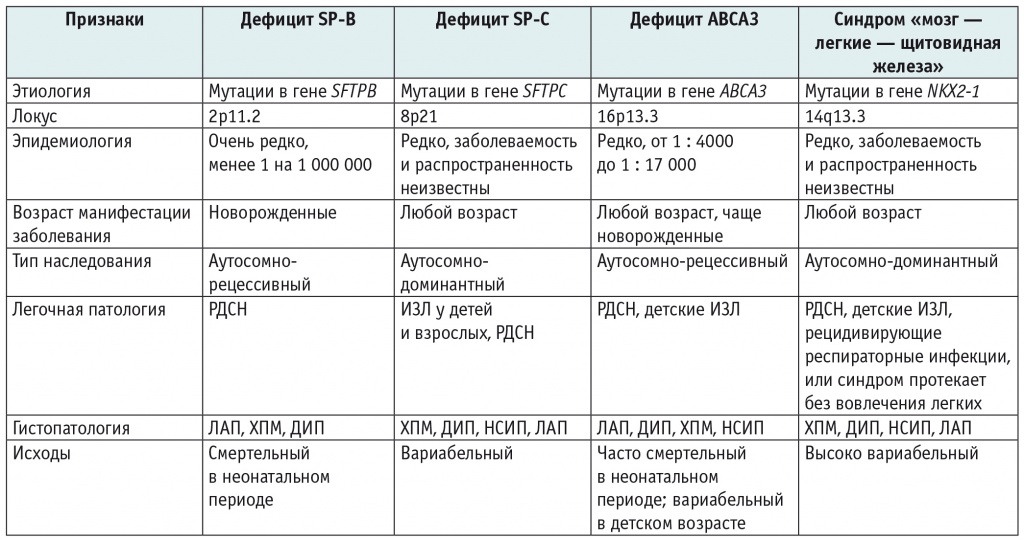
Примечание: ДИП — десквамативный интерстициальный пневмонит, ИЗЛ — интерстициальное заболевание легких, ЛАП — легочный альвеолярный протеиноз, НСИП — неспецифическая интерстициальная пневмония, РДСН — респираторный дистресс-синдром новорожденных, ХПМ — хронический пневмонит младенцев.
Цель исследования: генетическая, клиническая, лабораторно-инструментальная и морфологическая характеристика генетических дисфункций системы сурфактанта у детей, терапии и исходов заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Многоцентровое амбиспективное открытое описательное пилотное лонгитудинальное исследование проводилось на базе нескольких медицинских учреждений Российской Федерации и Республики Казахстан в период с 2014 по 2023 г. В исследование включены 17 детей из 16 семей с идентифицированными мутациями в генах SFTPC, NKX2-1, АВСА3. Критерии включения в исследование: симптомокомплекс ИЗЛ, наличие патогенных изменений референсной последовательности генов SFTPC, NKX2-1, АВСА3, ответственных за дисфункции системы сурфактанта. Критерии невключения: симптомокомплекс ИЗЛ при отсутствии данных генетического тестирования, отсутствие патогенных мутаций в генах SFTPB, SFTPC, ABCA3, NKX2-1.
Молекулярно-генетическое исследование для поиска патогенных вариантов в генах SFTPC и NKX2-1 проводилось методом секвенирования по Сэнгеру. У ребенка с мутацией в гене ABCA3 выполнено секвенирование клинического экзома. Биологическим материалом для исследования служили образцы крови. Выделение геномной ДНК осуществлялось с помощью набора реактивов DNA Blood Mini Kit (QIAGEN, Германия) на автоматической станции QIAQUBE (QIAGEN, Германия). Секвенирование по Сэнгеру производили на автоматическом секвенаторе ДНК ABI 3500 (Thermo Fisher Scientific, США) при помощи набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit (Thermo Fisher Scientific, США) в соответствии с протоколами и рекомендациями производителя.
В случае выявления не описанного ранее в HGMD варианта анализ патогенности делался для всех найденных вариантов с частотой менее 1% по базе данных gnomAD v.2.1.11 на основе биоинформатических модулей SIFT, PolyPhen-1, PolyPhen-2 и Mutation Tester, интегрированных в программу Alamut Visual Plus (version 1.5.1 SOPHiA GENETICS, Switzerland, Lausanne), согласно российскому руководству по интерпретации данных ДНК человека.
Анализ и сравнение последовательностей нуклеотидов с референсной базой данных GenBank Accession проводили при помощи программного обеспечения Geneious R10 (Biomatters, Новая Зеландия).
У 7 детей осуществлялся семейный сегрегационный анализ, показанием для которого в ряде случаев являлось наличие хронических респираторных симптомов либо симптомов СМЛЩЖ.
Производились клиническое, лабораторное обследование детей, обзорная рентгенография, компьютерная томография (КТ) органов грудной клетки (ОГК). У 4 больных выполнено гистологическое исследование легочной ткани (в двух случаях биопсия и в двух случаях аутопсия). Анализировали назначенную терапию и исходы заболевания. Данные пациентов сравнивались с результатами, полученными при проведении систематических обзоров[3, 13].
Статистическая обработка результатов осуществлялась при помощи программы Microsoft Office Excel (Microsoft, США), приведено процентное выражение данных.
РЕЗУЛЬТАТЫ
Исследование продолжает серию ранее опубликованных наблюдений пациентов с дефицитом SP-C, СМЛЩЖ[3, 13]. Среди наблюдавшихся нами на протяжении многих лет больных с генетическими дисфункциями системы сурфактанта не встречались пациенты с дефицитом SP-B, что может быть связано как с тяжелым течением данного заболевания, часто с летальным исходом в первые месяцы жизни, так и с низкой доступностью полноценного обследования в ряде регионов страны. У одной девочки, соответствующей критериям невключения в исследование, с десквамативной интерстициальной пневмонией, идентифицированной при биопсии легких, по данным генетического обследования, мутаций в генах, ответственных за дисфункции системы сурфактанта, не было.
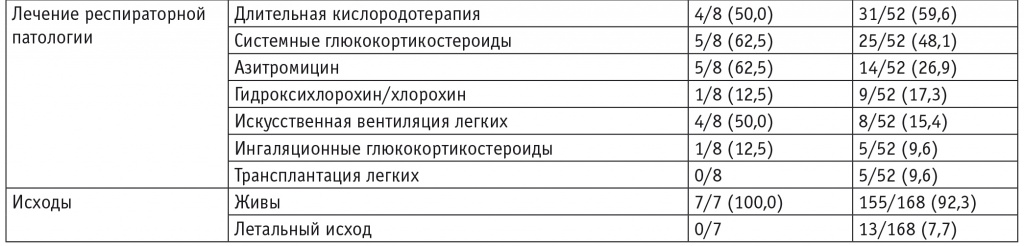
Включенные в исследование дети разделены на три группы: с врожденным дефицитом SP-С (8 пациентов), с СМЛЩЖ (8 пациентов), с врожденным дефицитом белка АВСА3 (1 пациент). В результате генетического обследования выявлены следующие типы мутаций: миссенс; мутации, приводящие к сдвигу рамки считывания, и мутации сайтов сплайсинга. Данные обследования, сведения о наличии респираторных симптомов в неонатальном периоде и исходах у наблюдавшихся пациентов представлены в таблице 2.
Таблица 2
Результаты генетического обследования, семейного сегрегационного анализа, сведения о течении неонатального периода и исходах
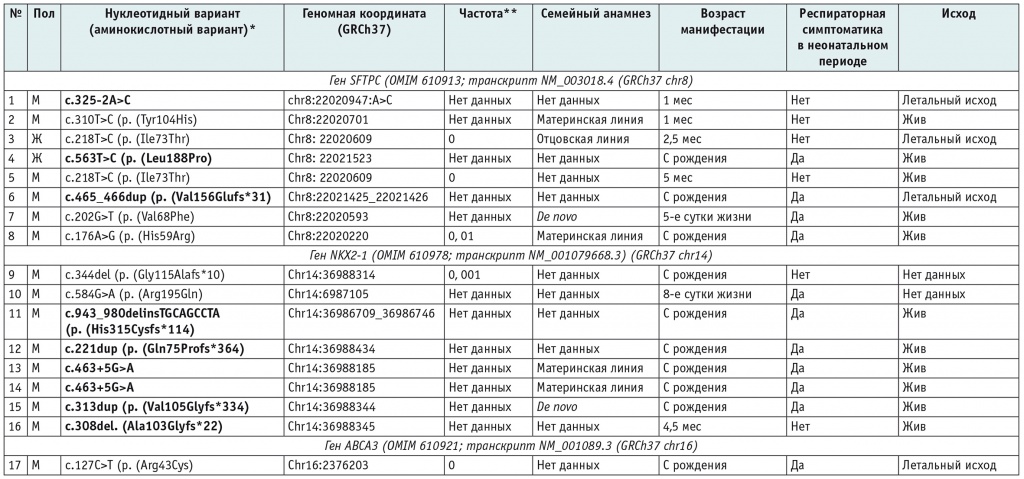
* Жирным шрифтом выделены нуклеотидные варианты, не описанные ранее в базах данных2.
** Согласно базе gnomAD, v2.1.13, нет данных, то есть частота в базе отсутствует.
Дети с СМЛЩЖ № 13 и № 14 — разнояйцовые близнецы. Их мать с детства наблюдалась у невролога с атаксической формой детского церебрального паралича (ДЦП), в дальнейшем в ходе обследования у нее найдена аналогичная выявленной у детей мутация в гене NKX2-1.
Отец ребенка № 16 с патогенным вариантом в гене NKX2-1 также в детстве наблюдался у невролога с ДЦП, имеет гипоплазию щитовидной железы.
Заслуживает внимания и семейный анамнез двух детей с врожденным дефицитом SP-C. У пациента № 2 бабушка по материнской линии наблюдалась с диагнозом «саркоидоз», в возрасте 27 лет у нее развилась кислородозависимость, в возрасте 28 лет наступил летальный исход. У матери данного больного при биопсии легких обнаружена неспецифическая интерстициальная пневмония и при дальнейшем генетическом обследовании — мутация в гене SFTPС.
У ребенка № 3 отец страдал от ИЗЛ, один брат отца умер в возрасте 4 месяцев (диагноз «пневмония», вскрытие не проводилось), другой брат умер во взрослом возрасте от ИЗЛ, сестра отца умерла в возрасте 2 лет (диагноз «пневмония», вскрытие не проводилось). У отца ребенка также выявлена мутация в гене SFTPС. Обследование родителей проводилось после манифестации заболевания у детей.
У матери пациента № 8 обнаружена та же мутация, что и у него самого, но клинических проявлений ИЗЛ на момент написания статьи нет, что может быть связано с неполной пенетрантностью заболевания.
Таким образом, у 4 родителей идентифицированы мутации в генах SFTPC и NKX2-1, ранее выявленные у пробандов.
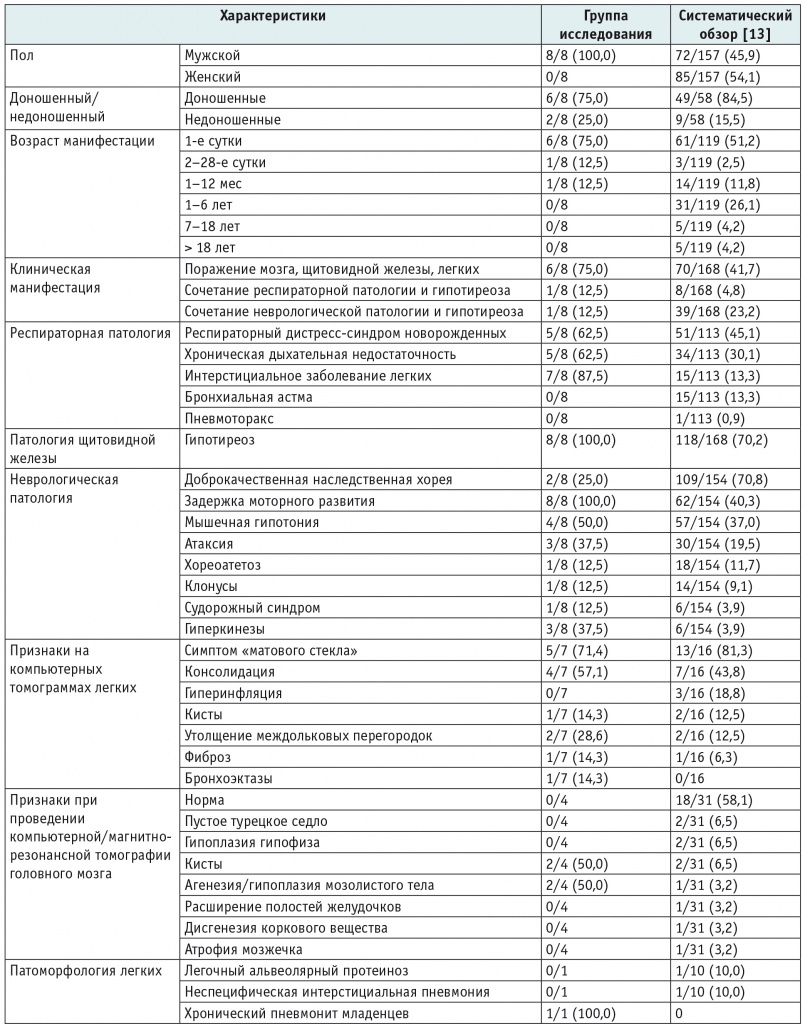
В таблицах 3 и 4 представлены демографические, клинические характеристики, сведения о результатах исследований (КТ ОГК, магнитно-резонансной томографии головного мозга, гистологической характеристике изменений в легких), терапии и исходах заболевания у наблюдавшихся пациентов с врожденным дефицитом SP-C и СМЛЩЖ соответственно в сравнении с данными систематических обзоров[3 13].
Таблица 3
Характеристики наблюдавшихся пациентов с генетическими вариантами SFTPC в сравнении с данными систематического обзора[3], n (%) из числа детей с имеющейся информацией в отношении того или иного признака
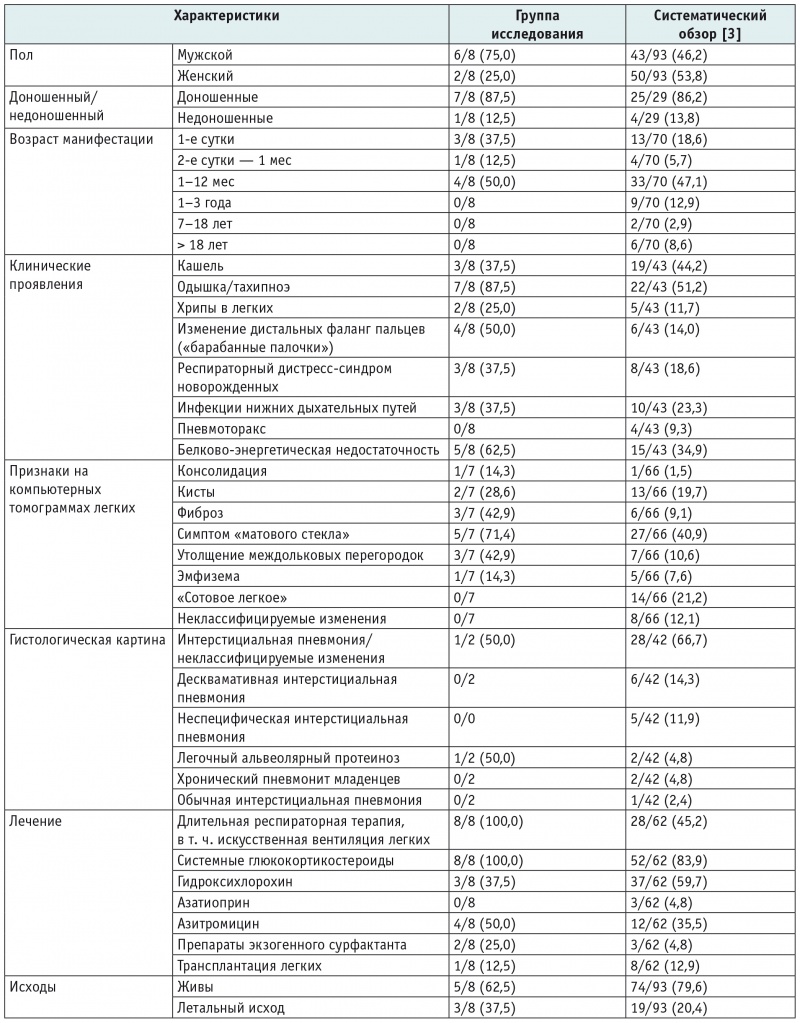
Таблица 4
Характеристики наблюдавшихся пациентов с генетическими вариантами в гене NKX2-1 в сравнении с данными систематического обзора[13], n (%) из числа детей с имеющейся информацией в отношении того или иного признака
Пациент № 17 (см. табл. 2) родился доношенным, через 2 часа после рождения у него появились признаки дыхательной недостаточности, которые потребовали проведения искусственной вентиляции легких (ИВЛ). На 7-е сутки жизни в связи с отсутствием положительной динамики на ИВЛ ребенку эндотрахеально был введен экзогенный сурфактант (порактант альфа), на 15-е и 35-е сутки жизни производились повторные введения без положительной динамики, ребенок находился на ИВЛ до момента смерти.
При аускультации легких выслушивались свистящие хрипы, крепитация, наблюдались приступообразный кашель, тахипноэ, эпизоды десатурации до 38–65%, генерализованный цианоз. По данным посевов из трахеобронхиального дерева и зева, неоднократно определялись Staphylococcus haemolyticus, Klebsiella pneumoniae, Pseudomonas aeruginosa. На рентгенограммах ОГК визуализировались диффузное неравномерное затемнение легочных полей, мелкие воздушные полости, очаговые тени, КТ ОГК не проводилась по тяжести состояния.
Ребенок получал антибиотики, системные глюкокортикостероиды. В возрасте 75 суток жизни в результате полиорганной недостаточности наступил летальный исход.
При аутопсии в легких определялись тотальный ателектаз, поля фиброза с очаговым гиалинозом альвеолярных перегородок и щелевидными структурами, выстланными метаплазированным плоским эпителием; резкое утолщение и фиброз межальвеолярных перегородок, местами десквамированные альвеолоциты; перибронхиальный фиброз, воспаление и очаговая лимфоплазмоцитарная инфильтрация межальвеолярных перегородок; гипертрофия средней оболочки мелких артерий в сочетании с клеточной пролиферацией интимы сосудов и ее склерозом.
Перечисленные изменения могут соответствовать десквамативной интерстициальной пневмонии, легочной гипертензии. Уже после смерти мальчика были получены результаты генетического исследования, обнаружена мутация в гене АВСА3 в гетерозиготном состоянии (см. табл. 2). Вторая мутация не найдена, так как ограничения метода высокопроизводительного секвенирования не позволяют достоверно выявлять протяженные инсерции и делеции. Кроме того, возможно наличие второго патогенного варианта в интронных областях, которые не были изучены в ходе проведенного исследования.
В январе 2023 г. в этой же семье родился доношенный мальчик, с рождения у него отмечались признаки дыхательной недостаточности, потребовавшей ИВЛ, на рентенограмме ОГК видно равномерное снижение пневматизации легочной ткани. Ребенок получал системные глюкокортикостероиды, азитромицин и гидроксихлорохин, находился на ИВЛ, в возрасте 2 мес наступил летальный исход. На аутопсии у него выявлены морфологические изменения, сходные с таковыми у брата.
С учетом мутации в гене АВСА3 у брата и сходной клинической картины рекомендован повторный биоинформатический анализ данных секвенирования экзома с целью поиска протяженных делеций/дупликаций в гене ABCA3 (на момент написания статьи исследование в работе).
Интересно отметить, что ИЗЛ вследствие дисфункции системы сурфактанта могут как сочетаться с инфекциями нижних дыхательных путей (нозокомиальная пневмония у пациента № 17 с врожденным дефицитом белка ABCA3; цитомегаловирусная пневмония, идентифицированная на основании специфических изменений в виде цитомегаловирусного метаморфоза эпителиоцитов — «совиный глаз» — у пациента № 6 c дефицитом SP-C), так и быть их «маской». У большинства больных, включая родственников обследованных детей, до установления диагноза генетической дисфункции сурфактанта заболевание расценивалось как пневмония.
ОБСУЖДЕНИЕ
По данным литературы, среди ИЗЛ в результате врожденных дисфункций сурфактанта наиболее частыми являются ассоциированные с мутациями в гене ABCA3 [1, 2, 6], но это не подтверждается в нашем исследовании (1 пациент с данным заболеванием), что может быть связано с малочисленностью представленной выборки больных, которым проведено молекулярно-генетическое исследование для поиска патогенных вариантов в гене ABCA3.
При сопоставлении результатов молекулярной диагностики наблюдавшихся нами пациентов (см. табл. 2) с данными литературы можно видеть, что у 2 из 8 детей с мутацией в гене SFTPC выявлен нуклеотидный вариант c.218T>C, неоднократно описанный ранее в литературе и базе данных HGMD professional как патогенный[4, 5].
Сравнение течения в неонатальном периоде и исходов заболевания у этих двух пациентов (№ 3, № 5, см. табл. 2) с указанным выше одним патогенным вариантом доказывает клинический полиморфизм врожденного дефицита SP-С от относительного благоприятного течения заболевания на фоне комплексной терапии до летального исхода. Таким образом, больные с одним генотипом могут обладать различающимися фенотипами и по-разному отвечать на терапию.
Еще недавно считалось возможным проводить избирательное обследование пациентов с подозрением на генетические дисфункции системы сурфактанта на основании анамнестических данных[7]. При неонатальной манифестации рекомендовалось начинать обследование с определения мутаций гена SFTPB, затем переходя к определению мутаций генов SFTPC, ABCA3. По нашим данным, у 50% детей с дефицитом SP-C заболевание манифестировало в неонатальном периоде, явившись у некоторых из них неожиданной находкой, поскольку при неонатальной манифестации предполагали выявить мутации гена SFTPB. Поэтому при подозрении на врожденный дефицит SP определение мутаций гена SFTPC должно, как показывают наши данные, быть обязательным.
Вместе с тем заболевания, ассоциированные с мутациями гена SFTPC, могут проявляться не только у детей, но и у взрослых, о чем свидетельствуют результаты систематического обзора (см. табл. 3) и выявление заболевания у родителей наших пациентов, до этого скрывавшегося под «масками» ИЗЛ неидентифицированной этиологии или других диагнозов (саркоидоза). В этом контексте для оптимизации алгоритма диагностики у больных с подозрением на генетические дисфункции системы сурфактанта может быть рекомендовано молекулярно-генетическое исследование методом высокопроизводительного секвенирования с помощью панели, включающей таргетные области генов SFTPB, SFTPC и ABCA3.
По сравнению с диагностикой заболеваний, ассоциированных с мутациями в генах SFTPB, SFTPC, ABCA3, диагностика СМЛЩЖ может представляться менее сложной ввиду ярких внелегочных проявлений (поражения нервной системы, гипотиреоза). Однако указанный синдром не обязательно протекает с развитием полной триады с поражением всех трех органов (см. табл. 4). Заподозрить СМЛЩЖ в одном случае позволили данные семейного анамнеза (атаксическая форма ДЦП у матери двоих разнояйцовых близнецов, родившихся с гестационным возрастом 34 недели). Доказана высокая эффективность секвенирования гена NKX2-1 методом Сэнгера для молекулярной диагностики СМЛЩЖ.
Особого внимания заслуживает вопрос о возможности врожденной дисфункции сурфактанта у недоношенных детей, для которых типичен респираторный дистресс-синдром новорожденных (РДСН) в результате низкого пула сурфактанта при рождении. По нашим данным (см. табл. 3, 4), частота недоношенности у наблюдавшихся детей выше популяционной, составляющей до 8%[14]. Врожденный дефицит SP-C установлен у одного ребенка с экстремально низкой массой тела при рождении, тяжелой бронхолегочной дисплазией, находившегося длительно (в возрасте старше года) на домашней кислородотерапии (пациент № 8).
По данным исследования M. Somaschini и соавт. (2018), редкие или новые генетические патогенные варианты в генах, кодирующих SP-B, SP-C, белок АВСА3, идентифицированы у 24 (35,3%) пациентов из 68 недоношенных новорожденных с особенно тяжелым РДСН, рефрактерным к стандартной терапии, или летальными исходом. Полагают, что недоношенные новорожденные с патогенными вариантами в генах SFTPB, SFTPC, ABCA3 могут иметь сниженную выработку или нарушенную функцию кодируемого ими белка, что в сочетании с незрелостью легких увеличивает тяжесть респираторного заболевания, являющегося в данном случае полиэтиологическим расстройством наряду с другими заболеваниями многофакторной природы[15, 16].
ЗАКЛЮЧЕНИЕ
Пациентам с быстро прогрессирующим, тяжелым, не отвечающим на стандартную терапию РДСН, развивающимся как у недоношенных, так и у доношенных детей, симптомокомплексом ИЗЛ с развитием тяжелой хронической дыхательной недостаточности, отягощенным семейным анамнезом по ИЗЛ показано проведение генетического тестирования для выявления мутаций в генах SFTPB, SFTPC, ABCA3. Комбинация у пациента респираторных симптомов с врожденным гипотиреозом и неврологической патологией — основание для генетического обследования на мутации гена NKX2-1 для исключения СМЛЩЖ. Генетическое обследование является неинвазивным методом диагностики и уменьшает потребность в биопсии легких.
Поступила: 07.03.2023
Принята к публикации: 24.04.2023
________
1 The Genome Aggregation Database (gnomAD). URL: http://gnomad.broadinstitute.org (дата обращения — 15.04.2023).
2 The Genome Aggregation Database(gnomAD). URL: http://gnomad.broadinstitute.org (дата обращения — 15.04.2023).
3 Там же.







