Грибовидный микоз (ГМ) — это наиболее частая форма Т-клеточной лимфомы кожи, которая встречается в основном у взрослых пациентов. Возникновение ГМ у детей, подростков и даже молодых взрослых является очень редкой ситуацией. Мы предлагаем описание истории болезни ребенка с ГМ и обзор современных взглядов на диагностику и лечение этого заболевания.
ОПИСАНИЕ КЛИНИЧЕСКОГО СЛУЧАЯ
Мальчик М., 14 лет, впервые обратился в Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии им. Дмитрия Рогачёва (ФНКЦ ДГОИ) в 2012 г. Из анамнеза известно, что начальные признаки болезни появились в 2006 г. в виде алопеции теменно-височной области, сыпи, расцененной как атопический дерматит, а также сухости кожи на бедрах, голенях, спине и ягодицах. В течение длительного времени мальчик наблюдался дерматологом по месту жительства. В 2012 г. ребенок был направлен на консультацию иммунолога-аллерголога в ФНКЦ ДГОИ, и там, в связи с нетипичным для атопического дерматита поражением кожи, ему была проведена биопсия кожи нижней трети левого бедра и левой теменной области.
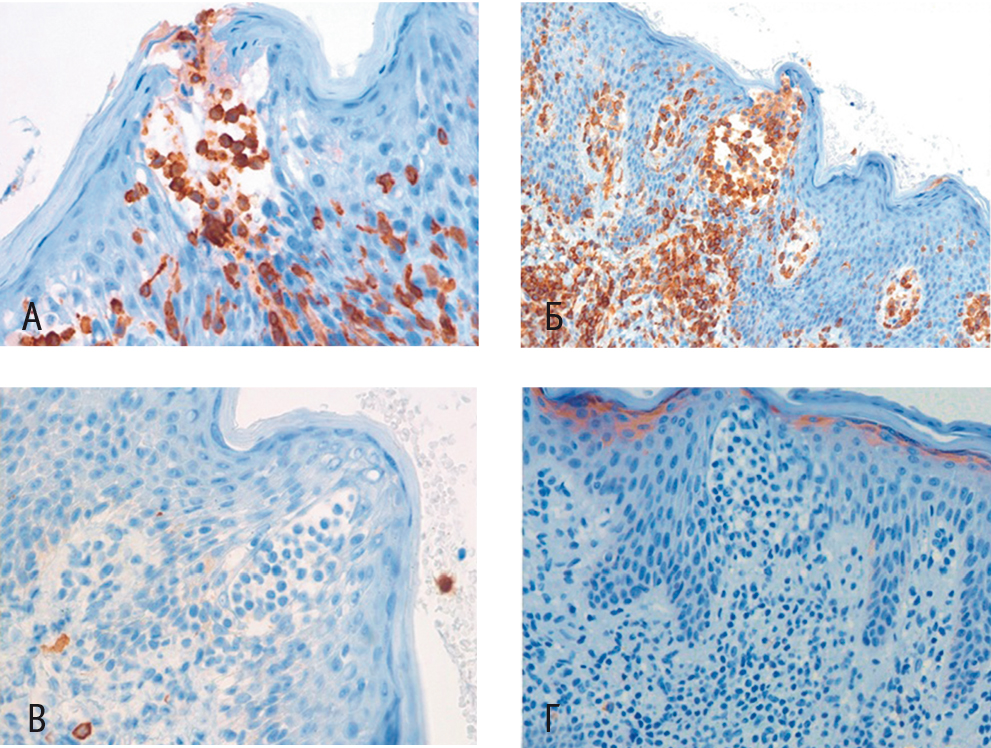
При гистологическом исследовании фрагмента кожи были обнаружены такие характерные признаки, как эпидермис с равномерно распределенным акантозом и признаками гиперкератоза; в шиповатом слое — скопления, формировавшие псевдоабсцесс Потрие (L. M. Pautrier), состоявшие из мелких клеток с высоким ядерно-цитоплазматическим соотношением и церебриформными ядрами. Такие же клетки располагались субэпидермально, периваскулярно, окружали протоки потовых желез и волосяные фолликулы с выраженным эпителиотропизмом и разрушением последних. Данный инфильтрат проникал глубоко в дерму и местами затрагивал подкожно-жировую клетчатку (рис. 1). По результатам иммуногистохимического исследования, клетки инфильтрата и псевдоабсцессов CD3/CD2/CD4/CD5 были позитивны, отсутствовала экспрессия CD7/CD8, не определялись CD30, Granzyme B, CD117, CD20 (рис. 2). Фенотипирование лимфоцитов периферической крови не выявило значимых изменений.
Рис. 1. Гистологическая картина грибовидного микоза, окраска гематоксилин-эозином. Отмечаются характерный эпидермотропизм (А), наличие псевдоабсцессов (Б), складчатые ядра (В) и инвазия луковицы волосяного фолликула (Г). Фото авторов
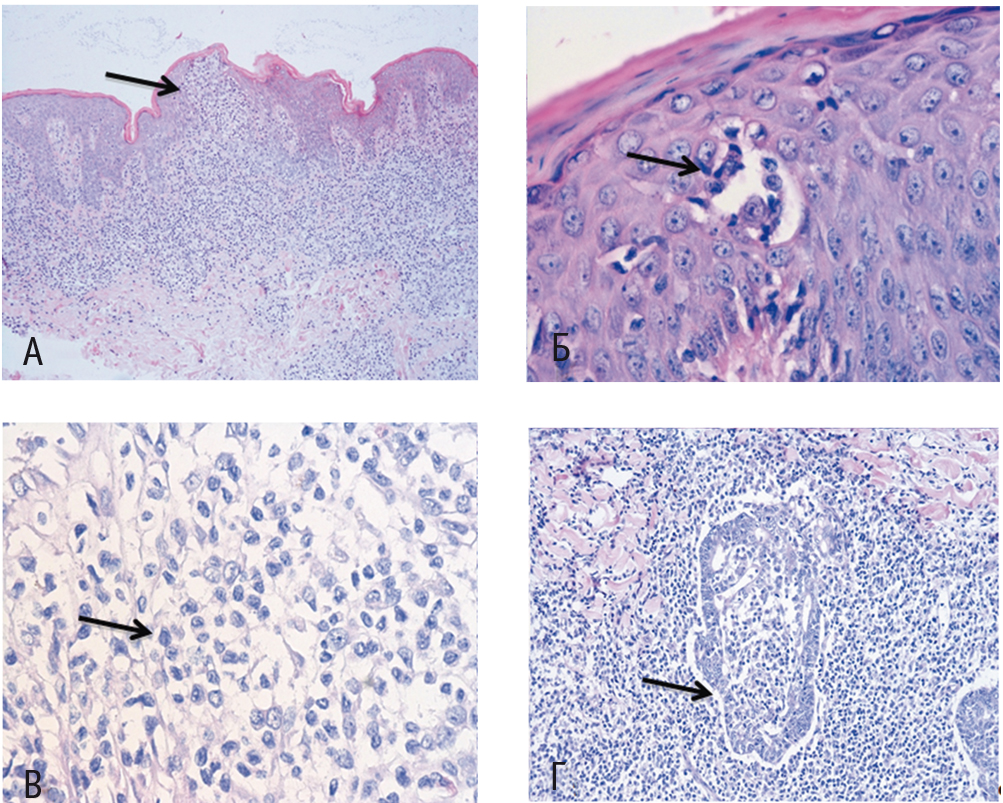
Рис. 2. Иммуногистохимическое исследование. Окраска гематоксилин-эозином. Клетки инфильтрата представлены CD3-позитивными Т-лимфоцитами (A), коэкспрессируют CD4 (Б), негативны по CD8 (В), отсутствуют CD20-позитивные В-лимфоциты (Г). Фото авторов
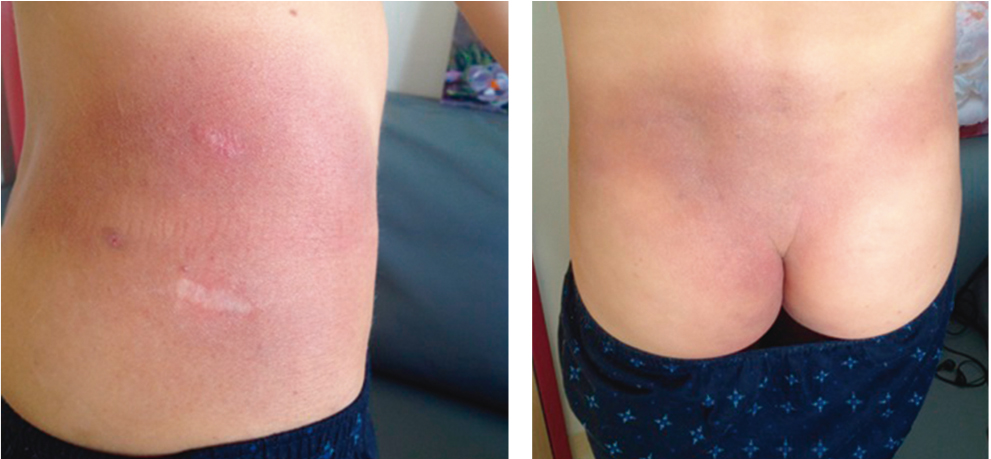
После гистологического и иммуногистохимического исследования биоптата и проведения инструментальных и лабораторных исследований был установлен диагноз: грибовидный микоз, фолликулярный (пилотропический) вариант, стадия IB (поражение кожи черепа, ягодиц, поясничной области, отсутствие поражения лимфоузлов и крови) (рис. 3).
Рис. 3. Поражение кожи поясничной области пациента М., 14 лет. Фото авторов
Мальчику была проведена фотохимиотерапия (PUVA-терапия), которая не оказала положительного действия. Затем в течение 3 месяцев он получал ИФН-α и метотрексат в дозе 10 мг/м2, на фоне чего сначала отмечалось улучшение состояния кожи (уменьшение количества папул), но затем вновь наступило обострение процесса.
В последующем ребенок получал метотрексат по 20 мг/м2 1 раз в неделю и липосомальный доксорубицин по 20 мг/м2 1 раз в 2 недели в течение 2 месяцев, на фоне чего была достигнута некоторая стабилизация процесса, но без значимой положительной динамики. В дальнейшем пациент проходил монотерапию бексаротеном в дозе 150–450 мг/сут в течение 6 месяцев со значительным улучшением состояния кожи: уменьшились ее шелушение и уплотнение. Но гиперемия и алопеция оставались.
С учетом возраста ребенка и резистентного течения заболевания было решено, что единственным радикальным методом излечения станет аллогенная трансплантация гемопоэтических стволовых клеток (ТГСК). В международном регистре пациенту был подобран неродственный 10/10 HLA-совместимый донор, и в марте 2014 г. была проведена аллогенная ТГСК с TCRa/b/CD19-деплецией с кондиционированием, включавшим: флударабин 150 мг/м2 (с –6 по –2 день), треосульфан 42 г/м2 (с –5 по –3 день), мелфалан 140 мг/м2 (–2 день), антитимоцитарный глобулин 5 мг/кг (с –5 по –3 день), бортезомиб 1,3 мг/м2 (–2 день), ритуксимаб 100 мг/м2 (–1 день) на фоне сопроводительной терапии.
Приживление трансплантата было достигнуто на +14 день, профилактика реакции «трансплантат против хозяина» проводилась бортезомибом. В настоящее время (полтора года после ТГСК) ребенок находится в ремиссии, с хорошей функцией трансплантата, без признаков хронической реакции «трансплантат против хозяина». Сохраняется алопеция волосистой части головы.
По нашему мнению, несмотря на интенсивность и разнообразие терапии, оптимальным методом излечения в данном случае являлась аллогенная ТГСК, так как вероятность прогрессирования заболевания была достаточно высока, а возраст пациента позволял использовать исключительно куративные терапевтические опции.
ОБЗОР ЛИТЕРАТУРЫ
Грибовидный микоз (ГМ) — это Т-клеточное лимфопролиферативное заболевание с характерным поражением кожи и потенциалом к диссеминации в лимфатические узлы, внутренние органы и костный мозг. Частота встречаемости ГМ составляет примерно 4 случая на 1 млн человек, чаще поражаются мужчины (соотношение мужчин и женщин — 2 : 1). Примерно 75% диагнозов ставится в возрасте старше 50 лет[5, 37]. Течение заболевания и исход варьируют от длительно существующей относительно благоприятной болезни до агрессивной опухоли с высокой смертностью[41]. В литературе имеются упоминания лишь нескольких серий более чем из пяти пациентов в возрасте до 20 лет (табл. 1).
Таблица 1
Лечение пациентов молодого возраста с грибовидным микозом по данным литературы[37]
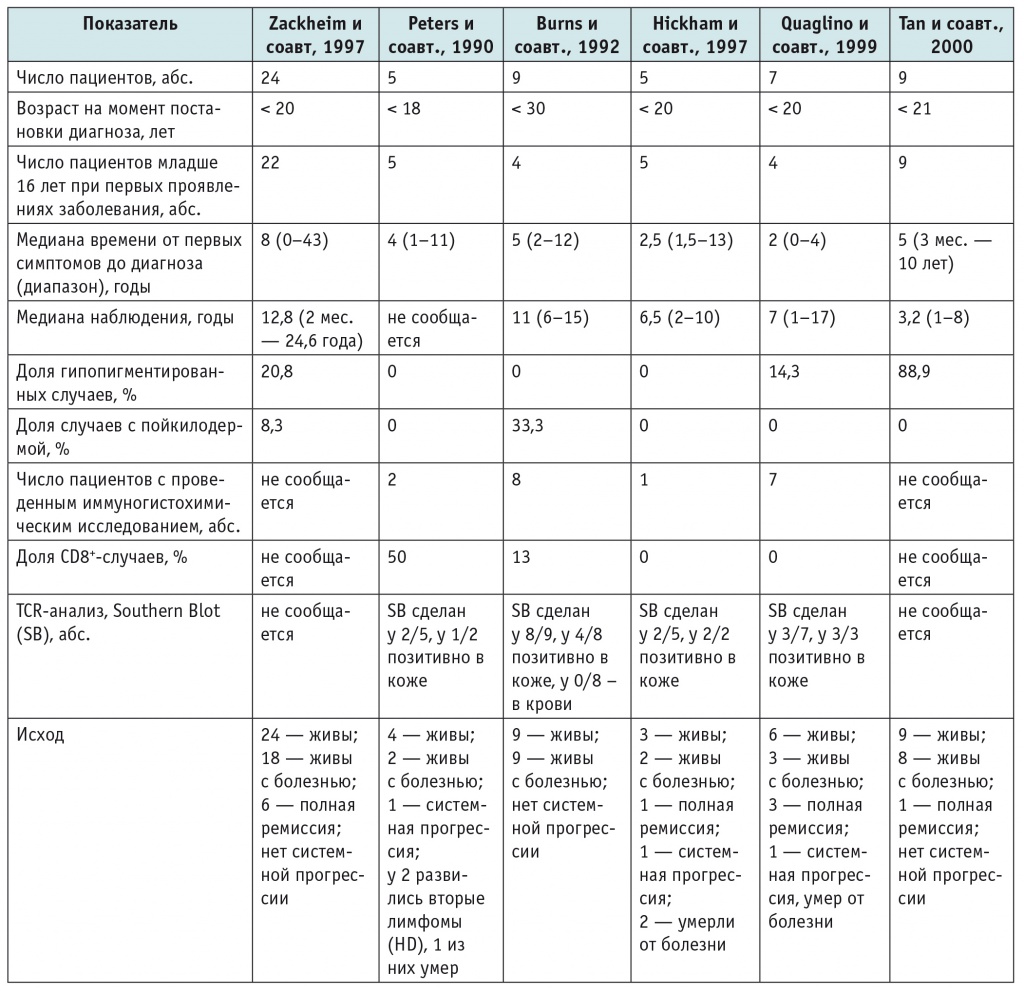
Примечание. HD — Ходжкина болезнь; TCR – Т-клеточный рецептор.
Стадирование
В течении ГМ выделяют три фазы[13, 14]. Это деление носит несколько условный характер, так как у одного и того же пациента могут быть симптомы, характерные для разных фаз развития заболевания.
- Премикотическая, или пятнистая, фаза характеризуется появлением на коже туловища, особенно в местах инсоляции, несимметричных, неправильной формы чешуйчатых эритематозных зудящих пятен с поверхностной атрофией, которые длительно (в течение месяцев и даже лет) существуют без значимой динамики. В это время гистологическая картина биоптата кожи не совсем характерна для ГМ, поэтому диагноз можно только заподозрить.
- Бляшечная (инфильтративная) фаза — появление плотных пальпируемых эритематозных зудящих бляшек, нередко кольцевидных, часто ассоциированных с алопецией и гиперкератозом.
- Опухолевая фаза — появление больших (> 10 см) узлов, растущих из предшествующих пятен, бляшек или на неизмененной коже, с системной инфильтрацией и распространением. Опухолевые узлы могут сопровождаться зудом и изъязвлением.
Клиническое стадирование проводится исходя из распространенности болезни и наличия опухолевых узлов. Международное общество лимфом кожи (англ. International Society for Cutaneous Lymphomas) и Европейская организация по изучению и лечению рака (англ. European Organisation for Research and Treatment of Cancer) предложили систему стадирования и классификации ГМ и синдрома Сезари[9, 26]. В ней оцениваются распространение и качество поражения кожи, вовлечение лимфоузлов и внутренних органов, что позволяет определить прогноз и необходимую терапию.
Стадия IA — пятна/бляшки занимают менее 10% всей поверхности кожи пациента, нет вовлечения крови, допустимо наличие менее 5% атипичных Т-клеток с церебриформными ядрами (клеток Сезари) в периферической крови (T1, N0, M0, B0–1).
Стадия IB — пятна/папулы/бляшки занимают 10% поверхности кожи и более, нет вовлечения крови, допустимо наличие менее 5% атипичных Т-клеток (клеток Сезари) в периферической крови (T2, N0, M0, B0–1).
Стадия IIA — любая площадь поражения (пятна/папулы/бляшки) и клинически измененные периферические лимфоузлы (N1) или их поражение ГМ (N2) без вовлечения крови (T1–2, N1–2, M0, B0–1). В 5% случаев отмечается диффузная болезненная зудящая эритродермия с клетками Сезари (опухолевые Т-лимфоциты) в количестве менее 5% в периферической крови (синдром Сезари, описан A. Sézary и J. Bouvrain в 1938 г.).
Стадия IIB — одна опухоль или более диаметром 1,5 см и больше, отсутствие или наличие поражения лимфоузлов, отсутствие висцерального поражения или значимого поражения крови (T3, N0–2, M0, B0–1).
Стадия III — эритема с вовлечением более 80% поверхности кожи, отсутствие или наличие поражения лимфоузлов, отсутствие висцерального поражения или значимого поражения крови. Стадия IIIA — T4, N0–2, M0, B0. Стадия IIIB — T4, N0–2, M0, B1.
Стадия IVA1 — определяется при наличии более 1000 клеток Сезари в 1 мл крови при позитивной клональности (T1–4, N0–2, M0, B2).
Стадия IVA2 — вовлечение регионарных или диффузных лимфоузлов, наличие в них больших кластеров атипичных клеток (более 6 клеток) или тотального замещения лимфоузла опухолевыми клетками (T1–4, N3, M0, B0–2).
Стадия IVB устанавливается при висцеральном поражении: печень, селезенка, костный мозг, почки, желудок, головной мозг (T1–4, N0–3, M1, B0–2)[5, 26].
Кроме объема распространения (стадии), негативное прогностическое значение имеют повышение уровней лактатдегидрогеназы, растворимого рецептора IL-2, СОЭ, увеличение содержания эозинофилов в крови[2, 9, 12, 22, 35, 38]. Однако существуют и благоприятные прогностические факторы: повышенное число CD8-позитивных реактивных Т-клеток, FoхP3-позитивных Т-регуляторных клеток, CD1a-позитивных дендритных клеток в биоптате[6, 8, 23, 36].
ГМ является злокачественным заболеванием. Моноклональные реарранжировки генов Т-клеточных рецепторов (TCR) определяются стандартными методами (Southern Blot для TCR-β и ПЦР для TCR-γ и TCR-β) у 90% пациентов с ГМ[7, 39, 40, 43, 44].
Этиология и патогенез этого процесса неизвестны. Существуют гипотезы о влиянии на развитие ГМ ретровирусов HTLV-1, HTLV-2, вируса Эпштейна — Барр, цитомегаловируса, токсических веществ, генетической предрасположенности, но эти гипотезы до настоящего времени не подтверждены[5, 10].
В последнее время все больше внимания уделяют возможной ассоциации ГМ и вируса герпеса 8-го типа (HHV-8). Исследования методом ПЦР в 70% случаев выявили в очагах поражения вирус-специфичную ДНК, но при этом иммуногистохимически латентный ядерный антиген не определялся, вероятно, в связи с низким содержанием вируса[18].
Клетки опухоли при ГМ экспрессируют цитокиновые рецепторы CCR4 и CCR10. CCL17 и CCL22 — это лиганды к CCR4, которые в высокой концентрации присутствуют в очагах поражения при ГМ и в сыворотке крови пациентов с синдромом Сезари, так же как и CCL27 — лиганд к CCR10[10]. Взаимодействие рецепторов с лигандами не только влияет на процесс миграции Т-клеток, но и обеспечивает их выживание путем активации антиапоптотических путей[10]. Возможно, что такое взаимодействие хемокинов обеспечивает персистенцию очагов в эпидермисе.
Клетки ГМ все время находятся в состоянии активации — они экспрессируют такие молекулы активированных Т-клеток, как CD45Ro и IL-2R, что ведет к запуску внутриклеточных сигнальных белков, например семейства JAK-STAT[1, 3, 21, 25]. Вероятно, это влияет на регуляцию клеточной пролиферации и выживания. Кроме того, нарушению нормальных путей апоптоза в клетках ГМ могут способствовать мутации гена Fas, ингибиторы апоптоза, вовлеченные в сигнальный путь TNF, и активация сигнального пути NF-κB[11, 33].
Диагностика
Диагноз ГМ ставится на основании гистологического исследования биоптата кожи с последующим его иммуногистохимическим и молекулярно-генетическим исследованием. Опухолевые клетки при ГМ — это зрелые Т-лимфоциты, которые прошли антигенную стимуляцию в лимфатическом узле. Они имеют тенденцию к колонизации эпидермиса (эпидермотропизм), лучше всего заметной в ранних фазах заболевания (пятно, бляшка) (см. рис. 1). Кожный инфильтрат содержит большие клетки неправильной формы с церебриформными или складчатыми ядрами, известные как клетки Сезари. Похожие клетки, но в меньшем количестве могут встречаться и при других дерматозах, поэтому необходимо принимать во внимание клинические данные и сопутствующие гистологические особенности.
Одну из главных черт представляет эпидермотропизм, он связан со стадией заболевания и степенью дифференцировки лимфоцитов — при развитии в опухолевую фазу ГМ клетки становятся большими, трансформированными и эпидермотропизм исчезает[4, 15, 24, 29, 31]. В то же время эпидермотропизм не является уникальным проявлением ГМ, так как он может встречаться при тяжелых формах поверхностного дерматита.
Типичным для ГМ является также наличие псевдоабсцессов Потрие — скоплений атипичных лимфоидных клеток в интрадермальных везикулах (см. рис. 1). Опухолевые клетки имеют иммунофенотип CD2+, CD3+, CD4+, CD5+, CD7– и CD8– (см. рис. 2). Редкими формами являются варианты с гипопигментацией, в таком случае клетки опухоли могут иметь фенотип цитотоксических лимфоцитов с экспрессией CD8.
Грибовидный микоз у детей и подростков
По данным литературы, частота ГМ у детей и подростков составляет всего 0,5–2,7%[16, 20, 32]. Однако возможно, что на самом деле он встречается чаще. Самый младший из пациентов был в возрасте 22 месяцев[19]. Мальчики болеют чаще девочек.
В детском возрасте заболевание обычно начинается с фазы пятна/бляшки или с гипопигментации, иногда отмечается поражение только одной области. Достаточно редко болезнь течет агрессивно, с быстрым развитием опухолевой прогрессии. В целом прогноз сопоставим с таковым у взрослых (10-летняя общая выживаемость — 74%)[28].
Иммунофенотип клеток такой же, как у взрослых. Однако в 50% случаев встречаются варианты с гипопигментацией.
В одном из самых больших ретроспективных исследований по ГМ у детей в группе из 34 пациентов медиана возникновения симптомов составила 10 лет (от 6 до 16 лет), а точный диагноз ГМ был поставлен в среднем по истечении 4–5 лет после появления первых симптомов. На ранних фазах чаще всего звучали диагнозы «экзема», «псориаз», «витилиго», при этом стадии заболевания не превышали I–IIA. После проведенной терапии у большинства пациентов отмечалась регрессия симптомов, частота случаев прогрессии за 10 лет составила 29%, а общая выживаемость — 93%[37].
Лечение
Терапию ГМ назначают прежде всего с учетом стадии заболевания. IA, IB, IIA относятся к ограниченным стадиям, а IIB, III, IV — к продвинутым. ГМ считается неизлечимым заболеванием, но при ограниченных стадиях средняя продолжительность жизни составляет 12 лет. С другой стороны, у пациентов с продвинутыми стадиями или прогрессией медиана выживаемости не превышает 2,5 года. Наиболее важными прогностическими факторами являются стадия болезни, туморозная форма и ответ на терапию.
При IA–IIA стадиях пациентов (как правило, это люди пожилого возраста) сначала можно просто наблюдать, но обычно выбором являются топическая терапия (кортикостероиды наружно или в очаги), фототерапия — псорален с облучением ультрафиолетом класса А (PUVA), облучение ультрафиолетом класса В. Отвечают на это лечение 60% пациентов, среди которых частота полных ремиссий достигает 80%. Кроме того, используются комбинации PUVA с ИФН-α или ретиноидами, топическая цитостатическая терапия — мехлоретамин (Мустарген) или кармустин. Применение последнего препарата часто сопровождается реакциями гиперчувствительности, особенно при сочетании с другими мазями, а длительное его использование может привести к вторичным ракам кожи. Терапия второй линии при ранних стадиях болезни включает ретиноиды (бексаротен), ИФН-α, низкие дозы метотрексата (20–60 мг в неделю), ингибиторы гистондеацетилаз (одобрен только вориностат), денилейкин дифтитокс (опухоль должна экспрессировать CD25) и может быть достаточно эффективной, прежде чем придется назначать химиотерапию.
Кожные лимфомы обычно радиочувствительны, но ответ зависит от дозы и стадии болезни. Так, достижение ремиссии при стадии Т1 (локальное облучение или электронное облучение всего тела) достигает 90%, а при Т4 — всего 20–30%. При дозах 10–20 Гр ответ составляет 55%, а при 30 Гр — 94%[27].
Ретиноиды — группа структурных и функциональных деривативов витамина А (ретинола), которые связываются с ядерными рецепторами (рецептор ретиноевой кислоты — RAR, рецептор ретиноида Х — RXR) и взаимодействуют через разные транскрипционные факторы. RAR и RXR имеют различные изоформы, по-разному представленные в тканях организма. Кожа содержит и RAR, и RXR. Бексаротен — новый синтетический ретиноид, селективно связывающийся с семейством RXR, который производится как в капсулах, так и в виде наружного геля. Даже в случаях рефрактерного процесса он эффективно редуцирует очаги в течение 2–4 месяцев.
ИФН-α модифицирует биологический ответ и используется во второй линии терапии для ранних стадий или в первой линии для продвинутых стадий ГМ. Ответ на него ожидается через несколько недель терапии, часто ИФН-α комбинируют с PUVA, химиотерапией и ретиноидами.
При продвинутых стадиях или рефрактерных начальных стадиях требуется мультидисциплинарный подход. Для IIВ–III стадий лечение чаще начинают с локальной терапии, ИФН-α, бексаротена, вориностата и только при рефрактерности переходят к системной полихимиотерапии. Для пациентов IV стадии агрессивная химиотерапия и трансплантация стволовых клеток должны рассматриваться как можно раньше.
Денилейкин дифтитокс — рекомбинантный химерный белок, состоящий из комбинации рецепторно-связываемой последовательности IL-2 с цитотоксическими А- и В-цепями дифтерийного токсина (DAB389IL-2). Он одобрен для лечения кожных лимфом, клетки которых экспрессируют CD25 (с рецепторами IL-2), и эффективно комбинируется с бексаротеном.
Ингибиторы гистондеацетилаз (HDACi) широко используются для лечения онкогематологических заболеваний. Вориностат ингибирует I и II классы гистондеацетилаз и используется для лечения лимфом кожи. Некоторые другие HDACi тоже оказались эффективны — ромидепсин, панобиностат, белиностат.
Еще один препарат, продемонстрировавший эффективность при ГМ, — моноклональное антитело к CD52 алемтузумаб, но он в настоящее время проходит стадию клинических исследований.
Важную роль в лечении ГМ играет системная химиотерапия — это и алкилирующие агенты, и антрациклины, и пуриновые аналоги, и этопозид. К сожалению, и при монотерапии, и при сочетании препаратов ответ бывает достаточно кратковременным. Оптимального режима с доказанной эффективностью не разработано, можно использовать разные схемы и сочетания (табл. 2).
Таблица 2
Эффективность системной химиотерапии при кожных Т-лимфомах по данным различных исследований[30, 34, 42, 45]
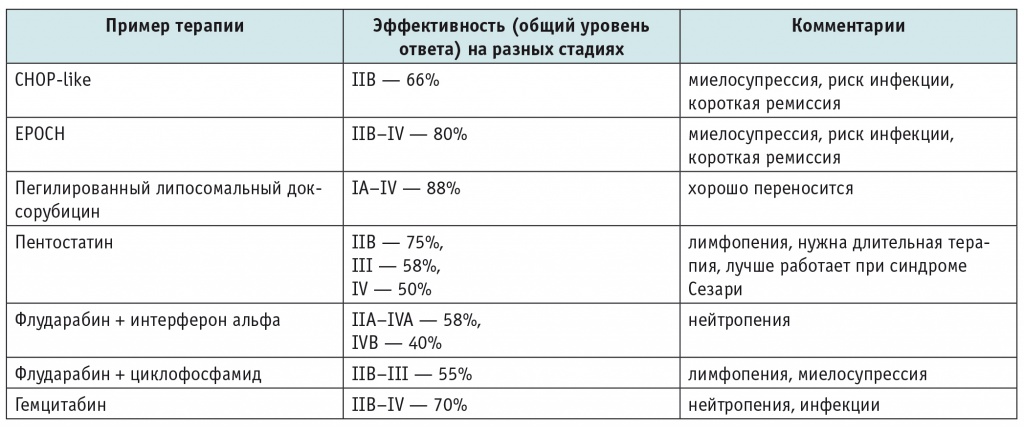
Примечание. СHOP — циклофосфамид, доксорубицин, винкристин, преднизолон; EPOCH — этопозид, преднизолон, винкристин, циклофосфамид, доксорубицин.
Для лечения ГМ в фазе опухолевой трансформации обычно используют системную химиотерапию с рассмотрением вопроса о ТГСК. При обнаружении на клетках опухоли антигена CD30 рассматривается вопрос о применении брентуксимаба ведотина — конъюгата антитела к CD30 с антитубулиновым агентом монометилауристатином, есть сообщения об эффективности такого подхода (общий уровень ответа — 68%)[17].
Трансплантация гемопоэтических стволовых клеток. Количество пациентов с ГМ, перенесших ТГСК, невелико, но уже известно, что аллогенная ТГСК со стандартной интенсивностью кондиционирования приводит к полным и длительным ремиссиям у пациентов с лимфомами кожи. Проблемой остаются инфекционные осложнения, поэтому последние исследования направлены на внедрение режимов редуцированной интенсивности кондиционирования и на оценку их эффекта. Общей рекомендацией является применение ТГСК у молодых пациентов и детей с продвинутыми стадиями болезни и без ответа на терапию второй линии.
ЗАКЛЮЧЕНИЕ
Первым шагом для успешного лечения грибовидного микоза является аккуратная и точная постановка диагноза с использованием всех современных методов гистологии, иммуногистохимии и молекулярной генетики. Кроме того, необходимы тщательное стадирование процесса и оценка темпов прогрессии. От стадии заболевания, возраста, клинического состояния зависит выбор лечения для каждого конкретного пациента. Появление новых таргетных препаратов, совершенствование технологии трансплантации гемопоэтических стволовых клеток дает надежду на новые горизонты в лечении данного заболевания.







