Механизмы ухудшения когнитивных функций при хронической болезни почек (ХБП) в настоящее время до конца не изучены, но доказана роль повреждающего действия уремических токсинов на нейроны головного мозга [6]. Прогрессирование ХБП повышает риск развития сердечно-сосудистых и других осложнений, которые, в свою очередь, усугубляют течение самой ХБП и приводят к прогрессированию когнитивных нарушений. К сожалению, до сих пор у части пациентов ХБП диагностируется поздно, нередко уже на терминальной стадии. Наличие терминальной почечной недостаточности требует дорогостоящих альтернативных методов лечения (гемодиализ, аллотрансплантация почки), повышает инвалидизацию и смертность населения в трудоспособном возрасте. В настоящее время чрезвычайно важны своевременная диагностика и раннее начало терапии когнитивных расстройств у лиц молодого и среднего возраста с ХБП.
Цель исследования: оценить когнитивные функции у пациентов с ХБП.
МАТЕРИАЛЫ И МЕТОДЫ
Обследованы 108 пациентов с хроническим гломерулонефритом на I, II, IIIА и IIIБ стадиях ХБП, наблюдавшихся в нефрологическом отделении Кемеровской областной клинической больницы: 49 (45,4%) женщин и 59 (54,6%) мужчин, средний показатель возраста — 37,2 ± 1,5 года. Патология почек в виде хронического гломерулонефрита морфологически подтверждена у 71 (65,7%) пациента; у 43 (60,6%) из них диагностирован мембранозный вариант, у 15 (21,1%) — мезангиопролиферативный, у 13 (18,3%) — фокально-сегментарный.
Всем пациентам были выполнены общий анализ крови, общий анализ мочи, биохимические анализы крови (калий, натрий, креатинин, мочевина, общий белок), определение содержания белка в суточной моче. Исследовался также уровень цистатина C сыворотки крови методом иммуноферментного анализа с применением набора RD191009100 Human Cystatin C ELISA (Бельгия), верхняя референсная граница при данной методике — 900 нг/мл. В группе больных с ХБП I он составил 1141 (914; 1474) нг/мл, в группе с ХБП II и III — 1164 (921; 1561) нг/мл (p = 0,0001).
Скорость клубочковой фильтрации (СКФ) оценивали по расчетной формуле CKD-EPI [1]. Среди обследуемых с I стадией ХБП было 70 (64,8%) пациентов, со II стадией ХБП — 18 (16,7%), с III (А и Б) стадией ХБП — 20 (18,5%). У 65 (60,2%) пациентов наблюдалась артериальная гипертензия, в качестве антигипертензивной терапии больные получали ингибиторы АПФ, блокаторы кальциевых каналов или их комбинацию.
Сравнение проводилось с группой лиц без почечной патологии (n = 36), средний возраст которых составил 37,5 ± 1,7 года. Обязательным условием включения в исследование было подписание пациентом информированного согласия.
Из исследования были исключены пациенты с наличием в анамнезе заболеваний ЦНС, травмы головного мозга, эпизодов нарушения мозгового кровообращения различной степени выраженности, нефротического синдрома, хронической соматической патологии (а именно сахарного диабета), ишемической болезни сердца, хронической сердечной недостаточности; беременные женщины; лица, злоупотребляющие алкоголем; пациенты, отказавшиеся от участия в исследовании. Следует отметить, что все обследуемые были праворукими.
Все участники исследования были протестированы по краткой шкале оценки психического статуса (Mini-Mental State Examination — MMSE) c целью выявления деменции и преддементных когнитивных нарушений. Критерием исключения из исследования на данном этапе было снижение количества баллов до 28 и менее [3]. У 3 (2,8%) пациентов c хроническим гломерулонефритом результат МMSE составил 24–27 баллов (преддементные когнитивные нарушения), таким образом, продолжили обследование 105 из 108 больных ХБП.
Психофизиологическое обследование проводилось с помощью программно-аппаратного комплекса Status PF, предназначенного для персонального компьютера типа IBM, совместно с адаптером регистрации ответных реакций, разработанным на базе Кемеровского государственного университета (Иванов В. И., 2001). В числе параметров когнитивных функций изучались показатели нейродинамики, включавшие время простой (ПЗМР) и сложной зрительно-моторной реакции (СЗМР) и реакцию на движущийся объект (РДО), а также память и внимание.
Статистический анализ данных проводили с использованием пакета прикладных программ Statistica 6.1 (StatSoft Inc., США). Характер распределения данных оценивали с помощью критерия Шапиро — Уилка. Количественные данные, имевшие нормальное распределение признака, представляли средним значением (М) и стандартным отклонением (σ). Если распределение признака отличалось от нормального, то центральная тенденция была представлена медианой, 25-м и 75-м квартилями. Сравнение двух независимых групп проводили с помощью t-критерия Стьюдента, если признак распределялся нормально, и путем проверки статистической гипотезы с помощью критерия Манна — Уитни при распределении, отличном от нормального. Взаимосвязь двух количественных признаков изучали с применением непараметрического метода Спирмена. Различия считали статистически значимыми при p ≤ 0,05.
Локальным этическим комитетом при Кемеровской государственной медицинской академии работа признана соответствующей стандартам Хельсинкской декларации.
РЕЗУЛЬТАТЫ
При сравнении групп пациентов с ХБП и лиц без почечной патологии выявлены статистически значимые различия минимальной экспозиции ПЗМР, отражающей нейродинамический статус пациента. Данный показатель у пациентов с ХБП составил 198,7 ± 9,6 мс, а в группе сравнения — 151,0 ± 20,0 мс (р = 0,0019). При оценке показателей нейродинамики, отражающих предельно быстрый ответ на внезапно исчезающий объект, у лиц с ХБП получена средняя экспозиция ПЗМР 430,0 ± 18,5 мс, в группе сравнения аналогичный показатель составил 298,0 ± 54,3 мс (р = 0,0001).
Статистически значимые различия были получены и в более сложном тесте СЗМР. Показатель минимальной экспозиции СЗМР у больных ХБП был 336,9 ± 7,2 мс, а в группе сравнения — 421,1 ± 23,4 мс (р = 0,0001). Средняя экспозиция СЗМР у пациентов с ХБП составила 541,9 ± 11,9 мс, тогда как в группе сравнения — 401,0 ± 10,7 мс (р = 0,0001). Количество ошибок у пациентов с ХБП было больше, чем у лиц группы сравнения (р = 0,0001).
Была проведена также оценка РДО, позволяющая судить о соотношении возбудительного и тормозного процессов в коре головного мозга. Пациенты с ХБП демонстрировали худшие показатели РДО в сравнении с лицами без патологии почек, выявленные различия были статистически значимы (р = 0,0001). Так, количество опережений и сумма запаздываний у пациентов с ХБП составили 5,0 ± 0,33 и 1061,0 ± 97,6 мс, а в группе сравнения — 8,0 ± 2,97 и 1749,0 ± 110,3 мс соответственно.
Показатель механической памяти (запоминание 10 чисел) в группе пациентов с ХБП составил 4,5 ± 0,18 балла, в группе сравнения — 6,5 ± 0,5 балла (p = 0,0001). Объем смысловой памяти (запоминание 10 слов) у пациентов с ХБП также был статистически значимо ниже: у пациентов с ХБП — 4,5 ± 0,2 балла, у лиц без почечной патологии — 5,7 ± 0,7 балла (p = 0,0001). Существенных различий в результатах теста запоминания бессмысленных слогов, отражающего долговременную память, не выявлено. Объем внимания в сравниваемых группах также не различался.
На следующем этапе работы проводилось сравнение пациентов с хроническим гломерулонефритом на стадиях ХБП I и II–III. В группе пациентов с ХБП I средняя экспозиция ПЗМР составила 347 (290; 459) мс, а в группе ХБП II–III — 441 (399; 504) мс (p = 0,008). Сопоставление других показателей представлено в таблице.
Таблица
Показатели нейродинамики, памяти и внимания у пациентов с хронической болезнью почек первой и второй — третьей стадий
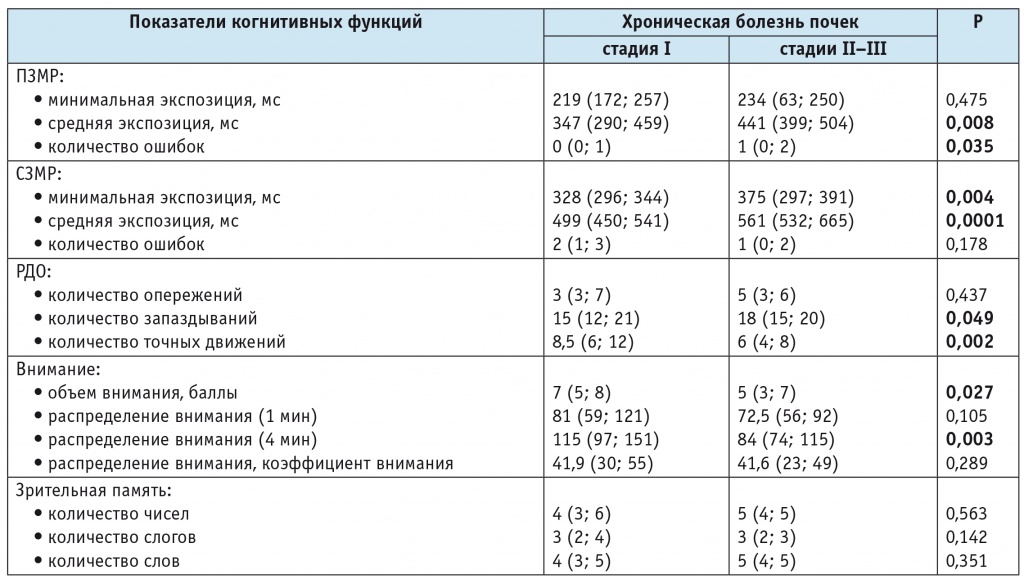
Примечание. ПЗМР — простая зрительно-моторная реакция; РДО — реакция на движущийся объект; СЗМР — сложная зрительно-моторная реакция.
В частности, обращает на себя внимание увеличение количества запаздываний со снижением числа точных движений при прогрессировании ХБП. В группе ХБП II–III наблюдался также меньший объем внимания (p = 0,027). Таким образом, пациенты с ХБП I имели лучшие показатели нейродинамики и внимания в сравнении с группой пациентов с ХБП II–III. Показатели, характеризующие память, в сравниваемых группах пациентов с ХБП статистически значимых различий не имели (см. табл.).
В ходе корреляционного анализа выявлены взаимосвязи между возрастом и показателями нейродинамики и внимания у пациентов с ХБП I–III. Получена положительная связь средней силы между средней экспозицией ПЗМР и возрастом (r = 0,38, p = 0,001); менее тесная корреляция выявлена между количеством ошибок при выполнении ПЗМР и возрастом (r = 0,23, p = 0,03). Кроме того, обнаружены значимые взаимосвязи между средней экспозицией СЗМР и возрастом и между минимальной экспозицией СЗМР и возрастом (r = 0,38, p = 0,001; r = 0,46, p = 0,001).
При оценке РДО, отвечающей за точность реагирования личности, получена отрицательная корреляционная связь средней силы между количеством точных движений и возрастом (r = –0,49, p = 0,001). В свою очередь, положительная взаимосвязь средней силы выявлена между количеством запаздываний и возрастом (r = 0,30, p = 0,001), более сильная — между суммарным временем запаздываний при выполнении теста и возрастом (r = 0,53, p = 0,001).
Что касается внимания, выявлены отрицательные взаимосвязи возраста и объема внимания, возраста и распределения внимания (r = –0,37, p = 0,001; r = –0,50, p = 0,001). Статистически значимых корреляционных связей между возрастом и памятью у пациентов с ХБП I–III не обнаружено.
Отрицательные корреляционные связи средней силы выявлены между минимальными экспозициями ПЗМР, СЗМР и СКФ (r = –0,39, p = 0,001; r = –0,38, p = 0,001), а также между средней экспозицией СЗМР и СКФ (r = –0,40, p = 0,001). Получены отрицательная корреляционная связь между количеством запаздываний и суммарным временем запаздываний по результатам РДО и СКФ (r = –0,27, p = 0,01; r = –0,40, p = 0,001) и положительная связь средней силы между количеством точных движений (РДО) и СКФ (r = 0,39, p = 0,001).
Выявлена положительная взаимосвязь средней силы между минимальной экспозицией ПЗМР и уровнем цистатина C (r = 0,37, p = 0,01). Кроме того, у пациентов с ХБП I–III обнаружены положительные корреляционные взаимосвязи между минимальной экспозицией СЗМР и уровнем цистатина С и между средней экспозицией СЗМР и уровнем цистатина С (r = 0,50, p = 0,00; r = 0,37, p = 0,01), а также отрицательная связь между количеством ошибок при выполнении СЗМР и уровнем цистатина С (r = –0,33, p = 0,02). При оценке точности реагирования пациентов получена положительная корреляционная взаимосвязь между суммарным временем запаздываний и уровнем цистатина С (r = 0,41, p = 0,001). Статистически значимых корреляций уровня цистатина С с показателями, характеризующими внимание, не получено.
Определялись положительные взаимосвязи средней силы между минимальной экспозицией ПЗМР и суточной протеинурией, суммарным временем запаздываний при оценке РДО и суточной протеинурией (r = 0,46, p = 0,00; r = 0,22, p = 0,04). Положительная взаимосвязь выявлена также между распределением внимания и суточной протеинурией (r = 0,28, p = 0,01). Статистически значимых взаимосвязей суточной протеинурии и памяти не обнаружено.
ОБСУЖДЕНИЕ
В ходе исследования установлено, что у пациентов молодого и среднего возраста с хроническим гломерулонефритом на I–III стадиях ХБП имеются нарушения когнитивных функций (нейродинамика, внимание), усиливающиеся по мере прогрессирования ХБП. Выраженность нарушений памяти не зависела от стадии ХБП. Возможно, потому, что в исследование не вошли пациенты c IV и V стадиями ХБП.
Выявлено нарушение аналитико-синтетической деятельности головного мозга, включающей в себя переработку информации, принятие решений и анализ данных. У пациентов с ХБП I–III снижена способность головного мозга удерживать длительное концентрированное возбуждение и замедлена скорость генерации процессов возбуждения и торможения. Свидетельством этого является увеличение количества пропущенных сигналов и совершаемых ошибок в проведенных нами тестах, направленных на оценку нейродинамического статуса пациентов.
В последнее время все больше исследований указывают на то, что ХБП является серьезным и независимым фактором риска развития и прогрессирования когнитивных нарушений. В метаанализе T. Etgen и соавт. (54 779 пациентов в возрасте от 36 лет до 81 года) выявлено ухудшение когнитивных функций по мере развития ХБП, снижения СКФ [7].
Имеются данные о том, что начальные проявления ХБП увеличивают риск развития деменции на 37% [15]. Ранее установлено, что степень выраженности когнитивных нарушений зависит от стадии ХБП [6]. Данный факт объясняется не только непосредственным влиянием уремических токсинов на нейроны, но и высокой распространенностью цереброваскулярных поражений при ХБП [5, 8]. В других исследованиях выявлена связь между маркерами поражения сосудов (эндотелиальная дисфункция) почек и головного мозга [9, 12].
Патогенетические механизмы развития когнитивных нарушений при ХБП — хроническое воспаление, гипергомоцистеинемия, оксидативный стресс, анемия [6]. Что касается последнего фактора, то доказательством служит регресс когнитивных нарушений на фоне терапии анемического синдрома [16]. Вместе с тем на фоне приема эритропоэтинов повышается риск развития ОНМК, а это увеличивает риск развития деменции в последующем [13].
В качестве предикторов когнитивных нарушений помимо СКФ рассматривают уровень креатинина крови, гораздо реже протеинурию, картину гистологического исследования биоптата почки [10]. Результаты нашего исследования подтвердили данные о связи СКФ и когнитивных функций головного мозга.
Следует отметить особую роль белка плазмы цистатина С, который, в отличие от креатинина, не зависит от мышечной массы, пола, возраста, физической активности. K. Yaffe и соавт. в своем исследовании, которое включало 821 пациента, пришли к выводу, что более высокие уровни сывороточного цистатина С напрямую коррелируют с худшими показателями когнитивных функций у пожилых пациентов [11]. Авторы отметили, что цистатин С независимо от СКФ может быть использован как маркер нарушения когнитивных функций.
Полученные нами данные указывают на то, что у пациентов молодого и среднего возраста с ХБП I–III по мере возрастания уровня цистатина С наблюдается ухудшение показателей нейродинамики. Однако параметры памяти и внимания не зависят от уровня цистатина С.
ЗАКЛЮЧЕНИЕ
У пациентов молодого и среднего возраста на I–III стадиях хронической болезни почек имеются легкие нарушения когнитивных функций, не выявляемые по краткой шкале оценки психического статуса (Mini-Mental State Examination), но диагностируемые при использовании программного комплекса Status PF. Из когнитивных нарушений в первую очередь наблюдается нарушение нейродинамических процессов головного мозга, внимания и, реже, памяти.







