По современным представлениям, ключевую роль в развитии шизофрении играет процесс воспаления в мозге (нейровоспаление), ассоциированный с системным воспалением (кровяное русло).
Возрастающий интерес к изучению воспаления/нейровоспаления при шизофрении сопровождается значительным ростом числа научных работ, посвященных этому направлению. По данным базы PubMed, начиная с 1963 года по рассматриваемой проблеме размещено 2493 публикации, из них более 50% — за последние пять лет, что, несомненно, свидетельствует о ее высокой актуальности.
Цель обзора состоит в представлении данных литературы, а также результатов собственных многолетних исследований, касающихся использования в клинической практике маркеров воспаления при шизофрении. Полученные данные нашли применение в практической психиатрии при ранней диагностике, мониторинге состояния пациентов, оценке результатов проведенного лечения и прогнозе дальнейшей траектории заболевания.
Основным признаком нейровоспаления является активация иммунокомпетентных клеток мозга — микроглии и астроглии, участвующих в фагоцитозе и презентации антигена. В ответ на воздействие повреждающих факторов клетки микроглии синтезируют провоспалительные цитокины, хемокины, белки системы комплемента и активные формы кислорода. Эти процессы в совокупности определяют интенсивность воспалительной реакции и могут приводить к нарушению нейротрансмиссии, а также повреждению липидов мембран, нейрональных белков, митохондрий и ДНК, нарушению функций и гибели нейронов, потере межнейрональных связей[1].
Исследования свидетельствуют, что воспаление в мозге ассоциировано с воспалением в кровяном русле. Реализация воспалительного ответа в крови осуществляется преимущественно нейтрофилами и моноцитами и, как и в мозге, происходит путем фагоцитоза, презентации антигена, а также за счет синтеза большого количества медиаторов воспаления — провоспалительных цитокинов, активных форм кислорода и азота и др.[2, 3]. Взаимосвязь между развитием воспалительных реакций на периферии и в мозге осуществляется посредством цитокинов[4].
О вовлеченности иммунной системы в патогенез шизофрении свидетельствуют повышенные уровни воспалительных маркеров в спинномозговой жидкости и сыворотке крови пациентов[5], ассоциация шизофрении с определенными вариантами генов иммунной системы[6], а также результаты экспериментальных исследований, которые демонстрируют изменения поведения и нарушения в «когнитивной» и «эмоциональной» сферах у животных, опосредованные повышением уровня цитокинов[7]. В пользу высказанного положения свидетельствуют клинико-биологические корреляции между уровнями воспалительных маркеров крови и выраженностью психопатологической симптоматики у больных шизофренией, оцененной с помощью психометрических шкал[5].
Вследствие наличия нейроиммунных взаимосвязей для оценки уровня воспаления в мозге могут быть использованы различные маркеры, определяемые в крови пациентов. По данным литературы, с этой целью используются интерлейкины, хемокины, рецепторы к цитокинам, иммуноциты, показатели гемостаза, белки системы комплемента, протеолитические ферменты, маркеры апоптоза, молекулы клеточной адгезии, нейроантигены и нейроспецифические антитела, другие показатели[3–5].
Наиболее известными и часто используемыми маркерами воспаления при шизофрении являются провоспалительные (ИЛ-1β, -6, -8, -12, -17, ФНО-α, ИФН-γ) и противовоспалительные цитокины (ИЛ-4, -10, -13, ТФР-β), а также острофазные белки (преимущественно CРБ). Отечественные и зарубежные исследователи изучают связь уровней этих маркеров с особенностями психопатологической симптоматики у пациентов с шизофренией, тяжестью позитивных и негативных симптомов, выраженностью когнитивных нарушений, а также стадией заболевания, эффективностью терапии и клиническим исходом[8–10].
Показано, что показатели цитокинов и других воспалительных биомаркеров коррелируют как с позитивной, так и с негативной симптоматикой. Так, выявлены положительные корреляции между уровнем CРБ и выраженностью позитивных симптомов у пациентов с первым эпизодом шизофрении, ранее не получавших лекарственных препаратов, а также между уровнем этого белка и концентрацией активных форм кислорода, что подтверждает участие воспаления и окислительного стресса в развитии шизофрении[11].
В работах D.R. Goldsmith и соавт. изучалась ассоциация уровней ряда воспалительных маркеров (ИФН-α, ИЛ-1β, рецепторного антагониста ИЛ-1 (ИЛ-1РА), ИЛ-4, -6, -8, -10 и ФНО-α) с развитием негативной симптоматики у пациентов с высоким риском развития психоза, первым психотическим эпизодом и больных шизофренией. Обнаружено, что во всех клинических группах наиболее значимую корреляцию с выраженностью негативных проявлений имеют ФНО-α и ИЛ-6[12, 13].
Отмечено, что тяжесть позитивных симптомов у пациентов с шизофренией положительно коррелирует с уровнями ИЛ-1β, -6, -8, -10, -17 и ИФН-γ, а отрицательно — с уровнями ИЛ-2 и ФНО-α. Выраженность негативных симптомов имеет положительную связь с показателями ИЛ-1β, -6, ФНО-α, ИФН-γ и ТФР-β, а отрицательную — с концентрацией ИЛ-17[14].
Сообщается также о наличии взаимосвязи между воспалительными показателями и тяжестью когнитивных нарушений при шизофрении. Так, по данным ряда авторов, снижение когнитивных функций у пациентов коррелировало с повышением в крови уровней ИЛ-1β, -4, -6, -12, ФНО-α, а также CРБ[15, 16].
Уровни маркеров воспаления и когнитивного дефицита у пациентов с шизофренией коррелируют с данными нейровизуализационных исследований и выявляемыми структурными изменениями мозга, в частности с толщиной лобной коры, объемом задней поясной извилины, изменением коэффициентов количественной анизотропии в области мозолистого тела и др.[17]. Выявлены ассоциации концентраций ИЛ-1β, -6 и ФНО-α с вербальной памятью и объемом гиппокампа у больных шизофренией[18], ИЛ-10 — с нарушением микроструктурной целостности белого вещества[19].
Приводятся данные об изменении уровней воспалительных маркеров на разных этапах течения болезни. Показано, что отклонения от нормы наблюдаются уже на ранних, доклинических стадиях заболевания. Так, цитокиновые профили у лиц из группы высокого или ультравысокого риска развития шизофрении отличаются от таковых у пациентов с первым психотическим эпизодом, получавших и не получавших лечение. Выявлены различия в соотношении про- и противовоспалительных цитокинов и содержании нитрита азота, а также простагландина — гормоноподобного вещества и медиатора воспаления, усиливающего сосудистую проницаемость, у подростков и взрослых с первым психотическим эпизодом[20].
Появляется все больше данных, свидетельствующих о том, что уровни маркеров воспаления могут использоваться для прогнозирования траектории дальнейшего развития заболевания. Так, в исследовании B.I. Perry и соавт. с участием 2224 человек проведено изучение связи уровней ИЛ-6 и CРБ с риском развития психоза. Построена регрессионная модель, согласно которой повышенный уровень ИЛ-6 (но не СРБ), выявляемый в детском возрасте, является фактором риска развития психотического приступа в последующие годы[21].
Другим примером могут служить результаты исследования V. Mondelli и соавт. В этой работе в крови 269 пациентов из группы высокого риска развития шизофрении, не получавших лечение, определяли значения 20 воспалительных маркеров, а затем сопоставляли их с вероятностью развития психоза в последующие два года. Полученные данные свидетельствуют, что наиболее значимыми факторами высокого риска шизофрении являются высокие уровни ИЛ-4 и ИЛ-6. Согласно разработанной математической модели, вероятность развития психотического приступа также увеличивается при повышении в крови пациентов концентрации фактора роста эндотелия сосудов и соотношения ИЛ-10/ИЛ-6[22].
По данным разных авторов, этапы активного течения заболевания характеризуются дальнейшим повышением уровней воспалительных маркеров, а ремиссии разной степени выраженности — их относительным снижением, что позволяет рассматривать некоторые показатели, многократно определенные у конкретного пациента, в качестве «маркеров состояния».
По мнению многих исследователей, одним из маркеров воспаления, наиболее информативных для оценки тяжести клинического состояния пациентов с шизофренией, является ИЛ-6[14, 23]. Другим привлекающим внимание показателем, подходящим также для долгосрочного наблюдения и оценки эффективности лечения таких больных, является CРБ. Многие исследователи подчеркивают, что стойкое повышение уровня CРБ у пациентов с шизофренией связано с худшим клиническим исходом[24]. Однако в отношении этого маркера различными авторами получены противоречивые результаты, что может быть обусловлено функциональной ролью СРБ в развитии иммунного ответа: известно, что он является опсонином, т. е. белком, который присоединяет генетически чужеродные (инфекционные) агенты, способствуя их поглощению фагоцитами[25].
Содержание некоторых цитокинов (ИЛ-4, -6, -8) коррелирует также с длительностью заболевания[26]. По данным И.А. Медновой и соавт., у пациентов, страдающих шизофренией более 10 лет, также наблюдается более высокий уровень ИЛ-10[27].
Показана связь уровней цитокинов с ответом на антипсихотическую терапию у пациентов с шизофренией. Так, длительно наблюдаемые высокие значения ИЛ-6 и ИФН-γ могут быть ассоциированы с резистентностью пациентов к лечению[28]. На уровни цитокинов могут влиять и нейролептики. Однако разные препараты могут оказывать различное действие: в частности, рисперидон снижает концентрации ИЛ-1β, -2, -4, -6 и -10, но повышает содержание ИЛ-12[29]; оланзапин снижает уровни ИЛ-2, ФНО-α и ИФН-γ; клозапин повышает уровни растворимого рецептора к ИЛ-2 (sIL-2R) и ФНО-α[9, 23]. В противоположность этим наблюдениям содержание ИЛ-8 в крови остается неизменным даже после трех месяцев терапии рисперидоном и галоперидолом[10].
Исследования последних лет свидетельствуют, что для объективной оценки клинического статуса пациентов и прогноза течения заболевания более значимы не отдельные маркеры воспаления, а их комбинации и соотношения. Так, например, в качестве показателей, позволяющих прогнозировать клинический исход шизофрении, предлагается использовать соотношения ИЛ-6/ИЛ-10, ФНО-α/ИЛ-10, характеризующие баланс между про- и противовоспалительными механизмами[30].
Сообщается, что «комплексный биомаркер», объединяющий пять биологических показателей (CРБ, белок межклеточной адгезии ICAM-1, сывороточный амилоид А, ИЛ-6 и нейротрофический фактор головного мозга), имеет более высокий коэффициент корреляции с уровнем когнитивного функционирования пациентов, чем отдельные биомаркеры[31].
Важно, что в последние годы предпринимаются попытки оценивать воспалительный процесс при шизофрении с помощью показателей рутинных анализов крови, в частности абсолютного числа отдельных клеточных элементов, а также гематологических индексов, например соотношения нейтрофилов и лимфоцитов, тромбоцитов и лимфоцитов, моноцитов и лимфоцитов[32].
Используют также базовые иммунограммы, содержащие количественные данные о субпопуляциях моноцитов крови, обладающих различным эффекторным потенциалом в отношении других иммуноцитов[33]. Могут применяться отношение нейтрофилов, а также острофазных белков (CРБ) к белкам крови, например альбумину, отношение моноцитов к триглицеридам и ЛПВП и другие индексы[26, 34, 35].
В связи с тем что эволюционно воспаление тесно связано с процессом гемостаза, для оценки уровня воспаления используются также маркеры коагуляции — как отдельные белки (фибриноген), так и показатели пространственно-временной динамики роста фибринового сгустка: плотность и время задержки роста сгустка, время появления спонтанных сгустков. Как установлено, более 40% больных шизофренией в остром состоянии имеют риск или шанс тромбозов мелких сосудов мозга, что приводит к развитию когнитивных расстройств. В связи с этим мониторинг показателей воспаления и гемостаза у пациентов с шизофренией важен для предупреждения развития тромботических и гемодинамических нарушений[36].
Значимыми иммунными показателями для оценки тяжести патологического процесса при шизофрении, связанного с вторичными метаболическими нарушениями, являются аутоантитела (аАТ) к антигенам мозга. Считается, что патологический процесс вызывает нарушение гематоэнцефалического барьера (ГЭБ), которое способствует проникновению антигенов мозга в кровь и приводит к синтезу специфических аАТ[37]. Соответственно, повышение уровня аАТ в крови пациентов рассматривается как фактор утяжеления течения заболевания.
Исследователи выявляют широкий диапазон уровней воспалительных маркеров при шизофрении, в значительной мере зависящий от клинических особенностей пациентов и стадии заболевания. Нельзя также исключить возможность развития шизофрении без вовлеченности воспаления[38].
В связи с вышесказанным целесообразны выделение подгрупп пациентов с различными спектрами иммунных маркеров и поиск клинико-биологических корреляций внутри выделенных иммунофенотипов, что важно как для диагностических и прогностических целей, так и для оптимизации терапии[39].
Таким образом, на сегодняшний день в литературе описано множество биомаркеров важнейшего патогенетического процесса шизофрении — воспаления. Вместе с тем полученные данные отличаются значительным разнообразием, включая отрицательные результаты исследований и слабые корреляции с клиническими показателями. Такие расхождения объясняются гетерогенностью шизофрении, небольшими размерами выборок, анализом различных этапов заболевания, гендерным фактором и т. д. На воспаление могут влиять возраст, курение, ожирение, действие лекарств и сопутствующие заболевания[14, 23]. Важно учитывать методы забора и вид биоматериала (плазма, сыворотка или цельная кровь), антикоагулянты, температурный режим и срок хранения проб, спецификации наборов и др. Существенными ограничениями являются короткий период полужизни многих воспалительных молекул, в первую очередь цитокинов, плейотропность их действия и низкие концентрации в крови. Перечисленные факторы могут искажать «биологический градиент», теоретически связывающий степень тяжести шизофрении с активностью воспалительного процесса[40].
Необходимо отметить, что уровень воспаления при шизофрении может зависеть от генетических факторов и определяться полиморфизмами генов иммунной системы, в частности главного комплекса гистосовместимости (HLA), расположенного на хромосоме 6, генов цитокинов и др., а также полиморфизмами, определяющими полигенный риск развития заболевания[41, 42].
В Научном центре психического здоровья разработана медицинская технология «Нейроиммунотест», предусматривающая комплексное определение уровней воспалительных и аутоиммунных маркеров крови. Уровни этих маркеров, как показано в многочисленных клинико-биологических исследованиях, отражают тяжесть и остроту патологического процесса в мозге и коррелируют с особенностями клинической симптоматики больных[43].
Основными показателями, определяемыми в рамках технологии, являются энзиматическая активность лейкоцитарной эластазы (ЛЭ), функциональная активность α1-протеиназного ингибитора (α1-ПИ), а также уровни аАТ к астроцитарному белку S100B и основному белку миелина (ОБМ). ЛЭ — протеолитический фермент нейтрофилов, который выбрасывается в кровь из дегранулирующих клеток при развитии воспаления; α1-ПИ — острофазный белок, синтезируемый клетками печени и являющийся основным эндогенным ингибитором ЛЭ; уровни аАТ к белку S100B и ОБМ отражают аутоиммунный компонент[44]. Известно, что аАТ, синтезируемые в крови, могут мигрировать через нарушенный ГЭБ в мозг, связываться с белками-мишенями и способствовать развитию вторичных метаболических нарушений, в связи с чем повышенные уровни аАТ в крови пациентов рассматриваются как неблагоприятный фактор, отражающий качественное изменение иммунного воспаления в связи с утяжелением течения заболевания[37].
По совокупности показателей «Нейроиммунотеста» проводится комплексная оценка уровня активации иммунной системы, учитывающая взаимосвязь между врожденным и приобретенным иммунитетом, а также гуморальные и клеточные составляющие. По соотношению активности ЛЭ и α1-ПИ оценивается активность протеолитической системы воспаления[45]. Она может существенно изменяться при наиболее тяжелых симптомокомплексах шизофрении в связи с критическим нарушением ГЭБ и/или функциональной истощенностью нейтрофилов[46].
К несомненным преимуществам «Нейроиммунотеста» относятся прежде всего высокая концентрация определяемых маркеров воспаления и их относительная стабильность в крови пациентов. Методы, используемые для определения вышеперечисленных иммунологических показателей, достаточно просты, что позволяет анализировать большое количество образцов крови и создавать репрезентативные базы данных. Важно также, что применяемый кинетический спектрофотометрический метод определения энзиматической активности ЛЭ позволяет оценивать общий уровень этого фермента — свободного и находящегося в комплексе с ингибитором (около 70% ЛЭ в крови находится в комплексе с α1-ПИ)[44]. Количественная оценка активности α1-ПИ отражает остроту воспалительного процесса вследствие тесной взаимосвязи этого белка с провоспалительным цитокином ИЛ-6, являющимся индуктором его синтеза в печени. Получены также корреляции средней и высокой силы между активностью ЛЭ и α1-ПИ и уровнями острофазных белков, а также тромбодинамическими показателями[36]. Выявлена ассоциация активности ЛЭ с перераспределением субпопуляционного состава моноцитов[47].
«Нейроиммунотест» хорошо зарекомендовал себя как в научных исследованиях, так и в клинической практике. С использованием этой технологии были выявлены особенности воспалительных реакций при ряде симптомокомплексов шизофрении (кататония, бредовые расстройства, астения), что позволило верифицировать ряд патогенетических гипотез шизофрении, построенных на клинических наблюдениях[48–50]. Практические вопросы, решаемые с помощью «Нейроиммунотеста», касаются диагностики, мониторинга, прогноза, оценки качества ремиссий и эффективности терапии.
Исследования, проведенные нами на различных выборках пациентов с эндогенными психозами, свидетельствуют, что увеличение тяжести патологического процесса в мозге, происходящее в ряду нозологических состояний от аффективных психозов к шизоаффективным психозам и далее к шизофрении, сопровождается ростом уровня активации иммунной системы (рис. 1).
Рис. 1. Иммунологическая гетерогенность расстройств шизофренического и аутистического спектра
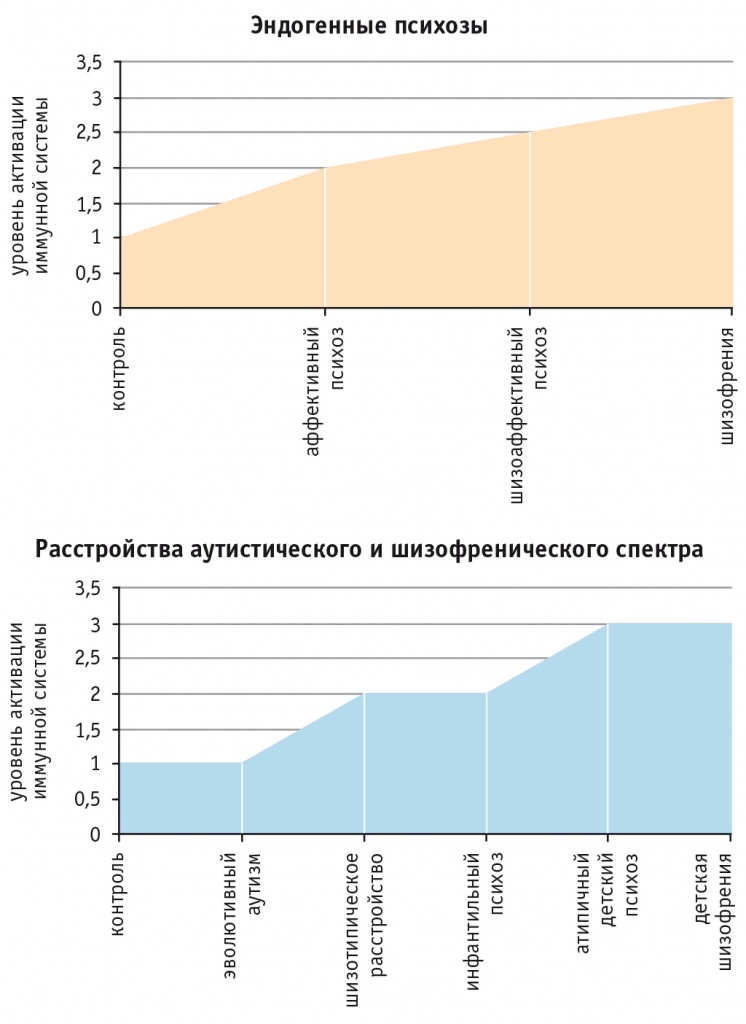
Схожая тенденция наблюдается у пациентов детского возраста с расстройствами аутистического и шизофренического спектра (см. рис. 1). При этом показано, что эволютивный аутизм (синдром Аспергера) сопровождается лишь незначительной активацией иммунной системы, не выходящей за пределы контрольного уровня. У пациентов с расстройствами аутистического и шизофренического спектра уровень активации иммунной системы нарастает от шизотипического расстройства и инфантильного психоза к атипичному детскому психозу и детской шизофрении, что отражает бо́льшую тяжесть психопатологических расстройств у таких больных[51].
Иммунологическая гетерогенность (количественная и качественная) характерна и для различных синдромокомплексов шизофрении. На рисунке 2 приведено сравнение активности ЛЭ и уровня аАТ к белку S100B у больных шизофренией с различными психопатологическими синдромами.
Рис. 2. Иммунологическая гетерогенность синдромокомплексов шизофрении.
Примечание. Знаком (*) отмечены статистически значимые различия с контролем (p < 0,05)
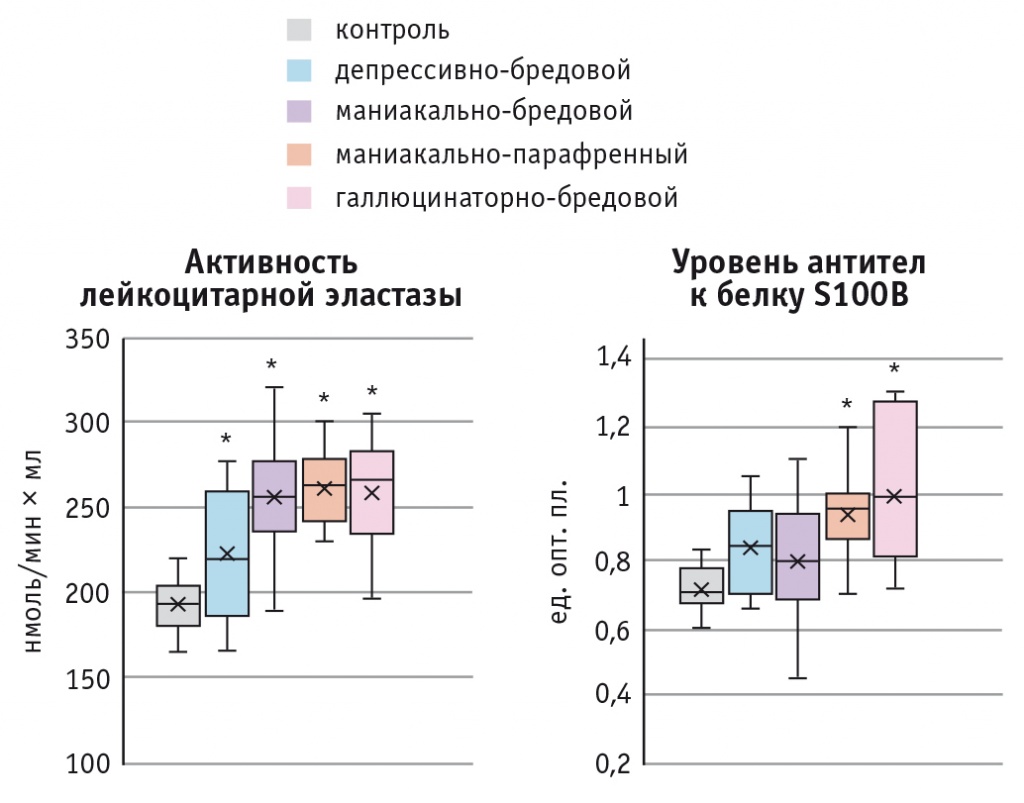
Можно видеть, что все клинические группы отличаются от контроля по активности как воспалительных (ЛЭ), так и аутоиммунных (аАТ к белку S100B) маркеров. При этом более высокие уровни активации иммунной системы наблюдаются у пациентов с психопатологическими расстройствами наиболее тяжелого регистра — маниакально-парафренными и галлюцинаторно-бредовыми.
Следует отметить, что в каждой клинической группе выявлен большой разброс значений иммунологических показателей. Это свидетельствует о том, что разные спектры иммунных показателей могут выявляться в рамках каждого из рассматриваемых синдромокомплексов. Напротив, разные клинические состояния могут быть ассоциированы со схожими иммунофенотипами. Таким образом, гетерогенность клинических проявлений шизофрении может определяться как различными уровнями воспаления и его особенностями, так и различной генетической нагрузкой, определяющей риск развития этого заболевания[42].
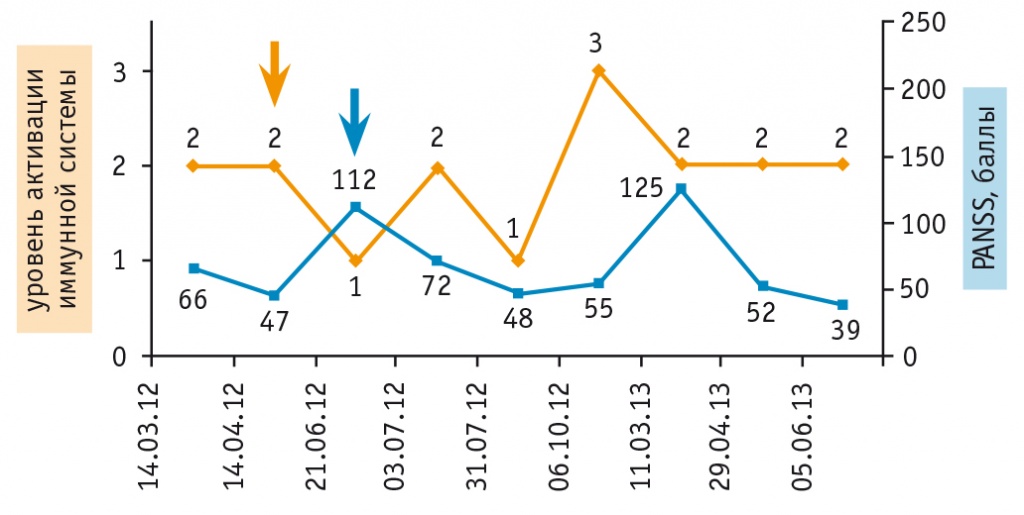
Результаты, иллюстрирующие применение «Нейроиммунотеста» для мониторинга состояния пациентов с шизофренией, представлены на рисунке 3. Можно видеть, что при наблюдении пациентов в течение года клинические (по PANSS) и иммунологические маркеры демонстрируют схожую динамику. Изменение иммунологических маркеров опережает изменение клинических показателей, что подтверждает их прогностическую значимость.
Рис. 3. Мониторинг состояния пациентов с шизофренией в динамике заболевания.
Примечание. PANSS — шкала оценки позитивных и негативных синдромов
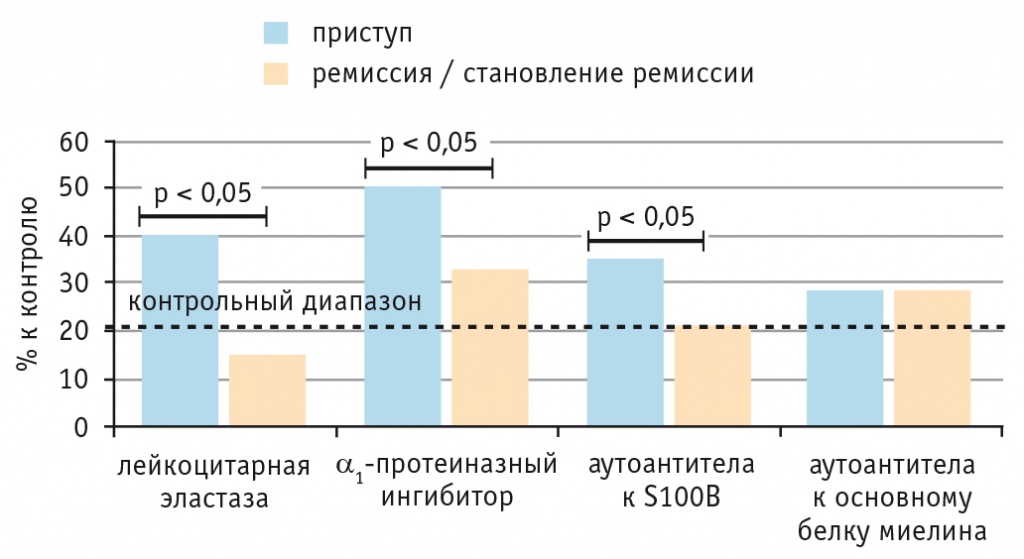
Развитие психотического приступа, как правило, сопровождается повышением активности воспалительных маркеров, а в 30–40% случаев — и ростом уровня аАТ к одному или обоим нейроантигенам. В ремиссии и на этапе ее становления наблюдается относительное снижение уровня активации иммунной системы, не достигающее, однако, контрольного показателя, что свидетельствует лишь о терапевтической ремиссии и сохранении продолжающегося патологического процесса (рис. 4).
Рис. 4. Иммунологические показатели у пациентов с шизофренией в стадии обострения и ремиссии / становления ремиссии
Особый интерес представляет иммунофенотип, характеризующийся высоким уровнем активации иммунной системы (высокие значения α1-ПИ, СРБ, ИЛ-6, а также уровня аАТ к нейроантигенам) и активностью ЛЭ, находящейся в рамках контрольного диапазона или ниже его. Такой профиль выявлен при тяжелых психопатологических состояниях: паракинетической кататонии и параноидной шизофрении с бредом воздействия и явлениями психического автоматизма, а также при астеническом синдроме в рамках шизофрении[48–50].
Наличие такого иммунного профиля предположительно может быть связано с функциональной истощенностью нейтрофилов вследствие длительно текущего патологического процесса и/или с критическим нарушением ГЭБ и трансмиграцией нейтрофилов из крови в мозг[46, 52, 53]. Показано, что этот иммунофенотип является неблагоприятным в плане дальнейшего развития психопатологических нарушений[48–50].
ЗАКЛЮЧЕНИЕ
Выявляемые различными авторами клинико-биологические закономерности свидетельствуют о ключевой роли иммунных механизмов, и в первую очередь воспаления, в формировании психопатологических расстройств у пациентов с шизофренией. Тяжесть клинических проявлений коррелирует с количественными и качественными характеристиками воспалительных реакций, что может служить дополнительным источником информации, объективизируя клиническое и психопатологическое обследование пациентов.
Определение иммунных маркеров, входящих в медицинскую технологию «Нейроиммунотест», является ценным нейробиологическим инструментом для изучения патогенеза шизофрении, а также объективизации и мониторинга состояния пациентов, прогноза развития заболевания и оценки эффективности терапии.
Приведенные в настоящем обзоре данные об иммунологической гетерогенности шизофрении свидетельствуют о том, что выделение групп пациентов, схожих по профилю иммунных маркеров, может представлять значительный интерес для клинической практики, поскольку такие группы объективно характеризуются различной активностью и тяжестью патологического процесса, различной эффективностью терапии, а также разным прогнозом дальнейшего развития заболевания.
Поступила: 27.04.2023
Принята к публикации: 16.06.2023







