В настоящее время в мире используется более 30 000 лекарственных средств, и с каждым годом это число растет в геометрической прогрессии. Изучение нежелательных эффектов медикаментозных препаратов крайне актуально для врачей всех специальностей. В пульмонологии описано более 380 медикаментов, обладающих пневмотоксичностью[2]. Наибольшие трудности в диагностике лекарственных поражений легких возникают в тех случаях, когда симптомы пневмотоксического воздействия препарата существенно не отличаются от симптомов основного заболевания, для лечения которого назначен этот препарат (слабость, одышка, чувство нехватки воздуха и др.). В связи с этим особый интерес представляет препарат амиодарон, пневмотоксические проявления которого маскируются сердечно-сосудистой патологией.
Цель работы: улучшить диагностику и оптимизировать тактику лечения амиодарон-индуцированного экзогенного токсического альвеолита (АИЭТА) («амиодаронового легкого»), основываясь на данных литературы о пульмотоксичном действии данного препарата и на анализе собственных наблюдений.
КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ
Амиодарон является бензофурановым антиаритмическим лекарственным средством, применяемым для лечения желудочковых аритмий и фибрилляции предсердий. Препарат хорошо растворим в жирах и в большом количестве накапливается в жировой и мышечной тканях, а также в печени, легких и коже. Высокое содержание в амиодароне йода (37% молекулярной массы) обусловливает его токсическое воздействие на щитовидную железу. Период полувыведения составляет от 4 до 20 часов после однократного приема, при продолжительной терапии — в среднем около 2 месяцев и может длиться до полугода. Под воздействием системы цитохрома Р450 амиодарон метаболизируется в печени в дезэтиламиодарон. Ни сам препарат, ни его метаболиты не могут быть удалены из организма с помощью диализа. Концентрация амиодарона в легочной ткани может в 100–500 раз превышать сывороточную концентрацию. Кроме того, клиренс амиодарона в ткани легкого очень медленный, и следы препарата могут выявляться в легких даже через год после прекращения лечения[13].
Амиодарон используется в клинической практике с 1960-х гг. Среди побочных эффектов этого препарата описаны гипо- и гиперфункция щитовидной железы (13–22% случаев), поражение печени (4–25%), неврологические расстройства (20–40%), поражение кожи, фотодерматоз (8–10%), пигментная кератопатия (91–100%), поражение легких (2–17%), расстройства со стороны ЖКТ (5%), брадикардия (1%). Однако, несмотря на внушительный список нежелательных побочных реакций, амиодарон до сих пор остается одним из самых эффективных антиаритмических препаратов как для экстренной помощи, так и для длительной терапии.
ЭПИДЕМИОЛОГИЯ
Впервые АИЭТА (в зарубежной литературе обозначается как амиодарон-индуцированная легочная токсичность) был описан в 1980 г.[10]. АИЭТА чаще встречается у мужчин[15]. По данным иностранных авторов, у пациентов, принимающих амиодарон в дозе 400 мг и более в сутки, частота встречаемости АИЭТА составляет 5–15%, в дозе менее 400 мг в сутки — около 1,6%[12, 15, 16]. Летальность от АИЭТА достигает 10–23%[5]. В связи с этим в настоящее время кардиологи используют дозы амиодарона 200 мг/сут и менее для уменьшения частоты токсических эффектов. Но даже такие дозы, несмотря на кажущуюся безопасность, могут приводить к развитию АИЭТА[5, 16]. В Японии минимально низкие дозы амиодарона используют в клинической практике с 1987 г. По данным исследования Y. Yamada и соавт. (2007), при многолетнем наблюдении 500 пациентов, длительно принимавших низкие (до 200 мг) дозы амиодарона, АИЭТА возникал в 4,2%, 7,8% и 10,6% случаев через 1, 3 и 5 лет соответственно[16]. Через год после приема амиодарона АИЭТА может развиться у 1% больных[13].
Анализ литературных данных показал, что минимальной безопасной дозы амиодарона не существует. Вероятность развития АИЭТА растет с увеличением дозы и длительности терапии. Данное заболевание чаще развивается при приеме амиодарона в дозе 400 мг/сут и выше при продолжительности курса более 2 месяцев (6–12 месяцев), накоплении суммарной кумулятивной дозы более 100–150 г и превышении уровня дезэтиламиодарона в плазме крови. У пожилых людей (старше 60 лет) риск развития АИЭТА увеличивается в 3 раза каждые 10 лет по сравнению с людьми моложе 60 лет[9]. По данным иностранных исследователей, именно суточная доза, возраст более 60 лет и превышение плазменной концентрации дезэтиламиодарона являются независимыми факторами риска развития АИЭТА[5, 16]. Многие авторы указывают на значительное увеличение риска развития и тяжести течения заболевания при проведении кислородотерапии, особенно в сочетании с ИВЛ или оперативным вмешательством на органах грудной клетки[7]. Такие факторы риска, как ХОБЛ и другие заболевания легких, а также снижение диффузионной способности легких (ДСЛ) как минимум до 45% от должной величины до начала лечения, не влияют на частоту возникновения АИЭТА[5, 16].
ПАТОМОРФОЛОГИЧЕСКИЕ ИЗМЕНЕНИЯ
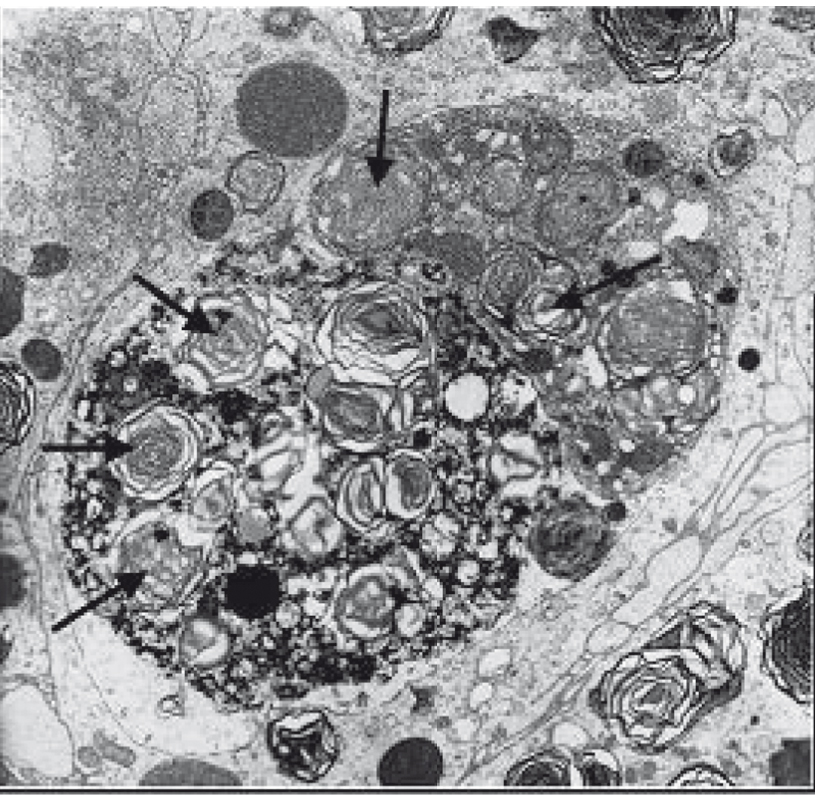
Механизм повреждающего действия амиодарона до конца не изучен. Амиодарон и его метаболиты могут оказывать как прямое цитотоксическое воздействие, так и опосредованное — через активацию продукции свободных радикалов. Препарат ингибирует действие фосфолипазы А. Фосфолипиды накапливаются в виде пластинчатых телец, определяемых при электронной микроскопии, в липосомах клеток легких (альвеолярных макрофагов, альвеолоцитов II типа) и в других тканях организма (рис. 1). Воздействие амиодарона и его метаболитов приводит также к митохондриальной дисфункции. По данным некоторых исследователей, на развитие АИЭТА влияет синергический эффект воздействия на индукцию апоптоза альвеолярных эпителиальных клеток амиодарона и ангиотензина II, концентрация которого увеличивается при сердечной недостаточности[14].
Рис. 1. Электронная микроскопия — толстоигольная биопсия легкого.
Примечание. Стрелки указывают на макрофаг с множественными пластинчатыми включениями[6]
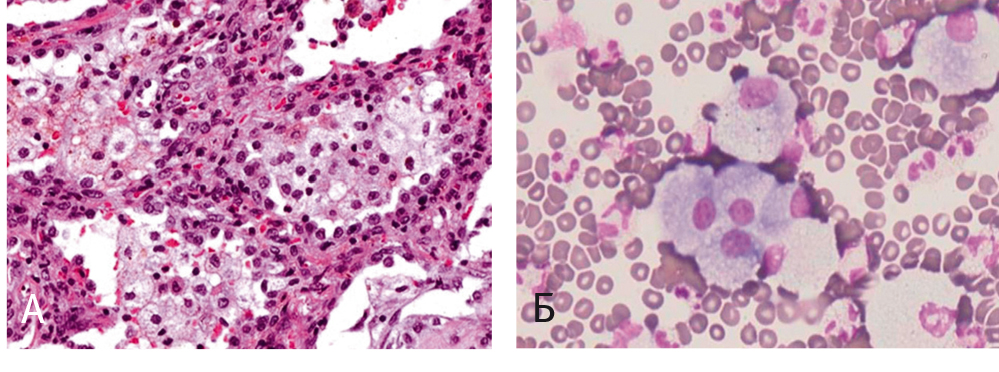
Типичная гистологическая картина при АИЭТА характеризуется гиперплазией альвеолоцитов II типа, утолщением межальвеолярных перегородок, клеточной инфильтрацией интерстиция и фиброзом. Патогномоничным признаком заболевания являются пенистые альвеолярные макрофаги, содержащие два типа аномальных вакуолей, выявляемых при электронной микроскопии: 1) маленькие пустые вакуоли; 2) пластинчатые включения, представляющие собой крупные фаголизосомы, содержащие фосфолипиды и организованные в пластинчатые структуры (рис. 2). Такие включения, кроме макрофагов, могут содержаться в альвеолоцитах II порядка. Однако эти же включения можно найти у людей без признаков АИЭТА, длительно принимающих амиодарон, что укажет лишь на прием препарата и не сможет свидетельствовать о его токсичном воздействии на легочную ткань.
Рис. 2. Пенистые макрофаги.
Примечание. А — при неспецифической интерстициальной пневмонии, индуцированной амиодароном (URL: http://pathhsw5m54.ucsf.edu/overview/interstitial2a.html), Б — в жидкости бронхоальвеолярного лаважа при амиодарон-индуцированном экзогенном токсическом альвеолите[11]
Кроме наиболее часто (50% случаев) развивающегося экзогенного токсического альвеолита (ЭТА), амиодарон может вызывать острый респираторный дистресс-синдром (ОРДС), облитерирующий бронхиолит с организующейся пневмонией[7, 9, 15].
КЛИНИЧЕСКАЯ КАРТИНА
Наиболее часто АИЭТА начинается подостро или хронически. Обычно к этому времени пациент принимает амиодарон уже на протяжении нескольких месяцев или даже лет. Заболевание проявляется прогрессирующей одышкой, сухим кашлем, общим недомоганием, лихорадкой, редко — плевральными болями, снижением массы тела, крайне редко — кровохарканьем. Постепенное начало заболевания отмечают в двух третях случаев. Острое начало заболевания чаще всего связывают с развитием ОРДС после оперативных вмешательств у пациентов, принимавших амиодарон до операции или получивших его уже в послеоперационном периоде, а также при использовании йодсодержащих контрастных препаратов и высокого потока кислорода на фоне терапии амиодароном[7, 9]. Аускультативно определяются крепитирующие хрипы.
Рентгенологическая и компьютерно-томографическая картины характеризуются двусторонними, чаще несимметричными (более характерно поражение верхней доли правого легкого) интерстициальными или интерстициально-альвеолярными изменениями, затенениями легочной ткани по типу «матового стекла» в периферических отделах легких, утолщением плевры, уменьшением в объеме долей легких. В ряде случаев может определяться плевральный выпот. АИЭТА также проявляется одиночными или множественными очагами, симулирующими новообразование[6, 15]. Выявляемая в ряде случаев лимфаденопатия средостения самостоятельного значения для диагностики не имеет.
Лабораторные тесты неспецифичны. В клиническом анализе крови могут определяться лейкоцитоз, повышение СОЭ. В сыворотке наблюдаются, так же как и при других интерстициальных заболеваниях легких, повышенные уровни лактатдегидрогеназы, гликопротеина KL-6 (> 520 ед/мл) и альвеоломуцина (> 70 ед/мл)[1].
Комплексное функциональное исследование внешнего дыхания (КФИВД) выявляет рестриктивные или смешанные нарушения, снижение ДСЛ. Уменьшение ДСЛ более чем на 15% от исходного уровня у пациента, принимающего амиодарон, является серьезным основанием для диагностики АИЭТА с чувствительностью 68–100% и со специфичностью 69–95%[9].
Сцинтиграфия легких с галлием уточняет наличие альвеолита и помогает при дифференциальной диагностике между АИЭТА и отеком легких, обусловленным прогрессирующей сердечной недостаточностью. Для исключения тромбоэмболии мелких ветвей легочной артерии выполняют перфузионную сцинтиграфию с технецием-99m.
Бронхоальвеолярный лаваж. Цитологическое исследование его жидкости позволяет сделать предположение о наличии экспозиции амиодарона, но является неспецифичным для диагностики АИЭТА. Клеточный состав ее вариабелен: могут выявляться лимфоцитоз (21% случаев), нейтрофилез (26%), смешанный клеточный состав (33%), норма (20%). Отношение CD4/CD8 при наличии экспозиции амиодарона в большинстве случаев ниже 1 и повышается после прекращения приема препарата[9]. Наиболее характерным для экспозиции является определение структурных изменений в альвеолярных макрофагах (пенистых макрофагов, пластинчатых включений в цитоплазме), подтверждающих контакт с амиодароном.
Таким образом, клинические и рентгенологические проявления АИЭТА неспецифичны и могут наблюдаться при других интерстициальных заболевания легких. Следует также отметить, что дифференциальная диагностика инфильтративных и интерстициальных изменений в легочной ткани усложняется у пациентов с кардиальной патологией. Такие патологические состояния, как тромбоэмболия легочной артерии, поражение клапанов сердца, нарушение ритма сердца, прогрессирующая сердечная недостаточность, острый коронарный синдром и инфаркт миокарда, а также экстракардиальная патология (например, хроническая аспирация, ассоциированная с гастроэзофагеальным рефлюксом), могут давать сходные клиническую и рентгенологическую картины. Тщательный сбор анамнеза, уточнение длительности и дозы амиодарона, времени появления первых жалоб, экстрапульмональные проявления амиодароновой токсичности (гипо- или гипертиреоз, фотосенсебилизация, поражение печени, тремор, атаксия, тошнота) позволяют заподозрить АИЭТА. Ухудшение самочувствия, наличие экстрапульмональных проявлений амиодароновой токсичности и отсутствие других причин изменения самочувствия указывают на вероятность АИЭТА. Подтвердить диагноз поможет характерная гистологическая картина, клиническое улучшение на фоне отмены амиодарона и назначения системной кортикостероидной терапии.
ПРОГНОЗ
При АИЭТА летальность составляет 10–23%; при остром начале заболевания и при развитии ОРДС она может достигать 40–50%, несмотря на кортикостероидную терапию. При подостром или хроническом течении в 5–20% случаев заболевание прогрессирует даже после отмены препарата, а летальность достигает 10–33%[9, 12, 13].
ТЕРАПИЯ
Основой терапии АИЭТА является замена амиодарона другим кардиологическим препаратом. В связи с длительным периодом выведения амиодарона ухудшение течения заболевания может наблюдаться даже несмотря на отмену препарата. Целесообразно назначение системных ГКС, так как отмена амиодарона сама по себе редко дает положительную динамику. Дозы и продолжительность терапии ГКС определяются в зависимости от длительности приема амиодарона, характера рентгенологических и функциональных нарушений. ГКС назначают в дозе 40–60 мг/сут (0,5–1 мг/кг/сут) на срок 4–12 месяцев с постепенным снижением дозы[9, 15]. Описаны рецидивы АИЭТА при быстром снижении дозы системных ГКС. Их чаще наблюдают у пациентов с высоким ИМТ, что, вероятнее всего, связано с накоплением амиодарона в жировой ткани[8]. Рентгенологически положительную динамику отмечают со второго месяца лечения. По данным экспериментальных исследований на хомяках, витамин Е снижает повреждение легочной ткани от воздействия амиодарона путем снижения концентраций TGF-ß1 и гидроксипролина (повышающихся при АИЭТА), но не влияет на течение митохондриальной дисфункции[4]. Отмечен также положительный эффект при использовании Эсбриета (действующее вещество — пирфенидон) за 3 дня до воздействия амиодарона на модели АИЭТА у хомяков и во время воздействия препарата[3].
ПРОФИЛАКТИКА
Для профилактики АИЭТА необходимо проведение рентгенографии грудной клетки, спирографии и определение ДСЛ до начала лечения амиодароном и каждые 4–6 месяцев в дальнейшем. Снижение ДСЛ на 15–20% от исходного уровня может служить первым функциональным признаком АИЭТА: чувствительность при снижении ДСЛ до 10% и менее составляет 76% (95%-ный ДИ: 62–91%), специфичность — 64% (95%-ный ДИ: 58–69%)[9, 16]. Дополнительным методом диагностики АИЭТА до начала терапии может стать определение гликопротеина KL-6 в сыворотке крови.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Обследованы 17 пациентов с диагнозом АИЭТА в динамике через год после начала терапии. Все пациенты прекращали прием амиодарона и получали системные ГКС в дозе 20–30 мг/сут в пересчете на преднизолон с постепенным снижением дозы до 5–10 мг/сут в течение года. Среди обследованных больных преобладали мужчины (0,7 — 12 человек), 7 (0,4) из которых были экс-курильщиками, средний возраст на момент начала заболевания составлял 64 ± 6 лет. У всех пациентов имели место значимые сердечно-сосудистые патологии: нарушения ритма сердца — у 14 (0,8), тромбоэмболия ветвей легочной артерии — у 4 (0,2) инфаркт миокарда перенесли 5 (0,3) больных. Амиодарон в основном назначали для купирования пароксизмов фибрилляции предсердий, мерцательной аритмии или коррекции постоянной формы мерцательной аритмии. Длительность приема препарата была различна, медиана составляла 2 года, более половины пациентов принимали амиодарон от 1 года до 5 лет. Реже встречался более короткий срок приема препарата — 3–6 месяцев (у 2 пациентов — 0,12) и крайне длительный срок — более 16 лет (у 3 больных — 0,18). Средняя суточная доза амиодарона составляла 276 мг/сут (от 120 до 400 мг/сут).
Чаще заболевание развивалось постепенно (0,77 — у 13 пациентов), острое начало болезни наблюдалось в 4 случаях (0,2). В клинической картине преобладали явления дыхательной недостаточности I–III степеней (у всех больных). Почти 50% пациентов беспокоил сухой кашель (0,5); реже (0,18) отмечалась лихорадка на начальном этапе заболевания. Возникали также внелегочные проявления токсического действия амиодарона: гиперфункция щитовидной железы (0,18), сине-серое окрашивание кожных покровов (0,06).
На стадии установления диагноза на рентгенограммах органов грудной клетки определялось усиление интерстициального компонента легочного рисунка (более выраженное субплеврально, в базальных отделах). КТ органов грудной клетки выявляла изменения по типу «матового стекла» (у 41% пациентов), очаговые затенения (0,4), инфильтративные и инфильтратоподобные (0,3), фиброзные изменения (0,2), редко выявлялись лимфаденопатия до 3 см (0,12), незначительный односторонний плевральный выпот (0,12), тенденция к более выраженным изменениям с одной стороны (слева) (0,12). На фоне лечения положительная динамика в виде уменьшения протяженности и выраженности интерстициальных изменений, уменьшения и исчезновения очаговых и инфильтративных затенений проявлялась с частотой 0,77, отрицательная — с частотой 0,15, волнообразное течение — с частотой 0,08.
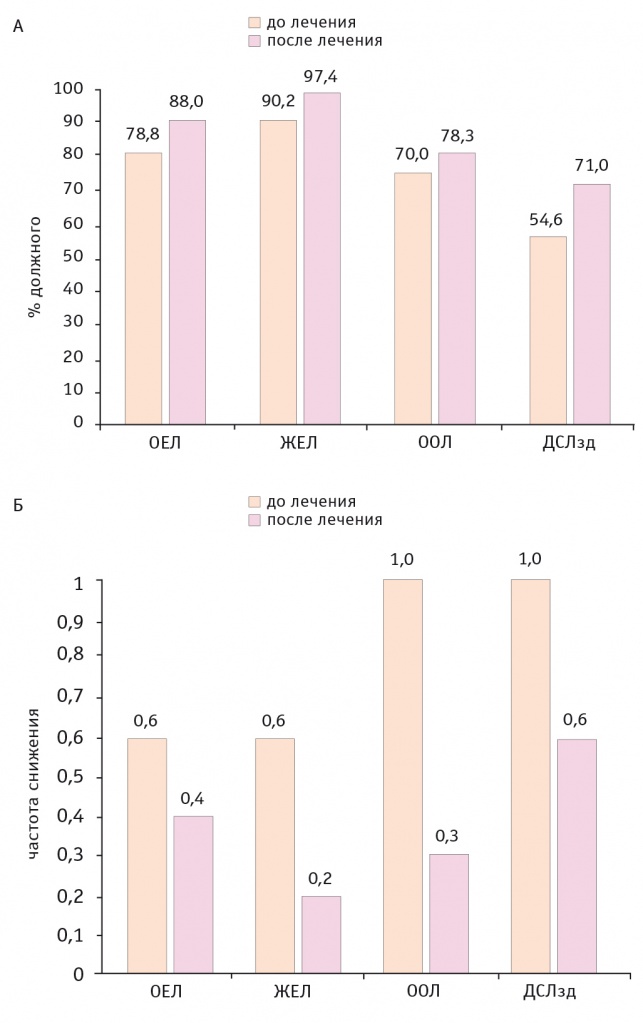
По данным КФИВД, у пациентов выявляли значительное снижение ДСЛ при задержке дыхания (ДСЛзд) (53 ± 2,8%) при умеренном снижении остаточного объема легких (ООЛ) (79 ± 6,3%) без существенного изменения ЖЕЛ (93 ± 5,3%). На фоне лечения была зарегистрирована статистически значимая положительная динамика ДСЛзд (р = 0,02) (рис. 3). По данным ЭхоКГ, отметили расширение правых камер сердца, легочную гипертензию (37 ± 2,7 мм рт. ст.)
Рис. 3. Показатели внешнего дыхания у больных амиодарон-индуцированным экзогенным токсическим альвеолитом в процессе лечения (1 год наблюдения).
Примечание. ОЕЛ — общая емкость легких, ЖЕЛ — жизненная емкость легких, ООЛ — остаточная емкость легких, ДСЛзд — диффузионная способность легких при задержке дыхания
Клинический случай
Интересным представляется пример волнообразного течения АИЭТА. Больной Р. 64 лет, житель г. Санкт-Петербурга, был направлен на консультацию в клинику пульмонологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И. П. Павлова Минздрава России в апреле 2008 г. в связи с жалобами на длительно сохраняющийся сухой кашель, общее недомогание, субфебрилитет; значимой одышки, кровохарканья пациент не отмечал. Описанные выше симптомы возникли у него в середине марта 2008 г. после перенесенной ОРВИ.
Больному амбулаторно был проведен курс антибактериальной терапии. В связи с отсутствием эффекта от антибиотиков пациента проконсультировали в противотуберкулезном диспансере по месту жительства — данных о туберкулезе легких получено не было. При аускультации выслушивались крепитирующие хрипы в нижних отделах легких с обеих сторон.
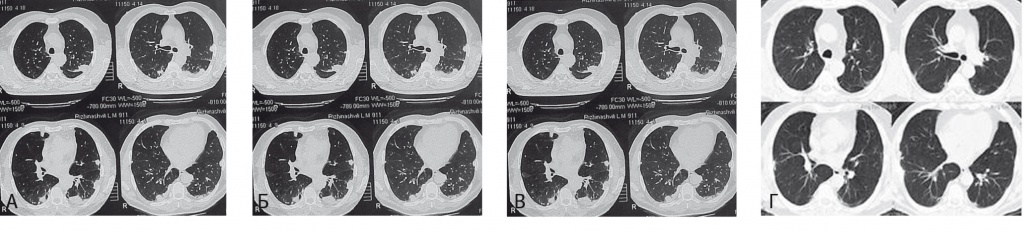
На рентгенограммах и КТ органов грудной клетки (июнь 2008 г.) в обоих легких выявлялись субплеврально расположенные разнокалиберные очаги от 2,7 до 5 мм в диаметре, более выраженные в средних и нижних отделах (рис. 4А). Протяженность поражения была более выражена в левом легком. В средостении определялись паратрахеальные (до 11 мм) и паравазальные (до 13 мм) лимфоузлы.
Рис. 4. Компьютерная томограмма органов грудной клетки больного Р. (данные авторов).
Примечание. А — до лечения в обоих легких выявлялись субплеврально расположенные разнокалиберные очаги от 2,7 до 5 мм в диаметре, более выраженные в средних и нижних отделах; Б — положительная динамика на фоне лечения и нарастание изменений при снижении дозы глюкокортикостероидов; В — при продолжающемся приеме амиодарона; Г — выраженная положительная динамика после отмены амиодарона
У пациента был заподозрен диссеминированный процесс в легких неясного генеза. С целью исключения неопластического поражения легочной ткани проводили фиброгастродуоденоскопию, фиброколоноскопию, УЗИ брюшной полости, предстательной железы, фибробронхоскопию — данных о вторичном (метастатическом) характере поражения легочной ткани получено не было.
КФИВД, проведенное в июне 2008 г., выявило значительно выраженные рестриктивные изменения показателей механики дыхания, сочетавшиеся со значительным ухудшением легочного газообмена в покое (ЖЕЛ составила 69% от должного, ДСЛзд — 63% от должного).
При ЭхоКГ (июнь 2008 г.) показатели сократительной способности миокарда, размеры правых отделов сердца, расчетное систолическое давление в легочной артерии (27 мм рт. ст.) были в пределах нормальных значений.
Характер рентгенологических изменений в легочной ткани не позволял исключить неинвазивную аденокарциному легких. Для гистологической верификации диагноза (08.07.2008) пациенту была выполнена видеоторакоскопическая биопсия правого легкого. При гистологическом исследовании биопсийного материала признаков опухолевого роста обнаружено не было, определялись утолщение и фиброз межальвеолярных перегородок, очаги рыхлой лимфоцитарной инфильтрации, единичные скопления макрофагов в альвеолах.
На основании комплекса исследований пациенту был установлен диагноз идиопатического фиброзирующего альвеолита, назначен метилпреднизолон по 4 таблетки (20 мг в пересчете на преднизолон) в сутки с постепенным снижением дозы препарата в сочетании с сопутствующей терапией (пентоксифиллином, спиронолактоном, кальцием в сочетании с витамином Д3, нандролоном, калия и магния аспарагинатом). Была рекомендована консультация кардиолога для коррекции кардиальной терапии, отмены амиодарона, однако пациент продолжил принимать препарат.
Из анамнеза жизни больного известно, что с 2002 г. ему был установлен диагноз пароксизмальной формы мерцательной аритмии, однако лечения пациент не получал. С 2005 г. его стали беспокоить приступы аритмии 1–2 раза в месяц, по поводу чего больному назначали β-блокаторы, однако положительной клинической динамики достигнуто не было. С 2006 г. для коррекции аритмии пациенту был назначен амиодарон в дозе 400 мг (2 таблетки) в сутки 5 дней в неделю. Пациент по профессии инженер, профессиональной вредности не было, никогда не курил. Наследственность по заболеваниям органов дыхания не отягощена. Аллергологический анамнез без особенностей.
При контрольном обследовании через 7–8 месяцев (февраль 2009 г.) на фоне приема 12 мг метилпреднизолона (15 мг в пересчете на преднизолон) в сутки самочувствие пациента оставалось удовлетворительным, лихорадки, одышки не было, сохранялись крепитирующие хрипы в нижних отделах легких. По данным КФИВД (рис. 5), наблюдалась положительная динамика: общая емкость легких (ОЕЛ) увеличилась на 1,3 л, ЖЕЛ — на 1,07 л, ДСЛзд — на 21% от должного. Пациенту было рекомендовано продолжить снижение дозы метилпреднизолона по схеме до 12 мг через день. В сентябре 2009 г. самочувствие пациента оставалось стабильным, однако на контрольной КТ, несмотря на положительную динамику субплеврально расположенных очаговых затенений (исчезновение, местами трансформация в фиброз), были выявлены новые, ранее не определявшиеся участки уплотнения легочной ткани по типу «матового стекла» в верхних и средних легочных полях (рис. 4Б). Амиодарон был заменен на пропафенон, пациент продолжал снижение дозы ГКС. К ноябрю 2009 г. изменения в легких, выявляемые при КТ, значительно возросли: появилось множество тяжистых линейных, очаговых и инфильтратоподобных уплотнений, более выраженных в периферических отделах (рис. 4В).
Рис. 5. Динамика изменений показателей внешнего дыхания больного Р. за 2008–2010 гг., % (данные авторов)
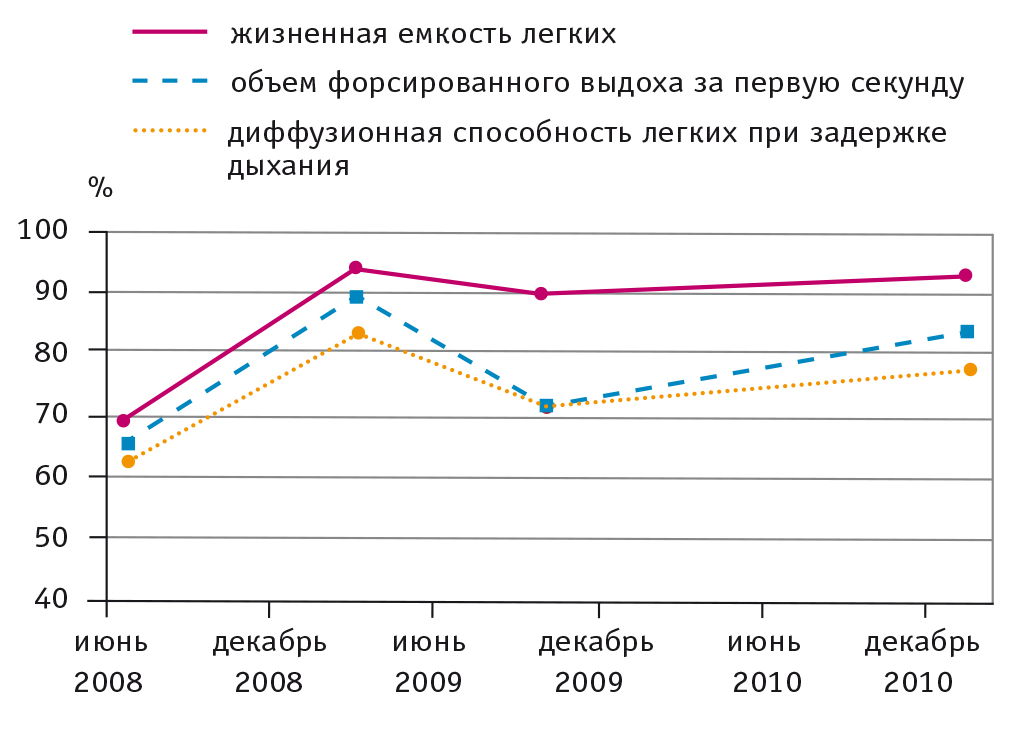
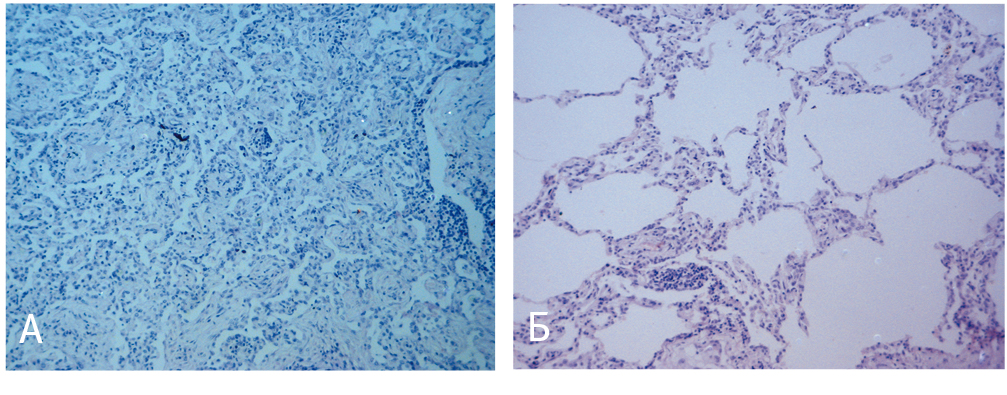
Учитывая длительный прием амиодарона в анамнезе, отрицательную динамику изменений по КТ на фоне снижения дозы ГКС и продолжения приема амиодарона, больной был расценен как пациент с АИЭТА («амиодароновым легким»). При пересмотре гистологических препаратов материала биопсии легкого выявлена картина организующейся пневмонии и облитерирующего альвеолита (рис. 6). Доза метилпреднизолона была увеличена до 16 мг (20 мг в пересчете на преднизолон) через день. При контрольном обследовании через 6 месяцев, в апреле 2010 г., наблюдалась положительная динамика по результатам КТ (сохранялось незначительное усиление периферического легочного интерстиция в субплевральных отделах с обеих сторон, там где ранее выявлялись участки уплотнения легочной ткани) (рис. 4Г).
Рис. 6. Биопсия легкого больного Р. (архив Первого «Санкт-Петербургского государственного медицинского университета имени академика И. П. Павлова, фото — И. С. Платонова).
Примечание. А — организующаяся пневмония, Б — облитерирующий альвеолит
Таким образом, некоторая положительная динамика, достигнутая на фоне назначения системных ГКС, отмеченная в начале терапии, сменилась значимым ухудшением на фоне продолжающегося приема амиодарона и снижения дозы ГКС. Даже отмена амиодарона на фоне небольшой дозы метилпреднизолона не предотвратила прогрессию заболевания, что было обусловлено длительным периодом кумулятивного эффекта амиодарона. Представленная история болезни свидетельствует о трудностях диагностики и лечения ЭТА («амиодаронового легкого»).
ЗАКЛЮЧЕНИЕ
Медикаментозный экзогенный токсический альвеолит является диагнозом исключения. При подозрении на «амиодароновое легкое» дифференциальную диагностику следует проводить между данным заболеванием и патологиями сердечно-сосудистой системы, неопластическими процессами и другими интерстициальными болезнями легких. Тщательный сбор анамнеза у пациентов с интерстициальной патологией легких позволяет заподозрить токсическое влияние лекарственных средств.







