Синдром обструктивного апноэ сна (СОАС) ассоциирован с увеличением риска инфаркта миокарда и инсульта[11]. Отдаленные результаты наблюдений за пациентами с ИБС показали возрастающий риск сердечно-сосудистой смерти у больных СОАС и ИБС по сравнению с пациентами с ИБС без СОАС, даже после поправки на важные отягощающие факторы риска, такие как возраст, вес и курение[6, 25].
По результатам ряда обсервационных наблюдений, ночная респираторная поддержка в режиме CPAP устраняет такие риски[20, 21, 26]. Вариантом СРАР-терапии является режим автоматического давления в дыхательных путях, податливого ко вдоху и выдоху пациента (A-Flex-терапия)[20]. Современное лечение пациентов СОАС среднетяжелого и тяжелого течения напрямую зависит от правильности выбора воздухоносного давления, которое должно эффективно устранять воздухоносные коллапсы в период сна, улучшать сон, уменьшать его фрагментацию, устранять явления избыточной дневной сонливости[24].
СРАР-терапия направлена на создание «воздухоносного стента», противодействующего отрицательным колебаниям инспираторного давления, приводящим к коллапсам верхних дыхательных путей и к апноэ во сне. Назальная СРАР-терапия, проводимая с использованием носовой маски, позволяет полностью контролировать СОАС и имеет максимальные положительные кардиоваскулярные эффекты за счет нормализации структуры и продолжительности сна[28]. A-Flex-терапия устраняет патофизиологические эффекты апноэ, уменьшает симпатический тонус и флуктуацию внутригрудного отрицательного давления[29]. Такой метод лечения препятствует повышению АД и снижает постнагрузку ЛЖ. Кроме того, СРАР-терапия путем устранения гипоксических эпизодов увеличивает доставку кислорода тканям и снижает степень кислородного дефицита.
К сожалению, влияние СРАР-терапии на метаболический синдром (МС) малопонятно. В большинстве исследований, за редким исключением[5], отмечена существенная стабилизация АД на целевых цифрах при использовании СРАР[8, 12, 19]. В работах, посвященных воздействию СРАР-терапии на инсулинорезистентность[8, 9, 13] и липидный профиль[4, 8, 27, 30], зарегистрированы противоречивые результаты. Более того, в двух исследованиях влияния СРАР-терапии на пациентов с СОАС в сочетании с МС были получены прямо противоположные результаты[8, 22].
Эндотелий (внутренняя выстилка сосудов) играет важнейшую роль в поддержании здорового состояния сосудистой стенки, локальном регулировании сосудистого тонуса и самой структуры, поддержании гомеостаза. Эндотелиальная дисфункция (ЭД) является проявлением функционального несоответствия, предиктором возможных неблагоприятных сосудистых событий у пациентов с установленными или неустановленными сосудистыми заболеваниями[31]. Она возникает при наличии у больного атеросклероза или факторов риска его развития и способствует появлению и прогрессированию атеросклеротических поражений[1]. ЭД является вероятным проводником между СОАС и ССЗ. Данное нарушение возникает в результате острого или регулярного хронического повреждения эндотелия.
СОАС способствует развитию дисфункции эндотелия по обоим механизмам. По данным ряда исследований, СРАР-терапия, проводившаяся в течение 6 месяцев, статистически значимо улучшала эндотелиальную функцию, особенно при хроническом повреждении эндотелия[3, 10, 14, 17, 23]. Однако эндотелиальные эффекты краткосрочных курсов СРАР-терапии (от 2 недель до 1 месяца) не были хорошо изучены. Интерес также представляет влияние А-Flex-терапии на устранение явлений МС и углеводного обмена.
Целью настоящего исследования явилась оценка влияния ночной респираторной поддержки в режиме A-Flex-терапии на основные показатели легочной вентиляции, МС, ЭД и углеводного обмена у пациентов с СОАС при ее применении коротким курсом 1 месяц.
МАТЕРИАЛЫ И МЕТОДЫ
Рабочая группа
Исследование проводилось кафедрой фтизиатрии и пульмонологии лечебного факультета Московского государственного медико-стоматологический университета им. А. И. Евдокимова (МГМСУ им. А. И. Евдокимова) на базе Центра респираторной медицины (ЦРМ) и Больницы Центросоюза РФ. Исследование было одобрено этическим комитетом МГМСУ им. А. И. Евдокимова.
Исследуемая группа
В период с апреля 2014 по апрель 2015 г. нами были обследованы 127 пациентов, обратившихся в ЦРМ с жалобами на избыточную дневную сонливость (по Шкале сонливости Эпфорта > 11 баллов), храп, частые ночные пробуждения. Пациентов включали в исследование, если они находились в возрастном интервале 35–65 лет и подписали информированное согласие на участие.
Пациентов исключали из исследования, если они имели днем SpO2 < 94% (при дыхании обычным воздухом с FiO2 = 21%), застойную сердечную недостаточность, цирроз печени, хроническую почечную недостаточность, ХОБЛ выше III–IV степени (по критериям Global initiative for Obstructive Lung Disease, 2012), дисфункцию щитовидной железы, ревматоидный артрит или другое хроническое или тяжелое воспалительное заболевание. Из исследования исключали курильщиков, пациентов с наркотической зависимостью, а также больных АГ, получавших антагонисты кальция, нитраты, α-блокаторы.
После проведения ночного полиграфического исследования по кардиореспираторному протоколу пациентов классифицировали как имеющих СОАС (группа А, n = 68, индекс апноэ-гипопноэ (ИАГ) > 5 соб/ч) и не имеющих СОАС (группа B, контрольная, n = 31, ИАГ < 5 соб/ч). Еще одну группу составили пациенты СОАС, отказавшиеся от проведения СРАР-терапии, подписавшие информированное согласие об отказе и получавшие базисную терапию основного заболевания (группа C, n = 32, ИАГ > 5 соб/ч). Пациенты, успешно закончившие исследование, составили группу D (n = 30) (рис.).
Рис. Графическое представление дизайна авторского исследования
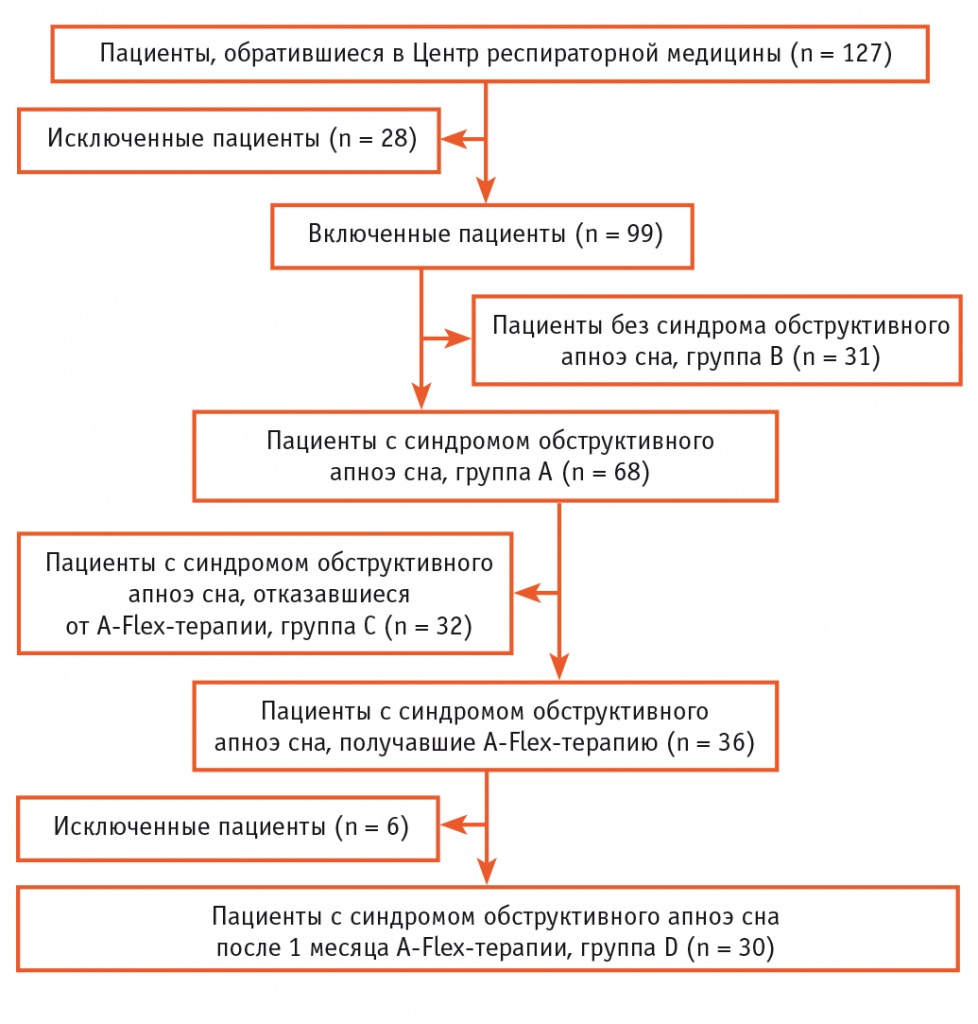
Дизайн исследования
Нами было проведено одноцентровое проспективное нерандомизированное параллельное исследование с контрольной группой. Все участники проходили врачебный осмотр и комплексное медицинское обследование с заведением карты пациента ЦРМ, где дополнительно учитывались история, симптомы и маркеры расстройств дыхания во сне. Пациентов интервьюировали на табакокурение и прием лекарственных препаратов. ИМТ рассчитывали по формуле: вес (кг) / рост (м2). Исследование предусматривало 5 последовательных визитов пациентов в клинику. Во время каждого визитаучастники исследования сначала отдыхали 15 минут, после чего им измеряли SpO2 с помощью пульсоксиметра Pulsox-300i (Konica Minolta Sensing, КНР) в период бодрствования и при вдыхании воздушной смеси с FiO2 = 21% (комнатный воздух). Исследование расстройств дыхания во сне проводили однократно методом ночной кардиореспираторной полиграфии, а эндотелиальная функция последовательно измерялась утром до 11:00 часов. АД пациенты измеряли самостоятельно в утреннее и вечернее время в течение всего наблюдения с помощью автоматического тонометра M2 Basic (Omron, Япония) с фиксацией значений в журнале пациента.
Всем пациентам, имевшим СОАС (ИАГ > 5 соб/ч), была предложена СРАР-терапия в режиме A-Flex на оборудовании PR System One REMstar Auto CPAP Machine with A-Flex (Philips Respironics, США). После 5 дней пробного лечения в домашних условиях проводилась оценка A-Flex-терапии с помощью программного обеспечения EncorePro 2 Version 2.2 (Philips Respironics, США).
Анализировались основные индексы эффективности СРАР-терапии: ИАГ, степень воздушной утечки, среднее давление СРАР, податливость к терапии в соответствии с международными требованиями Американской ассоциации нарушений сна (ASDA) [18]. Пациенты с СОАС, отказавшиеся от проведения СРАР-терапии, были информированы о последствиях и подписали согласие об отказе. Их выделили в группу C и назначили базисную терапию основного заболевания в соответствии с порядком оказания медицинской помощи (Федеральный закон от 21.11.2011 N 323-ФЗ «Об основах охраны здоровья граждан Российской Федерации»).
После оценки пробного лечения в течение следующего месяца домашней терапии СОАС в режиме A-Flex с пациентом устанавливался еженедельный телефонный контакт с использованием одобренного этическим комитетом МГМСУ им. А. И. Евдокимова вопросника эффективности СРАР-терапии. Результаты фиксировали в карте пациента. Больные, использовавшие СРАР-терапию менее 4 часов в течение ночи менее 4 раз в неделю, или те, у которых не достигалась полноценная коррекция эпизодов апноэ (сохранялся ИАГ > 5 соб/ч), считались досрочно прекратившими лечение и выбывшими (n = 4) из наблюдения. Пациенты с СОАС, окончившие месячный курс A-Flex-терапии, составили финальную группу наблюдения (группа D, n = 30, ИАГ < 5 соб/ч на протяжении всего курса A-Flex-терапии). По окончании месяца домашней терапии мы повторно проводили врачебный осмотр и полное комплексное медицинское обследование больных. На этой стадии мы исключали пациентов, существенно изменивших вес тела (> 3% прироста или снижения), которым потребовалось применение дополнительных лекарственных препаратов и у которых были установлены новые патологические состояния (n = 2).
Методы
Исследование ФВД осуществляли всем пациентам в соответствии с рекомендациями Европейского сообщества стали и угля (ЕССУ) путем анализа кривой «поток — объем», показателей спирометрии, общей бодиплетизмографии. Мы использовали спиро-бодиплетизмограф и программное обеспечение Platinum Elite (Medical Graphics, США). Все измерения газовых объемов регистрировали в системе BTPS. Оценку проводили при сопоставлении полученных данных с должными величинами в соответствии с рекомендациями ЕССУ. Для интерпретации полученных показателей использовали рекомендации ЕССУ от 1993 г. с дополнениями от 1997 г. Показатели выражали в процентах по отношению к должным величинам. У всех пациентов брали пробу на обратимость бронхиальной обструкции с ингаляцией 400 мкг сальбутамола. Обратимость данного синдрома оценивали по существующим стандартам функциональных легочных тестов[7].
Ночное кардиореспираторное полиграфическое исследование проводили для верификации расстройств дыхания в период сна в соответствии с правилами и рекомендациями ASDA[15]. Мы использовали кардиореспираторный полиграф Alice PDx (Philips Respironics, США) с программным обеспечением Sleepware G3 (Philips Respironics, США). Исследование начиналось в 00:00 часов и заканчивалось в 07:30 утра. Полиграф регистрировал воздушный ротоносовой поток, храп, грудное и брюшное усилия, пульсоксиметрическую SpO2, позицию тела. Мы устанавливали различные виды дыхательных расстройств: апноэ определялось как статистически значимое уменьшение (> 90%) амплитуды ротоносового потока длительностью ≥ 10 с; гипопноэ — как очевидное снижение амплитуды ротоносового потока > 30%, но < 90%, ассоциированное с десатурацией крови ≥ 3%. Устанавливались следующие индексы:
- ИАГ — суммарная совокупность событий апноэ и гипопноэ за 1 час наблюдения.
- SpO2 min — минимальная сатурация.
- ODI (индекс десатураций) — число сатурационных падений ≥ 3% за 1 час наблюдения.
- TSpO2 < 90% — суммарная совокупность времени, проведенного пациентом при SpO2 < 90%.
Все ночные исследования были проанализированы и интерпретированы по принципу слепого метода врачом-исследователем, сертифицированным в области медицины сна. Ночные кардиореспираторные полиграфические записи являлись основанием для постановки диагноза при условии их регистрации в течение ≥ 180 минут.
Изучение эндотелиальной функции сосудов проводили методом PAT-сигнала (периферический артериальный тонус — PAT). Для регистрации РАТ-сигнала мы использовали оборудование Endo-PAT2000 (Itamar Medical, Израиль) вместе с оригинальным программным обеспечением и методикой интерпретации результатов[16]. Если коротко характеризовать систему, она состоит из пневматического пальцевого датчика-пробы, улавливающего амплитуду и наполнение пульсовой волны. Манжету измерения АД закрепляют на «нерабочей» (исследуемой) руке пациента, в то время как другая его рука служит для контроля измерения. Датчики-пробы фиксируют на указательных пальцах обеих рук пациента для постоянной регистрации РАТ-сигнала. Исследование проводится после 20 минут отдыха, в положении полусидя или лежа. С рук снимаются все кольца, часы. После базового измерения РАТ-сигнала в течение 5–10 минут манжету накачивают воздухом до уровня давления, превышающего систолическое давление пациента на 60 мм рт. ст. (не менее 200 и не более 300 мм рт. ст. для прекращения кровотока). Затем манжета сдувается, после снятия окклюзии на плечевой артерии РАТ-сигнал продолжает регистрироваться еще 5 минут для определения степени реактивной гиперемии. Данные анализируются с помощью патентованного программного обеспечения компании Itamar Medical, независимым от оператора способом. Рассчитывается отношение усредненной амплитуды РАТ-сигнала за 1 минуту после сдувания манжеты (максимальной пульсовой амплитуды) к усредненной амплитуде РАТ-сигнала за 3,5 минуты до раздутия манжеты (базовой пульсовой амплитуде).
Значение коэффициента РАТ исследуемой руки соотносили с таковым контрольной руки, корректировали с учетом системных факторов (температуры помещения), что позволяло рассчитать индекс реактивной гиперемии (RHI). Кроме того, нами рассчитывался индекс аугментации (AI) — отношения ударной волны, возникающей во время увеличения давления в аорте, к отраженной волне во время систолы. Все исследования RHI и AI проводились в одной и той же комнате одним и тем же врачом-исследователем.
Для проведения лабораторных тестов (биомаркеры оксидативного стресса) у пациентов брали образцы крови в 08:00 часов во время 1-го, 3-го и 5-го визитов натощак после ночи отдыха. Образцы собирали в пробирки вакутайнеры в соответствии со стандартным протоколом забора биологических жидкостей Больницы Центросоюза РФ. Все образцы после предварительной подготовки доставляли в течение 3 часов в лабораторный комплекс ООО «ИНВИТРО» (ГОСТ ISO 9001–2011 (по ГОСТу ISO 9001–2008)). Мы оценивали уровень глюкозы натощак глюкозооксидазным методом, уровень инсулина плазмы натощак эугликемическим клямп-методом, измеряли уровень гликозилированного Hb (HbA1c). Оценку значений триглицеридов, ЛПВП, общего холестерина и ЛПНП проводили в соответствии с уравнением Friedewald[2].
Статистический анализ проводили с помощью программ Statistica 7.0 (StatSoft, США) и MiniLab 16 (MiniLab, Великобритания). При правильном распределении признака протяженные переменные были представлены в виде мины (M) и стандартного отклонения (SD), в случае неправильного распределения — в виде медианы (Me) и квартилей (1st Quartile, 3rd Quartile).
При нестандартном распределении признака использовали критерии Краскела — Уоллиса и Манна — Уитни. Для оценки корреляционных связей между различными показателями применяли критерий Пирсона (r), критерий ранговой корреляции Спирмена (Rs) и критерий Гамма. Для проведения одномоментного корреляционного анализа между большим количеством признаков проводили построение таблиц из коэффициентов корреляции Пирсона. Для сравнения частот в независимых выборках использовали критерий χ2.
С целью формирования групп в зависимости от ряда признаков в некоторых случаях выполняли кластерный анализ. Критический уровень достоверности нулевой статистической гипотезы принимали за р < 0,05. При 0,05 < p < 0,1 выносилось суждение о наличии статистической тенденции.
РЕЗУЛЬТАТЫ
Выраженность метаболических проявлений при наличии у пациентов обструктивного апноэ сна
Мы проводили анализ результатов сравнения пациентов, имевших СОАС (группа А, n = 68, ИАГ > 5 соб/ч) и не имевших данного заболевания (группа B, контрольная, n = 31, ИАГ < 5 соб/ч). Целью являлось установление возможных предикторов метаболических расстройств при наличии/отсутствии СОАС (табл. 1).
Таблица 1
Сравнение пациентов групп А и B
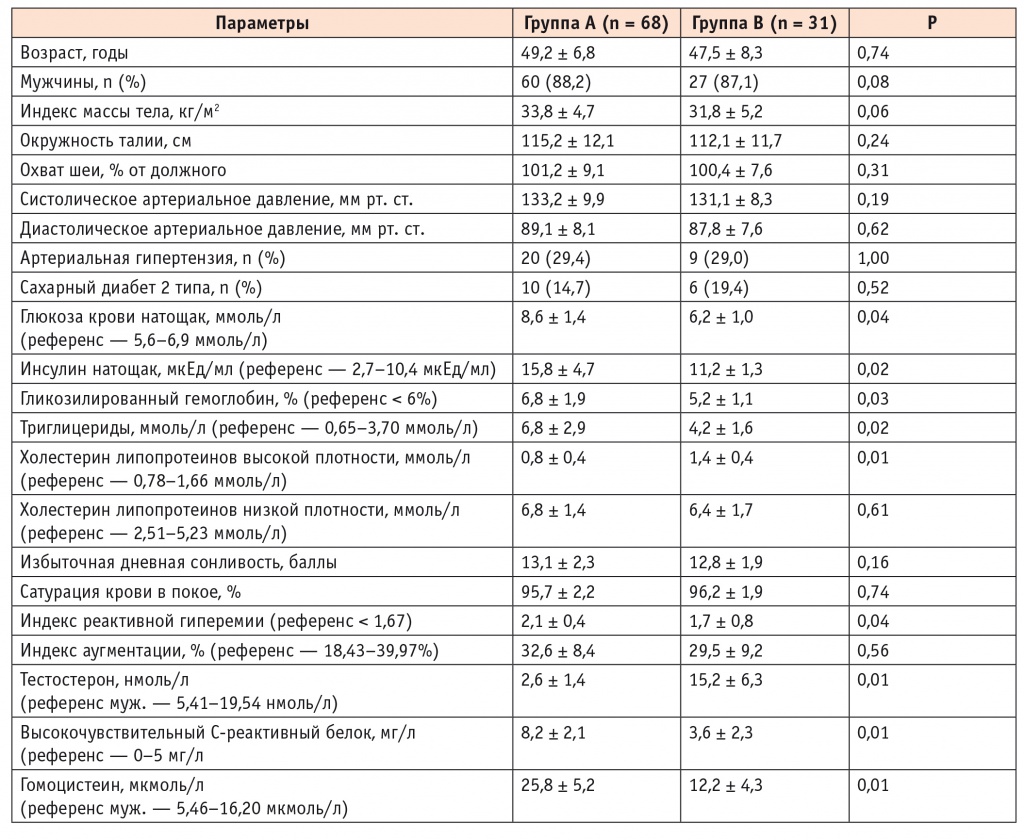
В обеих группах преобладали мужчины (87,9%) в возрасте 39–56 лет, у которых статистически значимо не различались длительность течения заболевания (p < 0,05), антропометрические характеристики, выраженность АГ и диагноз СД 2 типа. Выраженность явлений МС, по критериям IDF (International Diabetes Federation, 2005), устанавливалась при наличии центрального ожирения (которое определяется как окружность талии более 94 см у мужчин и более 80 см у женщин) и как минимум двух из нижеперечисленных факторов:
- уровня триглицеридов ≥ 150 мг/дл (1,7 ммоль/л);
- 40 мг/дл (1,03 ммоль/л) у мужчин и < 50 мг/дл (1,29 ммоль/л) у женщин;
- АГ (АД ≥ 130/85 мм рт. ст.);
- уровня глюкозы плазмы ≥ 100 мг/дл (5,6 ммоль/л) или ранее диагностированного СД.
Выраженность МС была статистически значимо выше в группе пациентов с диагностированным СОАС, чем у пациентов без явлений апноэ сна.
Кроме того, пациенты группы А имели статистически значимо более высокие уровни инсулина натощак (p = 0,02), гомоцистеина (р = 0,01), высокочувствительного СРБ (ВчСРБ) (р = 0,01) и процентного повышения HbA1С (р = 0,03), что свидетельствовало о сочетании высокой степени метаболических нарушений с явлениями ЭД.
Эти результаты хорошо согласовывались с данными исследования эндотелиальной функции сосудов методом PAT-сигнала. Пациенты группы А имели статистически значимо высокий RHI (р = 0,04) при сохранившем нормальные значения AI.
В связи с тем, что подавляющее большинство пациентов с СОАС были мужчинами репродуктивного возраста (88%), мы исследовали у них уровень тестостерона на наличие гипогонадизма (дефицита тестостерона) — патологического состояния, характеризующегося функциональной недостаточностью яичек, сопровождающегося снижением уровня общего тестостерона крови < 5,41 нмоль/л (для возраста 30–50 лет).
Достаточно часто гипогонадизм выявляется у мужчин с ожирением и другими проявлениями МС. Характерно, что пациенты с СОАС (группа А) имели статистически значимо более низкий уровень тестостерона (р = 0,01), чем пациенты с метаболическими нарушениями без явлений апноэ сна.
Таким образом, с высокой степенью вероятности можно предположить, что у пациентов с симптомами и маркерами СОАС (избыточной дневной сонливостью, ИМТ > 29 кг/м2, храпом) имеются основные предикторы отягощения метаболических нарушений и ЭД в виде ВчСРБ, инсулина натощак, холестерина ЛПВП и RHI, играющих весомую диагностическую роль в раннем выявлении больных СОАС с выраженной коморбидной патологией.
Эффекты месячного курса A-Flex-терапии у пациентов с синдромом обструктивного апноэ сна
В соответствии с рекомендациями по терапии больных СОАС различной степени тяжести методом СРАР[18] всем пациентам группы А была предложена указанная терапия в режиме A-Flex после предварительной ее титрации в домашних условиях в течение 5 дней. Несмотря на высокую переносимость и хороший клинический эффект, 32 пациента отказались от дальнейшего использования A-Flex, почему были выделены в группу С (ИАГ > 5 соб/ч) и получали базисную терапию основного заболевания.
Мы проводили анализ результатов сравнения пациентов с СОАС, прошедших месячный курс терапии (группа D, n = 30, ИАГ < 5 соб/ч в течение каждого дня A-Flex-терапии), с пациентами группы C (табл. 2).
Таблица 2
Эффекты после одного месяца A-Flex-терапии у пациентов с синдромом обструктивного апноэ сна
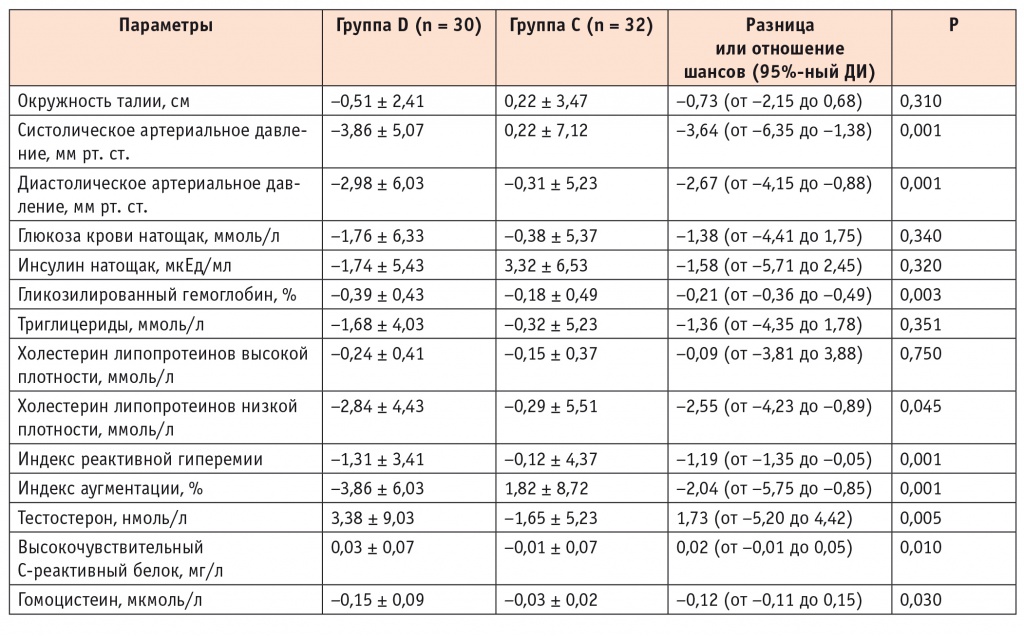
Основной задачей СРАР-терапии в режиме A-Flex являлось эффективное устранение СОАС со снижением ИАГ < 5 соб/ч, что говорило бы о нормализации состояния, восстановлении нормального уровня потребления кислорода в ночной период времени. При этом СРАР-терапия положительно воздействовала на основной метаболизм и восстанавливала функцию эндотелия сосуда.
Подтверждением тому являются установленные нами в группе D статистически значимые снижение уровней систолического и диастолического АД (р = 0,001), нормализация уровня HbA1С (р = 0,003), уменьшение RHI (р = 0,001) и AI.
Полученные данные хорошо согласуются с изменением клинической картины у пациентов группы D: исчезновением избыточной дневной сонливости, расширением двигательной активности, нормализацией ночного сна.
Интересным является восстановление уровня тестостерона до нижней границы нормы при использовании A-Flex-терапии (р = 0,005). Такая находка не является случайной и, на наш взгляд, связана с устранением ночного «гипоксического удара» и восстановлением глубокого сна пациентов.
ОБСУЖДЕНИЕ
Оба заболевания, СОАС и МС, являются клинически важными состояниями, резко повышающими риск кардиоваскулярных расстройств, особенно при синергизме. СРАР является терапией первой линии, особенно в случаях СОАС среднетяжелого и тяжелого течения. Она также может быть крайне полезной в случае сочетания метаболических расстройств или МС с СОАС. Мы специально отбирали пациентов со среднетяжелым и тяжелым течением СОАС в сочетании с МС или его компонентами. Мы обратили на них особое внимание, поскольку такие пациенты имеют максимальные риски смертельного исхода или кардиоваскулярных осложнений. Для устранения возможных искажений получаемых результатов мы исследовали только пациентов с СОАС, ранее не получавших СРАР-терапию или терапию любых компонентов МС. Несмотря на простой дизайн, отсутствие ослепления, плацебо-контроля и рандомизации пациентов, нам удалось достичь минимального воздействия на конечный результат путем правильного формирования исследуемой и сравнительной групп.
У 60% пациентов с СОАС и МС, которым проводили A-Flex-терапию в течение месяца, удалось «компенсировать» 2–4 компонента МС, что является статистически значимым положительным клиническим результатом. Однако чаще удается «нормализовать» максимум один, наиболее важный компонент МС. Интересно, что в рандомизированном перекрестном исследовании пациентов с СОАС в сочетании с МС, выполненном S. R. Coughlin и соавт.[8], не было достигнуто статистически значимого уменьшения проявлений МС после 6 недель терапии, в то время как в другом неконтролируемом исследовании устранение проявлений МС было достигнуто через 6 месяцев лечения[22].
Наши данные полностью согласуются с предыдущими исследованиями эффектов СРАР-терапии по нормализации АД у пациентов с СОАС[12, 19]. Механизм устранения АГ у таких больных, вероятнее всего, связан с устранением фрагментации сна, ночной гипоксемии и результирующей симпатической активности[5]. Эта гипотеза подтверждаетсяи в нашем исследовании, когда A-Flex-терапия в течение месяца достоверно стабилизировала АД на целевых уровнях, устраняла избыточную дневную сонливость и нормализовала RHI.
При проведении A-Flex-терапии в течение месяца была отмечена тенденция к снижению уровней биомаркеров МС, таких как триглицериды, холестерин ЛПВП, холестерин ЛПНП, гомоцистеина и ВчСРБ. Несмотря на то что статистически значимых результатов из-за краткости проведения СРАР-терапии получено не было, наши данные полностью согласуются с данными контролируемых рандомизированных исследований последних лет[5, 9, 13].
Результаты нашей работы хорошо согласуются с результатами ряда фармакологических исследований. Было показано, что снижение среднего АД на 5 мм рт. ст. уменьшает риск инфарктов и инсультов на 15 и 42% соответственно, в то время как снижение рисков на 20% по обеим причинам происходит при снижении холестерина ЛПНП до 40 мг/дл (1,0 ммоль/л)[4, 22, 30]. Мы также отмечали снижение систолического АД на 3,64 мм рт. ст. и диастолического АД на 2,67 мм рт. ст. с уменьшением уровня холестерина ЛПНП на 2,55 ммоль/л после 4 недель эффективной A-Flex-терапии. Такие данные свидетельствуют о высокой клинической значимости СРАР-терапии для уменьшения кардиоваскулярных рисков у пациентов с СОАС в сочетании с МС.
ЗАКЛЮЧЕНИЕ
Четырехнедельная терапия методом постоянного положительного воздухоносного давления в дыхательных путях (CPAP) в режиме A-Flex в группе пациентов с синдромом обструктивного апноэ сна (СОАС) среднетяжелого и тяжелого течения с выраженными проявлениями метаболического синдрома или его компонентов имеет достоверное терапевтическое действие по снижению уровней систолического и диастолического АД, липидов крови, гликозилированного гемоглобина, маркеров эндотелиальной дисфункции, уменьшает риски кардиоваскулярных фатальных и нефатальных событий. СРАР-терапия в режиме A-Flex приводит к улучшению контроля АГ и уменьшает метаболические нарушения у пациентов с СОАС.







