Новые, или прямые, оральные антикоагулянты (ПОАК) уже прочно вошли в клиническую практику, ознаменовав этим смену эпох в ведении пациентов с тромботическими заболеваниями. Хотя существуют некоторые пока не решенные вопросы (применение при тромбофилиях, клапанных пороках сердца, в первичной профилактике и прочее), ПОАК уже претендуют на статус универсальных антикоагулянтов. Несомненные преимущества перед антагонистами витамина К (АВК) и гепаринами расширили популяцию пациентов, которым назначаются антикоагулянты[1]. Несмотря на общее для всех ПОАК преимущество по безопасности перед АВК, есть один вид кровотечений, риск которых не только не снижается, но и зачастую возрастает при их применении. Это желудочнокишечное кровотечение (ЖКК) — одна из причин госпитализаций, увеличения затрат на лечение и ограничитель для широкого применения ПОАК.
Подавляющее большинство клинических рекомендаций и согласительных документов по ведению пациентов с ЖКК в основном посвящены хирургической классификации кровотечений, диагностике, преимущественно эндоскопической, и тактике лечения, нацеленной на посиндромное ведение пациента[2, 3]. Значительно меньше внимание уделяется факторам риска, не связанным с заболеваниями ЖКТ, ятрогенным причинам кровотечения, слабо представлена эпидемиология неязвенного кровотечения, тактика «осторожного» ведения пациента, получающего антиагреганты или антикоагулянты. В итоге проблема ЖКК находится в настоящее время на стыке различных специальностей: кардиологии, хирургии, интенсивной терапии, гастроэнтерологии, в результате чего отсутствует единый согласительный подход к ведению таких пациентов.
В зависимости от расположения повреждения по отношению к связке Трейца принято различать кровотечения из верхних и из нижних отделов ЖКТ, также иногда выделяют кровотечения из промежуточного тракта. Три типа кровотечений различаются по клиническим проявлениям и прогнозам. Статистические данные по общей частоте ЖКК могут значительно отличаться от региона к региону, колеблясь от 50 до 250 случаев на 100 тысяч населения. Частота ЖКК увеличивается с возрастом, снижается по мере внедрения современных методов лечения Helicobacter pylori и своевременной диагностики рака органов ЖКТ[4, 5].
Говоря о клинических проявлениях ЖКК, стоит принимать во внимание наличие трех переменных: объем кровопотери, время, в течение которого проявляются признаки кровопотери, и локализация источника кровотечения в ЖКТ. Комбинация этих переменных обусловливает различные клинические картины — от шока при массивной кровопотере в течение короткого времени до развития хронической анемии без явного кровотечения и нарушения гемодинамических показателей[5].
Важный фактор риска ЖКК — прием НПВП, их бесконтрольное применение зачастую и является пусковым механизмом. Ацетилсалициловая кислота (АСК) и другие антиагреганты, назначаемые преимущественно кардиологическим пациентам, часто пожилым, с различными сопутствующими заболеваниями (АГ, сердечной недостаточностью и др.), нередко становятся причиной ЖКК (от микро до массивных). Имеющаяся фоновая хеликобактерная инфекция значительно усугубляет ситуацию[5, 6].
Как уже было сказано выше, еще один существенный фактор риска ЖКК — применение пероральных, или оральных, антикоагулянтов (ОАК).
В мире зарегистрированы четыре ПОАК: относящийся в прямым ингибиторам тромбина дабигатрана этексилат и три ингибитора Хафактора — апиксабан, ривароксабан и не зарегистрированный в настоящее время в России эдоксабан. Для всех ПОАК характерны быстрое начало действия (в отличие от АВК) и быстрое его прекращение в соответствии с периодом полувыведения, составляющим в среднем 10–12 часов. Они обладают низким потенциалом взаимодействия с лекарственными препаратами и пищей, малой интра и межиндивидуальной вариабельностью. Все это делает их действие значительно более предсказуемым и дает возможность применять ПОАК у более широкой популяции больных, включая пациентов с разным риском кровотечения, с хронической болезнью почек, пожилых, «хрупких» и т. д.[7].
Патогенез ЖКК при применении антикоагулянтов не вполне ясен. Один из механизмов уже упоминался: антикоагулянты вызывают кровотечение при нарушении целостности слизистой оболочки ЖКТ. Любое локальное повреждение слизистых оболочек вызывает кровотечение (кровоизлияние) из сосудов богатого ими подслизистого слоя. При нарушении образования локального тромба вследствие применения антикоагулянтов это кровотечение может стать клинически значимым[8, 9].
Повреждению слизистой способствуют такие распространенные факторы, как соляная кислота и инфекция H. pylori в желудке, ферменты в тонкой кишке и микрофлора в толстой кишке. Нельзя забывать и о механическом повреждающем действии твердой пищи. Применение НПВП, нарушающих эпителизацию, является отягощающим фактором[8, 9].
Необходимо отметить, что дабигатран, содержащий в своей лекарственной форме винную кислоту, оказывает прямое повреждающее действие на слизистую. Описаны даже эрозивные повреждения пищевода при его применении[10].
В обзоре J. Desai и соавт. перечислены следующие возможные механизмы прямого действия ОАК в ЖКТ:
1) системный антикоагулянтный эффект;
2) топический антикоагулянтный эффект;
3) местное прямое повреждающее действие;
4) местное биологическое действие, не связанное со свертыванием крови (например, нарушение образования слизи).
Авторы связывают прямое действие антикоагулянтов с тем, что достаточно большое количество ПОАК не всасывается, а остается в ЖКК, выводясь в дальнейшем с калом. Однако вопреки этому ривароксабан, обладающий наилучшей биодоступностью среди ПОАК (почти 100% при приеме с пищей), имеет наихудший профиль безопасности в отношении ЖКК, а апиксабан с биодоступностью 50%, напротив, наиболее безопасен по оценке частоты ЖКК. Действие же варфарина реализуется в печени, в ЖКТ его остается крайне мало, поэтому какоелибо его местное действие маловероятно, и ЖКК возникают преимущественно изза его системных эффектов[9].
Из других обсуждаемых механизмов рассматривают нарушение процесса репарации, связанное с блокадой тромбина; однократный прием, приводящий к пиковой концентрации антикоагулянта в крови, и большая доза его в просвете ЖКТ.
ОЦЕНКА РИСКА КРОВОТЕЧЕНИЙ ПРИ ПРИМЕНЕНИИ ПРЯМЫХ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ
Персонализированная оценка риска кровотечений при приеме антикоагулянтов может проводиться с помощью семи различных шкал: mOBRI, CBRM, HEMORR2HAGES, HASBLED, ATRIA, ORBIT и шкалы оценки риска ABC. Наиболее часто при фибрилляции предсердий (ФП) используется шкала HASBLED (табл. 1), в которой 9 — максимальная сумма баллов, ее значение, равное или более 3, свидетельствует о высоком риске кровотечения. Указывается, что в такой ситуации необходимо наблюдать пациента «с осторожностью», что является довольно расплывчатым и не понимается практическим врачом[7, 11, 12].
Таблица 1
Шкала HAS-BLED
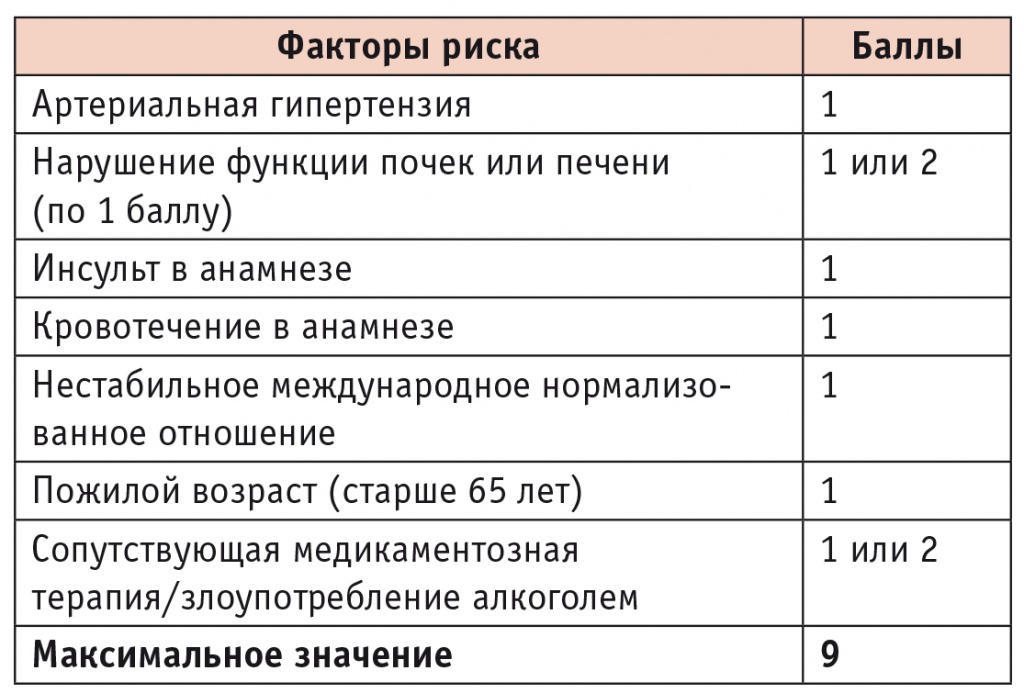
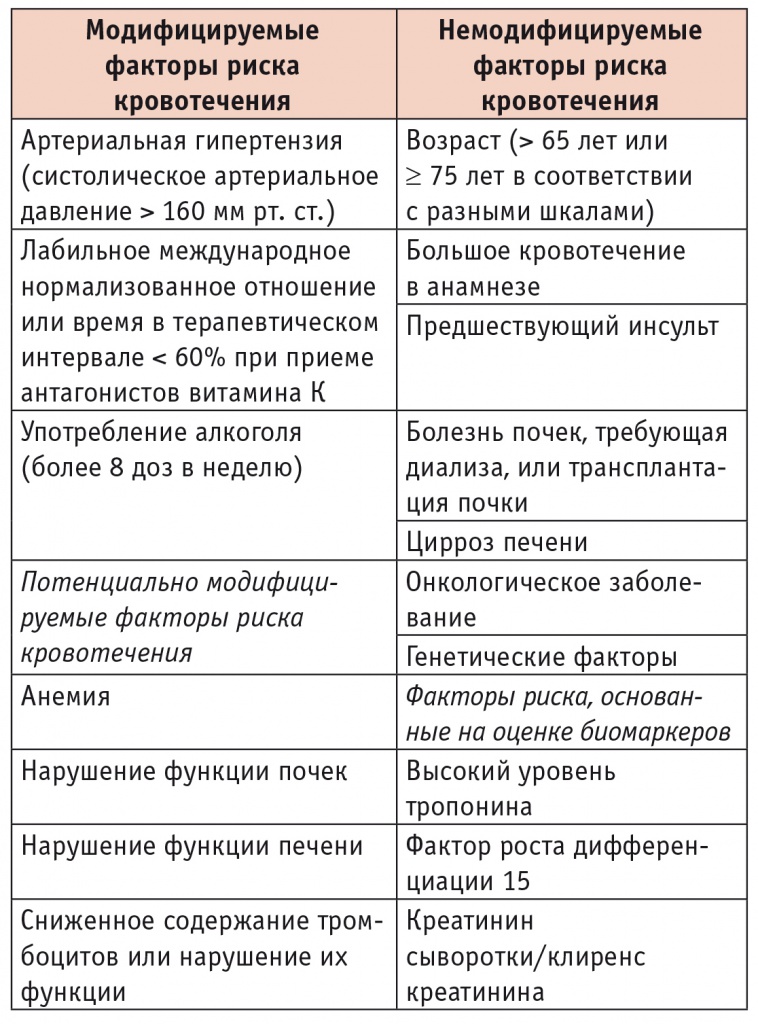
Пациенты с ФП, помимо собственно нарушения ритма, зачастую имеют различные заболевания и состояния, которые усугубляют риск кровотечения. Так, АГ, СД, дистрофические заболевания ЖКТ, сопутствующий прием антиагрегантов увеличивают риск ЖКК в разы по сравнению с таковым у лиц без подобных факторов. Поэтому в Европейских рекомендациях по ФП 2016 г. вводятся дополнительно модифицируемые и немодифицируемые факторы риска (табл. 2). В соответствии с таким подходом нормализация АД или отказ от НПВП (наиболее частые факторы) уже позволяет снизить риск кровотечения[7, 12].
Таблица 2
Модифицируемые и немодифицируемые факторы риска кровотечения у пациентов с фибрилляцией предсердий, получающих антикоагулянты
РАНДОМИЗИРОВАННЫЕ КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ ПРЯМЫХ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ И РИСК ЖЕЛУДОЧНОКИШЕЧНЫХ КРОВОТЕЧЕНИЙ
Так как наиболее частым поводом для назначения пероральных антикоагулянтов является профилактика тромбоэмболических осложнений у больных с ФП, рассмотрим основные регистрационные рандомизированные клинические исследования (РКИ) по изучению ПОАК.
Ривароксабан был изучен в многоцентровом двойном слепом с двойным контролем РКИ ROCKET AF. В него были включены 14 264 пациента с неклапанной ФП (НФП), перенесшие инсульт/транзиторную ишемическую атаку (ТИА)/системную эмболию (СЭ) и/или имевшие как минимум два дополнительных фактора риска инсульта. Это привело к тому, что в исследование практически не включались пациенты с низким риском, и в результате средний балл по шкале CHADS2 оказался искусственно завышенным. В последующих же исследованиях ривароксабана (в том числе наблюдательных, ретроспективных) этот балл был существенно ниже, что более приближено к реальной жизни.
Ривароксабан на популяции всех рандомизированных пациентов (intentiontotreat) подтвердил первичную гипотезу «не хуже» (non inferior) по эффективности по сравнению с варфарином в предупреждении конечной точки «комбинация всех видов инсульта, ТИА и СЭ» — ОР = 0,88; 95%ный ДИ: 0,74–1,03; p < 0,001 для гипотезы «не хуже» и p = 0,12 для превосходства. При оценке безопасности (большое и клинически значимое небольшое кровотечение) статистически значимых различий не было (ОР = 1,03; 95%ный ДИ: 0,96–1,11; p = 0,44), что свидетельствует о том, что ривароксабан обладает сходным с варфарином профилем безопасности.
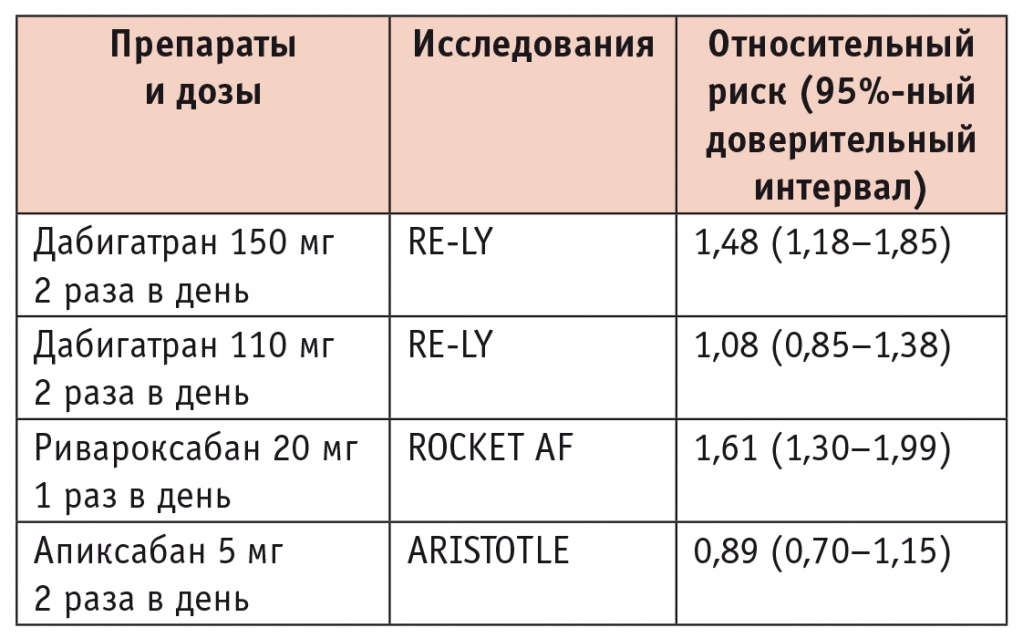
При оценке структуры конечных точек выявлено снижение частоты внутричерепных кровотечений (0,5% vs 0,7%, p = 0,02) и фатальных кровотечений (0,2% vs 0,5%, p = 0,003) в группе ривароксабана. Частота больших ЖКК при применении ривароксабана была статистически значимо выше, чем при приеме варфарина: 224 (3,2%) зарегистрированных события против 154 (2,2%) (p < 0,001)[13].
РКИ RELY сравнивало использование у пациентов с НФП и как минимум одним фактором риска инсульта двух доз дабигатрана (110 и 150 мг 2 раза в день) и варфарина. По своему дизайну это было рандомизированное открытое исследование (PROBE), где были «ослеплены» только дозы дабигатрана. Исследование включило больше пациентов с НФП, чем ROCKET AF, — 18 113, соответственно в равной степени были представлены больные с различными уровнями риска. Какоголибо специального критерия включения в группу низкой дозы дабигатрана не существовало. В результате лечения в группе варфарина зарегистрированы 1,69% в год первичных конечных точек (инсульт/ТИА/СЭ) по сравнению с 1,53% в год в группе дабигатрана 110 мг (ОР = 0,91; 95%ный ДИ: 0,74–1,11; p < 0,001 для гипотезы «не хуже») и 1,11% в группе дабигатрана 150 мг (ОР = 0,66; 95%ный ДИ: 0,53–0,82; p < 0,001 для превосходства). Таким образом, дабигатран в дозе 150 мг 2 раза в день был эффективнее варфарина, а в дозе 110 мг 2 раза в день имел сходную с варфарином эффективность.
При оценке риска большого кровотечения его частота составила 2,71% в год в группе дабигатрана 110 мг и 3,11% в группе дабигатрана 150 мг против 3,36% в группе варфарина. Это показывает бо́льшую безопасность низкой дозы дабигатрана (p = 0,003) и сходную высокой дозы (p = 0,31) по сравнению с варфарином.
Так же, как и в исследовании с ривароксабаном, было отмечено статистически значимое снижение риска внутричерепного кровотечения. Частота большого ЖКК в группе дабигатрана 110 мг была сходной с таковой при применении варфарина (ОР = 1,10; 95%ный ДИ: 0,86–1,41; р = 0,43) и значимо выше в группе дабигатрана 150 мг (ОР = 1,50; 95%ный ДИ: 1,19–1,89; р < 0,001). По результатам исследования RELY можно заключить, что дабигатран в высокой дозе был более эффективен, чем варфарин, но имел такой же риск большого кровотечения, а в низкой дозе — сходную эффективность, но бо́льшую безопасность, в том числе и по частоте большого ЖКК (не увеличивал его риск)[14].
Для ингибитора Хафактора апиксабана было проведено два РКИ III фазы: ARISTOTLE — сравнение с варфарином, AVERROSE — сравнение с АСК[15, 16].
В исследование ARISTOTLE вошел 18 201 пациент с НФП и как минимум одним фактором риска тромбоэмболических событий, участники были рандомизированы в две группы: получавшие апиксабан в дозе 5 мг 2 раза в день или варфарин с целевым МНО 2,0–3,0. Первичная конечная точка эффективности зарегистрирована у 1,27% пациентов в год в группе апиксабана и у 1,60% в год в группе варфарина. Таким образом, была подтверждена гипотеза о превосходстве апиксабана над варфарином по эффективности (ОР = 0,79; 95%ный ДИ: 0,66–0,95; p = 0,01 для превосходства). Риск большого кровотечения снижался при применении апиксабана на 31% по сравнению с варфарином (ОР = 0,69; 95%ный ДИ: 0,60–0,80; p < 0,001). Среди вторичных конечных точек также зарегистрировано уменьшение частоты внутричерепного кровоизлияния и общей смертности. Риск большого ЖКК при применении апиксабана не отличался от такового при применении варфарина. Итак, апиксабан по сравнению с варфарином был и более эффективен, и более безопасен, не увеличивал частоту ЖКК[15].
Другое исследование с апиксабаном — AVERROES — основано на том, что в действовавших тогда рекомендациях допускалось применение АСК для профилактики инсульта у отдельных категорий пациентов (низкий риск, непереносимость АВК, невозможность контроля МНО и прочее). Кроме того, до сих пор врачи назначают АСК пациентам с ФП, мотивируя это большей безопасностью по сравнению с ОАК[16].
Исследование AVERROES, включившее 5599 пациентов с ФП, завершено преждевременно изза доказательства большей эффективности апиксабана в дозе 5 мг 2 раза в день, чем у АСК в дозе 81–324 мг, по предотвращению первичной конечной точки «инсульт/СЭ» (ОР = 0,45; 95%ный ДИ: 0,32–0,62; p < 0,001). Риск большого кровотечения был сходным в обеих группах (ОР = 1,13; 95%ный ДИ: 0,74–1,75; p = 0,57), такая же картина наблюдалась и при оценке ЖКК (ОР = 0,86; 95%ный ДИ: 0,40–1,86; р = 0,71). Для апиксабана продемонстрирована не только высокая эффективность, но и сходная с АСК безопасность, что обезоружило сторонников антиагрегантов для профилактики инсульта.
Суммарные данные по частоте ЖКК в РКИ ПОАК приведены в таблице 3.
Таблица 3
Риск желудочно-кишечного кровотечения в регистрационных рандомизированных клинических исследованиях прямых оральных антикоагулянтов по сравнению с варфарином при фибрилляции предсердий
Изучив основные тенденции в эпидемиологических исследованиях, клинических исследованиях III фазы АВК и ПОАК, J. Desai и соавт. предложили некоторые пункты для оценки риска ЖКК у пациентов с НФП, принимающих антикоагулянты (табл. 4). Как видно, авторы подчеркивают бо’льшую безопасность апиксабана и низкой дозы дабигатрана и более высокий риск ЖКК при применении ривароксабана и дабигатрана в дозе 150 мг 2 раза в день. Отдельного обсуждения заслуживает совместное использование ОАК и антиагрегантов. Их комбинация увеличивает риск ЖКК, поэтому в некоторых последних рекомендациях у пациентов с ФП и другой сердечнососудистой болезнью, требующей применения антиагрегантов, допускается монотерапия ПОАК (что, кстати, не снижает эффективность лечения)[9].
Таблица 4
«Возьмите на заметку»: относительный риск больших желудочно-кишечных кровотечений (ЖКК) у пациентов с неклапанной фибрилляцией предсердий (по J. Desai и соавт.)

РЕАЛЬНАЯ ПРАКТИКА ПРИМЕНЕНИЯ ПРЯМЫХ ОРАЛЬНЫХ АНТИКОАГУЛЯНТОВ И РИСК ЖЕЛУДОЧНОКИШЕЧНЫХ КРОВОТЕЧЕНИЙ
Существующие ограничения РКИ не позволяют полностью оценить, как будут работать изученные препараты в реальной жизни. Жесткие критерии включения оставляют вне изучения достаточно большую популяцию пациентов, которым также может быть назначено подобное лечение. В случае ПОАК мало были изучены больные с некоторыми сопутствующими состояниями: заболеваниями почек, печени, пороками сердца, коагулопатиями, патологией щитовидной железы и др., а также молодого или очень пожилого возраста, некомплаентные, употребляющие алкоголь и проч. [17–19].
В связи с этим большое внимание уделяется так называемым исследованиям реальной клинической практики (РКП), которые объединяют проспективные наблюдательные и ретроспективные изучения. Изначально все исследования ПОАК в реальной жизни были направлены на оценку безопасности, включая ЖКК, сейчас уже оцениваются и различные конечные точки эффективности. Проводится сравнение определенных ПОАК с варфарином и между собой (facetoface), что невозможно было бы сделать в условиях РКИ[19, 20].
Прямое сравнение нескорректированных групп пациентов, получающих ПОАК, зачастую связано с большим количеством систематических ошибок. Поэтому для «уравнивания» разнородных популяций в ретроспективных исследованиях широко используется метод псевдорандомизации (propensity score matching). Этот метод позволяет составить сходные группы больных, получающих ПОАК и АВК, из большой разнородной популяции для проведения статистического анализа. Исследований РКП с использованием метода псевдорандомизации в настоящее время опубликовано достаточно много, далее мы подробнее рассмотрим результаты самых масштабных, вышедших в последнее время[19, 21].
При сравнении применения ривароксабана и варфарина у пациентов с НФП в реальной практике E. A. Chrischilles и соавт. отметили, что, несмотря на высокую эффективность в предотвращении тромбоэмболических событий, ривароксабан значительно увеличивал риск ЖКК (ОР = 1,47; 95%ный ДИ: 1,29–1,67). Данное наблюдение было выполнено в рамках US Food and Drug Administration Sentinel System на большой популяции пациентов (36 173 наблюдения — ривароксабан и 79 520 — варфарин)[22].
Интересно исследование I. Hernandez и соавт. (2017), проведенное на основе анализа базы заявок Medicare, включившее около 43 тысяч пациентов с НФП. Было показано, что ПОАК (ривароксабан, дабигатран и апиксабан) в целом обладают большей эффективностью, чем варфарин. Безопасность же ривароксабана оказалась значительно меньше по сравнению как с варфарином, так и с другими ПОАК. В то же время риск большого ЖКК был наибольшим при применении ривароксабана и значительно снижался при приеме апиксабана[23].
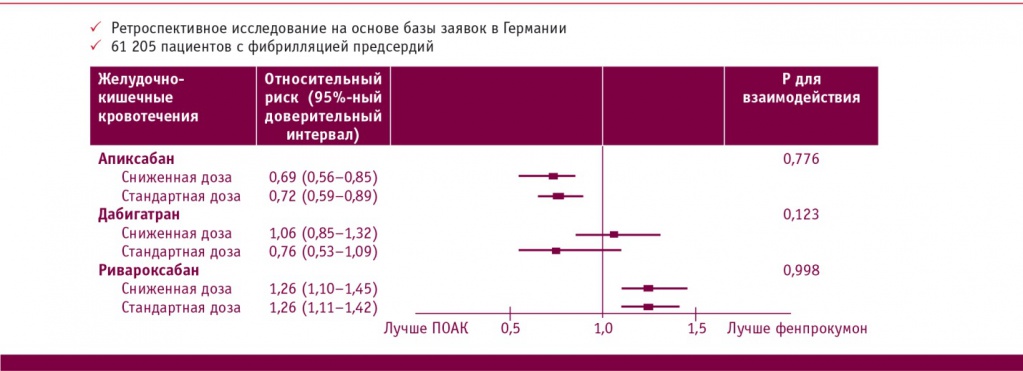
В ретроспективном когортном исследовании S. H. Hohnloser и соавт. (2017) оценивали сравнительные риски развития кровотечений, приводящих к госпитализации, на фоне терапии ПОАК и фенпрокумоном на основе базы заявок в Германии[24].
Была оценена частота больших кровотечений, ЖКК или любых других кровотечений. Изучены данные 35 013 пациентов, включая 3138 принимавших дабигатран, 3633 — апиксабан, 12 063 — ривароксабан и 16 179 — фенпрокумон. Для анализа результатов использовался метод псевдорандомизации. Апиксабан имел более низкий риск большого кровотечения (ОР = 0,68, 95%ный ДИ: 0,51–0,90, p = 0,008), ЖКК (ОР = 0,53, 95%ный ДИ: 0,39–0,72, p < 0,001) и других кровотечений (ОР = 0,80; 95%ный ДИ: 0,70–0,92; p = 0,002) по сравнению с фенпрокумоном. Не было значимых различий по риску кровотечений между дабигатраном и фенпрокумоном. Ривароксабан приводил к большей частоте ЖКК (ОР = 1,39; 95%ный ДИ: 1,21–1,60; p < 0,001) и других кровотечений (ОР = 1,19; 95%ный ДИ: 1,10–1,28; p < 0,001).
Последующий анализ этой же немецкой базы данных, в который вошли сведения по риску наступления событий, связанных с ФП, при использовании полных и сниженных доз ПОАК, продемонстрировал сходный результат (рис.): снижение риска ЖКК для обеих доз апиксабана, сходный риск при применении дабигатрана и увеличение риска при использовании ривароксабана[25].
Рис. Риск желудочно-кишечного кровотечения при использовании стандартных и сниженных доз прямых оральных антикоагулянтов (ПОАК) по сравнению с фенпрокумоном в исследовании реальной практики
Ретроспективное исследование N. S. Abraham и соавт. (2017) с использованием метода псевдорандомизации проведено на основе баз данных OptumLabs Data Warehouse и Medicare Advantage и включило 31 574 пациента, получавших апиксабан, дабигатран и ривароксабан. При оценке подобранных по соответствующим параметрам когорт было показано, что частота ЖКК выше при применении ривароксабана и дабигатрана, а апиксабан обладал самым благоприятным профилем безопасности. Риск ЖКК среди пациентов от 75 лет и старше увеличивался с возрастом. Апиксабан также имел меньший риск ЖКК у очень пожилых пациентов, чем дабигатран (ОР = 0,45; 95%ный ДИ: 0,29–0,71) или ривароксабан (ОР = 0,39; 95%ный ДИ: 0,25–0,61)[26].
Таким образом, результаты многих исследований РКП совпали с выводами основных клинических исследований по эффективности и безопасности ПОАК и АВК и дополнили информацию по частоте ЖКК в реальной практике. В целом апиксабан и дабигатран ассоциированы с более низким риском большого ЖКК по сравнению с АВК и ривароксабаном. В некоторых исследованиях РКП апиксабан имел меньших риск ЖКК по сравнению с дабигатраном. Ривароксабан не показал преимуществ при оценке риска ЖКК ни по сравнению с варфарином, ни по сравнению с другими ПОАК.
Естественно, данные выводы имеют риск больших допущений. В частности, редко приводятся используемые дозы ПОАК (а эффект возрастания риска кровотечений может быть дозазависим), часто отсутствует информация по параметрам функции почек, сопутствующим заболеваниям и принимаемым препаратам. Тем не менее даже такие ориентировочные данные могут помочь врачу в принятии клинического решения.
КАК МИНИМИЗИРОВАТЬ ЧИСЛО КРОВОТЕЧЕНИЙ У ПАЦИЕНТОВ, ПРИНИМАЮЩИХ АНТИКОАГУЛЯНТЫ?
Основной путь — коррекция модифицируемых факторов риска (см. табл. 2). Как уже упоминалось, нормализация АД уже снижает риск кровотечений. Так как МНО также является фактором риска кровотечений, возможно, варфарин следует сменить на ПОАК, если время пребывания МНО в целевом диапазоне 2,0–3,0 менее 70%. Нужно также при необходимости корректировать дозу НОАК, ориентируясь на возраст пациента, почечную функцию и массу тела.
А. LanasGimeno и A. Lanas, проанализировав факторы риска ПОАК в РКИ, выделили среди них основные для каждого препарата (табл. 5). Важно понимать, что ни один антикоагулянт не является абсолютно безопасным, что необходимо учитывать множество нюансов, сопоставляя риск и выгоду их применения[27].
Таблица 5
Основные факторы риска желудочно-кишечных кровотечений при применении антикоагулянтов в регистрационных рандомизированных клинических исследованиях (по А. Lanas-Gimeno, A. Lanas)
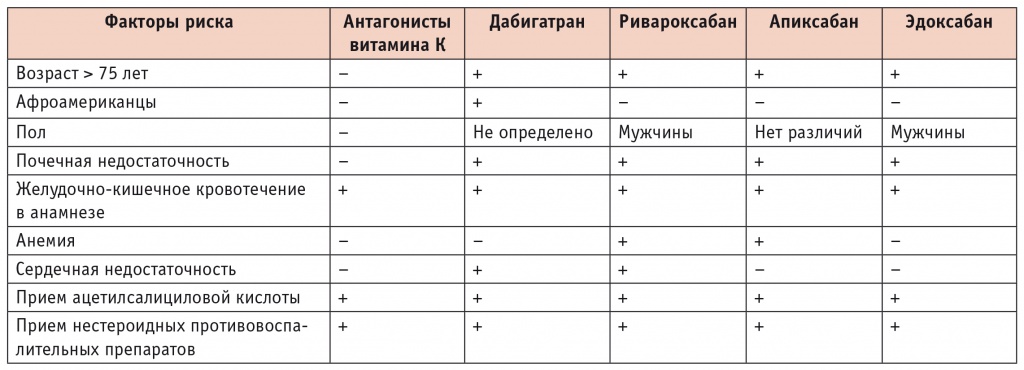
Кроме факторов, связанных с больным, необходимо также принимать во внимание особенности самого антикоагулянта. В Европейских рекомендациях по ведению больных с ФП указано[7]: «У пациентов с высоким риском желудочнокишечного кровотечения АВК или другой ПОАК следует считать предпочтительным перед дабигатраном 150 мг 2 раза в день, ривароксабаном 20 мг 1 раз в день или эдоксабаном 60 мг 1 раз в день (класс IIa, уровень B)». То есть у таких пациентов в полной дозе рекомендуется назначать только апиксабан и в сниженной дозе — дабигатран или эдоксабан.
Согласительные рекомендации по выбору ОАК для профилактики инсульта при НФП у отдельных групп пациентов (Diener H. C. и соавт., 2015) при высоком риске ЖКК предлагают в качестве препарата первого выбора использовать апиксабан в дозе 5 мг 2 раза в день или дабигатран в дозе 110 мг 2 раза в день[28].
Что касается прямых мер по профилактике ЖКК, нужно отметить, что выявление факторов риска и проведение профилактических исследований, например верхней эндоскопии с биопсией, скрининга колоректального рака, и специфическое лечение (в том числе эрадикация H. pylori) перед началом лечения антикоагулянтом могут снизить риск фатальных кровотечений. Однако последняя стратегия пока не проверена. Соблюдение этих мер, вероятно, может привести к снижению риска тяжелых или смертельных ЖКК. Что касается ПОАК, их короткий период полувыведения при отсутствии почечной или печеночной недостаточности является важным преимуществом, которое помогает не столкнуться с большими ЖКК[6, 8, 9, 29].
Еще один подход — использование ингибиторов протонной помпы (ИПП) одновременно с началом лечения. Такая тактика себя оправдала у пациентов, принимающих НПВП, низкие дозы АСК и клопидогрел, а также варфарин, она уменьшает риск кровотечений из верхних отделов ЖКТ. Эффективность такой профилактики при приеме ПОАК не ясна. Проводимые в настоящее время исследования покажут, насколько это целесообразно. Не понятно также, будет ли снижаться частота ЖКК из нижних отделов ЖКТ при приеме ИПП. А именно риск этих кровотечений увеличивается в большей степени[30–33].
В заключение хотим привести алгоритм, который предложен А. LanasGimeno и A. Lanas (2017). В нем представлен подход, учитывающий как факторы оценки риска, связанные с пациентом, так и меры по коррекции предполагаемых или уже состоявшихся кровотечений[27].
Алгоритм, которого необходимо придерживаться для минимизации риска желудочнокишечных кровотечений у пациентов, принимающих антикоагулянты
1. Изучите анамнез, сопутствующие заболевания, наличие ЖКК в анамнезе, принимаемые лекарственные препараты.
2. Адаптируйте назначения к принятым клиническим рекомендациям, основанным на строгих научных доказательствах.
3. У пациентов старше 75 лет, весом меньше 65 кг, с серьезной почечной недостаточностью, печеночной недостаточностью класса С по Чайлд — Пью рассмотрите назначение АВК.
4. Используйте ИПП у пациентов, получающих АСК/антиагреганты или комбинированную антиагрегантную терапию.
5. Используйте ИПП у пациентов с ЖКК из верхних отделов ЖКТ.
6. Рекомендуется проведение скрининга на H. pylori до назначения ОАК при наличии гастроэнтерологических заболеваний в анамнезе.
7. Избегайте совместного назначения с такими препаратами, как НПВП, кортикостероиды, ингибиторы Р450.
8. При ЖКК вследствие плохого контроля МНО переходите с АВК на ПОАК.
9. При ЖКК вследствие приема дабигатрана или ривароксабана рекомендуется АВК, апиксабан или снижение дозы.
ЗАКЛЮЧЕНИЕ
Современная наука предоставила врачу высокоэффективные оральные антикоагулянты. Их несомненные преимущества в эффективности и удобстве применения не должны затмевать снижение безопасности в виде риска кровотечения из ЖКТ. Коррекция факторов риска, обоснованный выбор конкретного прямого перорального антикоагулянта на основе информации из рандомизированных клинических исследований и исследований реальной практики, в том числе и по риску желудочнокишечных кровотечений, позволят оптимизировать лечение наших пациентов, предоставив им лучшие медицинские технологии на сегодняшний день.
_______________________________
Статья подготовлена при поддержке компании «Пфайзер». В статье выражено мнение авторов, которое может отличаться от позиции компании.







