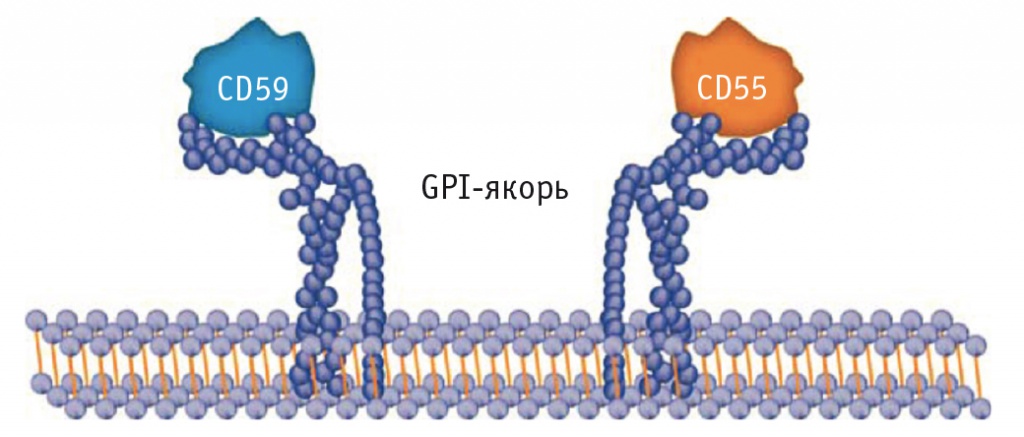
Заболевание вызывает соматическая мутация в гене PIG-A, расположенном на Х-хромосоме и кодирующем субъединицу фермента фосфатидилинозитол-N-ацетилглюкозаминтрансферазы [26]. Этот фермент участвует в биосинтезе гликозилфосфатидилинозитола (GPI) [45] — гликолипида, необходимого для фиксации на клеточной мембране нескольких белков, в том числе CD55 и CD59 (рис. 1) [45]. При ПНГ отсутствие белков CD55 и CD59 на поверхности эритроцитов приводит к деструкции последних системой комплемента [13, 31].
Рис. 1. Молекулярный дефект при пароксизмальной ночной гемоглобинурии приводит к отсутствию GPI-якоря для «защитных» белков CD59 и CD55 на поверхности клеток (адаптировано из [55]).
Примечание. Соматическая мутация в гене PIG-A приводит к нарушению биосинтеза гликозилфосфатидилинозитола (GPI), который служит якорем для многих поверхностных белков, в том числе ингибиторов комплемента CD55 и CD59. CD55 широко представлен на поверхности клеток гемопоэтического ряда; он ингибирует активацию комплемента на уровне С3-конвертазы, защищая собственные клетки от атаки системы комплемента. CD59 предотвращает полимеризацию C9 и образование мембраноатакующего комплекса. Эритроциты и тромбоциты с дефицитом CD55 и CD59 подвергаются атаке системы комплемента, что приводит к лизису эритроцитов и активации тромбоцитов
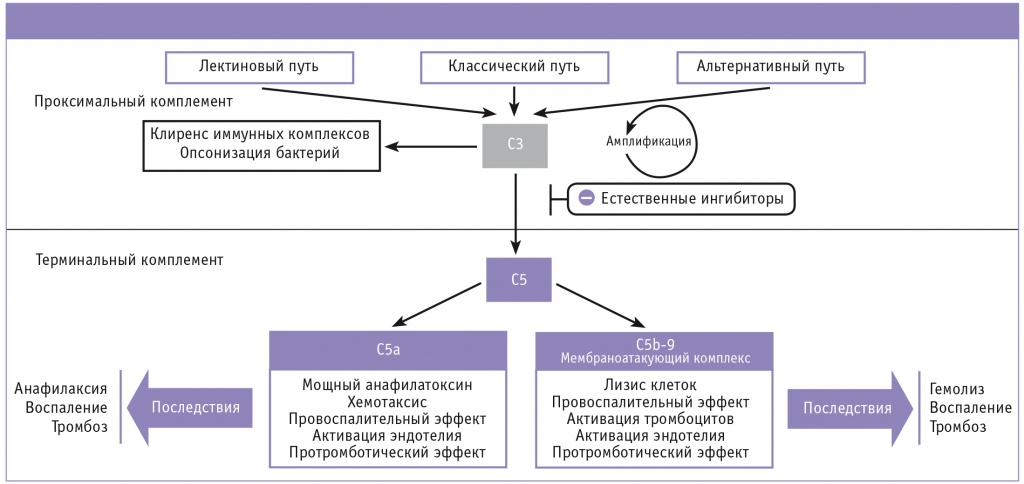
Система комплемента — каскадная система протеолитических ферментов, важная часть как врожденного, так и приобретенного иммунитета. Комплемент активируется тремя биохимическими путями: классическим, альтернативным и лектиновым (рис. 2). Все пути активации приводят к формированию С3-конвертазы — ферментного комплекса, расщепляющего компонент комплемента C3 на C3a и C3b [51]. C3b участвует в образовании C5-конвертазы, которая, в свою очередь, расщепляет C5-компонент комплемента на C5a и C5b. C5b начинает формирование мембраноатакующего комплекса (МАК), состоящего из C5b, C6, C7, C8 и полимерного C9. На поверхности клетки МАК образует трансмембранный канал, вызывающий осмотический лизис клетки-мишени. В норме CD55 и CD59, расположенные на поверхности клеток, обеспечивают их защиту от системы комплемента: CD55 ускоряет диссоциацию C3-конвертазы [24], а CD59 препятствует присоединению белка C9 к формирующемуся комплексу, предотвращая образование МАК [25].
Рис. 2. Последствия хронической неконтролируемой активации комплемента [56].
Примечание. Комплемент активируется тремя биохимическими путями: классическим, альтернативным и лектиновым. Вне зависимости от пути активации образуется С3-конвертаза, которая гидролизует компонент комплемента C3 на C3a и C3b, что запускает дальнейший каскад биохимических реакций, приводящих к образованию белка C5a и формированию мембраноатакующего комплекса. Хроническая неконтролируемая активация комплемента и развивающийся в результате хронический комплементзависимый гемолиз существенно отягощают жизнь пациентов с пароксизмальной ночной гемоглобинурией
Таким образом, на первом этапе развития ПНГ возникает мутация в гене PIG-A полипотентной гемопоэтической стволовой клетки, т. е. формируется GPI-дефицитный клон. При такой мутации дефицит GPI-связанных белков и, следовательно, «защитных» белков CD55 и CD59 наблюдается во всех типах клеток крови, которые являются потомками этого клона. В частности, отсутствие или дефицит ингибиторов комплемента на мембране эритроцитов приводит к их хроническому внутрисосудистому комплементопосредованному гемолизу. Однако для клинического проявления заболевания недостаточно одной мутации в гене PIG-A — нужен дополнительный фактор, который позволил бы мутации проявиться. Для возникновения клинической картины ПНГ необходимо достаточно много мутантных клеток. Таким образом, второе независимое событие — экспансия мутантного клона.
Существуют различные гипотезы о механизмах, лежащих в основе экспансии ПНГ-клона, т. е. о причинах конкурентного преимущества при делении клона с мутацией в гене PIG-A в костном мозге. Согласно одной из них, в развитие ПНГ, помимо мутации в гене PIG-A, вносят вклад аутоиммунные механизмы. Данную гипотезу подтверждают хорошо известное сочетание ПНГ и апластической анемии (АА), в большинстве случаев являющейся аутоиммунным заболеванием [22], а также прямая демонстрация иммунологических нарушений у больных ПНГ [21]. Предполагается, что для реализации цитолитического потенциала аутореактивным цитотоксическим лимфоцитам необходимо интимное взаимодействие с нормальными гемопоэтическими стволовыми клетками, в том числе через определенные GPI-связанные белки (CD58). Вероятно, отсутствие GPI-связанных белков на мембране позволяет клеткам ПНГ-клона избежать опосредованной Т-лимфоцитами аутоиммунной атаки, что дает патологическому клону преимущество в выживании [11, 21]. Согласно другой гипотезе, клетки с мутацией в гене PIG-A постепенно приобретают соматические мутации в других генах, обеспечивающие им пролиферативное преимущество перед остальными стволовыми клетками. По предположению авторов, эти дополнительные соматические мутации могут изменять свойства клеточного клона с мутацией PIG-A, что также объясняет разнообразие клинического течения болезни у пациентов с ПНГ [43].
Если механизмы, приводящие к гемолизу, хорошо известны, то патогенетические факторы повышенного риска тромбозов и их атипичной локализации при ПНГ изучены недостаточно. В развитие тромботических осложнений при ПНГ вовлечены следующие пути:
-
прямая активация комплементом ПНГ-тромбоцитов;
-
тромбоз вследствие появления прокоагулянтных микрочастиц или инактивации монооксида азота свободным гемоглобином, высвобождающимся при разрушении эритроцитов;
-
нарушение регуляции фибринолиза из-за отсутствия на поверхности клеток GPI-связанного рецептора урокиназоподобного активатора плазминогена [14].
КЛАССИФИКАЦИЯ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ
Согласно рекомендациям Международной группы по изучению ПНГ различают три основные формы заболевания [1, 32].
1. Классическая ПНГ характеризуется клинико-лабораторными признаками внутрисосудистого гемолиза без других признаков недостаточности костного мозга (тромбоцитопении и нейтропении).
2. ПНГ в сочетании с синдромами недостаточности костного мозга, например с АА или миелодиспластическим синдромом (МДС), когда при клинических и/или лабораторных признаках внутрисосудистого гемолиза в периферической крови определяется клон клеток с ПНГ-фенотипом.
3. Субклиническая ПНГ (сПНГ) у пациентов с малым ПНГ-клоном (как правило, менее 1%) и отсутствием клинических и лабораторных проявлений гемолиза или тромбозов. Следует отметить, что данная форма часто сочетается с другими заболеваниями, связанными с недостаточностью костного мозга (АА/сПНГ, МДС/сПНГ).
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ
В целом клинические проявления ПНГ, а также механизмы, лежащие в основе этих проявлений, одинаковы у взрослых и детей [49]. Различия состоят только в выраженности и частоте описанных ниже симптомов.
Анемия. Анемия при ПНГ часто бывает вызвана несколькими факторами: она может быть результатом гемолиза, дефицита железа вследствие потери свободного гемоглобина с мочой и/или недостаточности костного мозга. Как правило, у пациентов с классической ПНГ наблюдают выраженный внутрисосудистый гемолиз, умеренную или тяжелую форму анемии, ретикулоцитоз и повышение активности ЛДГ в сыворотке крови. Кроме того, при классической ПНГ отсутствуют морфологические признаки АА/МДС и для таких больных нехарактерны аномалии кариотипа [32]. Нередко ПНГ развивается на фоне синдромов костномозговой недостаточности (АА, МДС, миелофиброз). У таких пациентов часто наблюдается тяжелая форма тромбоцитопении в сочетании с умеренно повышенной или нормальной активностью ЛДГ [4, 32]. У пациентов с субклинической ПНГ отсутствуют клинические или лабораторные признаки гемолиза, число эритроцитов в пределах нормы. Субклиническую форму ПНГ, часто наблюдаемую у детей, нередко диагностируют на фоне заболеваний, характеризующихся нарушением функции костного мозга, — почти всегда (в 99% случаев) на фоне приобретенной АА. Со временем экспансия ПНГ-клона может приводить к развитию гемолитической формы АА/ПНГ [21]. Интересно, что при врожденных формах костномозговой недостаточности (анемии Фанкони, врожденном дискератозе) практически никогда не встречается ни клинически выраженной, ни латентной ПНГ.
Тромбозы. Тромботическими осложнениями обусловлено 40–67% летальных исходов при ПНГ [14]. У пациентов с ПНГ тромбозы развиваются преимущественно во внутрибрюшных венах (печеночной, портальной, брыжеечной, селезеночной) и мозговых венах (сагиттальной, пещеристого синуса), причем наиболее часто возникает тромбоз вен печени, приводящий к развитию синдрома Бадда — Киари. Помимо этого, весьма распространены тромбозы глубоких вен нижних конечностей, тромбоэмболии легочной артерии и тромбозы вен кожи [14]. Тромботические осложнения возможны у любого пациента с ПНГ, но в группе наибольшего риска находятся пациенты с большим ПНГ-клоном (> 50% гранулоцитов) [27, 28].
Недостаточность костного мозга. Недостаточность костного мозга у пациентов с ПНГ может варьировать от субклинической формы до АА тяжелой степени. Показано, что у пациентов с ПНГ снижено количество клеток-предшественников гемопоэза [23]. У значительной части (30–70%) больных ПНГ со временем развивается выраженная АА [13, 19, 44], так же как у пациентов с АА при полном или частичном восстановлении кроветворения после иммуносупрессивной терапии может развиться ПНГ. Так, ПНГ-клон на момент диагностики АА обнаруживают почти у 40% пациентов [40], его экспансия со временем нередко приводит к появлению клинических симптомов ПНГ.
Дистония гладкой мускулатуры. Боль в животе, спазм пищевода, дисфагия и эректильная дисфункция также принадлежат к наиболее распространенным симптомам классической ПНГ. Все эти симптомы являются прямым следствием внутрисосудистого гемолиза, высвобождения свободного гемоглобина и окисления оксида азота (NO) [39]. В норме свободный гемоглобин удаляется из плазмы крови с помощью гемопексина, CD163 и гаптоглобина при участии NO. У пациентов с ПНГ система утилизации свободного гемоглобина перегружена, поэтому свободный гемоглобин накапливается в плазме крови и связывает молекулы NO, что приводит к снижению уровня NO в плазме крови. В нормальных условиях NO синтезируется клетками эндотелия; он необходим для расслабления гладкой мускулатуры, в том числе артериол, а также для ингибирования активации и агрегации тромбоцитов. Гемоглобин-опосредованный дефицит NO ведет к нарушению регуляции тонуса гладкой мускулатуры и к активации тромбоцитов. Дистония гладкой мускулатуры чаще встречается у пациентов с большим ПНГ-клоном и активно протекающим гемолизом [27].
Другие проявления. По сравнению с общей популяцией, у пациентов с ПНГ в 6 раз чаще развивается хроническая болезнь почек1 [18]. Повреждение почечных канальцев бывает вызвано тромбозом мелких сосудов и накоплением гемосидерина. Помимо этого, в результате снижения уровня NO и развивающейся вазоконстрикции у больных ПНГ часто наблюдают легочную гипертензию легкой или средней степени [16, 17].
ОСОБЕННОСТИ ТЕЧЕНИЯ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ У ДЕТЕЙ И ПОДРОСТКОВ
ПНГ у детей и подростков встречается реже, чем у взрослых (примерно 10% пациентов с ПНГ младше 21 года) [19, 28, 44, 47]; при этом болезнь возникает в любом возрасте, но обнаруживают ее преимущественно у подростков [8, 50, 53]. Очень часто заболевание длительное время не диагностируют, вследствие чего пациенты не получают адекватного лечения [50, 53]. Клинические проявления ПНГ в детском возрасте несколько отличаются от течения заболевания у взрослых. У детей чаще отмечают субклиническую форму заболевания или ПНГ в совокупности с синдромом недостаточности костного мозга (в частности, с АА, рефрактерной цитопенией) [8, 12, 49, 50], причем симптом гемоглобинурии проявляется не всегда [50]. Тромботические осложнения наблюдают в среднем у 23% (6–50%) больных детского возраста [8, 50, 53].
В нашем исследовании, проводимом с 2012 г. в Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева Минздрава России (г. Москва), ПНГ-клон выявлен у половины детей с приобретенной АА (39 из 78 детей). При этом у 29 (74,4%) пациентов клон был минорным (˂ 1% гранулоцитов), а у 10 (25,6%) размер ПНГ-клона гранулоцитов был равен 1% и более. Тромбозы наблюдали только в двух случаях (у 5,1% детей с АА/ПНГ), и у обоих пациентов размер ПНГ-клона на гранулоцитах превышал 55%. Повышение активности ЛДГ более 1,5 верхней границы нормы обнаружено у 7 (17,9%) пациентов с АА/ПНГ и только у 1 (2,6%) больного в группе с АА без ПНГ.
Вследствие малого числа наблюдений сведения о клинических проявлениях, течении заболевания и выживаемости у детей весьма ограниченны. В последние 5 лет были предприняты попытки масштабного статистического анализа данных о симптомах ПНГ в детской и взрослой популяциях на основании Международного регистра больных ПНГ (Global Registry of Patients With Paroxysmal Nocturnal Hemoglobinuria) [47, 48]. Показано, что в обеих популяциях ПНГ с равной частотой встречается у лиц мужского и женского пола. Большинство больных принадлежат к европеоидной расе, но в детской популяции доля пациентов монголоидной расы немного ниже, чем во взрослой группе (7,1% против 17,7%; p = 0,017) [47].
На момент включения в исследование размеры клона ПНГ на гранулоцитах у детей и взрослых пациентов различались: у детей они были статистически значимо меньше. Например, клон размером менее 10% наблюдали у 57,3% детей и 39,5% взрослых, а ПНГ-клон размером 50% и более — у 24,7% детей и 38,9% взрослых (p = 0,003 при общем сравнении). АА чаще отмечали у детей, чем у взрослых (77,8% против 54,4%; p < 0,001), а МДС, напротив, в детской популяции встречался реже, чем во взрослой (2,0% против 10,2%; p = 0,007). Тяжелую форму цитопении (число нейтрофилов < 0,5 × 109/л или число тромбоцитов < 20 × 109/л) чаще наблюдали у детей (33,3% против 13,2% у взрослых; p < 0,001), но доля пациентов с гемолизом в детской и взрослой популяциях была сопоставимой (50,0% и 59,5% соответственно). Частота тромботических осложнений у детей и взрослых статистически значимых различий не имела [47].
ПОДХОДЫ К ДИАГНОСТИКЕ И ТЕРАПИИ ПАРОКСИЗМАЛЬНОЙ НОЧНОЙ ГЕМОГЛОБИНУРИИ
Сегодня наиболее информативным и надежным методом диагностики ПНГ у детей и взрослых признана высокочувствительная проточная цитометрия [3]. Дефицит GPI-связанных белков при ПНГ выявляют при снижении связывания клеток пациента с моноклональными антителами к этим белкам, меченными флюоресцеинами, а также при иммунофенотипировании клеток периферической крови с использованием флюоресцентно-меченого аэролизина (fluorescein-labeled proaerolysin), который связывается с углеводной частью GPI-якоря [3].
Независимо от возраста у пациентов с ПНГ обнаруживают три типа эритроцитов: клетки I типа с нормальной экспрессией CD55 и CD59, клетки II типа со сниженным количеством этих белков и эритроциты III типа, где соответствующие белки полностью отсутствуют [32]. У большинства пациентов зафиксировано сочетание клеток I и III типов (наиболее распространенный фенотип), у меньшего числа больных — I, II и III типов (второй по частоте фенотип), у некоторых — I и II типов (наименее распространенный фенотип). Такую мозаичность фенотипов необходимо учитывать, так как эритроциты II типа сравнительно устойчивы к гемолизу и у пациентов с бо́льшим процентом клеток II типа болезнь протекает сравнительно легко [30].
Анализ дефицита GPI-связанных белков необходим как на эритроцитах, так и на лейкоцитах (моноцитах и гранулоцитах). При этом истинная величина клона ПНГ коррелирует именно с процентным содержанием CD24-дефицитных гранулоцитов, поскольку ПНГ-эритроциты лизируются под действием комплемента [3]. Недавно проведенные трансфузии эритроцитов также влияют на оценку размера клона, так как увеличивают количество нормальных эритроцитов.
Алгоритм скрининга пациентов детского возраста из групп высокого риска. Установлено, что ПНГ-клон чаще выявляют у пациентов детского возраста с АА или рефрактерной цитопенией. Так, дефицит GPI-связанных белков обнаружен у 21–41% детей с АА [41, 46, 53] и у 41% детей с рефрактерной цитопенией [2]. В связи с этим всем детям с установленной костномозговой недостаточностью необходим скрининг для определения клона ПНГ. Первичный отрицательный результат не следует расценивать как окончательный: со временем клон может возникнуть или проявиться. По этой причине всем пациентам детского возраста с АА, даже при отсутствии клинических проявлений гемолиза, рекомендован скрининг на ПНГ при постановке диагноза АА, а также как минимум раз в год в ходе последующего наблюдения [3, 49].
В настоящее время наиболее эффективные подходы к лечению ПНГ включают ингибирование терминальных компонентов системы комплемента лекарственным препаратом экулизумаб или трансплантацию костного мозга (ТКМ) [4].
Экулизумаб — гуманизированное моноклональное антитело, которое связывается с C5-компонентом системы комплемента, ингибирует его последующее расщепление на C5a и C5b и, следовательно, препятствует формированию МАК [40]. Экулизумаб зарегистрирован на территории РФ в 2011 г., и на сегодняшний день это единственный в мире лекарственный препарат, одобренный для таргетного лечения ПНГ. Эффективность и безопасность экулизумаба у взрослых пациентов продемонстрированы в двух международных исследованиях фазы III [7, 20]. Препарат позволяет добиться значительного уменьшения внутрисосудистого гемолиза, снижения риска развития тромбозов и трансфузионной зависимости, а также существенно снизить выраженность симптомов, определяющих качество жизни пациентов с ПНГ. Наиболее серьезным следствием блокирования терминального компонента комплемента является повышенный риск развития инфекций Neisseria spp, главным образом менингококковой инфекции (приблизительно 0,5% в течение года или 5% после 10 лет) [4]. По этой причине экулизумаб следует назначать только пациентам, прошедшим вакцинацию от менингококка.
В 2014 г. были опубликованы результаты исследования фазы I/II по оценке эффективности и безопасности применения экулизумаба у детей и подростков с ПНГ [35]. В исследовании участвовали 7 пациентов в возрасте 11–17 лет: четверо детей с классической ПНГ и трое — с ПНГ на фоне АА. Участники эксперимента хорошо переносили терапию экулизумабом; лечение позволило добиться полного ингибирования внутрисосудистого гемолиза, стабилизировать гематологические показатели, а также значительно уменьшить выраженность других проявлений ПНГ [35]. Результаты эксперимента хорошо согласуются с данными исследований по применению экулизумаба у взрослых с ПНГ, что обосновывает применение препарата для лечения ПНГ у детей и подростков.
Терапия экулизумабом показана пациентам детского возраста с активно протекающим заболеванием и при невозможности аллогенной ТКМ (например, при отсутствии донора или отказе от трансплантации). Вопрос о выборе терапии у больных с классической формой ПНГ и тромботическими осложнениями в анамнезе остается открытым: согласно некоторым исследованиям, таким пациентам ТКМ не может быть рекомендована в качестве основного метода терапии в связи с высоким риском осложнений и смерти [6, 33]. У этих больных лечение экулизумабом может стать терапией выбора.
Трансплантация костного мозга. Появление экулизумаба существенно повлияло на терапию ПНГ. Тем не менее аллогенная ТКМ остается единственным радикальным методом, позволяющим добиться излечения при данном заболевании. В связи с этим у детей ТКМ проводят в рамках стандартных показаний при аплазии кроветворения (АА/ПНГ и АА/сПНГ) и в редких случаях клональной трансформации ПНГ в МДС/острый лейкоз. ТКМ может быть разумной альтернативой для пациентов, не отвечающих на терапию экулизумабом [10], или при тяжелой форме панцитопении, вызванной сопутствующей недостаточностью костного мозга.
Российский опыт. На заседании Национального гематологического общества 14 февраля 2014 г. представлены и одобрены клинические рекомендации по диагностике и лечению ПНГ [1]. Они включают методы и критерии диагностики ПНГ, показания для скрининга и оптимальную терапевтическую тактику, предполагающую применение таргетного препарата экулизумаб, ТКМ и симптоматической терапии. В целом российские рекомендации не отличаются от международных подходов к диагностике и лечению ПНГ.
ЗАКЛЮЧЕНИЕ
Пароксизмальная ночная гемоглобинурия (ПНГ) — редкое заболевание, для изучения механизмов развития которого потребовались объединенные знания таких областей, как биохимия, молекулярная биология и генетика. Сведения об участии системы комплемента в развитии заболевания позволили создать препарат экулизумаб, существенно изменивший естественное течение болезни. В то же время анализ результатов терапии экулизумабом приводит к более глубокому пониманию патофизиологии ПНГ и, что еще важнее, к разработке новых подходов, направленных на ингибирование компонентов комплемента. Так, в редких случаях при терапии экулизумабом у пациентов с ПНГ развивается C3-опосредованный внесосудистый гемолиз [15, 36]; соответственно, в настоящее время проводятся разработка и доклинические исследования новых агентов, действующих на уровне C3-компонента комплемента [34, 37, 42]. Кроме того, на терапевтический ответ при использовании экулизумаба могут влиять различные генетические факторы (например, полиморфизм генов, кодирующих C5 и CR1 [29, 33]), в связи с чем нужны дальнейшие фармакогенетические исследования, которые позволят «подстроить» лечение под каждого конкретного пациента.
Одно из современных направлений исследования ПНГ — изучение особенностей болезни в разных подгруппах (в детской популяции, у представителей разных рас). Обнаружено, в частности, что, наряду с существенным сходством клинических проявлений заболевания в детской и взрослой популяциях, ПНГ у детей характеризуется некоторыми особенностями, которые нужно учитывать при установлении диагноза и последующем ведении. Согласно нашим наблюдениям и данным литературы, ПНГ у детей значительно чаще сопровождается синдромом недостаточности костного мозга, чем у взрослых. Тромботические осложнения этого заболевания характеризуются тяжелым течением и достаточно часто регистрируются у детей, что отмечено и в группе пациентов с ПНГ, находившихся на лечении в Федеральном научно-клиническом центре детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева Минздрава России. Своевременная диагностика ПНГ в сочетании с современными терапевтическими походами позволяет значительно снизить риск таких осложнений и улучшить прогноз заболевания.







