Всемирная организация здравоохранения (ВОЗ) и профессиональные педиатрические сообщества рекомендуют первое прикладывание к груди в течение первого часа жизни, исключительно грудное вскармливание в течение первых шести месяцев и продолжение грудного вскармливания до 2 лет[1]1. Грудное молоко является единственным рекомендуемым источником питания для новорожденных из-за его уникального состава, естественного происхождения и идеального соответствия потребностям ребенка в младенчестве.
Помимо макронутриентов, грудное молоко содержит множество биоактивных компонентов, включая олигосахариды грудного молока (ОГМ), которые способствуют адекватному росту, помогают сохранить здоровую микробиоту и иммунную систему ребенка[2–4]. Существует множество преимуществ для здоровья новорожденных, связанных с грудным вскармливанием и грудным молоком. Среди них — меньшая частота диареи, пневмонии, среднего отита, атопического дерматита и синдрома внезапной детской смерти[5–7].
Высказано предположение, что меньшие заболеваемость и смертность детей, находящихся на грудном вскармливании, связаны с составом грудного молока. Взаимосвязь между грудным вскармливанием и здоровьем младенца основана на питательных и биологически активных компонентах грудного молока, включая ОГМ[3, 8, 9]. В начале 1900-х E. Moro и H. Tissier независимо друг от друга обнаружили большее количество бифидобактерий в стуле детей, находившихся на грудном вскармливании, чем у детей, не получавших грудное молоко[10]. Олигосахариды, присутствующие в грудном молоке, действительно стимулировали рост бифидобактерий. В 1950-х годах были опубликованы первые четкие описания структуры наиболее распространенных ОГМ, и стали изучаться их эффекты[11, 12].
ОГМ обеспечивают различные физиологические функции. В этом обзоре будут описаны известные и предполагаемые эффекты ОГМ в иммуномодуляции и профилактике аллергических заболеваний.
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА: СТРОЕНИЕ, ОСНОВНЫЕ ФАКТЫ
На сегодняшний день выявлено, что грудное молоко содержит более 200 олигосахаридов разной структуры, что гораздо больше, чем в молоке любого животного. ОГМ являются третьим по количеству в сухом остатке компонентом грудного молока после лактозы и жиров, при этом известно, что они не обладают значимой питательной ценностью для младенцев[2–4, 13]. ОГМ устойчивы к высоким и низким температурам, поэтому не разрушаются при пастеризации и низкотемпературной сушке[14].
ОГМ не расщепляются ферментами поджелудочной железы и пристеночного пищеварения, а также устойчивы к кислоте желудка. Большинство ОГМ либо метаболизируются кишечной микробиотой младенца, либо выделяются в неизменном виде с калом. При этом 1–2% ОГМ все же всасываются в кишечнике и попадают в кровоток, могут оказывать системные эффекты, выводятся с мочой[8].
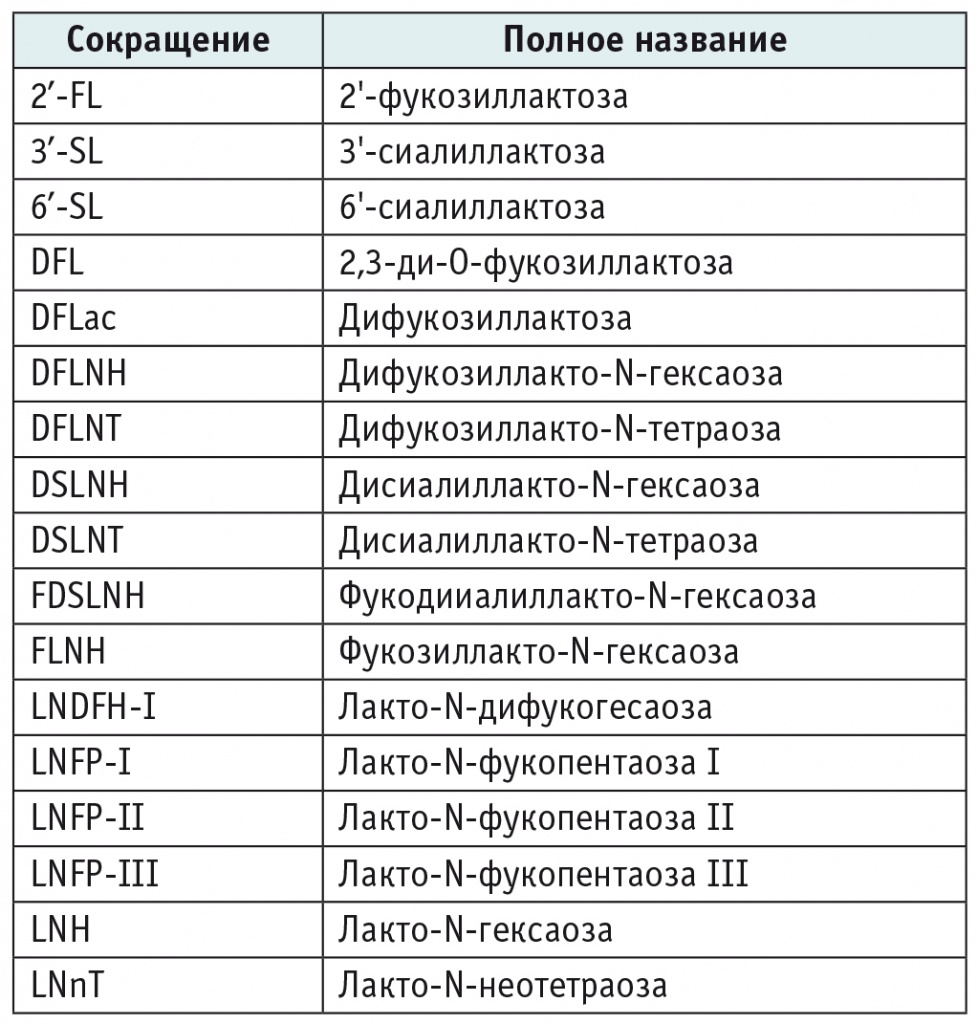
ОГМ представляют собой многофункциональные неконъюгированные и неперевариваемые гликаны. Они состоят из пяти моносахаридных компонентов: галактозы, глюкозы, фукозы, N-ацетилглюкозамина и производного сиаловой кислоты[8, 9]. В таблице 1 представлены общепринятые сокращения названий некоторых ОГМ.
Таблица 1
Общепринятые сокращения названий некоторых олигосахаридов грудного молока
В грудном молоке женщин присутствуют три основные категории ОГМ[4, 8, 9]:
1) нейтральные фукозилированные ОГМ (35–50%), например 2'-фукозиллактоза (2'-FL) и 2,3-ди-O-фукозиллактоза (DFL);
2) кислые сиализированные ОГМ (12–14%), например 3'-сиалиллактоза (3'-SL) и 6'-сиалиллактоза (6'-SL);
3) нейтральные нефукозилированные ОГМ (42–55%), например лакто-N-неотетраоза (LNnT), лакто-N-гексаоза (LNH).
Содержание ОГМ колеблется от 20–25 г/л (в среднем 9–22 г/л) в молозиве до 10–15 г/л (в среднем 8–19 г/л) в зрелом молоке и 4–6 г/л после 6 месяцев лактации[9].
Индивидуальные концентрации ОГМ варьируют у разных женщин в зависимости от генетически детерминированного секреторного статуса и группы крови по Льюису, расы, географического региона, этнической принадлежности, условий окружающей среды, времени года, диеты женщины, физиологического статуса, гестационного возраста ребенка и способа родоразрешения[2, 3, 8, 9, 15–17]. У женщин секреторного типа (70–80% всех женщин) 2'-FL является доминирующим олигосахаридом, его концентрация сохраняется на уровне около 1 г/л и через год лактации[16]. При этом содержание многих других ОГМ снижается в течение лактации. Однако концентрации некоторых ОГМ, включая 3'-SL, 3'-FL и DSLNT, увеличиваются в течение первых месяцев грудного вскармливания и даже после 1 года лактации[2, 15, 17].
Хотя неизвестно, имеют ли эти вариации уровней ОГМ клиническое значение, стабильность или рост содержания некоторых ОГМ во время лактации предполагает, что они могут обладать важной биологической активностью[15].
В итоге состав ОГМ зависит от многих переменных. Однако, за исключением секреторного статуса матери, мало доказательств того, что эти составляющие имеют клиническую значимость.
БИОЛОГИЧЕСКАЯ РОЛЬ ОЛИГОСАХАРИДОВ ГРУДНОГО МОЛОКА
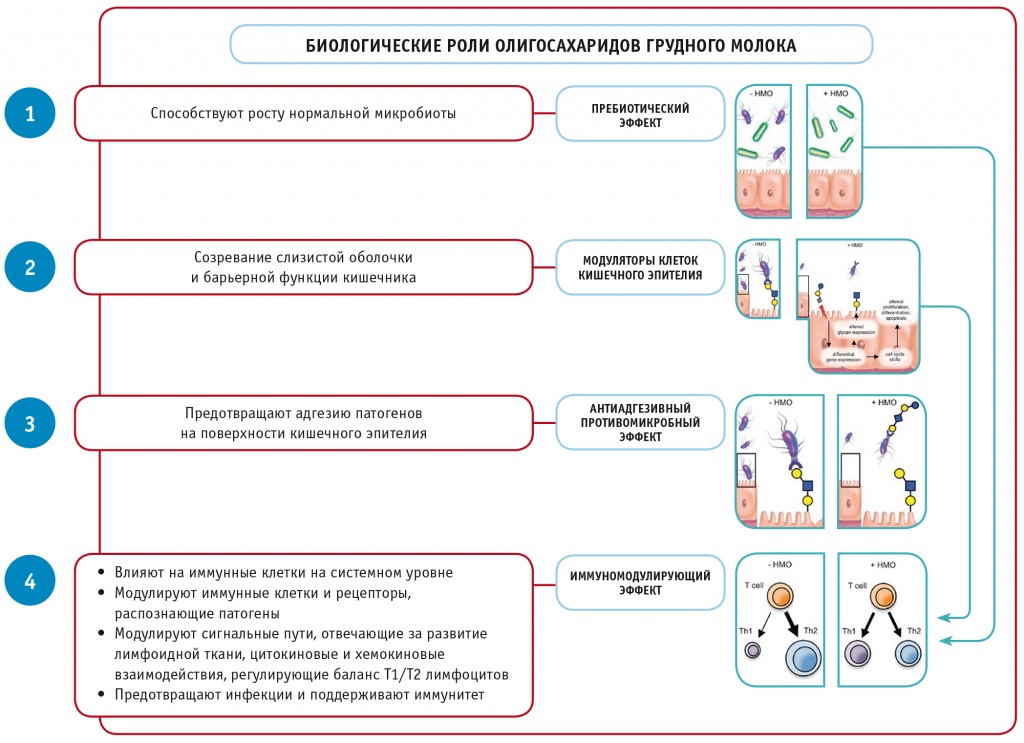
На данный момент известно, что ОГМ оказывают множественное положительное воздействие на младенцев, находящихся на грудном вскармливании (рис.)[9].
-
В качестве пребиотиков ОГМ являются метаболическими субстратами для полезных бактерий, обеспечивая им преимущество в росте по сравнению с потенциальными патогенами.
-
В качестве антиадгезивных противомикробных компонентов они действуют как ловушки растворимых гликановых рецепторов, предотвращая контакт патогена со слизистой оболочкой кишечника.
-
Непосредственно воздействуют на эпителиальные клетки кишечника и модулируют экспрессию их генов, что приводит к модификациям гликанов клеточной поверхности и другим клеточным реакциям.
-
Модулируют выработку цитокинов лимфоцитами, увеличивая вероятность более сбалансированного ответа Th1/Th2.
-
Уменьшают вероятность воспалительной инфильтрации и активации лейкоцитов в слизистой оболочке за счет снижения интенсивности селектин-опосредованных взаимодействий между иммунными клетками и роллинга лейкоцитов на активированных эндотелиальных клетках.
Рис. Биологическая роль олигосахаридов грудного молока (адаптировано из[9])
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА КАК ПРЕБИОТИКИ
Поскольку у младенцев отсутствуют гликозид-гидролазы, большинство ОГМ достигают толстой кишки непереваренными и уже там утилизируются определенными бактериями, что и влияет в итоге на состав микробиоты кишечника[18]. Бифидобактерии в толстой кишке как раз экспрессируют гликозид-гидролазы, что позволяет им утилизировать ОГМ[18]. Как следствие, у младенцев, находящихся на грудном вскармливании, бифидобактерии могут доминантно колонизировать желудочно-кишечный тракт к третьему месяцу жизни[19].
Определенные виды бифидобактерий могут участвовать в иммунных реакциях. Например, ОГМ, индуцируя рост в кишечнике младенцев Bifidobacterium infantis, которые отвечают за выработку пептидов, нормализующих кишечную проницаемость, играют свою роль в улучшении функции эпителиального барьера[19, 20].
В исследованиях сообщается о высокоизбирательном пребиотическом эффекте ОГМ в формировании нормальной микробиоты кишечника в первые недели жизни за счет сокращения фекальной популяции бактерий, не потребляющих ОГМ (Enterobacteriaceae и Staphylococcaceae), и повышения популяции бактерий, их потребляющих (Bacteroidaceae и Bifidobacteriaceae)[19].
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА КАК МОДУЛЯТОРЫ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК КИШЕЧНИКА
ОГМ, взаимодействуя с гликанами на поверхности эпителиальных или дендритных клеток (ДК), способствуют функциональному созреванию стенки кишечника и целостности барьера за счет увеличения роста различных штаммов бифидобактерий[21].
ОГМ также могут воздействовать на рецепторы иммунных клеток. Например, галектины — гликан-связывающие белки — регулируют внутриклеточную передачу сигналов, межклеточную коммуникацию, пролиферацию и апоптоз[22]. ОГМ могут быть лигандами для галектинов, участвуя таким образом в иммунных реакциях. С помощью схожего механизма ОГМ могут действовать локально или системно на рецепторы лимфоидных клеток, ассоциированных со слизистой оболочкой кишечника[9].
Фактически ОГМ способны напрямую изменять экспрессию генов эпителиальных клеток и способность связывания определенных патогенов с клеточной поверхностью посредством изменения экспрессии гликанов клеточной поверхности.
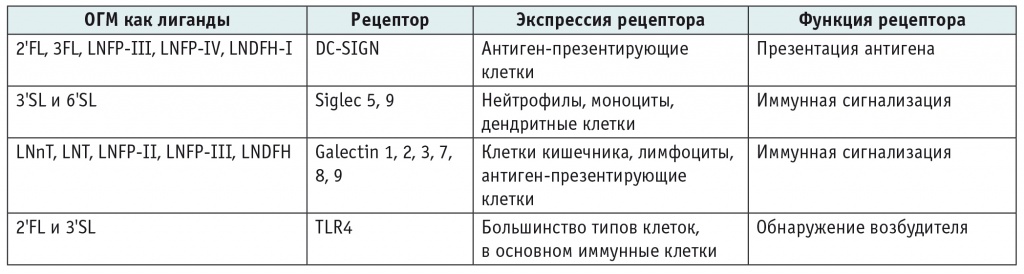
В таблице 2 представлены рецепторы, находящиеся на поверхности различных иммунных клеток, которые могут взаимодействовать с определенными ОГМ как с лигандами, что влияет в итоге на ход иммунных реакций.
Таблица 2
Рецепторы, связывающие олигосахариды грудного молока (ОГМ), потенциально участвующие в иммуномодуляции (адаптировано из[23])
ОГМ также могут изменять ферментативную активность микробиоты кишечника, способствуя выработке короткоцепочечных жирных кислот (КЖК). КЖК являются важными источниками энергии для энтероцитов и ключевыми сигнальными молекулами для поддержания здоровья кишечника. Определенные виды бифидобактерий, такие как B. infantis, B. bifidum и B. breve, утилизируя ОГМ, вырабатывают КЖК, которые способны стимулировать высвобождение муцина и созревание эпителиальных клеток кишечника[24–26].
Эти функции очень важны в раннем неонатальном периоде, так как здоровье кишечника и барьерная функция — первая линия защиты врожденного иммунитета.
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА КАК ПРОТИВОМИКРОБНЫЕ И ПРОТИВОВИРУСНЫЕ АГЕНТЫ
ОГМ имитируют гликаны на поверхности клеток эпителия кишечника, которые распознаются патогенами как поверхностные рецепторы (вирусов, бактерий, токсинов). В результате такого свойства ОГМ в просвете кишечника срабатывают как ловушки патогенов, предотвращая их адгезию к клеткам эпителия и образование биопленок за счет конкурентного взаимодействия[21, 27, 28].
Помимо действия в качестве рецепторов-ловушек и блокирования адгезии вирусных патогенов к эпителиальным клеткам, ОГМ могут также косвенно предотвращать адгезию вирусов путем связывания с эпителиальной поверхностью, вызывая структурные изменения в рецепторе[21, 28].
Кроме того, ОГМ поддерживают колонизационную резистентность, так как патогены практически не используют ОГМ как питательный субстрат, в отличие от представителей нормальной кишечной микробиоты (например, бифидобактерий), что также подавляет рост возбудителей инфекции[10].
Примечательно, что, помимо действия в качестве пребиотиков, ОГМ обладают бактериостатическими и антимикробными свойствами[29]. Сообщалось, что ОГМ ингибируют колонизацию Campylobacter и обеспечивают защиту от пневмококковой пневмонии в исследованиях на животных[30, 31]. Исследования у младенцев показали, что ОГМ обеспечивают защиту от инфекционной диареи, некротизирующего энтероколита и могут напрямую ингибировать рост стрептококков группы B — основной причины инвазивной бактериальной инфекции у новорожденных[32–34]. Следовательно, профилактическое и терапевтическое влияния ОГМ, возможно, особенно важны у младенцев с высоким риском инфекции[20].
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА КАК ИММУНОМОДУЛЯТОРЫ И ПОТЕНЦИАЛЬНЫЕ ИНДУКТОРЫ СОЗРЕВАНИЯ ИММУННОЙ ФУНКЦИИ
Кишечный барьер включает слой слизи, эпителий, пристеночную микробиоту и иммунные клетки. При этом иммунные реакции у новорожденных являются незрелыми, поскольку основаны в первую очередь на Th2, а не на Th1-иммунном ответе, и у них наблюдается относительное отсутствие иммунологической памяти[35].
ОГМ влияют на экспрессию нескольких цитокинов, хемокинов и рецепторов клеточной поверхности, включая молекулы межклеточной адгезии, рецепторы интерферона и некоторых интерлейкинов (ИЛ). Таким образом, ОГМ могут модулировать внутреннюю экспрессию воспалительных маркеров, связанных с миграцией клеток, сигнальных путей, лимфоидной тканью, а также сетей цитокинов и хемокинов, ответственных за баланс лимфоцитов Th1/Th2. В итоге эти механизмы обеспечивают иммунное созревание за счет развития сбалансированного и эффективного иммунного ответа и, следовательно, меньшего риска инфекций и аллергических заболеваний[20, 21, 36].
Считается, что ОГМ нацелены на экспрессию рецепторов, участвующих в распознавании патогенов, таких как toll-подобные рецепторы (TLR), для взаимодействия с ДК в непосредственной близости от кишечного эпителиального барьера, что приводит к дифференцировке Т-клеток,
Т/В-клеточному взаимодействию и системным эффектам при взаимодействии нейтрофилов, лимфоцитов и моноцитов с эндотелиальными клетками, а это влияет на популяции иммунных клеток и секрецию цитокинов[20, 21, 36].
ДК играют ключевую роль в регуляции и развитии врожденных и адаптивных иммунных реакций при инфекциях и воспалительных заболеваниях, а субпопуляция так называемых толерогенных ДК приводит к снижению продукции воспалительных цитокинов (например, ИЛ-4, ИЛ-12, ИЛ-6 и фактора некроза опухоли α), но повышает продукцию регуляторных цитокинов (например, TGF-β, ИЛ-10 и ИЛ-27)[36].
Соответственно, ОГМ играют роль в созревании иммунной системы младенцев как на уровне кишечного барьера посредством воздействия на микробиоту, экспрессию генов и созревание эпителиальных клеток кишечника, так и путем оказания прямого иммуномодулирующего влияния после всасывания в системный кровоток.
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА И АЛЛЕРГИЯ
Значение грудного молока и его компонентов в отношении риска развития аллергических заболеваний неоднозначно[37], возможно, отчасти из-за большой изменчивости состава грудного молока. Как упоминалось ранее, состав ОГМ в грудном молоке сильно варьирует и оказывает значительное влияние на развитие микробиома новорожденного, что само по себе связано с развитием толерантности, сенсибилизации и аллергических проявлений[38, 39].
В ряде исследований изучалась возможная связь между составом ОГМ и аллергическими проявлениями у младенцев, находящихся на грудном вскармливании.
В финской когорте (n = 266) у детей с семейным риском развития аллергии, рожденных путем кесарева сечения, при грудном вскармливании матерями с несекреторным статусом раньше возникала IgЕ-ассоциированная экзема, чем у детей, которых кормили матери секреторного типа[40]. У младенцев, которых вскармливали грудным молоком матери с несекреторным статусом, также наблюдалась более выраженная задержка в формировании микробиома с преобладанием бифидобактерий в возрасте 3 месяцев, чем у детей, которых кормили грудным молоком матери секреторного типа[41].
Как определено в недавнем систематическом обзоре, данные наблюдений показывают, что более низкая численность бифидобактерий в младенчестве связана с более высоким риском экземы, особенно у младенцев с семейным анамнезом атопии[42]. Однако основные механизмы и отдельные виды бифидобактерий, вовлеченные в процесс, остаются неизвестными.
Небольшое исследование типа «случай — контроль» с участием 20 пар «мать — младенец» в Швеции не выявило связи между концентрациями девяти нейтральных ОГМ и риском развития аллергических заболеваний в возрасте до 18 месяцев[43]. В другом исследовании типа «случай — контроль» обнаружено, что содержание некоторых отдельных ОГМ (LNFP III, LNFP I, 6'-SL, DSLNT) было ниже в грудном молоке матерей младенцев с аллергией к белкам коровьего молока (АБКМ), чем у матерей младенцев без аллергии[44]. Не только 6'-SL, но и 2'-FL, в отличие от лактозы, обеспечивали некоторую защиту от развития пищевой аллергии на овальбумин на мышиной модели пищевой аллергии[45].
Механизм этого эффекта, вероятно, частично связан со стабилизацией тучных клеток, которая приводит к меньшему высвобождению гистамина. Для понимания механизма иммуномодулирующих функций LNFP-III нужны дальнейшие исследования[46].
Другое крупное клиническое обсервационное исследование (421 пара «мать — младенец») не выявило какой-либо связи между отдельными ОГМ и пищевой сенсибилизацией[47]. Вместо этого обнаружено, что из 19 измеренных ОГМ с более низким риском пищевой сенсибилизации ассоциировался определенный профиль. Он может характеризоваться относительно более высокими концентрациями FDSLNH, LNFP-II, LNnT, LNFP-I, LSTc и FLNH и относительно более низкими концентрациями LNH, LNT, 2'-FL и DSLNH.
Аналогичным образом, в другой когорте новорожденных (n = 285) с риском аллергии определенные профили ОГМ оказались связаны с аллергией до 18-летнего возраста[48]. Хотя подход к классификации ОГМ по профилям является многообещающим и заслуживает распространения на другие компоненты грудного молока, его интерпретация может быть сложной.
В отношении влияния ОГМ на риски и механизмы развития аллергии у детей остается много вопросов. По мнению экспертов, чтобы понять, модулируют ли ОГМ риск сенсибилизации и аллергии у детей, находящихся на грудном вскармливании, и каким образом, необходимы крупные хорошо контролируемые когортные исследования, учитывающие в том числе секреторный статус матерей, концентрации других биоактивных компонентов грудного молока как значимых факторов, влияющих на исход исследований. Развивающийся кишечный микробиом также может сильно воздействовать на ожидаемые функции ОГМ, поэтому его изучение должно быть частью таких исследований[2].
ОЛИГОСАХАРИДЫ ГРУДНОГО МОЛОКА В СОСТАВЕ ЛЕЧЕБНЫХ СМЕСЕЙ ДЛЯ ИСКУССТВЕННОГО ВСКАРМЛИВАНИЯ ДЕТЕЙ С АЛЛЕРГИЕЙ К БЕЛКАМ КОРОВЬЕГО МОЛОКА
Лечение младенцев с диагнозом АБКМ, которые по каким-то причинам не получают грудное вскармливание, состоит в исключении из их рациона белков коровьего молока и назначении в качестве питания лечебных смесей на основе высоко гидролизованного белка или аминокислот[49]. В более ранних исследованиях среди детей без подозрения на пищевую аллергию добавление в смеси олигосахаридов, полученных путем бактериального синтеза, идентичных по строению натуральным ОГМ (в первую очередь 2'-FL и LNnT), не оказало негативное влияние на их переносимость и на физическое развитие детей по сравнению с таковым у аналогичных смесей без добавления ОГМ.
Кроме того, отмечено положительное действие смесей с ОГМ на состав кишечной микробиоты в виде приближения видового разнообразия к таковому у младенцев на грудном вскармливании. Наблюдалось и снижение частоты и тяжести течения респираторных инфекций у младенцев, получавших смесь с добавлением 2'-FL и LNnT, по сравнению с таковыми у детей, получавших аналогичную смесь без ОГМ[50].
В последние несколько лет опубликованы новые данные клинических исследований лечебных смесей на основе высоко гидролизованного белка и аминокислот с добавлением двух ОГМ (2'-FL и LNnT) у детей с АБКМ[51–53].
Данные первого исследования гипоаллергенности смеси на основе высоко гидролизованного белка с добавлением двух ОГМ (2'-FL и LNnT) при АБКМ, проведенного А. Nowak-Wegrzyn и соавт., подтвердили сохраняющуюся гипоаллергенность новой смеси[51]. Были некоторые опасения, что добавление к лечебным смесям компонентов, сырьем для получения которых является коровье молоко, может негативно повлиять на лечебные свойства смеси. Однако лабораторный анализ промышленных партий 2'-FL и LNnT не выявил наличие остаточных молочных аллергенов, несмотря на тот факт, что ОГМ производятся путем биоферментации из лактозы, что теоретически может нести риск контаминации остаточными молочными аллергенами. Фактически, поскольку высокоочищенная лактоза является еще одним субстратом, модифицирующим микробиом, авторы выдвинули гипотезу о том, что одновременное присутствие лактозы и ОГМ в гидролизованной смеси может оказывать благотворное синергетическое воздействие на младенцев с АБКМ — на развитие кишечного микробиома и иммунной системы[51].
В двойном слепом рандомизированном многоцентровом интервенционном исследовании двух параллельных групп на искусственном вскармливании Y. Vandenplas и соавт. оценивали, поддерживает ли лечебная смесь Alfare’ Gastro (Nestle’ Health Science) на основе высоко гидролизованного белка с добавлением двух ОГМ (2’-FL и LNnT) и пониженным содержанием белка (2,20 г/100 ккал) нормальный рост у младенцев с АБКМ[52]. Вторичными результатами стали желудочно-кишечная переносимость, безопасность и влияние на инфекции.
В исследование включены дети с АБКМ в возрасте 0–6 месяцев, не находившиеся на грудном вскармливании. Массу тела, длину и окружность головы измеряли ежемесячно в течение 4 месяцев (первичная конечная точка исследования), через 6 месяцев и в возрасте 12 месяцев. Из 200 обследованных младенцев были рандомизированы 194 ребенка (средний возраст — 3,2 месяца). При последующем наблюдении через 4 месяца ежедневный прирост массы тела в группе тестируемой смеси не уступал таковому в группе контрольной смеси. Значимые межгрупповые различия по антропометрическим параметрам отсутствовали. Обе смеси были безопасны и хорошо переносились.
Динамика симптомов пищевой аллергии на фоне лечения обеими смесями оценивалась с помощью инструмента CoMiSS. В целом не было никаких существенных групповых различий по показателям опросника CoMiSS ни в один из моментов исследования. В обеих группах показатели по шкале CoMiSS значительно снизились — среднем на 6 баллов. У детей, получавших смесь с ОГМ, статистически значимо уменьшилась частота инфекций верхних дыхательных путей, и они реже болели ушными инфекциями через 12 месяцев наблюдения. Относительный риск инфекций нижних дыхательных путей и желудочно-кишечного тракта снизился на 30–40%, но этот результат не был статистически значимым из-за ограниченного размера выборки.
Таким образом, смеси Alfare’ (Nestle’ Health Science) на основе высоко гидролизованного белка с добавлением двух ОГМ поддерживают нормальный рост у детей с АБКМ раннего возраста и предполагает защитный эффект от респираторных инфекций и отитов в течение первого года жизни, при этом сохраняется лечебное действие на основные симптомы АБКМ[52].
В открытом нерандомизированном многоцентровом исследовании M.S. Gold и соавт. оценивали, поддерживает ли лечебная смесь Alfare’ Amino (Nestle’ Health Science) на основе аминокислот, дополненная двумя ОГМ (2’-FL и LNnT), нормальный рост и хорошо ли она переносится младенцами с АБКМ[53]. В исследование включены доношенные дети в возрасте от 1 до 8 месяцев со среднетяжелой и тяжелой формами АБКМ. Дети получали исследуемую смесь в течение 4 месяцев, и их матерям предлагалось использовать ее до достижения детьми 12 месяцев. Переносимость и безопасность оценивались на протяжении всего исследования.
Из 32 младенцев (средний возраст — 18,6 недели, 20 (62,5%) мальчиков) 29 завершили исследование. В течение основного периода средний показатель массы тела к возрасту Z увеличился с –0,31 в начале исследования до +0,28 в течение 4-месячного наблюдения. Линейный рост и рост головы также происходили в соответствии с эталонным ростом детей ВОЗ с аналогичной небольшой тенденцией к повышению. Смесь хорошо переносилась и имела отличный профиль безопасности.
Исходные симптомы значительно уменьшились после 1 месяца лечения смесями Alfare’ (Nestle’ Health Science).
-
Доли младенцев с частыми или постоянными плачем и беспокойством снизились на 79,9 и 88,4% соответственно (p = 0,009), доля детей с частыми или стойкими срыгиваниями — на 51,7% (p = 0,039), а со рвотой — на 90,8% (p = 0,0013).
-
Распространенность значительных затруднений при кормлении через 1 месяц лечения уменьшилась на 87,7% (p = 0,010), а распространенность частых или постоянных кожных изменений — с 25 до 6,9% (p = 0,059).
-
При сравнении исходного микробиома с таковым при последующих посещениях отмечено значительное обогащение ОГМ-утилизирующими бифидобактериями во время лечения, что, в свою очередь, связано с выраженным увеличением содержания КЖК в кале.
-
Также наблюдалось существенное снижение количества фекальных протеобактерий, и это свидетельствует, что экспериментальная смесь с добавлением ОГМ частично корректировала микробный дисбиоз кишечника у младенцев с АБКМ[53].
ЗАКЛЮЧЕНИЕ
ОГМ вносят значительный вклад в положительное влияние грудного молока на ребенка — в обеспечение здоровой микробной колонизации кишечника, подавления процессов воспаления, иммунной защиты и созревания кишечного барьера. В настоящее время ОГМ считаются одними из наиболее важных биоактивных компонентов грудного молока, поскольку они действуют как антимикробные и противовирусные средства, как модуляторы эпителиальных клеток кишечника, в качестве специфических пребиотиков и эффекторов кишечной микробиоты и в качестве иммуномодуляторов.
Снижение кишечного микробного разнообразия в раннем возрасте, а также смещение иммунного ответа в сторону Th2-реакций считаются факторами риска иммунных заболеваний, в том числе аллергии в раннем возрасте. Ввиду выраженного влияния ОГМ на развитие здоровой микробиоты кишечника, непрямых (ловушки патогенов, пребиотический эффект, стимулирующее действие на продукцию КЖК и толерогенных ДК) и прямых противовоспалительных и иммуномодулирующих функций, которые способствуют сдвигу T-клеточных реакций на более сбалансированную продукцию Th1/Th2-цитокинов, предполагаемая связь между ОГМ и профилактикой аллергии в первую очередь основана на воздействии ОГМ на микробиоту кишечника, барьер слизистой оболочки кишечника и иммуномодуляцию.
Очень важно накопление данных о безопасности и переносимости лечебных смесей с добавлением ОГМ, так как получены многообещающие начальные сведения об их эффектах в лечении детей с АБКМ. Тем не менее требуется дополнительное изучение воздействия отдельных ОГМ и их комбинаций на четко определенные клинические и иммунные исходы, включая развитие толерантности и лечебный потенциал при АБКМ.
Поступила: 22.04.2023
Принята к публикации: 22.05.2023
________
1 WHO. Infant and young child feeding. 2021. URL: https://www.who.int/news-room/fact-sheets/detail/infant-and-young-child-feeding (дата обращения — 15.04.2023).







