ВВЕДЕНИЕ
Синдромы преждевременного старения — это группа редких (орфанных) наследственных заболеваний, характеризующихся различными молекулярно-клеточными изменениями, приводящими к ускоренному старению организма. К этой группе заболеваний относятся неонатальный прогероидный синдром (синдром Видемана–Раутенштрауха), прогероидные ламинопатии, RecQ-ассоциированные прогероидные синдромы, сегментарные прогероидные синдромы, связанные с нарушением репарации ДНК и др. (табл. 1)[1, 2].
Таблица 1. Синдромы преждевременного старения[1, 2]
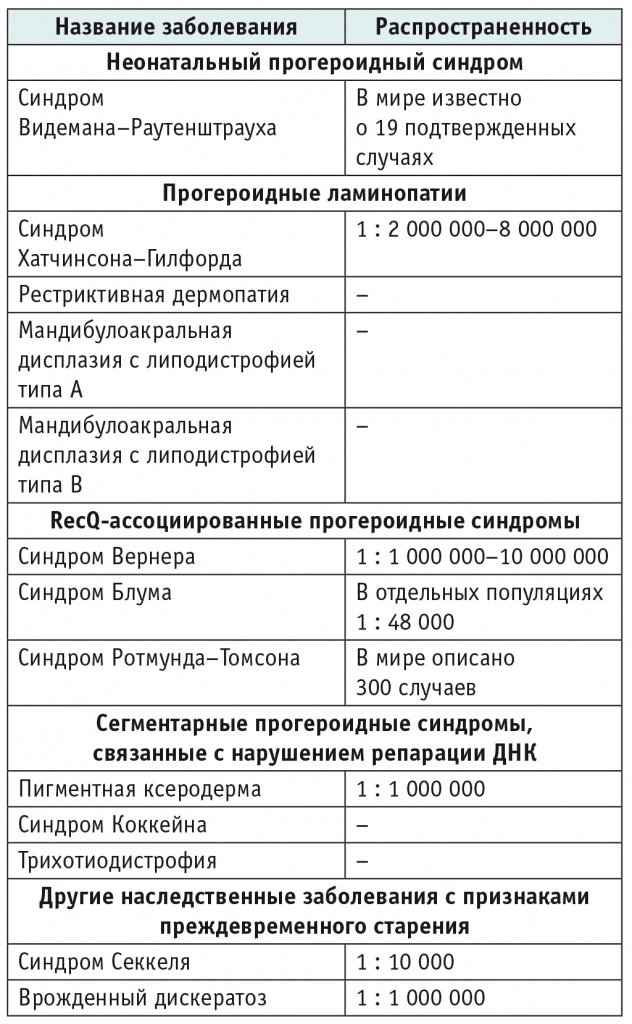
Большинство пациентов с синдромами преждевременного старения имеют врожденные или приобретенные прогероидные черты лица (клювовидный нос, микрогнатия верхней и/или нижней челюсти, преобладание мозгового отдела черепа над лицевым, низко посаженные уши и т.д.), генерализованную или парциальную липодистрофию, а также, в зависимости от заболевания, патологии сердечно-сосудистой, нервной, бронхолегочной, желудочно-кишечной, костно-мышечной, суставной и других систем организма[1].
Одним из самых редких в данной группе заболеваний является синдром Видемана–Раутенштрауха (неонатальный прогероидный синдром), клинические признаки которого очевидны с первых дней жизни. Это ультраорфанное заболевание с аутосомно-рецессивным типом наследования, ассоциированное с мутацией в гене POLR3A, характеризуется врожденной липодистрофией и преждевременным старением[3–7].
История изучения заболевания начинается с момента описания T. Rautenstrauch в 1977 г. двух сестер, рожденных с липодистрофией и прогероидными чертами лица[8]. Спустя 2 года H.R. Wiedemann описал 2 неродственных мальчиков, родившихся с прогероидными чертами лица и множественными пороками развития. Учитывая клинические характеристики, проявляющиеся при рождении и указывающие на заболевание, эти врачи в 1979 г. обозначили его как неонатальный прогероидный синдром и предположили, что синдром носит аутосомно-рецессивный тип наследования[8–10].
В настоящее время в литературе описано около 50 пациентов с фенотипом синдрома Видемана–Раутенштрауха, однако только у 19 пациентов диагноз является окончательно подтвержденным. Частота заболевания на сегодняшний день неизвестна[11].
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Доказано, что при синдроме Видемана–Раутенштрауха отсутствуют хромосомные нарушения, а заболевание возникает в результате биаллельных мутаций преимущественно в гене POLR3A. В последние годы появляется все больше сообщений о биаллельных мутациях в генах POLR3B и POLR3GL, также вызывающих развитие этого заболевания. Все перечисленные гены кодируют РНК-полимеразу III[5, 12–14].
РНК-полимераза III представляет собой ДНК-направленную РНК-полимеразу и осуществляет транскрипцию генов, кодирующих малые РНК (рибосомальная 5S РНК, тРНК, U6 малая ядерная РНК и митохондриальная РНК-процессинговая РНК), которые необходимы для роста клеток и регуляции клеточного цикла, а также регуляции транскрипции, процессинга и трансляции РНК[12–16].
Известно, что пептиды, кодируемые POLR3B и POLR3A, образуют совместный каталитический центр РНК-полимеразы III, кодируя самую большую (RPC1) и вторую по величине (RPC2) субъединицы РНК-полимеразы III, которые необходимы для транскрипции множества не кодирующих белки РНК[17–19].
В 2019 г. E. Beauregard-Lacroix и соавт. впервые сообщили о неонатальном прогероидном синдроме у девочки с гомозиготной мутацией в гене POLR3GL, приводящей к формированию стоп-кодона. Оба родителя были гетерозиготны по этому варианту. Фенотипически и по тяжести состояния девочка не имела отличий от пациентов с мутацией в POLR3A. Диагноз был подтвержден секвенированием по Сэнгеру с использованием стандартных методов. Ранее мутации в гене POLR3GL были описаны у пациентов с эндостальным гиперостозом и олигодонтией[24, 25].
По данным литературы, в настоящее время также известно, что мутации в генах POLR3A и POLR3B, помимо неонатального прогероидного синдрома, ассоциированы также с неврологическими расстройствами. К ним относятся синдром лейкодистрофии «4h» (гипомиелинизация, гипогонадотропный гипогонадизм и гиподонтия), прогрессирующая спастическая атаксия у подростков, протекающая как изолированно, так и в сочетании с эстрапирамидными симптомами[18–22].
Примечательно, что в литературе присутствует описание пациентов с синдромом Видемана–Раутенштрауха, сопровождающимся похожей неврологической симптоматикой. Так, J. Ulrich и соавт. описали пациента с подтвержденным молекулярно-генетическими методами исследования неонатальным прогероидным синдромом и врожденным полным отсутствием зрелого миелина нервных волокон. J.J. Martin и соавт. продемонстрировали пациентку 5,5 лет с обширной демиелинизацией и большим количеством нейтральных жиров и промежуточных остатков распада миелина в макрофагах. Также присутствует сообщения о пациентах с атаксией, дисметрией, нистагмом, умственной отсталостью разной степени тяжести, диффузной кортикальной дисфункцией, вентрикуломегалией, атрофией головного мозга, замедленной миелинизацией, арахноидальными кистами, кальцификацией базальных ганглиев[26–28].
Однако стоит отметить, что неврологические состояния чаще всего связаны как с гетерозиготными, так и с гомозиготными мутациями в POLR3A и POLR3B, в то время как неонатальный прогероидный синдром, по данным литературы, проявляется только при биаллельной мутации с потерей функции[15, 20, 23].
В большинстве случаев POLR3-ассоциированные заболевания манифестируют в раннем детском возрасте. Однако D. Lessel и соавт. описали 37-летнюю женщину с гомозиготной мутацией c.3336G>A в POLR3A с фенотипом синдрома Видемана–Раутенштрауха и тяжелой неврологической симптоматикой (спастической квадриплегией)[21].
КЛИНИКО-ДИАГНОСТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Пренатальный период
Диагностика синдрома Видемана–Раутенштрауха возможна еще в пренатальном периоде. Так, G. Castiñeyra и соавт. выделили ультразвуковые характеристики развития плода с неонатальным прогероидным синдромом: тяжелая задержка темпов роста, особенно выраженное отставание бипариетального (расстояние от одной височной области до другой) и брюшного размеров, маловодие. Авторы обращают внимание на то, что до 16–18-й недели гестации никаких особенностей развития плода по данным УЗИ не отмечалось, а замедление скорости роста стало прогрессировать с 18–20-й недели[29]. Во всех описаниях клинических случаев отмечается выраженная задержка внутриутробного развития с последующей плохой прибавкой в росте и весе в постнатальном периоде[30–33].
Постнатальный период
При рождении дети имеют ярко выраженные фенотипические особенности: псевдогидроцефалия с широким передним родничком, ярко-выраженными венами скальпа, редкими и тонкими волосами; треугольная форма лица с тонкой, морщинистой и гиперпигментированной кожей (при описании отмечались также пятна цвета «кофе с молоком»), часто пораженной атопическим дерматитом; вдавленная переносица, клювовидный кончик носа, низко посаженные уши и короткая шея; длинные пальцы рук и ног, мышечная гипотония. 100% детей рождаются с генерализованной липодистрофией с единичными локализациями подкожно-жировой клетчатки в грудной, абдоминальной, ягодичной, щечной областях[6, 28, 30–35].
Отличительной особенностью синдрома Видемана–Раутенштрауха является рождение детей с 2–4 неонатальными резцами, однако зубы быстро разрушаются, и дальнейшее прорезывание зубов замедляется или, чаще всего, полностью отсутствует[3].
По мере роста и развития сохраняются тяжелый дефицит веса и прогрессирующая задержка роста, несмотря на высококалорийное питание. По результатам биоимпедансометрии отмечается дефицит жировой и мышечной массы[32–34].
После достижения 1,5–2,0 лет у пациентов наблюдаются контрактуры мелких суставов, после 6–7 лет — контрактуры больших суставов, прогрессирующий кифосколиоз, ранняя тяжелая остеопения и в последующем остеопороз[30].
РЕЗУЛЬТАТЫ ЛАБОРАТОРНЫХ И ИНСТРУМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
При лабораторных исследованиях выявляются крайне низкие уровни инсулиноподобного фактора роста-1, незначительная гиперпролактинемия. Возможны нарушения липидного обмена в сторону относительной гиполипидемии и снижения триглицеридов, но сообщается и о случаях дислипидемии в раннем неонатальном периоде[28, 30, 32]. Несмотря на врожденную генерализованную липодистрофию, метаболические нарушения, связанные с нарушением углеводного обмена, встречаются редко[36].
При рентгенологическом обследовании обычно выявляются отставание костного возраста более чем на 2 года, остеопороз[30].
При неонатальном прогероидном синдроме в единичных случаях у детей отмечались также дефицит гормона роста, врожденный гипотиреоз, врожденная тугоухость, ларингомаляция, врожденная дисплазия тазобедренных суставов, врожденная глаукома, лагофтальм, врожденные пороки сердца, гипоспадия[28, 34, 37, 38].
Еще один интересный аспект лабораторного обследования — изучение теломер. Именно теломерам отводится существенная роль в патогенезе старения. «Золотым стандартом» оценки их длины является измерение терминального рестрикционного фрагмента (ТРФ). Обнаружено, что у пациента с неонатальным прогероидным синдромом длина ТРФ не отличалась от таковой у здоровых детей, а при прогерии Хатчинсона–Гилфорда наблюдается укорочение ТРФ[39, 40].
Прогноз для жизни при синдроме Видемана–Раутенштрауха неблагоприятный. По разным данным, средняя продолжительность жизни пациентов составляет от 7 мес до 2 лет, однако в литературе присутствуют описания пациентов подросткового возраста, а также одного пациента 27 лет[36]. По данным T. Rautenstrauch и соавт., внешний вид с возрастом остается неизменным. Пациенты чаще всего погибают от сепсиса, вызванного аспирационной или бактериальной пневмонией[41].
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА
Дифференциальная диагностика синдрома Видемана–Раутенштрауха имеет принципиальное значение, поскольку пациенты, рожденные с прогероидным фенотипом, нуждаются в особых терапевтических подходах с самого рождения. Более того, ранняя верификация заболевания необходима для прогноза течения заболевания, методов лечения и определения дальнейшей тактики ведения пациента.
Прогерия (синдром Хатчинсона–Гилфорда)
Наиболее часто, по данным зарубежной литературы, дифференциальную диагностику неонатального прогероидного синдрома проводят с синдромом Хатчинсона–Гилфорда (табл. 2). Это редкое генетическое заболевание из группы ламинопатий, ассоциированное с мутацией в гене LMNA, характеризующееся преждевременным старением. Наследуется по аутосомно-доминантному типу[42].
Таблица 2. Дифференциальная диагностика неонатального прогероидного синдрома (синдрома Видемана–Раутенштрауха)[30–36, 42–50]
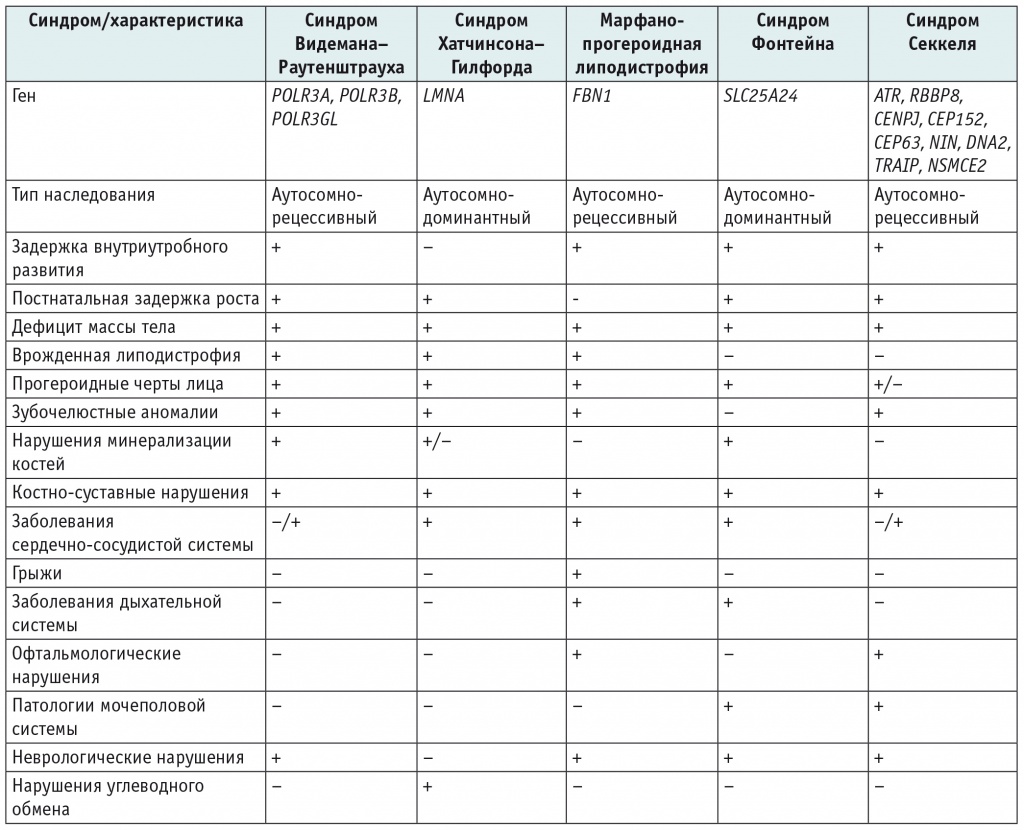
В отличие от неонатального прогероидного синдрома, при прогерии Хатчинсона–Гилфорда отсутствует задержка внутриутробного развития, а при рождении дети имеют нормальные массо-ростовые показатели и фенотип. Первые клинические признаки синдрома отмечаются в возрасте 1,5–2,0 лет и включают тяжелую задержку роста и дефицит массы тела, прогероидные черты лица (преобладание мозгового черепа над лицевым, широкий лоб, клювовидный нос, скученность зубов), генерализованную липодистрофию, универсальную алопецию, склеродермоподобные изменения кожи[43].
При прогерии отмечается прогрессирующее развитие атеросклероза, дислипидемии, гиперхолестеринемии, возможны нарушения углеводного обмена[43, 44].
Средняя продолжительность жизни пациентов с синдромом Хатчинсона–Гилфорда — 13–14 лет, а основными причинами смерти являются нарушения работы сердечно-сосудистой системы, такие как инфаркт и инсульт[44].
Синдром Марфано-прогероидной липодистрофии
У пациентов с синдромом Марфана вследствие мутаций в экзоне 64 гена FBN1, как и при синдроме Видемана–Раутенштрауха, отмечаются задержка внутриутробного развития, врожденная липогипертрофия, прогероидные черты лица (широкий, выступающий лоб (краниосиностоз); тонкая, гиперпигментированная, морщинистая кожа; гипоплазия средней и нижней трети лица, клювовидный нос). Данные пациенты также не имеют метаболических нарушений углеводного обмена. Отличительной особенностью являются частичные проявления синдрома Марфана, такие как ускоренный рост (при тяжелом дефиците веса), расширение корня аорты, пролапс митрального клапана, врожденный вывих хрусталика, близорукость, деформация грудной клетки, диафрагмальные и паховые грыжи (табл. 2)[45, 46].
Учитывая схожие фенотипические признаки, в зарубежной литературе синдром Марфана с мутацией в экзоне 64 гена FBN1 принято обозначать, как синдром Марфано-прогероидной липодистрофии[45, 46].
Прогероидный синдром Фонтейна
Синдром Фонтейна — орфанное аутосомно-доминантное заболевание, вызываемое мутациями в гене SLC25A24. Пациенты характеризуются тяжелой задержкой внутриутробного развития, постнатальной значительной задержкой роста и дефицитом веса. С рождения имеют прогероидные черты лица: треугольное лицо, широкий лоб и маленькая голова с преждевременным закрытием черепных швов, низко посаженные уши, редкие волосы на голове, гипоплазированная средняя и нижняя трети лица, тонкая морщинистая кожа, клювовидный нос, маленький рот; гипоплазия больших половых губ/микропенис и короткие дистальные фаланги пальцев. Как и при синдроме Видемана–Раутенштрауха, типичны врожденные зубные аномалии, проявляющиеся олиго- или микродонтией, и нарушения минерализации костей, с возрастом проявляющиеся тяжелой остеопенией и остеопорозом (табл. 2)[47].
Отличительной особенностью прогероидного синдрома Фонтейна являются генерализованный гипертрихоз лица и тела, тяжелые врожденные пороки развития сердечно-сосудистой и дыхательной систем[47].
В зарубежной литературе также описаны похожие на синдром Фонтейна заболевания: синдром Горлина–Чаудри–Мосса и синдром Фаррио. Однако было доказано, что все они ассоциированы с SLC25A24, из-за чего были объединены в неонатальный синдром Фонтейна. Существует мнение, что синдромы, описанные ранее, вероятнее всего, могут являться более легкими формами этого заболевания[48].
Синдром Секкеля
На наш взгляд, дифференциальную диагностику следует также проводить и с синдромом Секкеля, входящим в группу наследственных заболеваний с признаками преждевременного старения (табл. 2). Это редкое аутосомно-рецессивное заболевание, характеризующееся внутриутробной задержкой роста, микроцефалией и умственной отсталостью. Синдром связан с мутациями генов ATR, RBBP8, CENPJ, CEP152, CEP63, NIN, DNA2, TRAIP и NSMCE2[49].
Фенотип синдрома Секкеля не является прогероидным, однако имеет с ним много схожего: пре- и постнатальная задержка роста, тяжелый дефицит массы тела, микроцефалия с ранним закрытием черепных швов, редкие волосы, клювовидный нос, низко посаженные уши, маленький рот и микрогнатия. У пациентов описаны нарушение зубочелюстной системы (олиго- или микродонтия), расщелина неба, пороки развития скелета (брахидактилия, клинодактилия, сколиоз). В литературе присутствуют единичные описания пороков сердечно-сосудистой, эндокринной, желудочно-кишечной систем[49, 50].
ЛЕЧЕНИЕ
На сегодняшний день при неонатальном прогероидном синдроме возможны только скрининг и коррекция осложнений. Патогенетического лечения не разработано, однако существует перспектива генной терапии данного заболевания.
ЗАКЛЮЧЕНИЕ
Учитывая вариабельность клинических проявлений при неонатальном прогероидном синдроме и трудности дифференциальной диагностики, описание новых клинических случаев и обобщение данных расширяет наши знания о синдромах преждевременного старения и позволяет узнавать новые механизмы старения организма, что является реперной точкой для разработки патогенетической терапии таких ультраорфанных заболеваний, как синдромы преждевременного старения.
Поступила: 06.06.2023
Принята к публикации: 20.06.2023







