ВВЕДЕНИЕ
Ишемическая болезнь сердца (ИБС) по-прежнему остается основной причиной смерти и инвалидности трудоспособного населения во всем мире. По прогнозам Всемирной организации здравоохранения (ВОЗ), к 2030 году число умерших от сердечно-сосудистых заболеваний (ССЗ) составит около 23,6 млн, что свидетельствует о возникновении эпидемии ССЗ в XXI веке. Однако в Российской Федерации, по данным Федеральной службы государственной статистики, с 2000 года зафиксировано снижение смертности от ССЗ. За 2021 год умерли от ССЗ 933 986 человек, что на 30% меньше, чем в 2000 году1.
Подобная положительная тенденция, по мнению специалистов, связана с тем, что все больше граждан проходят медицинские профилактические осмотры, и с эффективностью мероприятий по борьбе с табакокурением и употреблением алкоголя, а также доступностью высокотехнологичной медицинской помощи.
Одним из основных факторов риска развития ССЗ служит сахарный диабет (СД) 2 типа. Ввиду нарушения углеводного и липидного обменов у больных СД 2 типа наблюдаются эндотелиальная дисфункция и прогрессирование атеросклероза сосудов, которые становятся триггерами в развитии ССЗ, в частности ИБС. Известно, что гипергликемия вызывает активацию системного воспалительного ответа, приводящую к увеличению продукции провоспалительных цитокинов, способствующих прогрессированию атеросклероза и дестабилизации бляшек, они привлекают лейкоциты в очаг поражения и нарушают функцию тромбоцитов. Одним из таких ключевых провоспалительных цитокинов является хемокин, экспрессируемый и секретируемый Т-клетками при их активации (RANTES). У больных СД 2 типа RANTES принимает участие в индукции процесса воспаления, имеющего определяющее значение в формировании и последующем разрыве атеросклеротической бляшки[1].
Кроме того, избыточная масса тела, которая часто сопутствует СД 2 типа из-за особенностей метаболических нарушений, также провоцирует развитие хронического воспалительного процесса.
Адипоциты — источник синтеза множества цитокинов и гормонов, в частности лептина. Лептин способствует атерогенезу, участвуя в привлечении моноцитов к очагу повреждения и трансформации их в пенистые клетки, а также стимулируя продукцию провоспалительных и проатерогенных цитокинов, что приводит к повреждению структуры и к дисфункции эндотелиальных клеток, кардиомиоцитов[2].
У пациентов с СД 2 типа чаще встречается многососудистое поражение коронарного русла, требующее выполнения операции коронарного шунтирования (КШ). Известно, что в норме в ответ на оперативное вмешательство развивается острый воспалительный ответ, вырабатываются провоспалительные маркеры острой фазы, главным образом С-реактивный белок (СРБ). СРБ влияет на процессы инициации эндотелиальной дисфункции, активируя макрофаги и увеличивая продукцию молекул клеточной адгезии, что в итоге повышает риск развития сердечно-сосудистых событий.
Помимо этого, при выполнении хирургического вмешательства у пациентов без СД может также развиться стрессовая гипергликемия[3]. С учетом неблагоприятного воздействия гипергликемии на сердечно-сосудистую систему, опосредованного различными патогенетическими механизмами, поиск наиболее эффективного метода управления гликемией в периоперационном периоде КШ чрезвычайно важен.
Непрерывная внутривенная инсулинотерапия служит «золотым стандартом» достижения и поддержания нормогликемии при выполнении кардиохирургических вмешательств, в частности операции КШ. Интересным представляется тот факт, что от способа подачи и дозы инсулина зависит интенсивность продукции адипокинов. Так, согласно результатам нескольких исследований, внутривенное введение инсулина остро стимулирует выработку лептина, а при его внутривенной инфузии в течение 4 часов концентрация лептина увеличивается на 10%[2]. В настоящее время применение систем непрерывного мониторирования глюкозы (НМГ) позволяет проводить более тщательный контроль гликемии и своевременно выявлять гипо- и гипергликемические состояния, а современные технологии помповой системы подачи инсулина помогают эффективно управлять нарушенным гомеостазом глюкозы в периоперационном периоде КШ.
Цель исследования: оценка эффективности периоперационного управления гликемией у больных ИБС и СД 2 типа при использовании систем НМГ и непрерывной подкожной инфузии инсулина (НПИИ) для снижения риска послеоперационных осложнений КШ.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное сравнительное исследование включены 105 больных со стабильной ИБС и многососудистым поражением коронарного русла, имевших показания к КШ, согласно национальным и международным рекомендациям. Операции КШ проводились по двум основным методикам: на работающем сердце с подключением параллельного искусственного кровообращения (ИК) в условиях нормотермии и без применения ИК (Оff-pump coronary artery bypass).
Все пациенты проходили обследование и лечение в отделении неинвазивной аритмологии и хирургического лечения комбинированной патологии Национального медицинского исследовательского центра сердечно-сосудистой хирургии имени А.Н. Бакулева в период с 2016 по 2018 г. (руководитель — академик РАН Е.З. Голухова).
В соответствии с Проектом Федерального закона «О проведении биомедицинских исследований», пункт 5 (действие настоящего Федерального закона не распространяется на биомедицинские исследования, проводимые на изъятых у человека биоматериалах, а также на исследования с использованием персональных данных), получение разрешительных документов этического комитета не потребовалось. При поступлении в Национальный медицинский исследовательский центр сердечно-сосудистой хирургии им. А.Н. Бакулева все пациенты в обязательном порядке подписывали документы правового характера — согласие на госпитализацию, инвазивную диагностическую процедуру, хирургическое вмешательство (все документы хранятся в архиве Центра).
Критериями исключения выбраны СД 1 типа, острый гепатит, острое нарушение мозгового кровообращения (ОНМК) в течение последнего месяца, психические расстройства, острые инфекционные заболевания, злокачественные новообразования, аллергические реакции на йодосодержащие контрастные препараты, кровотечение из желудочно-кишечного тракта в течение последнего месяца.
Больные ИБС были разделены на две группы: в основную группу (n = 52) включены пациенты с ИБС с установленным диагнозом СД 2 типа (стадия компенсации) на основании диагностических критериев СД и других нарушений гликемии (ВОЗ, 1999–2013); в контрольную группу (n = 53) вошли больные ИБС без СД 2 типа и других нарушений гликемии в анамнезе и по данным лабораторных исследований при поступлении в стационар.
Клиническая характеристика больных представлена в таблице.
Таблица. Клинико-инструментальные характеристики больных ишемической болезнью сердца (ИБС), перенесших аортокоронарное шунтирование
Пациенты с ИБС и СД 2 типа были разделены на две подгруппы случайным образом (простая рандомизация): в первой подгруппе (n = 24) коррекция гликемии проводилась посредством НПИИ с учетом данных НМГ; во второй подгруппе (n = 28) осуществлялось внутривенное болюсное введение инсулина короткого действия с учетом значений глюкозы в образцах венозной крови 1 раз в 3 часа; показатели НМГ во внимание не принимались.
Перед выполнением оперативного вмешательства проводили сбор жалоб, анамнеза жизни и заболевания, объективный осмотр пациентов, включавший перкуссию, пальпацию и аускультацию. У всех больных до и после операции выполнены нижеследующие диагностические мероприятия.
1. Клинико-лабораторные исследования: клинический и биохимический анализы крови, в том числе оценка липидного профиля, концентрации гликированного гемоглобина и гормонов щитовидной железы, степени агрегации тромбоцитов; скрининговые клоттинговые тесты. Кроме того, у всех пациентов брали кровь из периферической вены для измерения уровня высокочувствительного СРБ (вч-СРБ) в нескольких временны́х точках (до операции, через час, 12 часов, на 7-е сутки и через год после нее) и определения концентраций лептина, адипонектина, RANTES до операции, на 7-е сутки и через год после КШ. Пробы центрифугировали при комнатной температуре на скорости 3000 об/мин в течение 10 мин. В дальнейшем полученная сыворотка или плазма отделялась и замораживалась при температуре –40 °C. Непосредственно перед выполнением анализа образцы размораживались.
2. Инструментальные исследования: электрокардиография (ЭКГ), холтеровское мониторирование ЭКГ, трансторакальная эхокардиография (ЭхоКГ), ультразвуковое дуплексное сканирование экстракраниальных отделов брахиоцефальных артерий, артерий и вен нижних конечностей, рентгенологическое исследование органов грудной клетки, эзофагогастродуоденоскопия, а также повторная селективная коронарография в случае необходимости.
Особенности предоперационной подготовки больных сахарным диабетом 2 типа
Для оценки риска послеоперационных осложнений и адекватности контроля СД до оперативного вмешательства проанализированы параметры гликемического профиля, в том числе измерен уровень гликированного гемоглобина. Значение менее 7% свидетельствовало о компенсации СД, что было неотъемлемым условием для выполнения КШ. У больных, принимавших пероральные антигипергликемические препараты, бигуаниды отменяли за 48 часов до КШ, препараты сульфонилмочевины — за 24 часа. В случае необходимости пациентов переводили на инсулинотерапию в базисно-болюсном режиме под наблюдением эндокринолога.
Техника контроля и коррекции периоперационной гликемии
У всех пациентов проводился контроль гликемии в течение 72 часов после КШ посредством системы НМГ, интегрированной в инсулиновую помпу MiniMed Paradigm VEO 554/754. Значения гликемии в интерстициальной жидкости регистрировались каждые 5 минут с помощью сенсора (Medtronic Enlite), установленного подкожно в область трапециевидной мышцы вблизи VII шейного позвонка за несколько часов до хирургического вмешательства. Полученные данные через трансмиттер передавались непосредственно на помпу.
В первой подгруппе больных ИБС и СД 2 типа коррекция гликемии осуществлялась посредством НПИИ через помпу с учетом значений НМГ в режиме реального времени. С момента поступления пациента в отделение реанимации проводилась НПИИ в базальном режиме при условии отсутствия гипогликемии, по данным анализа газового состава крови. Базальная скорость корректировалась с учетом данных НМГ в режиме реального времени по согласованию с эндокринологом с использованием алгоритмов специализированной медицинской помощи больным СД.
Во второй подгруппе пациентов с ИБС и СД 2 типа осуществлялось внутривенное болюсное введение инсулина короткого действия с учетом значения глюкозы в образцах венозной крови 1 раз в 3 часа (данные НМГ во внимание не принимались). В контрольной группе тактика коррекции гликемии была аналогична таковой во второй подгруппе.
Исходы в раннем послеоперационном периоде
В раннем послеоперационном периоде (7-е сутки) конечными точками исследования выбраны летальные исходы и послеоперационные осложнения: посткардиотомный синдром (ПКТС) (диагноз ставили при наличии как минимум двух критериев: лихорадки, болевого синдрома перикардиального или плеврального генеза, шума трения перикарда/или плевры, перикардиального или плеврального выпота с повышенным уровнем СРБ), пневмония, медиастинит, сепсис, острый коронарный синдром, ОНМК, фибрилляция предсердий, острая почечная недостаточность. Выполнен и анализ длительности госпитализации.
Исходы в отдаленном послеоперационном периоде
Через год после операции пациенты были приглашены на обследование в НМИЦ ССХ им. А.Н. Бакулева, которое включало сбор жалоб и анамнестических данных за прошедший год, взятие образцов крови для определения уровней вчСРБ, RANTES, лептина и адипонектина, общего и биохимического анализов крови; проведение ЭКГ, трансторакальной ЭхоКГ. Если пациент предъявлял жалобы на боли ангинозного характера, выполнялся стресс-ЭКГ тест (тредмил-тест). При положительной пробе производилась коронарошунтография. Анализировались также частота и причины летальных исходов, послеоперационных осложнений (инфекционно-воспалительных процессов, сердечно-сосудистых событий) в отдаленном периоде КШ.
Статистический анализ
Статистическая обработка данных выполнена с помощью программы SPSS Statistics 21. Использовались методы описательной статистики. Для количественных показателей вычислены медианы, первый (Q1) и третий (Q3) квартили, для качественных рассчитаны частоты. Анализ статистической значимости параметров проводился при расчете точного критерия Фишера и U-критерия Манна — Уитни. При анализе повторных изменений применялся парный критерий Вилкоксона. Методом ранговой корреляции Спирмена оценивалась взаимосвязь признаков. Статистически значимыми считались результаты при уровне значимости p ≤ 0,05.
РЕЗУЛЬТАТЫ
Динамика гликемии у больных ишемической болезнью сердца и сахарным диабетом 2 типа в послеоперационном периоде коронарного шунтирования в зависимости от метода управления гликемией
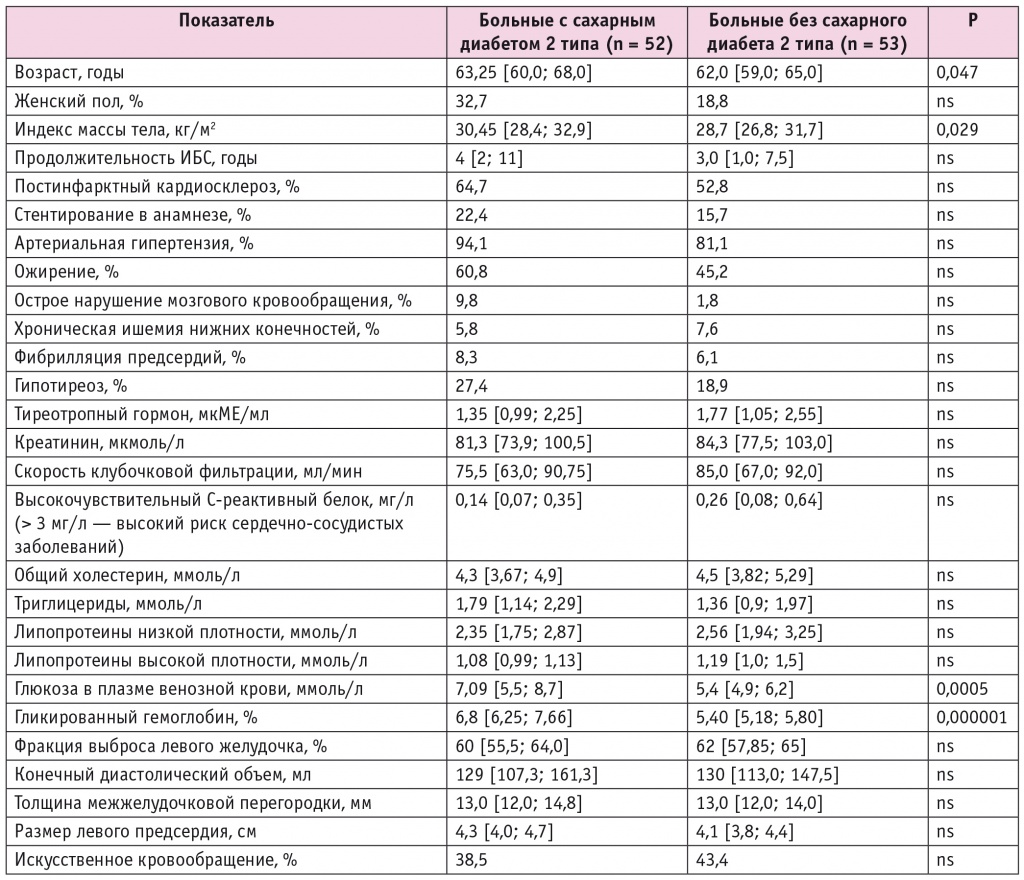
У всех больных ИБС вне зависимости от наличия СД выявлена стойкая гипергликемия, которая сохранялась в течение 48 часов после операции. В подгруппе пациентов с ИБС и СД 2 типа, которым осуществлялась НПИИ, наблюдалось постепенное, без резких колебаний снижение уровня глюкозы, по данным НМГ, в течение 48 часов после операции, причем через 12 часов концентрация глюкозы в данной подгруппе была значимо ниже (р = 0,021), чем во второй (рис. 1).
Рис. 1. Динамика уровня гликемии у больных ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде, согласно данным непрерывного мониторирования уровня глюкозы
При НПИИ через 12 часов после операции уровень глюкозы в большинстве случаев (n = 15; 62,5%) находился в диапазоне допустимых значений (4–10 ммоль/л). Напротив, среди пациентов, которым делали внутривенные инъекции инсулина, целевой уровень гликемии отмечался лишь у шести (21,4%) (р = 0,003). В обеих подгруппах больных ИБС и СД 2 типа ни одного эпизода гипогликемии (уровень глюкозы менее 3,9 ммоль/л) не зарегистрировано.
Динамика уровней провоспалительных медиаторов у больных ишемической болезнью сердца и сахарным диабетом 2 типа в послеоперационном периоде коронарного шунтирования в зависимости от метода управления гликемией
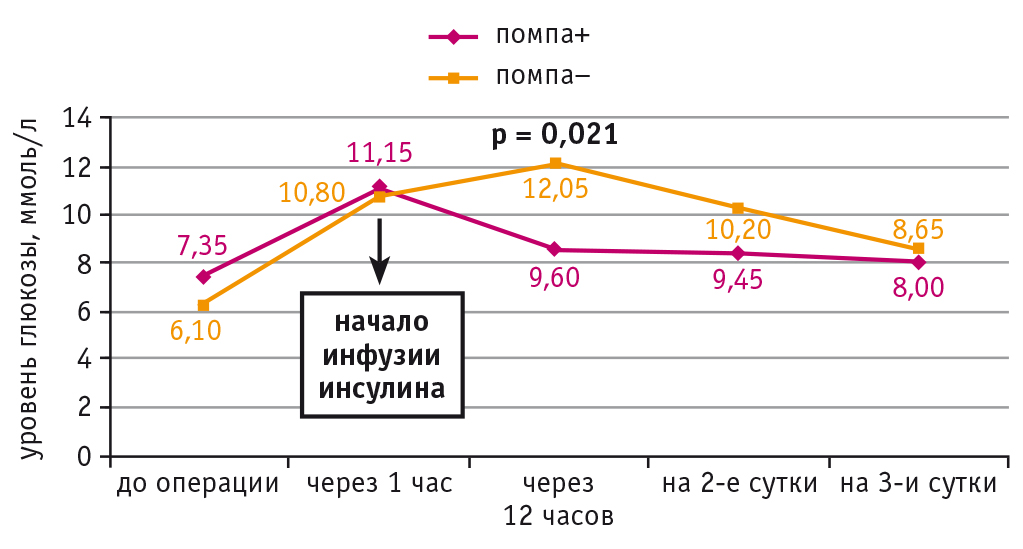
Согласно полученным данным, в обеих подгруппах больных ИБС и СД 2 типа выявлено статистически значимое (р = 0,0001; р = 0,0001 соответственно) повышение уровня вч-СРБ в раннем послеоперационном периоде (в течение 12 часов). Однако при НПИИ его концентрация через 12 часов после операции стала значимо ниже, чем во второй подгруппе (p = 0,0001) (рис. 2).
Рис. 2. Динамика уровня высокочувствительного С-реактивного белка (вч-СРБ) у больных ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в периоперационном периоде
В ходе корреляционного анализа у больных ИБС и СД 2 типа найдена прямая связь между содержанием вч-СРБ через 12 часов после операции и частотой развития ПКТС в раннем послеоперационном периоде (r = 0,4; р = 0,012), а также длительностью госпитализации (r = 0,5; р = 0,001).
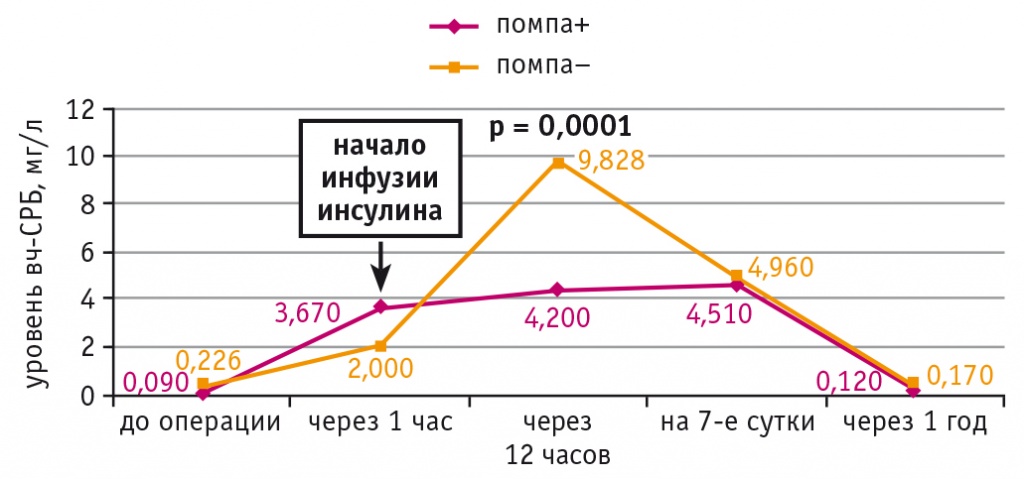
Уровень RANTES до операции был сопоставимым в обеих подгруппах. На 7-е сутки после КШ он увеличился, однако в подгруппе НПИИ его концентрация была статистически значимо ниже (р = 0,035) (рис. 3). По данным корреляционного анализа, у больных ИБС и СД 2 типа выявлена прямая связь между уровнем RANTES на 7-е сутки и частотой ПКТС в раннем послеоперационном периоде (r = 0,74; р = 0,023).
Рис. 3. Динамика уровня RANTES у больных ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде
Динамика содержания адипокинов у больных ишемической болезнью сердца и сахарным диабетом 2 типа в послеоперационном периоде коронарного шунтирования в зависимости от метода управления гликемией
Концентрация лептина до операции была сходной в обеих подгруппах больных ИБС и СД 2 типа и не превышала допустимые референсные значения. У женщин она составляла 47,59 [10,72; 150,2] нг/мл, у мужчин — 19,76 [5,39; 29,72] нг/мл (p = 0,004).
У больных ИБС и СД 2 типа на 7-е сутки после КШ наблюдалось повышение уровня лептина в обеих подгруппах независимо от метода коррекции гликемии. Однако в подгруппе НПИИ уровень лептина оказался значимо ниже, чем при внутривенном болюсном введении инсулина, согласно внутрибольничному протоколу (р = 0,039). Через год после операции уровень лептина стал сопоставимым в обеих подгруппах (рис. 4).
Рис. 4. Динамика уровня лептина у больных ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде
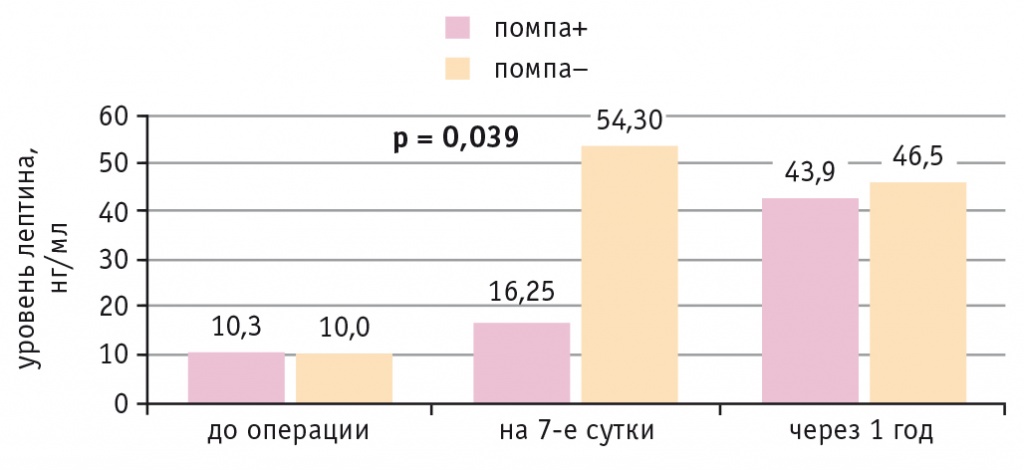
По данным корреляционного анализа, у всех больных независимо от наличия СД 2 типа выявлена прямая связь между уровнем лептина до операции и содержанием глюкозы, вч-СРБ через 12 часов после КШ (r = 0,3 р = 0,008; r = 0,2 р = 0,031 соответственно).
Отмечены сильная прямая связь между уровнем лептина на 7-е сутки и частотой ПКТС в раннем послеоперационном периоде (r = 0,725 р = 0,027) и обратная его связь с использованием помпы в раннем послеоперационном периоде (r = –0,73 р = 0,025).
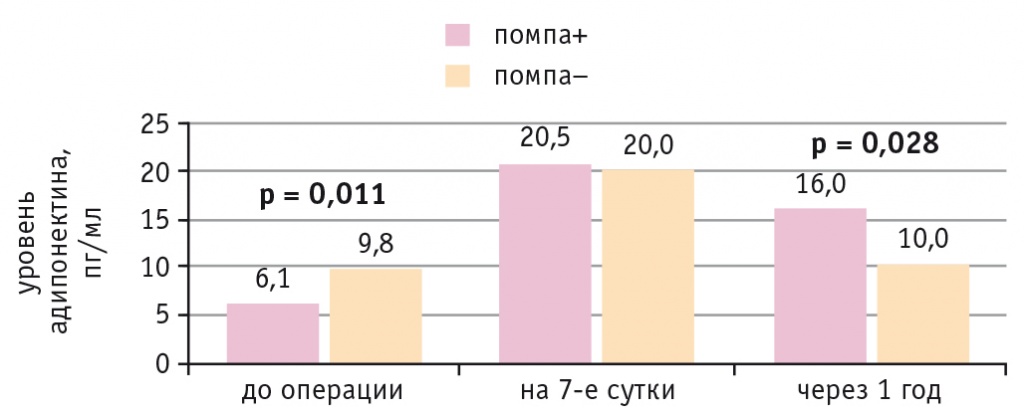
В обеих подгруппах больных ИБС и СД 2 типа концентрация адипонектина до операции находилась в диапазоне допустимых значений (8,3 ± 2 пг/мл). На 7-е сутки после КШ она возросла в обеих подгруппах независимо от метода коррекции гипергликемии. Через год после операции уровень адипонектина был значимо выше в подгруппе больных, которым проводилась НПИИ (р = 0,028) (рис. 5). У всех пациентов выявлена отрицательная корреляция между уровнем адипонектина через год после операции и содержанием лептина в раннем послеоперационном периоде (7-е сутки) (r = –0,79 р = 0,021).
Рис. 5. Динамика уровня адипонектина у больных ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде
В подгруппе больных ИБС и СД 2 типа с НПИИ через год после операции наблюдалась тенденция к уменьшению окружности талии (до операции — 111,0 [105,0; 117,75] см, через год — 108,0 [94,0; 108,0] см), в то время как у пациентов, которым проводилось его внутривенное болюсное введение, — напротив, к ее увеличению (до операции — 106,0 [94,0; 113,0] см, через год — 109,0 [99,0; 117,0] см).
По данным корреляционного анализа, в обеих подгруппах больных ИБС и СД 2 типа найдены сильная положительная связь между окружностью талии и уровнем лептина (r = 1; р = 0,01) и отрицательная связь между окружностью талии и содержанием адипонектина через год после операции (r = –0,2; р > 0,05).
Анализ осложнений в раннем послеоперационном периоде и длительности госпитализации в зависимости от метода управления гликемией
В раннем послеоперационном периоде один больной ИБС без СД 2 типа умер в результате острой сердечной недостаточности, возникшей из-за тромбоза шунтов. Проанализировав общее число осложнений в раннем послеоперационном периоде, мы обнаружили, что чаще всего у пациентов после КШ встречался ПКТС (n = 45). При НПИИ он возникал значимо реже, чем при внутривенном болюсном введении инсулина (р = 0,03) (рис. 6).
Рис. 6. Частота послеоперационных осложнений в раннем периоде после коронарного шунтирования у пациентов с ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде
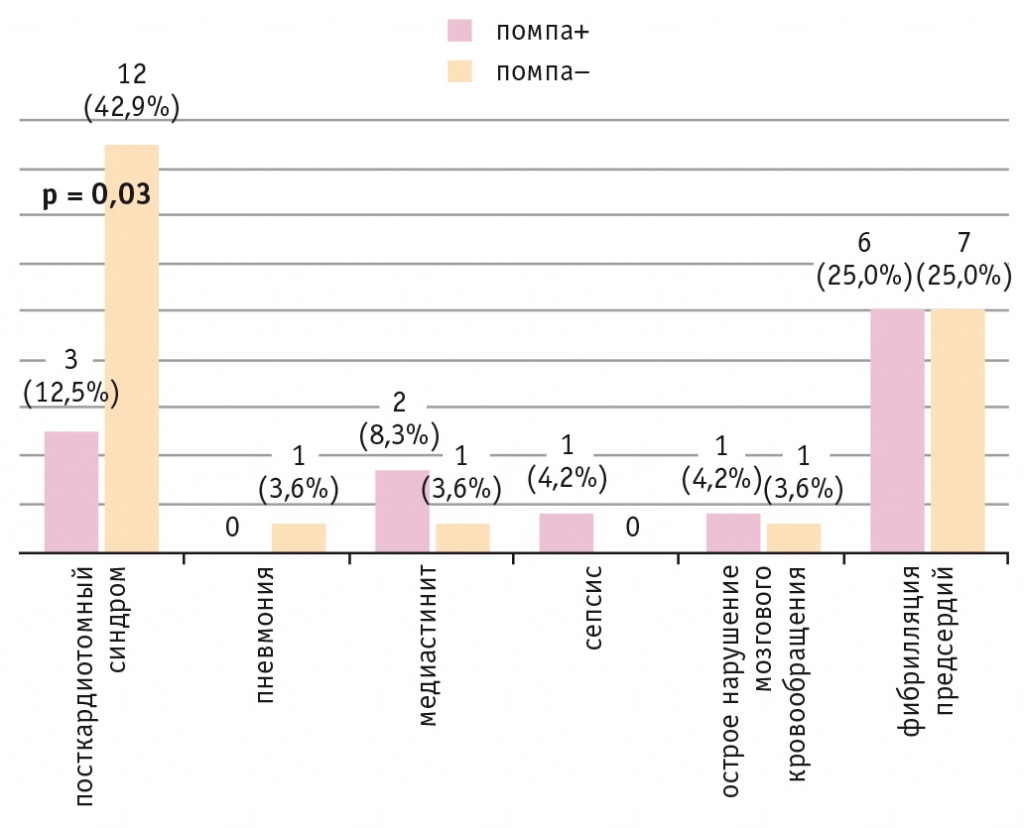
Длительность госпитализации у больных ИБС и СД 2 типа при НПИИ составила 9,0 [8,25; 10;75] дней, при внутривенном болюсном введении инсулина — 12,0 [10,0; 14,0] дней (р = 0,007). По данным корреляционного анализа, увеличение длительности госпитализации было главным образом обусловлено развитием ПКТС (r = 0,63, р = 0,0001).
Анализ осложнений в отдаленном послеоперационном периоде в зависимости от метода управления гликемией
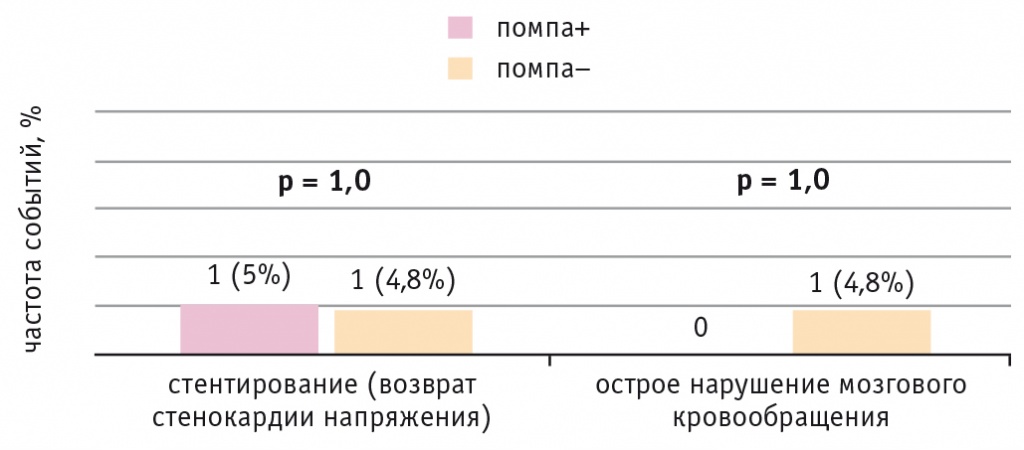
Через год после операции КШ обследованы 83 пациента — 40 больных ИБС и СД 2 типа и 43 без СД 2 типа. В отдаленном послеоперационном периоде один человек с ИБС без СД 2 типа умер по причине острого коронарного синдрома. У двух пациентов с ИБС и СД 2 типа произведена повторная операция реваскуляризации миокарда методом стентирования нативных артерий. Применение помпы для непрерывного введения инсулина в раннем послеоперационном периоде не влияло на рецидивы стенокардии напряжения и развитие других неблагоприятных событий в отдаленном послеоперационном периоде (рис. 7).
Рис. 7. Частота неблагоприятных событий в отдаленном периоде коронарного шунтирования у пациентов с ишемической болезнью сердца и сахарным диабетом 2 типа при непрерывной подкожной инфузии инсулина (помпа+) и при внутривенном болюсном введении инсулина (помпа–) в послеоперационном периоде
ОБСУЖДЕНИЕ
Влияние непрерывной подкожной инфузии инсулина на активность системного воспалительного ответа при проведении операции коронарного шунтирования
Пациенты с ИБС и СД 2 типа составляют особую группу риска развития послеоперационных осложнений и неблагоприятных исходов после кардиохирургических вмешательств, поэтому требуют внимательного и грамотного подхода со стороны медицинского персонала. Сейчас существуют разнообразные возможности и современные технологии, которые позволяют оказывать качественную и высокоспециализированную медицинскую помощь. Однако весьма актуальной задачей по-прежнему остается поиск наиболее эффективного метода контроля и коррекции периоперационной гликемии для снижения числа осложнений после кардиохирургических вмешательств.
Впервые прибор НМГ использовали при операциях на брюшной полости. H.G. Piper и соавт. доказали эффективность его применения в кардиохирургической практике у детей. Согласно результатам проведенного исследования, данные НМГ были сопоставимыми с показателями глюкозы в артериальной крови[4]. Кроме того, продемонстрировано, что гипотермия, отечность кожных покровов и инотропная поддержка не оказывали значимого влияния на функционирование устройства. H. Sato и соавт. сообщили об успешном применении систем НМГ для осуществления гликемического контроля в периоперационном периоде КШ[4]. Использование НМГ дает уникальную возможность оценить уровень глюкозы в реальном времени, определить динамику гликемии и уменьшить риск гипогликемических событий[5].
В Российской Федерации в НМИЦ ССХ им. А.Н. Бакулева под руководством академика РАН Е.З. Голуховой проведены первые исследования, посвященные изучению периоперационной дисгликемии с помощью приборов НМГ, продемонстрирована их эффективность и безопасность при КШ. По данным исследователей, выявлена тесная линейная корреляционная зависимость между значениями глюкозы, полученными с помощью прибора НМГ, глюкометра и при газовом анализе артериальной крови (r = 0,99; p = 0,00001)[6].
Как известно, операция — стресс для организма, в результате которого запускается целый каскад патофизиологических реакций, приводящих к формированию защитного механизма — гипергликемии. Однако при чрезмерно высокой концентрации глюкозы наблюдаются неблагоприятные исходы. Выбор диапазона допустимых значений гликемии в нашем исследовании основан на результатах ранее проведенных работ и рекомендациях по периоперационному ведению больных при кардиохирургических вмешательствах. Он составил от 8,3 до 10,0 ммоль/л в раннем послеоперационном периоде КШ. В течение 48 часов после оперативного вмешательства, по результатам НМГ, отмечалась стойкая гипергликемия независимо от наличия СД 2 типа. Ввиду возможного развития негативных эффектов от чрезмерно высокой концентрации глюкозы целесообразен поиск наиболее эффективного метода управления гликемией в периоперационном периоде.
В наше исследование включены 105 больных, из которых 52 пациента страдали компенсированным СД 2 типа. Мы сопоставили два метода контроля и коррекции гликемии у больных СД 2 типа: использование инсулиновой помпы с функцией НМГ, посредством которой проводилась НПИИ, и стандартный внутрибольничный протокол, включающий внутривенные инъекции инсулина с контролем уровня глюкозы газового состава крови 1 раз в 3 часа.
Какой же из подходов более эффективен? Некоторые авторы сообщают о том, что НПИИ сопоставима по качеству гликемического контроля с непрерывной внутривенной инфузией инсулина[7]. Согласно результатам нашего исследования, при НПИИ допустимые значения глюкозы в раннем (в течение 12 часов) послеоперационном периоде КШ наблюдались чаще, чем при проведении внутривенных инъекций инсулина (62,5% vs 21,4%, р = 0,003), что свидетельствует о более качественном контроле гликемии. В обеих подгруппах больных ИБС и СД 2 типа не зарегистрировано ни одного гипогликемического события (уровень глюкозы менее 3,9 ммоль/л), что доказывает безопасность как НПИИ, так и внутривенного болюсного введения инсулина, согласно стандартному внутрибольничному протоколу.
Таким образом, применение инсулиновой помпы с функцией НМГ в раннем послеоперационном периоде позволяет не только эффективно контролировать концентрацию глюкозы, снижая риск гипогликемических состояний, но и осуществлять более качественную коррекцию гипергликемии, чем внутривенное болюсное введение инсулина.
Существует ли преимущество в снижении риска развития осложнений в раннем послеоперационном периоде КШ у одного из методов управления гликемией? После того как H.E. Wasmuth и соавт. определили, что гипергликемия ассоциируется с повышением концентраций провоспалительных медиаторов, в том числе интерлейкина (ИЛ) 6, появились данные об устойчивом противоспалительном эффекте инсулина при его непрерывной инфузии[8]. Так, P. Dandona и соавт. выявили, что у больных с непрерывной внутривенной инфузией инсулина концентрация СРБ при выполнении КШ была значимо ниже, чем у пациентов, которым проводились его внутривенные болюсные инъекции (р < 0,05)[9]. Подобные результаты могли быть обусловлены тем, что экзогенный инсулин обладает рядом протективных свойств, которые в итоге предотвращают прогрессирование атеросклероза и тромбоз коронарных сосудов.
Мы провели собственный анализ влияния методов коррекции гликемии на провоспалительный статус больных СД 2 типа в послеоперационном периоде, поскольку предположили возможность уменьшения риска различных осложнений, главным образом инфекционно-воспалительных процессов, на фоне НПИИ. Оценена динамика уровней маркеров как острого (СРБ), так и хронического воспаления (RANTES). Cогласно результатам нашего исследования, содержание вч-СРБ в течение 12 часов после операции у всех больных СД 2 типа вне зависимости от метода коррекции гликемии значимо повышено (р = 0,0001; р = 0,0001 соответственно). Однако стоит отметить, что при НПИИ через 12 часов после хирургического вмешательства уровень вч-СРБ стал статистически значимо ниже, чем при проведении внутривенной болюсной инсулинотерапии (p = 0,0001), причем в подгруппе пациентов с НПИИ резкие колебания уровня вч-СРБ в динамике отсутствовали.
Крайне важен, на наш взгляд, в практическом отношении тот факт, что при НПИИ число случаев возникновения ПКТС в раннем периоде КШ и длительность госпитализации были статистически значимо меньше, чем при проведении внутривенных инъекций инсулина (р = 0,03). С учетом положительной корреляции между уровнем вч-СРБ через 12 часов после КШ и частотой ПКТС у пациентов с ИБС и СД 2 типа можно предположить преимущество НПИИ для уменьшения системной воспалительной реакции в ответ на кардиохирургическое вмешательство.
В пользу данной гипотезы свидетельствует и то, что у пациентов с НПИИ уровень RANTES на 7-е сутки после КШ был значимо ниже, чем у больных, которым проводились внутривенные болюсные инъекции инсулина (р = 0,035).
RANTES — хемокин, участвующий в активации и привлечении Т-лимфоцитов, эозинофилов и базофилов в очаг воспаления и оказывающий влияние на процессы ангиогенеза, апоптоза, пролиферацию и дифференцировку клеток. Y. Gramlich и соавт. выявили повышение уровня RANTES и его рецептора CCL5 в сыворотке крови у пациентов после КШ[2]. Мы также продемонстрировали сильную взаимосвязь между концентрацией RANTES на 7-е сутки и частотой возникновения ПКТС в раннем периоде КШ (r = 0,74; р = 0,023), что служит косвенным доказательством преимущества НПИИ как метода коррекции гликемии при КШ. Ранее упоминалось, что при НПИИ уменьшалось число случаев развития ПКТС, что же касается других осложнений в раннем и отдаленном периодах (через год) КШ, значимых различий при сопоставлении методов коррекции гликемии не было.
Влияние непрерывной подкожной инфузии инсулина на адипокиновый профиль при операции коронарного шунтирования
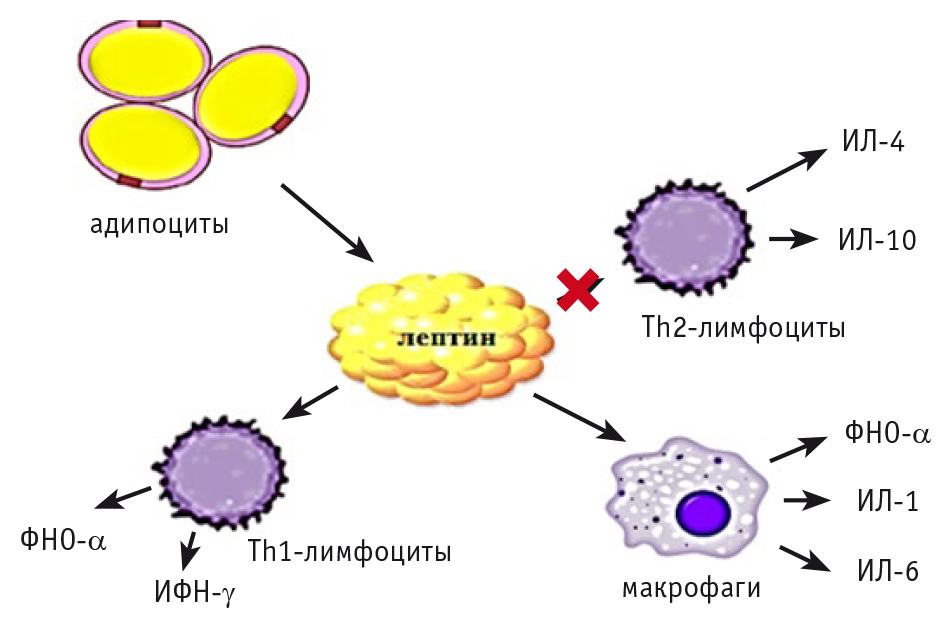
Уникальность лептина состоит в том, что данная субстанция обладает свойствами как гормона, так и цитокина, источником его служат адипоциты жировой ткани. Лептин стимулирует активность макрофагов/моноцитов, Th1-лимфоцитов, увеличивая высвобождение провоспалительных цитокинов (фактора некроза опухоли α, ИЛ-1 и ИЛ-6), а также ингибирует действие Th2-лимфоцитов, которые синтезируют ИЛ-4 и ИЛ-10, обладающие противовоспалительным эффектом. Действие лептина опосредовано активацией ядерного фактора транскрипции κB (NF-κB) и c-Jun NH2-терминальной протеинкиназы (JNK) (рис. 8)[10].
Рис. 8. Влияние лептина на провоспалительный статус. Иллюстрация авторов.
Примечание: ИЛ — интерлейкин, ФНО — фактор некроза опухоли α, ИФН — интерферон
P.E. Carey и соавт. сообщили о влиянии инсулинотерапии на синтез лептина адипоцитами[11]. Результаты немногочисленных исследований демонстрируют, что внутривенное введение инсулина остро стимулирует выработку лептина. Так, в среднем при инфузии инсулина в течение 4 часов концентрация лептина увеличивается на 10%. Доказано, что воздействие инсулина на секрецию лептина дозозависимо[2]. Можно предположить, что при НПИИ осуществляется более тщательная коррекция дозы инсулина, чем при внутривенных болюсных инъекциях, что предотвращает чрезмерное введение и депонирование инсулина в подкожной клетчатке.
Вероятно, вышеуказанные механизмы объясняют то, что при НПИИ в раннем послеоперационном периоде отмечены более низкий уровень лептина, чем при проведении внутривенных болюсных инъекций (р = 0,039), и обратная взаимосвязь между содержанием лептина в раннем послеоперационном периоде и использованием инсулиновой помпы (r = –0,73 р = 0,025).
С учетом провоспалительных эффектов лептина можно предположить, что снижение его продукции приводит к уменьшению выраженности системной воспалительной реакции и частоты ПКТС в раннем послеоперационном периоде. В пользу данного суждения свидетельствует выявленная в ходе нашего исследования высокая положительная корреляция между частотой развития ПКТС в раннем послеоперационном периоде и уровнем лептина на 7-е сутки (r = 0,725; р = 0,027).
Интересным представляется тот факт, что в подгруппе пациентов с НПИИ через год после операции уровень адипонектина был значимо выше, чем у больных, которым проводились внутривенные инъекции инсулина (р = 0,028). Именно у участников с НПИИ через год после операции наблюдалась тенденция к уменьшению окружности талии, в то время как у пациентов, получавших внутривенные инъекции инсулина, — к ее увеличению.
Поскольку адипонектин служит маркером метаболического здоровья, то полученные нами результаты, вероятно, свидетельствуют об его улучшении через год после операции в группе лиц с НПИИ.
В целом современные взгляды на роль ожирения как фактора риска неблагоприятных исходов, в том числе у пациентов после КШ, весьма противоречивы. Так, по некоторым данным, ожирение способствует прогрессированию атеросклероза, усиливая окислительный стресс и усугубляя провоспалительное состояние[2]. Однако, согласно результатам других исследований, существует «парадокс ожирения», то есть больные ССЗ с ожирением и избыточной массой имеют лучший прогноз, чем пациенты с ССЗ и нормальной массой. Единого мнения по поводу причин «парадокса ожирения» не существует, но научное сообщество выдвигает разные гипотезы, в т. ч. увеличение мышечной массы, генетические особенности и т. д.
Несмотря на то что ожирение — общепризнанный фактор риска ССЗ, у пациентов с избыточной массой и умеренным ожирением риск неблагоприятных исходов после КШ был ниже, чем у больных с нормальным индексом массы тела (ИМТ). Но у людей с морбидным ожирением (ИМТ > 40 кг/м2) и недостаточной массой тела результаты КШ оказались значительно хуже[4].
Оценка ожирения как фактора риска неблагоприятных событий после КШ не входила в задачи настоящего исследования, и из-за низкого процента осложнений в отдаленном послеоперационном периоде выполнение данного анализа было бы крайне затруднительным. Однако полученные результаты свидетельствуют о необходимости проведения дальнейших исследований в этом направлении с целью определения свойств висцерального жира и изучения его роли в патогенезе ССЗ.
ЗАКЛЮЧЕНИЕ
В клинической практике больные ИБС и СД 2 типа встречаются чрезвычайно часто и требуют особого внимания и грамотного ведения, поскольку наличие СД 2 типа у пациентов с ИБС увеличивает риск фатальных осложнений в послеоперационном периоде КШ в несколько раз. Мы продемонстрировали возможность безопасного применения альтернативного метода коррекции гликемии — НПИИ с учетом данных НМГ — и его бо́льшую эффективность в сравнении с таковой стандартного внутрибольничного протокола. Но необходим дальнейший поиск наиболее экономически и клинически привлекательных технологий для осуществления качественного управления периоперационной гликемией и снижения риска развития осложнений после хирургических вмешательств.
Поступила: 03.11.2023
Принята к публикации: 08.12.2023
________
1 Российский статистический ежегодник. 2022: стат.сб./Росстат. М.; 2022. 691 с.







